大豆斑疹病菌内切甘露聚糖酶ManA的功能研究
2022-04-13王宏杰孙楚韵苏如意田传玉徐江玲张俊楠许梦洁
王宏杰, 孙楚韵, 苏如意, 田传玉, 徐江玲,张俊楠, 许梦洁, 郭 威
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
由大豆斑疹病菌(X.axonopodispv.glycines,Xag)引起的大豆斑疹病(bacterial pustule,BP)是大豆上重要的检疫性细菌病害[1].该病原菌可侵染大豆叶片、叶柄、茎和豆荚,整个生育期均可引起大豆病害,导致叶片早枯脱落、籽粒皱缩,从而降低大豆经济效益[2-3].
借助Ⅱ型分泌系统,植物病原黄单胞菌将多种细胞壁水解酶如内切甘露聚糖酶、淀粉酶、纤维素酶等分泌至胞外,破坏细胞壁以便于病原菌在植物上寄生和致病[4-6].内切甘露聚糖酶负责随机切割β-1,4-糖苷键,在病原菌与寄主植物互作过程中起重要作用[7].相较于其他细胞壁水解酶,有关植物病原黄单胞菌内切甘露聚糖酶的研究鲜有报道.2003年,Dow等[8]研究证实野油菜黄单胞菌(X.campestrispv.campestris,Xcc)8004菌株的内切甘露聚糖酶编码基因manA(XC2458)突变,导致菌株的内切甘露聚糖酶活性丧失,在寄主上的致病性、生物膜形成能力相对于野生型均显著减弱.2010年,Hsiao等[9]研究再次证实,XccXc17菌株的manA基因突变,导致菌株的内切甘露聚糖酶活性完全丧失.已有研究表明,Xag具有较高的内切甘露聚糖酶活性[10-11],但其编码基因仍未知.在Xag中,manA是唯一注释编码内切甘露聚糖酶的基因,但其是否负责Xag的内切甘露聚糖酶合成及其他生物学特性,并不知晓.
本研究证实ManA涉及负调控engXCA和egl2基因的表达,其突变增强菌株的内切甘露聚糖酶活性和胞外纤维素酶活性、促使菌株形成胶状物;但不影响菌株的其他生物学特性,如生物膜形成、胞外多糖合成及蛋白酶和淀粉酶活性.
1 材料和方法
1.1 供试材料
本研究所用菌株和质粒列于表1.XagZJ15菌株及其衍生菌株在28 ℃NB(3 g/L牛肉膏,10 g/L蔗糖,5 g/L多聚蛋白胨,1 g/L酵母提取物)中培养.培养菌株所用抗生素浓度:羧苄青霉素(Cb)100 μg/mL,卡那霉素(Km)50 μg/mL,壮观霉素(Sp)100 μg/mL[11].

表1 本研究所用菌株和质粒
1.2 缺失突变株构建及功能互补
本研究所用引物列于表2.基于同源重组原理,借助pKMS1自杀载体[12],以Xag野生型菌株ZJ15为出发菌株,构建内切甘露聚糖酶manA基因的缺失突变株,命名为ΔmanA.同时,以pHM1为互补载体[13],构建ΔmanA的功能互补菌株,命名为CΔmanA.
1.3 RNA提取及RT-PCR
将新鲜的各供试菌株培养至OD600≈2.0,富集菌体,洗涤2次;使用RNA抽提试剂(TRIzol)制备各菌株的总RNA,去除基因组DNA;利用反转录试剂盒(TaKaRa)将mRNA反转录成cDNA;然后采用实时荧光定量PCR试剂盒(TaKaRa)检测各待测菌株中目标基因的mRNA水平(见表2).

表2 本研究所用引物
1.4 胞外酶活性分析
参照文献[10]方法,检测分别以刺槐豆胶、羧甲基纤维素、可溶性淀粉或脱脂牛奶为底物培养基上的各菌株水解能力,分析各菌株的内切甘露聚糖酶、纤维素酶、淀粉酶及蛋白酶的活性.
1.5 胞外多糖测定
将新鲜的各供试菌株培养至对数生长期,收集菌体,灭菌水洗涤2次后调至OD600≈1.0.吸取2 μL各待测菌液分别接种至含2%葡萄糖或蔗糖的NY固体培养基上,28 ℃培养3~5 d后,观察结果并拍照记录[14].
1.6 生物膜测定
参照文献[15]将等量新鲜的各供试菌株接种至生物膜测定培养基中,28 ℃静置培养5~7 d后,观察结果并拍照记录.
2 结 果
2.1 内切甘露聚糖酶ManA在植物病原黄单胞菌中高度保守
内切甘露聚糖酶(mannanendo-1,4-β-mannosidase,ManA)属于第5家族糖基化水解酶,在植物病原细菌中分布较广.根据生物信息学分析显示,XagZJ15,12-2和8ra等菌株中的manA基因序列完全一致,具有100%同源性.此外,XagZJ15菌株的manA基因与柑橘溃疡病菌(X.axonopodispv.citri,Xac)306菌株的manA基因(XAC1796)、辣椒斑点病菌(X.campestrispv.vesicatoria,Xcv)85-10菌株的manA基因(XCV1826)、水稻条斑病菌(X.oryzaepv.oryzicola,Xoc)BLS256菌株的manA基因(XOC2180)和野油菜黄单胞菌(X.campestrispv.campestris,Xcc)8004菌株的manA基因(XC2458)分别具有99.9%,96.3%,89.2%和81.4%的同源性.这些结果说明,内切甘露聚糖酶ManA在植物病原黄单胞菌中高度保守.

图1 大豆斑疹病菌内切甘露聚糖酶基因manA的系统发育树
2.2 大豆斑疹病菌内切甘露聚糖酶基因manA的缺失突变
为了便于Xag内切甘露聚糖酶编码基因manA的功能研究,以ZJ15菌株为模板,分别扩增毗邻manA基因的上游片段(644 bp)和下游片段(317 bp),将其顺式融合并构入敲除载体pKMS1中,经2次同源片段重组交换获得双交换子(见图2a).然后,采用2轮巢式PCR对所获取的双交换子进行验证后发现,2轮PCR扩增所获取的DNA片段相对于野生型均缺失987 bp(见图2b).结果表明,实验获得了正确的manA基因缺失突变体,命名为ΔmanA,可用于后续功能研究.
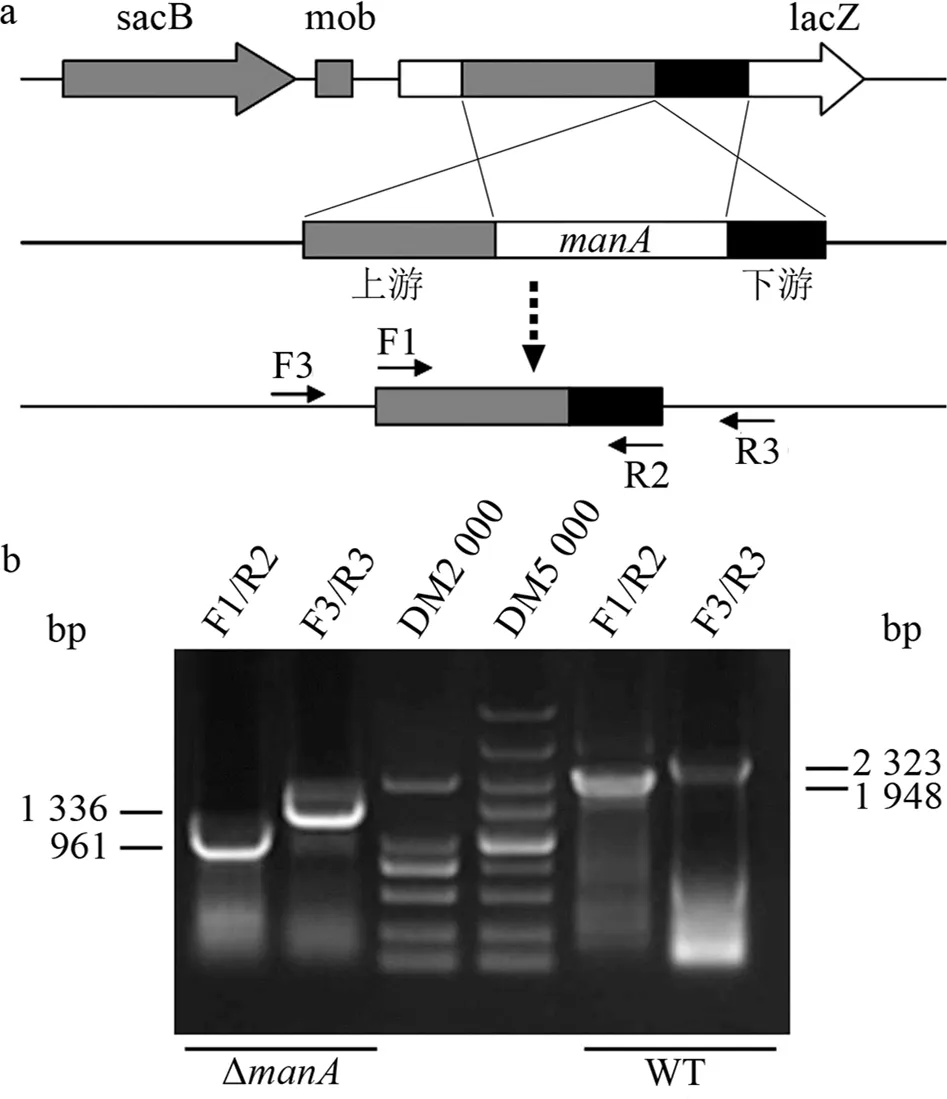
a:manA基因缺失突变的构建示意图;b:manA基因缺失突变株的PCR验证
2.3 ManA负调控大豆斑疹病菌的胞外纤维素酶活性和内切甘露聚糖酶活性
为了探究ManA是否参与Xag的胞外纤维素酶活性和内切甘露聚糖酶活性,采用平板法定性检测ΔmanA、CΔmanA和野生型菌株的纤维素酶活性和内切甘露聚糖酶活性.结果显示:在含0.5%羧甲基纤维素或含0.2%刺槐豆胶的NA平板上,ΔmanA菌株相较于野生型均形成明显较大的水解圈;功能互补使ΔmanA菌株的上述2种胞外酶活性均恢复至野生型水平(见图3a~3b).这些结果表明,ManA负调控Xag的胞外纤维素酶活性和内切甘露聚糖酶活性.
先前研究证明,engXCA和egl2基因共同控制Xag的胞外纤维素酶合成[16],本研究证实,engXCA和egl2基因也共同决定Xag的内切甘露聚糖酶活性(见图3d~3f).为了探究ManA调控Xag内切甘露聚糖酶活性和胞外纤维素酶活性的方式,借助荧光定量PCR手段分析同时编码内切甘露聚糖酶和胞外纤维素酶的engXCA和egl2基因的表达模式.结果显示,engXCA和egl2基因在ΔmanA菌株中的表达水平相对于在野生型中均显著增加(P<0.01)(见图3c).这些结果表明,ManA负调控Xag的engXCA和egl2基因的转录表达.

a:ΔmanA菌株的胞外纤维素酶活性测定;b:ΔmanA菌株的内切甘露聚糖酶活性测定;c:egl2和engXCA基因表达分析;d:Δegl2菌株的内切甘露聚糖酶活性测定;e:ΔengXCA菌株的内切甘露聚糖酶活性测定;f:ΔengXCAΔegl2菌株的内切甘露聚糖酶活性测定
2.4 ManA不参与大豆斑疹病菌的蛋白酶活性和淀粉酶活性
为了探究ManA是否参与Xag的蛋白酶活性和淀粉酶活性,采用平板法定性检测ΔmanA,CΔmanA和野生型菌株的蛋白酶活性和淀粉酶活性.结果显示:在含1%脱脂牛奶或含0.2%可溶性淀粉的NA平板上,3个菌株均产生大小相近的水解圈,说明3个菌株水解牛奶或可溶性淀粉的能力基本一致(见图4).这些结果表明,ManA不参与Xag的蛋白酶活性和淀粉酶活性.
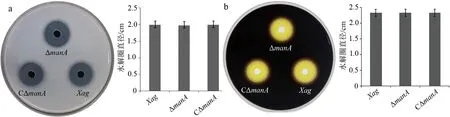
a:ΔmanA菌株的蛋白酶活性测定;b:ΔmanA菌株的淀粉酶活性测定
2.5 内切甘露聚糖酶基因manA突变促使菌株形成胶状物
为了探究ManA是否参与Xag的生物膜形成,分别检测ΔmanA,CΔmanA和野生型菌株的生物膜形成能力.结果显示:在试管侧壁上,ΔmanA菌株能形成明显的细菌细胞聚集圈,其形成能力与野生型基本一致(见图5a).然而,实验中却发现了一种新的表型,即离心后在ΔmanA菌株细胞沉淀的顶部积累了一层透明可见的胶状物质,这种现象在CΔmanA和野生型菌株中并未观察到(见图5b).这些结果表明,manA突变不影响菌株的生物膜形成能力,但能促使菌株形成胶状物质.为了探究ManA是否参与Xag的胞外多糖合成,分别检测ΔmanA,CΔmanA和野生型菌株的胞外多糖合成能力.结果显示:3个菌株产生胞外多糖的能力基本一致(见图5c),表明ManA不参与Xag的胞外多糖合成.

a:ΔmanA菌株的生物膜测定;b:ΔmanA菌株的胶状物形成;c:ΔmanA菌株的胞外多糖合成分析
3 讨 论
在分类上,ManA属于第5家族糖基化水解酶,它在植物病原细菌中分布较广[9].在已完成基因组测序的植物病原黄单胞菌中,manA是全基因组中唯一注释编码内切甘露聚糖酶的基因,在不同菌株间约有81%~100%的碱基同源性(见图1),说明manA基因在植物病原黄单胞菌中具有高度保守性.然而由目前研究可知,ManA在不同植物病原黄单胞菌中的生物学功能差异显著,揭示其具有菌株特异性.
有趣的是,与Xcc菌株的ManA功能相悖[8-9],Xag的内切甘露聚糖酶基因manA缺失突变,显著增强菌株的内切甘露聚糖酶活性和胞外纤维素酶活性(见图3a~3b).先前研究报道,EngXCA和Egl2是Xag的2个胞外纤维素酶[16];此外,engXCA和egl2基因在Xoo,Xag基因组中注释编码内切葡聚糖苷酶(endoglucanase)或内切葡聚糖苷酶前体(endoglucanase precursor)[17].基于此,本研究进一步证实:Egl2和EngXCA也共同控制Xag的内切甘露聚糖酶活性(见图3d~3f);ManA涉及负调控egl2和engXCA基因的表达(见图3c).由此推断,manA基因突变导致egl2和engXCA基因的表达水平上调,从而增强菌株的胞外纤维素酶和内切甘露聚糖酶活性.这些研究表明,植物病原黄单胞菌内切甘露聚糖酶的编码基因不尽相同,因菌株而异.
ManAXcc能驱散Xcc菌株的生物膜形成[8];然而manAXag基因突变并不影响Xag的生物膜形成和胞外多糖合成(见图5a和图5c),但却能在离心管底部产生一种由于较少或轻量细胞聚集所形成的胶状物现象(见图5b),这种现象属于一种较弱的生物膜形成[18].这表明,ManAXag驱散菌株生物膜形成能力相较于ManAXcc较弱.此外研究发现,manA基因突变显著削弱病原菌在寄主大豆上的致病性(数据未显示),ManA是如何在Xag与寄主植物亲和互作中发挥毒性作用、是否还参与Xag的其他生物学特性,有待进一步研究.
