子宫内膜息肉中肿瘤坏死因子-α和环氧合酶-2的表达水平
2022-04-12肖艳来张丽张艺玮王若晰王健
肖艳来 张丽 张艺玮 王若晰 王健
子宫内膜息肉(endometrial polyp,EP)是常见的妇科疾病,通常包括子宫内膜腺体、间质以及血管,病灶可以是单一性的,也可是多发性的,且病灶的直径存在差异性[1]。通常可导致子宫异常出血及不孕等,但也可无症状。各个年龄层的女性均可发病,以绝经后女性发病率最高[2]。EP是良性肿瘤,但一些EP可能是癌前病变甚至是癌症[3]。随着妇科超声及宫腔镜等技术的发展,子宫内膜息肉的诊断和治疗水平已经有了极大的提高,但目前其发病机制和病因仍不清楚。近年来中外大量的研究结果显示,多种因素的共同作用导致了息肉的发生[4,5]。本研究通过观察绝经后女性子宫内膜息肉、息肉周围内膜组织和宫腔内远离息肉内膜组中 TNF-α和COX-2的表达情况,并分析研究炎性因子TNF-α与COX-2的相关性,探讨子宫内膜息肉可能的发生机制,以期为临床工作提供理论支持。
1 资料与方法
1.1 一般资料 选取2019年1月至2020年10月在河北医科大学第三医院妇科就诊,因异常子宫出血或宫腔占位行宫腔镜检查的患者,将接受宫腔镜检查且病理证实为子宫内膜息肉者30例患者作为研究对象,根据取材部位不同将其分为息肉组、息肉周围内膜组、宫腔内远离息肉内膜组。排除标准:以上各组患者治疗前3个月未应用激素及抗组胺等药物,未合并感染性疾病及其他恶性肿瘤病史。所有入组患者签署相关知情同意,且本研究经医院伦理委员会批准。
1.2 方法 宫腔镜直视下用活检钳钳取息肉组织或宫腔镜下电切息肉组织、息肉周围内膜组织和宫腔内远离息肉内膜。术中获取的组织标本放入液氮中保存。
1.3 试剂与主要仪器 COX-2(#12282,兔单抗)、TNF-α(#6 945,兔单抗)、β-Actin(#3700,兔单抗)抗体购自美国Cell Signaling Technology,HRP偶联山羊抗鼠(ab6 789)、山羊抗兔多克隆二抗(ab97051)购自美国Abcam。组织蛋白裂解液、BCA蛋白浓度测定试剂盒、ECL发光试剂盒购自美国Thermo。总RNA提取试剂盒购自武汉赛维尔生物科技有限公司,反转录试剂盒、RT-PCR试剂盒购自莫纳生物科技有限公司,引物由美国Invitrogen生命技术有限公司合成、ELISA试剂盒购自酶免试剂盒。
1.4 蛋白印记 0.2 g组织中加入1 ml蛋白提取用组织裂解液,在研钵中研碎组织后将其转移到EP管中,置于4 ℃振荡器上振荡裂解10 min,12 000×g 4℃离心10 min。吸取上清液置于新EP管中,并用BCA蛋白浓度检测试剂盒检测蛋白浓度,所剩蛋白样品按量加入蛋白上样缓冲液,混匀后置于100°C沸水中加热5 min,样品可直接用于Western blot实验及SDS-PAGE,用5%牛奶封闭PVDF膜,加入相应一抗(1∶1 000)及二抗(1∶5 000),并用ECL发光试剂盒检测相应分子的表达量,并利用Image J软件计算灰度值。以目标蛋白与内参蛋白的吸光度比值表示蛋白的相对表达量。
1.5 RT-PCR
1.5.1 组织标本提取细胞总RNA:方法严格按照武汉赛维尔RNA提取液说明书执行。
1.5.2 反转录反应:严格按照莫纳试剂盒说明书进行操作。
1.5.3 引物由invitrogen公司合成如下:引物序列COX-2F:5′-TTC AAA TGA GAT TGT GGA AAA AT -3′,R:5′-AGA TCA TCT CTG CCT GAG TAT CTT -3′,GAPDHF:5′-AAG GTC GGA GTC AAC GGA TTT -3′,R:5′-AGA TGA TGA CCC TTT TGG CTC -3′,qPCR反应程序以 cDNA 为模板行qPCR,分别扩增COX -2 和 GAPDHCOX-2 循环条件:预变性 95℃ 5 min; 变性95℃ 10 s,退火60℃ 10 s,延伸72℃ 30 s,共计40个循环。GAPDH 循环条件:预变性 95℃ 5 min; 变性95℃ 10 s,退火55℃ 10 s,延伸72℃ 30 s,共计30个循环。采用GAPDH作为内参,以2-ΔΔCt计算所得值作为目的mRNA的相对定量。
1.6 ELISA 严格依照酶免试剂盒操作说明检测TNF-α。

2 结果
2.1 TNF-α和COX-2在子宫内膜息肉组织、息肉周围组织和远离息肉组织中的表达 TNF-α和COX-2在子宫内膜息肉组织、息肉周围组织和远离息肉组织中均有不同程度的表达。
2.1.1 TNF-α在30例子宫内膜息肉组织中强阳性表达28例,阳性表达率93.3%(28/30);30例息肉周围组织中强阳性表达12例,阳性表达率40.0%(12/40);30例远离息肉组织中强阳性表达2例,阳性表达率6.7%(2/30)。TNF-α在子宫内膜息肉组织中的表达高于息肉周围组织和远离息肉组织,TNF-α在息肉周围组织中的表达高于远离息肉组织,差异均有统计学意义(P<0.05)。见图1,表1。
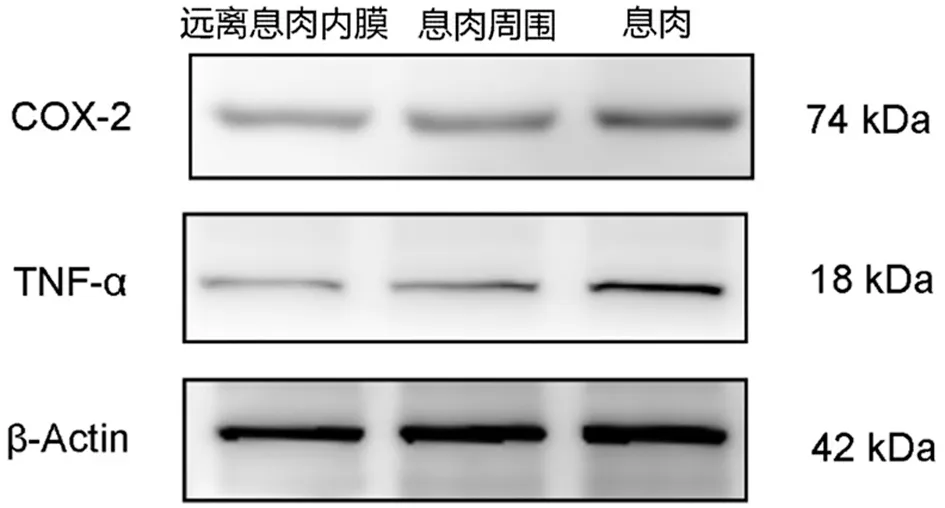
图1 Western blot实验检测TNF-α和COX-2在3组中的表达
2.1.2 COX-2在30例子宫内膜息肉组织中强阳性表达27例,阳性表达率90.0%(27/30);30例息肉周围组织中强阳性表达15例,阳性表达率50.0%(15/30);30例远离息肉组织中强阳性表达3例,阳性表达率10.0%(3/30);COX-2在子宫内膜息肉组织的表达高于其在息肉周围组织和远离息肉组织的表达,COX-2在息肉周围组织中的表达高于远离息肉组织,差异均有统计学意义(P<0.05)。见图1,表1。

表1 TNF-α和COX-2在3组中的强阳性表达 n=30,例(%)
2.2 COX-2 mRNA在子宫内膜息肉组织、息肉周围组织和远离息肉组织中的表达 COX-2 mRNA在子宫内膜息肉组织中的表达高于息肉周围组织和远离息肉组织,差异均有统计学意义(P<0.05)。见表2。
2.3 TNF-α在子宫内膜息肉组织、息肉周围组织和远离息肉组织中的表达 TNF-α在子宫内膜息肉组织中的表达高于息肉周围组织和远离息肉组织,差异均有统计学意义(P<0.05)。见表3。
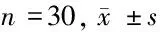
表2 COX-2 mRNA在子宫内膜息肉组织、息肉周围组织和远离息肉组织中的表达
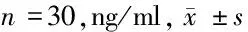
表3 TNF-α在子宫内膜息肉组织、息肉周围组织和远离息肉组织中的表达
2.4 TNF-α与COX-2表达的关系 TNF-α在30例子宫内膜息肉组织中强阳性表达28例,COX-2强阳性表达25例;COX-2在30例子宫内膜息肉组织中强阳性表达27例,TNF-α阳性表达25例;呈负相关(rs=-0.516,P=0.001)。见表4。
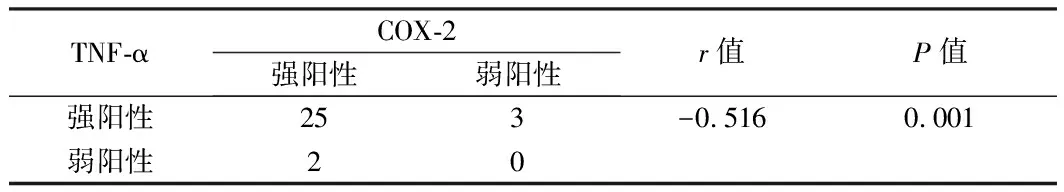
表4 TNF-α与COX-2表达的相关性 例
3 讨论
子宫内膜息肉是妇科常见病之一,宫内膜局部组织受某种因素的影响,过度增生形成一种良性肿物。月经量增多、经期改变、异常子宫出血、绝经后阴道流血及不孕等临床症状都可由其导致。
COX又称前列腺素过氧化物合成酶,是前列腺素合成过程中一个重要的限速酶,机体的多种病理生理过程中,如炎性反应、发热、出凝血机制等均有其参与。COX至少包含两种同工酶,即COX-1和COX-2。普遍认为,COX-1介导了生理过程,而COX-2则参与了病理过程的介导。研究发现,在正常组织中COX-2几乎不表达,而在炎症等的发生发展中可见其表达痕迹[6],且已被证实在大肠和胃黏膜息肉的发展中起关键作用[7],例如COX-2在50%的结肠腺瘤和90%的大肠癌中表达,在大肠肿瘤中具有促进生长的特性[8]。COX-2促进细胞增殖、肿瘤进展和新血管生成的能力不仅限于结直肠肿瘤,而且在包括子宫内膜癌在内的其他肿瘤中也已观察到,在这些肿瘤中,微血管密度和浸润倾向受COX-2表达水平的影响[9]。肿瘤的分级和侵袭性均与COX-2水平也呈正相关[10]。在子宫内膜中,COX-2的活性受月经周期阶段的影响,在黄体期后期(腺体增殖为零时)会大大降低[11]。在子宫内膜增生中也已检测到COX-2表达,提示前列腺素在其发病机制中的可能作用,但是目前机制尚不明确[12]。促炎细胞因子中的肿瘤坏死因子(tumor necrosis factor-α,TNF-α)是一种细胞因子,其具有多种生物学功能,可介导多种细胞因子、生长因子及其受体基因的表达,在机体的炎性反应、免疫反应、抗肿瘤作用及细胞凋亡等程序中均有参与,其在炎性反应过程中最早出现,同时也是最重要的炎性介质[13]。它不但能刺激巨噬细胞、上皮细胞等分泌细胞因子及花生四烯酸代谢物等,而且还能吞噬细胞产物和补体片段,从而使得间质中蛋白质水肿、破坏、细胞坏死。TNF-α通过调节血管生成,促进子宫内膜间质细胞增生和炎性因子的产生[14]。子宫内膜息肉中COX-2活性和TNF-α表达是否相关尚不明确。
关于子宫内膜息肉的形成机制,目前尚不明确,但主要学说有以下几种:(1)炎症刺激学说:通过研究发现具有宫内节育器、子宫内膜炎、子宫内膜结核的女性,其发生子宫内膜息肉的概率高于正常女性,因此,可以认为是长期的机械刺激和/或炎性因子的刺激致使子宫内膜增生,从而产生子宫内膜息肉。(2)激素刺激学说:Taylor等[15]研究分泌期以及增生期子宫内膜息肉组织得出促使子宫内膜息肉形成的原因可能与ER高表达,PR低表达相关。(3)细胞凋亡/增殖失衡学说:Maia等[16]研究表明,在子宫内膜息肉组织中,月经增殖期Ki67、Bcl-2、p53 的表达要高于黄体期的表达,由此考虑子宫内膜息肉与增生和分化程序失调有关。(4)蛋白表达异常学说:Erdemoglu等[17]研究表明,在绝经前后患者的子宫内膜息肉组织中,COX-2、MMP-2和MMP-9均可被检测到,且其在绝经前息肉组织间质中表达要高于绝经后息肉组织。(5)细胞因子学说:Xuebing等[18]发现,在息肉组织腺上皮中血管内皮生长因子的含量高于其在周围内膜组织的含量。靳闪闪[19]研究表明内皮拟素ENS在息肉组织中的表达呈高水平,并且与VEGF表达呈正相关。(6)遗传因素:Dal Cin等[3]通过对良性子宫内膜息肉的研究表明57%的患者有常染色体重组现象,Vanni等[20]认为,子宫内膜息肉组织中异常改变的主要基因位点为 t(6;14)(p21;q24)。(7)其他:服用激素类药物、肥胖、妊娠次数等也与子宫内膜息肉的发生有关。总之,其发病并不是由单一因素导致,而是由炎症、细胞凋亡、免疫逃逸、内分泌失衡等因素共同导致[21],宫腔内炎症导致内膜息肉的发生最早被提出,宫腔镜下可见基质水肿、腺体周围充血、内膜增厚等炎性反应,但炎症导致EP发生的机制并不明确。且有研究发现,炎性细胞、致炎因子等诸多途径还可促进肿瘤的发生及发展。
本研究发现在已知患有子宫内膜息肉的女性人群中,子宫内膜腔中TNF-α和COX-2的表达水平升高,并且两者具有相关性。先前的观察表明,雌激素可以有效地增加人子宫微血管内皮细胞中的COX-2 mRNA和蛋白质水平[22]。前列腺素参与细胞增殖和肿瘤进展,并且COX-2对于调节该过程至关重要。事实证明,使用选择性COX-2抑制剂可有效治疗和预防结直肠息肉[23]。根据我们在这里报道的数据,子宫内膜息肉中COX-2的存在可能暗示COX-2在子宫内膜息肉生长中的作用类似于结肠息肉中这种酶的作用[8]。
众所周知,子宫的某些紊乱会产生子宫内膜环境的改变,与子宫内避孕药具相关的子宫变化似乎导致IL-1b、TNF-α和IL-6升高。但是,无论子宫组成改变的原因如何,无论子宫内膜环境如何变化,都可能影响成功受孕的可能性。例如,据报道IL-1、TNF-α和IFN-g在高浓度下对胚胎发育和植入具有有害作用[24]。同样,这些细胞因子也参与了无法解释的反复流产[25]。在本研究中,发现绝经期子宫内膜息肉患者息肉中TNF-α和COX-2的表达呈相关性。TNF-α可通过趋化EOS聚集或诱导COX-2的表达,调控前列腺素分泌,从而加重炎性反应。TNF-α还能快速诱导EOS中P38磷酸化,从而诱导COX-2的产生,产生一系列病理反应[26]。
综上所述,子宫内膜息肉目前尚未明确发病机制,可能与炎症刺激、细胞增殖/凋亡失衡、局部血管生成异常等多种因素有关。本研究结果表明,患者的息肉组织相比于正常内膜组织,TNF-α和COX-2表达升高,并具有相关性,进一步验证了子宫内膜息肉的发生发展是多因素共同作用的结果;同时这也是临床上单一药物治疗后容易复发的原因,这也为该疾病需要综合的临床治疗提高了理论依据。
