冷冻鸡肉中单核细胞增生李斯特菌2个分离株的毒力及毒力相关因素研究
2022-04-11阮婷玉孙天浩康立超
李 楠,阮婷玉,孙天浩,康立超,彭 健,王 静*,马 勋*
(1.石河子大学动物科技学院,新疆石河子 832003;2.新疆农垦科学院分析测试中心,新疆石河子 832003)
单核细胞增生李斯特菌(Listeriamonocytogenes,LM)简称单增李斯特菌,是一种重要的食源性胞内病原体,由其引起的疾病能够侵害多种家畜、野生动物和人类,属自然疫源性人兽共患病。17多种禽类(如鸡、火鸡、鸽子和水禽等)对LM敏感[1],LM感染禽类后通常导致肠、脾、肝、肾、心脏、肺和气囊局部坏死[2]。LM耐受低温环境,常污染冷藏、冷冻食品[3]。评估宿主与LM病原体相互作用的体外和体内模型有很多,包括组织培养、小鼠、豚鼠、秀丽隐杆线虫[4]、果蝇和斑马鱼等。鸡胚已经被用来确定许多不同微生物的感染能力,包括细菌、真菌、寄生虫和病毒[5]。本文以2株冷冻鸡肉中分离的LM为研究对象,以鸡胚作为感染模型,对分离株的毒力及其相关致病因素的差异进行研究,以期为实验易感动物的扩展、食源性LM的致病机理奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和实验动物 2株冷冻鸡肉来源的LM分离株,编号为LM873和LM925,无害李斯特菌(L.innocua),均由石河子大学预防兽医学实验室保存;鸡胚由乌苏市鑫湖养鸡农民专业合作社提供。
1.1.2 主要试剂及引物 脑心浸液培养基(BHI)、10 g/L亚碲酸钾溶液,青岛高科技工业园海博生物技术有限公司产品;2×PCR Mix,广州东盛生物科技有限公司产品;DNA Marker,北京全式金生物技术有限公司产品;结晶紫,索莱宝生物科技有限公司产品;草酸铵,天津市北联精细化学品开发有限公司产品;NaCl,国药集团化学试剂有限公司产品。引物参考文献[6]设计8对引物(表1),由北京华大基因公司合成。
1.1.3 主要仪器 细菌振荡培养箱(IS-RDV 1),苏州捷美电子有限公司产品;普通PCR仪(ArKtiK),德国Thermo公司产品;台式高速冷冻离心机(LabCYCIeV),美国Bio-Rad产品;酶标仪(POWER WAVE XS),美国BIOTEK公司产品;电泳仪(CS-500V),英国Cleaver公司产品;孵化机,大江电子有限公司产品。
1.2 方法
1.2.1 鸡胚毒力测定 将鸡胚在37.9℃、53%湿度条件下孵育至14日龄,将LM873、LM925和L.innocua摇菌至对数生长期,然后进行菌量测定,将0.1 mL倍比稀释的细菌经绒毛尿囊膜接种鸡胚,对照组注入0.1 mL PBS,每组5枚鸡胚。接种后继续在相同条件下孵育,每天监测胚胎死亡情况至20日龄,用改良寇氏法计算菌的50%致死量(LD50)。计算公式:LD50=log-1[Xm-i(∑P-0.5)],其中:Xm为接种的最大剂量的对数;P为各组动物的死亡率;∑P为各组动物死亡率总和;i为组间距。

表1 本试验所用PCR引物
1.2.2 鸡胚肝脏指数测定 及时取出死亡鸡胚并剖检,观察其肝脏变化,称重鸡胚与肝脏,计算肝脏指数。对未死亡鸡胚在20日龄时剖检,操作同上。
1.2.3 毒力基因PCR检测 将LM873、LM925和L.innocua摇菌至对数生长期,收集菌液于-20℃保存备用。通过PCR扩增上述8个毒力基因,产物进行琼脂糖凝胶电泳,确定分离株有无毒力基因。 PCR扩增体系:2×PCR mix 12.5 μL,lmo0833、lmo2672、lmo1188、lmo1134、lmo0834、lmo2470、lmo1116和lmo2821基因的上、下游引物(25 μmol/L)各0.5 μL,菌液2 μL,剩余用超纯水补足25 μL。PCR扩增程序:94℃ 2 min;94℃ 20 s,60℃ 20 s,72℃延伸45 s,共35个循环;72℃ 2 min。
1.2.4 溶血活性测定方法 采集健康绵羊全血,制备成10 mL/L绵羊红细胞悬液。将菌液离心后取上清液,用PBS缓冲液调OD600nm值至相同大小,加入96孔板,加入等体积的10 mL/L绵羊红细胞悬液37℃作用2 h,并以PBS缓冲液作为空白对照,将能产生50%溶血的最高稀释倍数表示为溶血价。
1.2.5 生物被膜形成能力的测定 将3株菌分别培养,每孔加入180 μLBHI和20 μL培养菌液于96孔细胞培养板中,至每孔OD600nm值≈0.4~0.6,8个平行重复,37℃条件下静置培养2、4、6、8、10、12、24、36、48 h,吸去孔中的培养物,PBS洗涤3~5次,采用结晶紫染色法[7],每孔加100 μL 10 g/L结晶紫染色20 min,弃染液,PBS洗涤3~5次,倒置显微镜下观察不同时期生物被膜的形成状态。每孔加入950 mL/L乙醇脱色30 min,测定OD600nm值。
2 结果
2.1 冷冻鸡肉LM分离株鸡胚毒力测定结果
将不同浓度菌液经绒毛尿囊膜接种于14日龄鸡胚,连续观察和记录至21日龄,发现L.innocua组和PBS对照组对鸡胚无致死性,其他分离株均有致死性,其中接种LM925的鸡胚在16日龄开始死亡,死亡时间集中在16日龄~18日龄,接种LM873的鸡胚在17日龄开始出现死亡情况死亡集中在17日龄~20日龄,2株菌对鸡胚的致死率存在差异,用改良寇氏计算法进行统计发现,LM925的LD50为1.533,LM873的LD50为4.733,相差3.2个数量级(表2)。
2.2 鸡胚肝脏指数
鸡胚解剖称重发现,攻毒鸡胚的肝脏指数高于PBS和L.innocua组,差异显著(P<0.05),但2个分离株之间以及L.innocua和PBS之间无显著差异(表3)。
2.3 毒力基因检测
3株菌毒力基因检测结果显示,8个毒力基因均不存在于L.innocua中,lmo1116基因只存在于LM925中,除此之外其余7个毒力基因LM873和LM925均含有(图1)。
2.4 分离菌株溶血活性的测定结果
溶血活性结果显示L.innocua不溶血,LM925溶血价为24,LM873溶血价为23(图2),LM925的溶血能力比LM873高2倍。

表2 LM分离株接种鸡胚半数致死量(LD50)统计结果
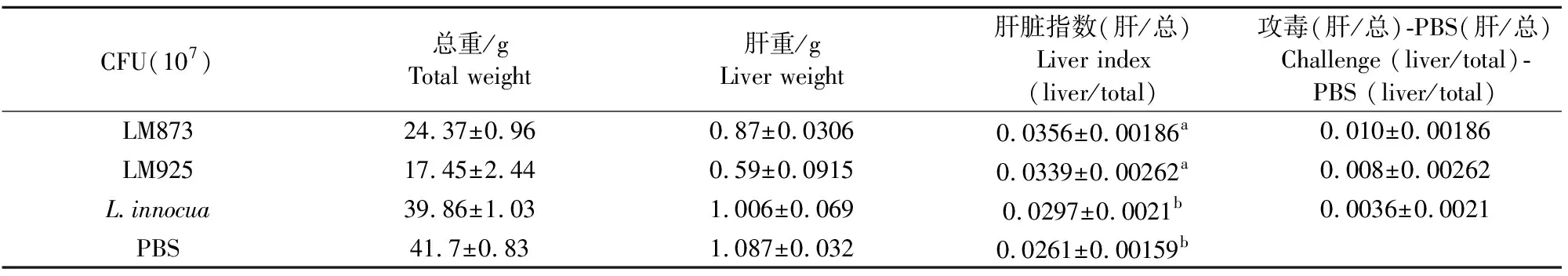
表3 鸡胚肝脏指数测定结果
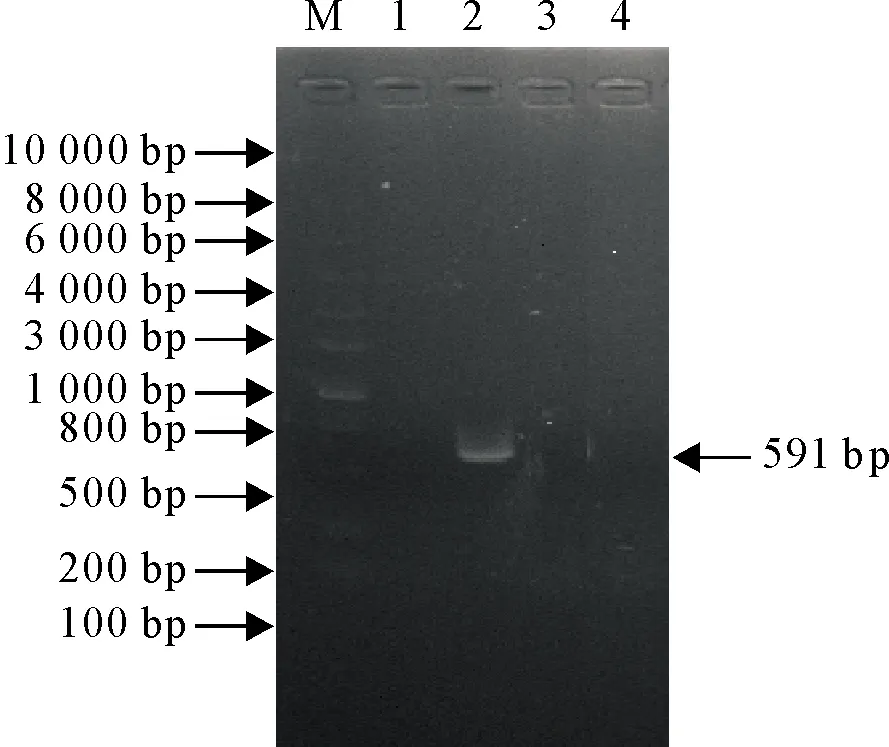
M.DNA标准DL 10 000 ;1.LM873;2.LM925;3.L.innocua;4.空白
2.5 生物被膜形成能力的测定
结晶紫染色法检测LM925、LM873和L.innocua的生物被膜形成能力。结果显示,6 h开始出现疏松的结构;8、10、12、24h时,逐渐形成明显有序的网状结构,36 h生物被膜的结构最明显,且密集程度最高,其中LM925的生物被膜最致密也最完整;48 h时网状结构开始瓦解,LM925还可见到松散的网格,而LM873和L.innocua的生物被膜已经完全消失(图3)。
生物被膜形成不同时间点OD600nm测定结果显示,6、8、10、12、24、36 h时,LM925与LM873相比,生物被膜的形成均差异显著(P<0.05),且在10、24、36 h时,LM925较LM873的差异极显著(P<0.01),48 h时,LM925与LM873无显著差异(P>0.05),而LM873与L.innocua仅在24 h时差异显著(P<0.05)(图4)。
3 讨论
由于LM在肉类食品中污染广泛,危害性大,因此,加强对LM的检测很重要。有研究对LM无毒株和强毒株的比较,筛选得到仅存在于强毒株的lmo0833、lmo0834和lmo1188基因。又通过比较EGD-e和L.innocua的转录调节因子和内化素筛选出lmo1116、lmo2672和lmo1134等转录调节因子基因,lmo2470和lmo2821等内化蛋白[6]。发现这8个毒力基因与L.innocua均无同源序列,小鼠毒力测定和大量细菌菌株PCR检测,结果显示这8个毒力基因可区分有毒和无毒LM分离株。本试验对这8个毒力基因的检测显示,L.innocua中不含8个毒力基因,LM925比LM873多1个lmo1116,而lmo1116是一个转录调节剂,可能调控了其他毒力基因的表达。本试验LM925的溶血活性强于LM873。单增李斯特菌溶血素O(listeriolysin O,LLO)作为LM致病最重要的毒力因子之一[8],LM能够利用进入宿主细胞细胞质躲避宿主免疫系统的攻击、摄取营养并增殖,这一过程很大程度上依赖LLO[9],鸡胚模型中LLO在LM导致鸡胚死亡过程中发挥关键性作用[2]。2株冷冻鸡肉LM分离株的毒力差异较大,其中LM925的LD50结果比LM873高3.2个数量级。综合毒力基因和溶血活性结果,确定LM925与LM873为有毒株,虽然LM925生物被膜的形成能力强于LM873,但LM873与L.innocua却无明显差异。结果推测2株冷冻鸡肉分离株毒力差异与溶血素活性和lmo1116基因有关。
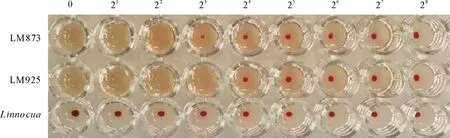
图2 LM873、LM925与L.innocua溶血价测定结果

图3 不同时间段生物被膜的观察结果
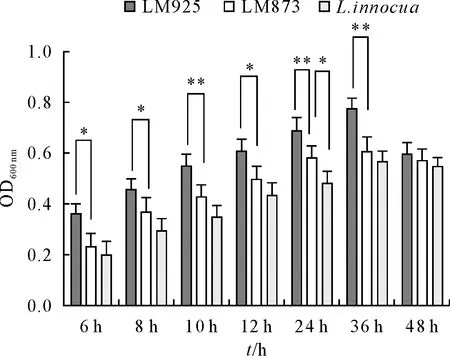
*P<0.05;**P<0.01图4 LM生物被膜形成能力测定结果
生物被膜是附着于物体表面的微生物群落,能够保护内部细菌免受免疫系统和抗菌药物的作用[10],生物被膜也易导致食品的持续污染。本试验发现LM925与LM873均具有形成生物被膜的能力,6 h有少量微菌落的形成,8 h开始生物被膜逐渐形成,36 h形成最致密、完整的生物被膜,48 h开始分散。由于生物被膜对消毒剂、低温等不利环境耐受性强,食品源LM一旦生成生物被膜,对食品安全的危害将更大。本试验以鸡胚作为感染模型,发现鸡胚对LM敏感,是LM感染的理想模型,而毒力相关因素分析表明2株菌为强毒株,且LM的毒力主要与溶血素活性和lmo1116相关。冷冻鸡肉LM分离株具有生物被膜形成能力,同时能致鸡胚死亡,提示养禽业与食品业应加大对LM的管控力度。
