鼻腔路径PM2.5暴露致大鼠中耳炎症及听力损伤的研究
2022-04-11管燕平田书心王碧旭田成华丁志山周芳美
管燕平 田书心 王碧旭 田成华 丁志山 周芳美
浙江中医药大学 杭州 310053
近年来随着我国工业化进程加快,大气细颗粒物(particulate matter 2.5,PM2.5)污染日趋严重,因其粒径小、比表面积大,表面往往吸附较多有害物质。大量研究表明,PM2.5成分复杂,主要包括微量重金属元素、碳类颗粒、多环芳烃类和生物性物质[1],由人体吸入后,可永久停于体内,严重损害呼吸系统、心血管系统、生殖系统及中枢神经系统等,并可增加耳鼻咽喉疾病的发病率[2-3]。
Zhang等[4]研究证明,脂多糖(lipopolysaccharide,LPS)引起的中耳炎症破坏了内耳液体平衡,显著影响了对内耳内环境稳态至关重要的血管纹内淋巴-血液屏障,而PM2.5吸附的多种病原微生物含有LPS成分,这提示PM2.5暴露可能与中耳炎症有着密切关联,并可能导致听力损失。目前研究显示,城市空气颗粒、沙尘、吸烟烟雾等吸入性颗粒物可以导致中耳组织病理学改变,促进中耳炎的发展[5-9],但PM2.5对中耳听力的影响尚未进行深入探究。
本实验以SD大鼠为研究对象,通过检测大鼠中耳腔内相关炎症因子表达、组织病理学改变以及听觉传导通路指标变化,旨在探讨鼻腔路径PM2.5暴露与短期听力损伤之间的联系及其相关机制,为听力损失防治研究提供新的线索。
1 材料和方法
1.1 实验动物及分组 无特定病原体(specific pathogen free,SPF)级健康雄性SD大鼠32只,共64耳,听力正常,体质量(200±10)g,购于上海斯莱克实验动物有限责任公司[实验动物生产许可证号码:SCXK(沪)2017-0005],饲养于浙江中医药大学动物实验中心[实验动物使用许可证号:SYXK(浙)2018-0012]。 将大鼠随机分为8组,正常对照组进一步分为第1、3、5、14天处死组,PM2.5染毒组同样分为第1、3、5、14天处死组,每组各4只,共8耳。
1.2 主要仪器和试剂 石英膜购于英国沃特曼公司(批号:1831032); 髓过氧化物酶(myeloperoxidase,MPO)酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA) 试剂盒、 白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒均购于上海钰博生物有限公司(批号:202002、201912);血管内皮生长因子(vascular endothelial growth factor,VEGF)ELISA 试剂盒购于北京欣博盛生物有限公司(批号:40031);粘蛋白5AC(mucin-5 subtype AC,MUC5AC)ELISA试剂盒购于CUSABIO生物有限公司(批号:K13012031);大鼠γ-干扰素(interferon-γ,IFN-γ) CBA Flex Set A6和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)CBA Flex Set C8检测试剂均购于美国BD公司(批号:9255717、9221625)。
Thermo Anderson G-2.5型 PM2.5大流量空气采样仪购于美国Thermo Fisher公司;美国智听SMART EP听觉诱发电位为上海涵飞医疗器械有限公司产品;Interacoutics Titan-IMP440中耳分析仪购于上海奥迪康国际贸易有限公司;Biosciences Accuri C6流式细胞仪购于美国BD公司。
1.3 方法
1.3.1 PM2.5悬液制备 在浙江中医药大学教学楼楼顶 (距离地面约20 m),采用PM2.5大流量空气采样仪,以5 L·min-1流量进行采样,连续采样3 d。将采样膜剪成1 cm×1 cm大小,置于丝口瓶中,加入磷酸盐缓冲液(phosphate buffer saline,PBS)至完全没过采样膜碎片,避光放入摇床,200 r/min充分洗脱24 h。超声震荡30 min后,洗脱液以8层无菌纱布过滤,真空冷冻干燥后获得PM2.5全颗粒物样品,-80℃避光保存备用。实验前用PBS配制成15 mg·mL-1悬液,超声20 min后使用。
1.3.2 鼻腔路径染毒方法 大鼠以1%戊巴比妥钠40 mg·kg-1腹腔注射麻醉,并固定于固定架上。结合咽鼓管特殊解剖位置[10-12],在内镜下采用软腭正中入路,在鼻咽部近鼻腔后端的软腭正中进针,PM2.5染毒组按1 mL·kg-1剂量将PM2.5悬液注射于咽鼓管开口附近,正常对照组注入1 mL·kg-1的PBS。两组连续干预7 d,于干预后第1、3、5、14天各处死4只大鼠进行指标检测。
1.3.3 鼓膜形态观察及听力学测试 充分麻醉大鼠,清除外耳道耵聍,借助电耳镜观察鼓膜形态;采用声导抗仪行鼓室图测试,探测音频率为226 Hz,压力变化范围为+200~-200 daPa(1 daPa=10 Pa),泵速为50 daPa·s-1,采用自制硅胶耳塞,适当调整探头,使之与外耳道紧密嵌合,确保声漏较少,记录鼓室声导纳值及峰压值。
1.3.4 听性脑干诱发电位(auditory brainstem response,ABR) 采用针灸针电极,记录电极置于颅顶矢状缝正中与双侧外耳道连线的交点,参考电极置于双侧耳后皮下,接地电极置于鼻根。Click声刺激,刺激速率13.1次·s-1,滤波范围50~3 000 Hz,叠加1 024次,测试以10 dB nHL为梯度,自40 dB nHL依次降低强度,接近阈值处以5 dB nHL为步距进行刺激,若Ⅲ波消失,则上升5 dB nHL重复两次,以判断反应阈值。
1.3.5 炎症因子水平检测 消毒大鼠耳部,剪除外耳,暴露中耳,以PBS反复灌洗双侧中耳各4次,收集中耳灌洗液(middle ear lavage fluid,MELF),以1 000 r/min离心5 min,收集上清液。严格按照ELISA试剂盒说明书检测MELF上清液中VEGF、MPO、MUC5AC和IL-6水平;采用流式细胞术检测TNF-α、IFN-γ水平。
1.3.6 中耳组织切片观察 取大鼠一侧听泡,4%多聚甲醛固定24 h,10%乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)溶液脱钙至骨质软化,经梯度乙醇脱水后,石蜡包埋切片,常规苏木精-伊红(hematoxylin-eosin,HE)染色,光镜下观察中耳黏膜增生及炎症细胞浸润情况。
1.4 统计学分析 采用SPSS 22.0统计软件进行统计学分析,以Graphpad Prism 7.0软件进行图表分析,计量资料以x±s表示,两组组间比较采用独立样本t检验,多组间不同时间点比较采用双因素重复测量方差分析。两两比较方差齐时采用Befforoni检验,方差不齐时采用Dunnett's T3检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠鼓膜形态变化比较 第1~14天正常对照组鼓膜形态完好,可见明显光锥。PM2.5染毒组大鼠染毒后第1、14天鼓膜形态变化不大;第3天可见鼓膜表面充血内陷,光锥消失,其中2耳存在轻度中耳积液;第5天可见鼓膜表面浑浊暗淡,其中4耳存在中耳积液。
2.2 不同时间点各组大鼠鼓室图测试变化比较 与染毒前比较,染毒后第3、5天PM2.5染毒组大鼠声导纳值明显下降(P<0.01,P<0.0001),峰压值低于正常范围(-50~+50 daPa);与正常对照组比较,峰压值显著下降(P<0.0001)。见表1。染毒后第1天峰压值有所下降,但未超出正常范围,为A型鼓室图,第3天有2耳为B型(平坦型)鼓室图,第5天共4耳为B型(平坦型)鼓室图,其余均为C型(负压型)鼓室图。正常对照组各项指标参数均在正常范围内,均为A型鼓室图。
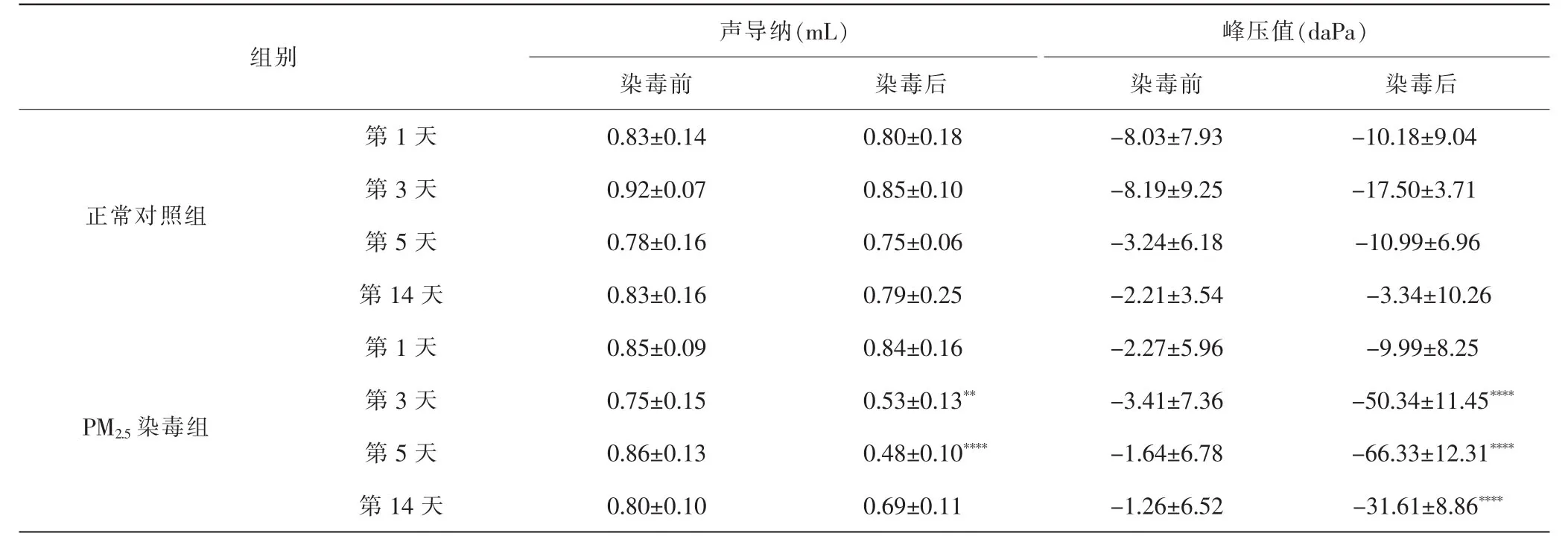
表1 各组大鼠造模前后声导纳、峰压值比较Tab.1 The changes of acoustic admittance and peak pressure before and after nasal route modeling in each group
2.3 不同时间点各组大鼠ABR变化比较 PM2.5染毒组染毒后第3、5天反应阈值显著升高(P<0.01),染毒后第1、14天反应阈值均在正常范围内;正常对照组染毒前后ABR反应阈值相对稳定,均在误差范围内。与染毒前比较,PM2.5染毒组40 dB nHL处Ⅲ波潜伏期在染毒后第3、5天延迟(P<0.05,P<0.001),第1、14天潜伏期无明显变化;正常对照组染毒前后40 dB nHL处潜伏期相对稳定,差异无统计学意义(P>0.05)。见表2。
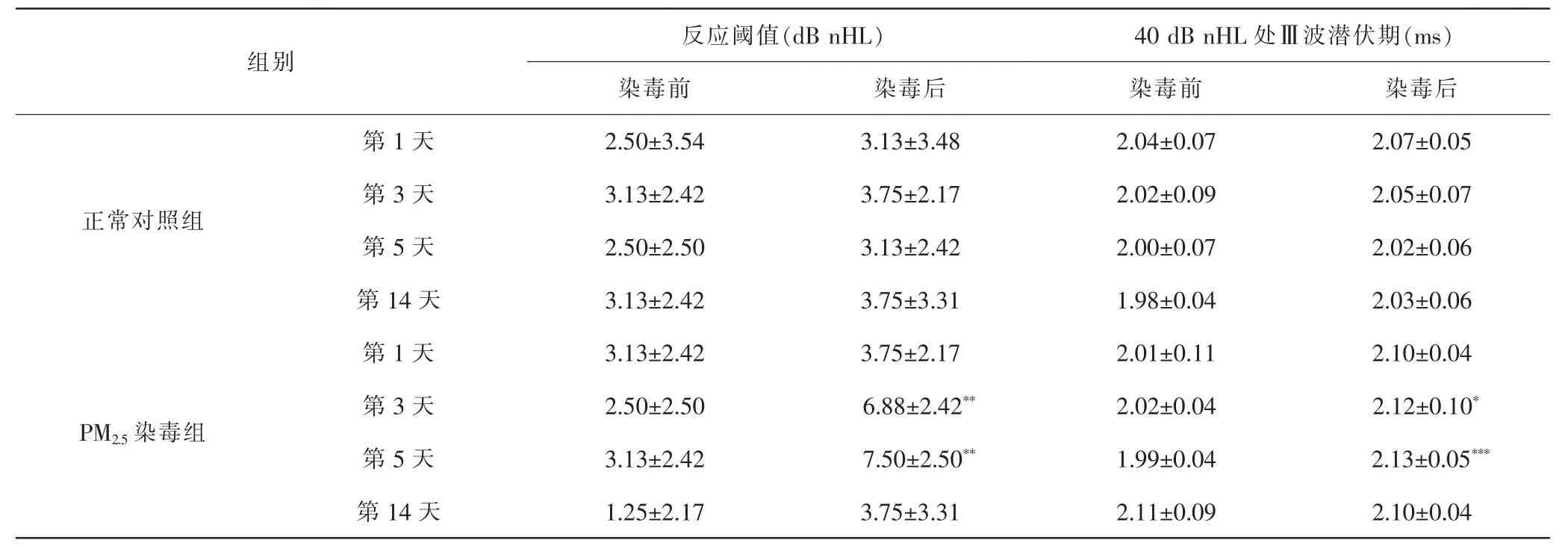
表2 各组大鼠造模前后反应阈值、40 dB nHL处Ⅲ波潜伏期变化Tab.2 Changes of response threshold and latency of wave Ⅲ at 40 dB nHL before and after modeling in each group
2.4 各组大鼠中耳黏膜VEGF、MPO、MUC5AC水平比较 与正常对照组比较,PM2.5染毒组大鼠染毒后第3、5天,VEGF水平均升高(P<0.01);MPO和MUC5AC水平均显著升高(P<0.0001)。 VEGF、MPO、MUC5AC水平均于第5天达到高峰,而后呈下降趋势;染毒后第14天,各指标水平差异无统计学意义(P>0.05)。见图1。

图1 各组大鼠VEGF、MPO、MUC5AC表达情况Fig.1 The expression of VEGF,MPO and MUC5AC in each group
2.5 各组大鼠中耳炎症因子表达比较 与正常对照组比较,PM2.5染毒组大鼠染毒后第3、5天,IL-6、TNF-α、IFN-γ水平均不同程度升高 (P<0.01,P<0.001,P<0.0001),于第3或5天达到高峰后呈缓慢下降趋势;染毒后第14天,各指标水平差异无统计学意义(P>0.05)。 见图2。

图2 各组大鼠MELF炎症因子表达比较Fig.2 Expression of inflammatory factors in MELF in each group
2.6 大鼠中耳黏膜病理改变比较 HE染色结果显示,正常对照组鼓室黏膜为单层上皮细胞,无明显破坏,无明显炎症反应。与正常对照组比较,PM2.5染毒组大鼠染毒后第1天中耳黏膜形态基本正常;第3、5天中耳黏膜厚度显著增加,第5天尤为明显,中耳上皮细胞排列紊乱,炎性细胞浸润明显,伴黏膜纤毛脱落;第14天中耳黏膜厚度降低,但仍略有增厚。见图3。

图3 鼻腔路径染毒大鼠中耳黏膜形态学改变(HE染色,400×)Fig.3 Morphological changes of middle ear mucosa in rats exposed to nasal route(HE staining,400×)
3 讨论
已有研究显示,大气颗粒物污染会影响耳科疾病的发生与发展[13]。PM2.5作为重要的大气颗粒物污染之一,因其粒径小,比表面积大,极易富集重金属、病原微生物、多环芳烃等有害物质,又因其渗透性强,沉积于细小支气管分支和肺泡的速度极快[14]。以往研究多集中于PM2.5对呼吸与心血管系统的影响,针对PM2.5与听力关系的研究寥寥可数。众所周知,中耳是一个含气空腔,外以鼓膜接外耳道,前经咽鼓管与鼻咽腔相通,易受细菌、病毒感染以及颗粒物损伤,引起中耳功能受损。鼻腔作为呼吸道防御的第一道门户,首先接触空气中的PM2.5,进而发生吸附、吸收反应。经鼻呼吸时,纤毛和黏液对大多数直径超过10 μm的颗粒物起着非常有效的过滤作用[14],而PM2.5的大小与细菌相似,可能经过鼻纤毛向后输送,导致咽鼓管咽口水肿和鼻咽部感染逆行入中耳。本研究通过软腭正中入路染毒,模拟鼻腔路径PM2.5暴露,研究PM2.5对于听力的影响,并探讨其作用机制。
鼓室声导抗对分泌性中耳炎的诊断价值已被国内外学者所肯定,具有特异度和灵敏度高等特点。大鼠鼻腔路径染毒后第3、5天后声导纳值显著降低,峰压值向负值方向变化,提示大鼠中耳的声能量传导特性发生改变,导致中耳腔吸收的声能量减少,这可能与PM2.5引起的咽鼓管阻塞以及而后导致中耳腔内的炎性变化有关。咽鼓管功能障碍,中耳内外压力平衡功能失调,产生中耳负压,诱导炎症反应。本研究发现,染毒后第3、5天的鼓室图为B型(平坦型)和C型(负压型)。文献显示,B型鼓室图为典型的鼓室积液图,C型鼓室图提示咽鼓管功能不良或阻塞,中耳气体被吸收形成负压,导致鼓膜内陷,两者都与分泌性中耳炎有密切关系[15]。同时电耳镜可见,染毒后第3、5天鼓膜表面浑浊,出现中耳积液,2周后均出现代偿趋势,说明这是一种急性损伤,有缓慢自愈的特点。此外,本研究采用以Click声为刺激声的听性脑干反应测试,该项测试瞬态特异性好,波形分化清晰,在一定程度上可评估听觉传导通路的功能变化[16]。与染毒前相比,鼻腔路径染毒后第3、5天ABR反应阈值和40 dB nHL处Ⅲ波潜伏期上升明显,这提示听觉传导通路出现异常,声能量到达听皮层的时间延长[17]。听功能的变化可能与中耳的阻抗调节系统损伤有关[18],PM2.5染毒后经咽鼓管作用于中耳,导致急性炎症损伤,产生鼓室积液,阻滞声信号传导,使得进入内耳的声能量减少;听功能的下降亦可能与PM2.5的毒性作用有关,致使血管纹内淋巴-血液屏障出现障碍,听觉通路功能下降。
本研究联合运用鼓室图测试和听性脑干反应测试检测大鼠听功能变化,使结果更具有参考性。结果证明,鼻腔路径PM2.5染毒后第3、5天大鼠听力损伤明显,第14天好转。本研究进一步探究了可能的机制,中耳炎症反应是导致中耳功能损伤的主要原因之一,TNF-α、IL-6、IFN-γ等炎症因子是造成急性中耳炎的分子基础。研究表明,TNF-α可通过核因子-κB(nuclear factor-κB,NF-κB)信号通路诱导炎性因子的分泌,从而加速炎症反应[19];IL-6可促进免疫细胞增殖,延长炎症反应的持续时间[20]。中耳炎时两者均可促使中耳腔组织结构重塑,诱导骨质破坏,导致中耳损伤[21]。IL-6还可以作为诱导因子,诱导机体分泌VEGF,促进血管新生和炎症发展[22]。IFN-γ是Th1型辅助T细胞的特征性细胞因子,可由巨噬细胞等分泌,作为强大的前炎症因子激活局部炎症反应[23]。本研究结果显示,鼻腔路径染毒后第3、5天,PM2.5染毒组大鼠MELF中IL-6、TNF-α、IFN-γ表达均不同程度升高,后期呈缓慢下降趋势,至第14天与正常对照组差异无统计学意义,提示鼻腔路径PM2.5染毒后第3、5天,中耳黏膜组织发生炎性细胞浸润。
鼻腔路径VEGF、MPO的表达在染毒后第3、5天均升高,达到高峰后呈缓慢下降趋势。VEGF是作用最强的促血管生成细胞因子,能够特异性作用于血管内皮细胞,促进细胞增殖、出芽、迁移,诱导血管生成,增加血管通透性[24],其表达的增加会加重中耳黏膜水肿,增加炎性细胞的浸润,加剧中耳炎症,已证实与耳蜗功能和听力损失密切相关[25]。MPO是一种血红素蛋白,富含于中性粒细胞中,是中性粒细胞浸润的重要指标,可促进活性氧簇(reactive oxygen species,ROS)的分泌,同时与单核细胞结合促进细胞因子分泌,加重炎性损伤[26-27]。本研究选用VEGF、MPO为指标,侧面反映大鼠中耳黏膜的炎性改变。MUC5AC是中耳积液中积聚的主要粘蛋白,存在于黏膜表面,起着保护和润滑上皮作用,并且通过对病原体的黏附,发挥防御作用[28-29]。鼻腔路径MUC5AC的表达在染毒后第3、5天均显著升高,而后不断下降,证明PM2.5染毒所造成的急性炎症损伤伴有一定程度中耳积液,而后缓慢吸收。中耳组织切片HE染色结果显示鼻腔PM2.5暴露可以诱导中耳黏膜增厚、炎细胞浸润等特征性形态学改变,2周后缓慢趋于正常,直观反映了大鼠中耳黏膜的急性炎症改变和自愈过程,与Chang等[8]和Park等[30]研究结果相符。
综上所述,本研究初步证实了鼻腔路径PM2.5暴露可导致大鼠中耳急性炎性损伤并伴有积液渗出,引起听力功能损失。本研究结果将为听力损失防治研究提供新的线索,在临床诊断和治疗中具有借鉴价值。深入探讨大气PM2.5对听觉功能的危害,对提高人群的健康水平具有较重要的现实意义。
