温敏型细胞培养皿的生物学研究及其对细胞生长的影响
2022-04-11王霄彤


摘要:目的 观察温敏型细胞培养皿生物学研究以及对于细胞生长指标的影响,为贴壁型易损伤细胞在体外扩增和细胞治疗等医疗应用方面提供安全依据。方法 采用内毒素试验、溶血试验和细胞毒性试验观察温敏型细胞培养皿的生物安全性,另外通过细胞贴壁生长汇合度和细胞温敏脱落率观察温敏细胞培养皿对于细胞生长的影响。结果 温敏细胞培养皿在凝胶法细菌内毒素试验条件中浓度小于0.25 EU/mL;在体外溶血试验中溶血率<5%;细胞毒性反应级别为2级;细胞贴壁生长汇合度和细胞温敏脱落率均>80%。
关键词:温敏细胞培养皿;医疗器械;内毒素;溶血;细胞毒性
【中图分类号】 R197.39 【文献标识码】 A 【文章编号】2107-2306(2022)06--02
Abstract: Objective To observe the biological research of temperature-sensitive cell culture dish and its effect on cell growth indexes, and to provide a safe basis for the medical application of adherent vulnerable cells in vitro expansion and cell therapy. Methods Endotoxin test, hemolysis test and cytotoxicity test were used to observe the biosafety of temperature-sensitive cell culture dishes. In addition, the effect of temperature-sensitive cell culture dishes on cell growth was observed by cell adherent growth confluence and cell temperature-sensitive shedding rate. Results The concentration of temperature-sensitive cell culture dishes was less than 0.25 EU/mL in the gel method bacterial endotoxin test conditions; the hemolysis rate in the in vitro hemolysis test was less than 5%; the cytotoxic reaction grade was grade 2; Cell adherent growth confluence and cell temperature-sensitive shedding rate were both >80%.
Key words: Temperature-sensitive cell culture dish; Medical device; Endotoxin; Hemolysis; Cytotoxicity
随着临床治疗的发展,一个新的治疗方式——细胞治疗,慢慢进入人们视野。这种治疗方式是在体外培养的健康干细胞,随后移植到患者体内,植入人体的健康干细胞通过自身的分化和增殖起到修复或替换人体原有的受损细胞或组织来达到治愈的目的。但是,干细胞本身十分脆弱,因此其在体外培养的条件也十分苛刻。为了保证干细胞在培养和传代過程中尽可能保证完整性和减少损失,一般选用温敏细胞培养皿进行体外干细胞的培养。温敏细胞培养皿因对温度敏感的特性,其聚合物涂层能够随着外界温度的变化将温敏表面从疏水转向亲水,从而获得具有高活力和完整表面蛋白的贴壁干细胞,避免细胞受外力或蛋白酶水解的损伤,并最大程度保留细胞表面蛋白。本研究通过对温敏细胞培养皿的内毒素含量、溶血率和细胞毒性[1]的生物学研究以及细胞贴壁生长汇合度和细胞温敏脱落率的生长指标研究,观察温敏细胞培养皿的性能,为其在医疗器械制造以及应用方面提供安全依据和建议。
1.材料与方法
1.1材料 小鼠成纤维细胞 L-929(美国菌种保存中心(ATCC)),细菌内毒素检测用水(湛江博康海洋生物有限公司),鲎试剂(TAL,灵敏度0.25 EU/mL,规格0.1mL)(湛江博康海洋生物有限公司),细菌内毒素工作标准品15EU/支(湛江博康海洋生物有限公司),MEM培养基(Hyclone),胎牛血清(Clark),青链霉素(Gibco),胰蛋白酶(biosharp),PBS(Gibco),MTT(Solarbio),异丙醇(Rhawn),0.9 %氯化钠注射液(广西裕源药业有限公司),高密度聚乙烯(Hatano Research Institute. FDSC),DMSO(Macklin)。
1.2仪器 电热恒温干燥箱(上海精宏),紫外分光光度计(INESA),CO2 培养箱(Thermofisher Scientific),电子天平(赛多利斯),恒温水浴锅(Crystal),洁净工作台(苏净安泰),低速自动平衡离心机(湖南湘仪),Multiskan? Sky酶标仪(Thermofisher Scientific),倒置显微镜(含成像)(NIKON)、 立式单门双层恒温振荡箱(Crystal)
1.3实验动物 新西兰兔3只,健康、初成年、雌性未产且无孕,试验初体重2.3~2.8 kg,来源于无锡恒泰实验动物养殖有限公司,许可证号:SCXK(苏)2015-0004,每天供应无锡恒泰实验动物养殖有限公司的实验兔全价颗粒饲料。饲养环境温度为18-26 ℃,相对湿度30 %-70 %。
1.4方法
1.4.1内毒素试验 将所有玻璃器皿和其他热稳定材料在250℃的温度下脱热至少30min去除外源性内毒素,被测物品的内毒素限值:L≤20EU/件,鲎试剂灵敏度:λ= 0.25 EU / mL,浸提介质体积:V= L/ λ。取同批次3件样品,将温敏细胞培养皿在无菌内毒素检查用水中浸提,于37 ℃条件下孵育1小时。准备细菌内毒素标准品2支,按《细菌内毒素工作标准品使用说明书》配制2λ内毒素标准溶液以及2λ测试样品溶液。取12支0.1mL/支的鲎试剂,开瓶后先在每支安瓿瓶中各加入0.1mL检查用水溶解鲎试剂粉末,之后三个平行样品的每2支各加入0.1mL测试样品浸提液作为测试样品管(A),2支加入0.1mL含有2λ的测试样品浸提液作为样品阳性对照管(B),2支加入0.1mL含有2λ的检查用水作为阳性对照管(C),2支加入0.1mL检查用水作为阴性对照管(D)。将试管中液体轻轻混匀并用封口膜封闭管口,垂直放入37℃恒温水浴锅中。60分钟后将试管轻轻取出,缓慢倒转180°。若试管内容物呈紧实凝胶,不变形,不从管壁滑脱为阳性,记录为(+);不呈凝胶或虽生成凝胶但不能保持完整并从管壁滑脱为阴性,记录为(-)。在试验有效情况下,如果测试样品管两个平行管均为阴性,判定测试品内毒素含量小于药典规定限值。
1.4.2溶血试验 将温敏细胞培养皿按照按照0.2 g/mL的比例浸没在0.9%氯化钠注射用水中,于37℃恒温水浴锅中浸提。新西兰兔心脏采血10 mL至一次性使用真空采血管(EDTA-K2管)混勻,按照新鲜抗凝兔血:氯化钠注射液为8mL:10mL比例稀释。浸提结束后,每支试管内按照10 mL浸提液:0.2 mL稀释后的兔血比例加入稀释后兔血,轻轻混匀,继续放置于37℃水浴锅中60分钟。保温结束后倒出管内液体,以2500 rpm离心5分钟,吸取上清液于比色杯中,空白比色杯调零,在545 nm波长处测定吸光度值,计算平均值和溶血率。溶血率% =(供试品组吸光度-阴性对照组吸光度)/(阳性对照组吸光度-阴性对照组吸光度)×100%。溶血率小于5%时判定合格。
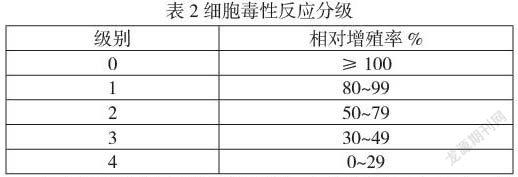
1.4.3细胞毒性试验 全程在超净台内操作,保证无菌操作过程。将温敏细胞培养皿按照0.2 g/mL的比例浸没在含血清的培养基中,于37 ℃浸提24小时。生长至对数生长期的L-929细胞用0.25%的胰蛋白酶(含EDTA)消化,消化后将细胞悬浮液离心(1000 rpm,5分钟),弃去上清,用MEM培养基重悬细胞,计数得到1×104个/mL 细胞悬液。将细胞悬液以每孔100 μL 接种于96孔板中,并在细胞培养箱(37 ℃,5% CO2,>90%湿度)中培养,镜下观察细胞形态。待孵育24小时后弃去96孔板内原培养基,在96孔板相应孔内各加入100 μL浸提液,空白对照(含血清培养基),阴性对照(按3cm2/mL浸提的高密度聚乙烯)和阳性对照(0.1% ZDEC)。将96孔板置于细胞培养箱中培养72小时,每组设置六个复孔。培养72小时后取出96孔板,在显微镜下观察细胞形态,然后去除液体,每孔加入20 μL质量浓度为5 g/L的MTT溶液,置二氧化碳培养箱中培养。4小时后去除上清,每孔加入150 μL异丙醇溶解结晶,在酶标仪上测定570 nm和630 nm 波长下的吸光度值,计算其细胞毒性。细胞活力%=试验(或阴性及阳性)样品组OD570 /空白对照组OD570×100%。根据表2分级标准判定。阴性对照组的级别应≤1级,阳性对照组≥3级。供试品分级不大于2级时判定为合格。
1.4.4细胞贴壁生长汇合度试验 全程在超净台内操作,保证无菌操作过程。生长至对数生长期的细胞用0.25%的胰蛋白酶(含EDTA)消化,消化后将细胞悬浮液离心(1000 rpm,5分钟),弃去上清,用MEM培养基重悬细胞,计数得到2×106个/mL 细胞悬液。接种10 mL细胞悬液至温敏细胞培养皿,并在细胞培养箱(37 ℃,5% CO2,>90%湿度)中培养48小时,倒置显微镜下观察细胞汇合度。
1.4.5细胞温敏脱落率试验 取L-929细胞生长汇合度良好的温敏细胞培养皿,置于4℃冰箱,低温放置20分钟后用移液枪均匀吹打培养皿表面20次,收集脱落细胞并计算脱落细胞总数,再用胰酶消化培养皿中未脱落的细胞并计数。计算收获细胞总量,并计算细胞脱落率。脱落率=/(温敏脱落收获的细胞数+胰酶消化收获的细胞数)×100%。
1.5统计方法 数据表示为mean±SD。
2. 结果
2.1细菌内毒素试验 阴性对照管结果均为阴性,阳性对照管结果均为阳性、测试样品阳性对照管结果均为阳性,测试样品管结果均为阴性。在凝胶法细菌内毒素试验条件中浓度小于0.25 EU/mL。
2.2溶血试验 阴性对照组吸光度平均值为0.004,阳性对照组吸光度平均值为0.601,测试样品吸光度平均值为0.013,见表3,溶血率=(0.013-0.004)/(0.601-0.004)×100%=1.51%。因此试验样品在体外溶血试验中溶血率<5%,无溶血反应。
2.3细胞毒性试验 试验样品浸提液在与细胞接触72小时后在显微镜下均可见胞浆内离散颖粒,无细胞溶解和细胞增殖下降情况。细胞存活率分别为71.2%,细胞分级为2级,无潜在的细胞毒性,见表4。
2.4细胞贴壁生长汇合度试验 L-929细胞在温敏细胞培养皿中培养48小时后细胞形态完好,细胞汇合度大于80%。
2.5细胞温敏脱落率试验 温敏细胞培养皿在4℃冰箱放置20分钟后用移液枪均匀吹落细胞总数为6.5×108个,用胰酶消化培养皿中未脱落的细胞总数为1.5×108个,因此脱落率=6.5×108个/(6.5×108个+1.5×108个)×100%=81.25%。
3. 讨论
随着干细胞研究的不断深入,通过体外培养细胞进行人体疾病治疗的方法也逐渐成为一种新型的治疗方式。这种治疗方式对于神经方面、免疫方面疾病以及其他内科或外科疾病都有良好的治疗效果,并且由于它的自我更新和多向分化的潜能[2],在病人体内也能起到造血支持和免疫调控的作用。但是干细胞非常脆弱,其在体外的培养通常会受到许多因素的影响,如干细胞生存所需的养分、培养基的pH值、培养环境的温度、氧气和二氧化碳的含量等。细胞制备作为细胞治疗的重要环节,为了保证其在临床治疗上的有效性,必须尽可能从细胞培养介质上收获无损伤、高活性且功能完好的贴壁细胞。传统的方式是利用胰蛋白酶进行消化,但这种方式对于细胞治疗来说存在很多缺点。由于胰蛋白酶会降解细胞膜蛋白和细胞外基质,导致细胞活力降低甚至某些功能的丧失[3,4],最终影响临床治疗时细胞质量。此外,胰蛋白酶的来源一般是动物衍生的蛋白质,由于种属的不同在治疗时可能会存在疾病传播风险[5]。温度作为对环境敏感的聚合物系统中使用最广泛的一种刺激方式,相比于其他因素来说其变化更容易控制,因此温敏细胞培养皿适合用于细胞的培养与收获,避免了培养过程中细胞由于外力或蛋白水解的损伤,是目前最有应用前景的细胞培养材料。温敏性聚合物材料存在最低临界溶解温度[6],当温度处在最低共溶温度时温敏性聚合物发生从无规卷曲形式到塌陷或球形形式的相变,温敏表面从疏水转向亲水,而使貼壁细胞能够轻易脱落,获得表面蛋白完整且活力高的贴壁细胞。
宋克东[7]等发现在制备的温敏性玻璃微载体上骨髓间充质干细胞能够保持粘附并具有良好的生长曲线,降温收获细胞后再培养也能保持良好的生长活性。此外,温敏型壳聚糖支架与诱导后的脂肪干细胞复合后不会影响干细胞表型和功能的变化,可作为干细胞植入的可注射性载体材料[8]。因此,利用温敏细胞培养皿能够满足生物医学和组织工程中对于高质量细胞的需求。在本研究中也发现温敏细胞培养皿在培养细胞过程中细胞生长汇合度良好,对细胞生长无不良影响,且能够依据温度变化收获>80%的贴壁细胞,发挥其温敏特性保持细胞的完整性。同时,作为细胞治疗中的医疗器械,在生物学试验中内毒素含量合格,且无溶血反应和细胞毒性反应,体现出良好的生物学特性。因此,研究温敏型细胞培养皿的特性能够为贴壁型易损伤细胞在体外扩增和细胞治疗等医疗应用方面提供安全依据。
[1]GB/T 14233.2-2005医用输液、输血、注射器具检验方法 第2部分:生物学试验方法
[2]Pegtel D M and Gould S J. Exosomes [J].Annu Rev Biochem, 2019, 88: 487-514.
[3]Dey S, Kellam B,Alexander MR, et al. Enzyme-Passage Free Culture of Mouse Embryonic Stem Cells on Thermo-Responsive Polymer Surfaces[J]. Journal of Materials Chemistry, 2011, 21(19): 6883.
[4]Yang H S, Jeon O, Bhang S H, et al. Suspension Culture of Mammalian Cells Using Thermosensitive Microcarrier That Allows Cell Detachment without Proteolytic Enzyme Treatment[J]. Cell Transplant, 2010, 19(9): 1123-1132.
[5]Nakajima K,Honda S, Nakamura Y, et al. Intact Microglia Are Cultured and Non-Invasively Harvested without Pathological Activation Using a Novel Cultured Cell Recovery Method[J]. Biomaterials, 2001, 22(11): 1213-1223.
[6]Plate N A, Lebedeva T L, Valuev L I. Lower Critical Solution Temperature in Aqueous Solutions of Yv-Alkyl-Substituted Polyacrylamides[J]. Polymer Journal, 1999, 31(1): 21-27.
[7]宋克东,杨延飞,武爽,李丽颖,闫新宇,刘天庆. BMMSCs在温敏性玻璃微载体上的培养及收获[J]. 高校化学工程学报,2016,30(03):633-640.
[8]文天用,李放,叶超群,刘连江. 脂肪干细胞与温敏型支架构建人工髓核的体外研究[J]. 中国康复理论与实践,2010,16(04):335-338.
作者简介:王霄彤,1994年6月,女,江苏苏州,助理工程师,中检华通威国际检验(苏州)有限公司,医疗器械生物相容性检测
