太子参RAPD 反应体系的优化
2022-04-07董晓菲叶祖云
史 辉,董晓菲,叶祖云
(1.宁德师范学院生命科学学院,福建宁德 352100;2.闽东特色生物资源福建省高校工程研究中心,福建宁德 352100)
太子参为石竹科(Caryophyllaceae)假繁缕属(PseudostellariaPax)植物孩儿参[Pseudostellaria heterophylla(Miq.)Pax ex Pax et Hoffm]的干燥块根,具有益气健脾、生津润肺之功效[1].福建省柘荣县被誉为中国太子参之乡,90%农户种植太子参,太子参产量占全国产量的50%以上[2].目前太子参选育工作严重滞后,缺乏科学规范的品种选育与种源管理.长期以来,由于不同产地的太子参互引互种频繁,且引种交流缺乏系统性,从而导致现有栽培群体间种源混杂,内在质量和药材产量参差不齐.因此,对太子参种质资源进行鉴定和品种改良的研究势在必行.
随机扩增多态性DNA 标记(random amplified polymorphic DNA,RAPD)是Williams 等[3]和Welsh 等[4]于1990年建立的检测基因组DNA多态性的分子标记技术.该技术具有操作简单、灵敏度高、成本低等特点,且不需要提前获知被研究材料的基因组序列,就可以较全面地展示个体间的变异情况[5].目前,该技术已被广泛应用于植物遗传多样性分析、基因定位和品系鉴定等领域[6].但RAPD 标记技术也存在着一些缺点,如:引物序列较短,退火温度较低,对实验条件的变化非常敏感,实验重复性一般[7].因此,针对不同的研究材料,优化建立其RAPD 反应体系对获得稳定的试验结果至关重要.
1 材料和方法
1.1 试验材料
供试材料为柘参1号,2018年3月采自柘荣县太子参良种繁育基地,取完好的幼嫩叶片提取基因组DNA.
试剂植物基因组DNA 提取试剂盒、TaqDNA 聚合酶、dNTPs、Marker(DM2000)均购自北京康为世纪生物科技有限公司;引物由武汉擎科创新生物科技有限公司合成;琼脂糖为西班牙Biowest进口分装;其他试剂均为国药分析纯.
仪器超微量核酸蛋白测定仪(美国ACTGene Nanodrop 2000)、梯度PCR 扩增仪(美国Biometra C-412)、全自动凝胶电泳成像仪(美国伯乐Gel DocTM EZ)、电泳仪(北京六一DYY-10C)、超纯水机(美国Milipor)、高速冷冻离心机(德国Sigma 3K-30)、微量移液器(法国吉尔森Ppetman系列).
1.2 试验方法
RAPD-PCR 反应体系单因子优化选用S10 RAPD 引物,模板为柘参1 号DNA,分别对影响RAPD-PCR 扩增的模板DNA 用量、TaqDNA 聚合酶浓度、dNTPs 浓度、引物浓度、退火温度、循环次数和延伸时间7 个因素进行优化,每个优化设3 次重复,每个条件的优化结果作为下一个实验的条件.分别设置9 个模板量:7、14、21、28、35、42、49、56、63 ng;9 个TaqDNA 聚合酶浓度:0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1 U;8 个dNTPs 用量:0.10、0.13、0.16、0.19、0.22、0.25、0.28、0.31mmol·L-1;9 个引物用量0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8µmol·L-1;8 个退火温度:28、30、32、34、36、38、40、42 ℃;4个循环数:30、35、40、45 次;4 个延伸时间:60、80、100、120 s.初始扩增体系(20 µL)含10×buffer 2µL、50 ng·µL-1模板DNA 2 µL、4 µmol·L-1引物2 µL、2.5 mmol·L-1dNTPs1.6 µL、Taq酶0.9 U.初始扩增程序为:94 ℃预变性4 min;94 ℃变性45 s,36 ℃退火45 s,72 ℃延伸90 s,共35 个循环[8].扩增产物经1.5%琼脂糖电泳检测,凝胶成像系统拍照记录.比较PCR 体系中各因子的不同水平对扩增效果的影响,前一个因子的最适条件确定后,作为下一个因子优化的反应条件.以优化后的反应体系进行RAPD-PCR反应体系的稳定性检测,用S1 引物对10 个太子参样品进行扩增.
2 结果与分析
2.1 单因素试验结果分析
2.1.1 退火温度对RAPD-PCR 的影响 退火温度对扩增影响较大(图1),当退火温度低于38 ℃时,500~750 和250~500 bp 之间的一些片段条带不清晰,或者没有扩增;当退火温度高于38 ℃时,一些大片段(1 000~2 000 bp)的扩增条带亮度降低,甚至数量减少.因此,选择38 ℃为最适的退火温度,作为优化的结果进行下一步优化.

图1 退火温度对RAPD-PCR的影响
2.1.2 模板量对RAPD-PCR 的影响 模板量对结果影响不明显,对扩增条带的亮度有轻微的影响(图2),而对谱带数量几乎没有影响.随着模板用量的增加,条带亮度也随之增加,当模板量达到28 ng时,条带清晰且亮度较高,继续增加模板量对谱带亮度和数量没有影响.因此,在20µL 的反应体系中,28 ng是最适的模板DNA量.

图2 模板量对RAPD-PCR的影响
2.1.3TaqDNA 聚合酶浓度对RAPD-PCR 的影响Taq酶浓度对扩增影响较显著,主要影响谱带的亮度和种类(图3).随着Taq酶浓度的增加,扩增条带亮度和种类都逐渐增加,当Taq酶浓度达到0.7 U 时,基本不再增加.因此,为节约起见,20µL的反应体系中,0.7 U的Taq酶是比较合适的浓度.

图3 Taq DNA聚合酶浓度对RAPD-PCR的影响
2.1.4 dNTPs浓度对RAPD-PCR的影响 在一定范围(0.10~0.22 mmol·L-1)内,随着dNTPs用量的增加,条带的清晰度增加,当浓度达到0.22 mmol·L-1时,条带清晰度最高,容易分辨和统计.当浓度继续增加时,条带的清晰度有下降趋势,且大片段的扩增效果变差(图4),具体原因有待于进一步验证.因此,0.22 mmol·L-1是最适宜的dNTPs浓度.

图4 dNTPs浓度对RAPD-PCR的影响
2.1.5 引物浓度对RAPD-PCR 的影响 在一定范围内,随着引物浓度的增加,条带的数量和清晰度随之增加(图5).但当引物浓度超过0.8µmol·L-1时,1 000~2 000 bp 之间的大片段模糊并消失,背景亮度也增加,呈现非特异性扩增.因此,引物最适浓度为0.8µmol·L-1.

图5 引物浓度对RAPD-PCR的影响
2.1.6 循环次数对RAPD-PCR 的影响 循环数决定PCR 产物量,随着循环数的增加,条带的亮度有增加趋势,1 000~2 000 bp的大片段亮度增加明显,因为大片段的扩增效率较小片段低,所以需要较多的循环才能扩增出较为明亮的条带(图6).40次循环时所有条带基本明亮清晰,再增加循环数基本没有影响,因此,40个循环是最适宜的循环数.

图6 循环次数对RAPD-PCR的影响
2.1.7 延伸时间对RAPD-PCR 的影响 延伸时间主要根据欲扩增片段的长度来确定.本实验中设置了4种延伸时间60、80、100和120 s.结果显示随着延伸时间的增加,条带的亮度有增加趋势(图7),100 s的延伸时间已经达到较好的扩增效果,因此,100 s是最适宜的延伸时间.
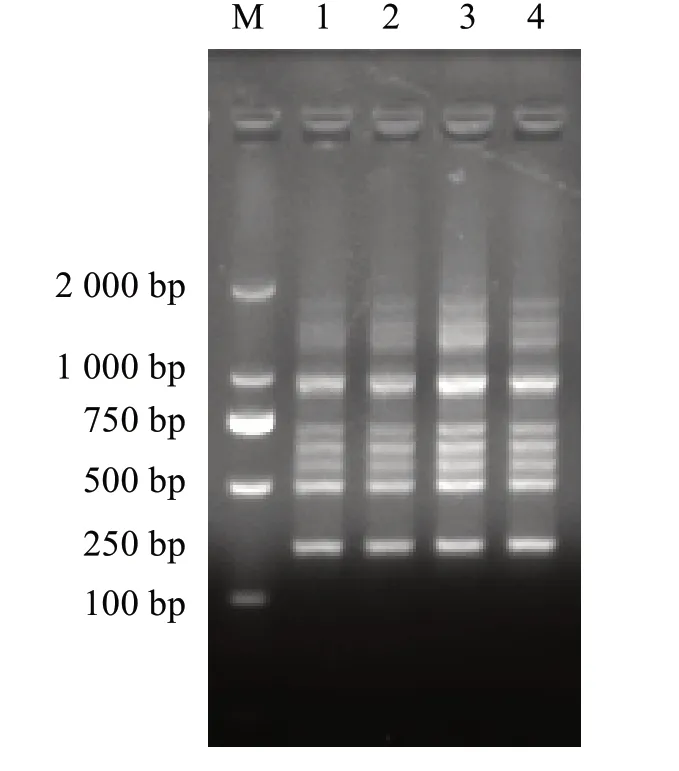
图7 延伸时间对RAPD-PCR的影响
2.2 RAPD-PCR 反应体系的稳定性检测
以优化确定的太子参RAPD-PCR反应体系,用S1 引物对10 个太子参样品进行扩增.10个太子参样本均能扩增出明亮清晰的条带,扩增条带大小介于250~2 000 bp 之间,且在不同太子参品种间表现出丰富的多态性(图8).这表明由一个RAPD 引物优化的PCR 反应体系可用于其他引物,重复实验表明优化确立的太子参RAPD-PCR反应体系稳定可靠,可用于后续研究.

图8 引物S24对10个太子参品种的扩增效果
3 讨论
RAPD 分子标记的扩增结果易受很多因素的影响,而RAPD-PCR 结果的准确性与稳定性是利用RAPD标记技术进行遗传多样性分析的前提[9].因此,为获得准确而稳定的RAPD谱带,提高分析准确性,对扩增条件中各因子进行优化非常有必要.前期实验发现退火温度对扩增影响最大,故先对其进行优化.在一定的退火温度范围内,高的退火温度更有利于扩增,可能是由于高的退火温度可以消除引物分子内的部分二级结构、消除误配片段、增加互补片段碰撞的机会,有利于引物与模板的复性,故其扩增效率高[10].但退火温度过高时,引物与模板结合不牢,易从模板上脱落下来,减少有效的扩增条带.Williams等[3]指出,高于40 ℃的复性温度会使RAPD-PCR反应受到抑制,本实验结果也支持这一观点.
模板量在一定范围内对扩增条带的种类无影响,对条带产量有轻微的影响,表现为初始模板用越多,扩增产物越多,条带越亮[11].太子参模板用量对RAPD-PCR 扩增结果的影响不明显,其适宜的范围较宽.本研究结果与其他植物的研究结果基本一致[9].
RAPD扩增条带的产量和清晰度与TaqDNA聚合酶、dNTPs、引物浓度密切相关.其浓度的高低直接影响扩增终产物量,浓度过低扩增不完全,产物少,条带弱;引物浓度过高容易错配,出现非特异性扩增,并增加形成引物二聚体的机会,扩增产物量下降[12].本研究还发现高浓度的引物不利于1 000~2 000 bp的大片段的扩增,但有利于1 000 bp以下的小片段的扩增,这与前期用ISSR标记扩增太子参的实验结果一致[8].循环数直接决定PCR 产物量,对结果影响较为显著.循环数少,产量少,条带暗,达到平台期后,继续增加循环数,产物量不再增加.循环数过多,可能会导致一些非特异性产物的出现,且发生错配的比例也会增加[13].延伸时间对RAPD-PCR 的影响主要体现在时间过短,长片段得不到有效扩增,对短片段影响较小;时间过长,易产生非特异性扩增[14].在本研究中,延伸时间对大片段扩增的影响较大,主要是因为PCR 扩增的效率并不是理想的100%,大片段需要更多的延伸时间,当延伸时间较短时,有些循环中的扩增反应并没有延伸到末端,这些扩增产物不可以作为下一轮扩增的模板,因此达不到理想的指数型扩增.如果增加延伸时间,可以使更多的片段(尤其是大片段)延伸到末端,这些扩增产物就可以作为下一轮扩增的模板,因此扩增效率较高,条带亮度增加.这与陈宏等[15]和Bielawski 等[16]的扩增产物最大片段的大小和强度随延伸时间的增长而增加的结果相一致.
4 结论
本研究通过单因子试验优化建立了可用于太子参RAPD-PCR 分析的最适反应体系.20µL 的PCR反应体系中,模板DNA用量为28 ng,TaqDNA聚合酶浓度为0.7 U,引物浓度为0.8µmol·L-1,dNTPs浓度为0.22 mmol·L-1.PCR 扩增程序中延伸时间为100 s,循环数为40.本研究结果可为后续应用RAPD 标记技术进行太子参种质资源遗传多样性分析、亲缘关系鉴定、品种鉴定和辅助育种等工作奠定研究基础.
