采用细胞毒性试验对23个药用包装材料进行生物安全性评价
2022-04-06黄雅理孙会敏
黄雅理,孙会敏,林 飞,赵 霞,*,汤 龙,*
(1.中国食品药品检定研究院,北京 100050;2.海关总署国际检验检疫标准与技术法规研究中心,北京 100013)
药用包装材料包括注射剂、输液剂、储血、输血材料及其在体内长期滞留的设备或替代品的包装等,由于药用包装材料绝大部分是不溶物质,可能对人体安全性危害的风险较大。其体外细胞毒性试验如何设计,目前尚无明确的技术规范或国家标准。目前,药用包装材料的生物学评价多根据《国家药包材标准》第7部分方法类药包材标准[1]进行。但该标准只颁布了包括细胞毒性检查法等7个生物学试验项目,并未规定受试物前处理的详细方法,检测单位多参考《GB/T 16886.12-2017医疗器械生物学评价》第12部分样品制备与参照样品[2]的要求进行,但可变条件多、针对性不强、检测样品不能最大限度的进行加严和加速浸提,其毒理学风险性评估受到限制。
本研究参考多个国家标准(规范)对受试物前处理的要求[3-5],针对医疗器械和包装材料的特殊性,选择用于注射、体内滞留等对人体风险性较高的23个包装材料,用MEM培养液和水(氯化钠注射液和超纯去离子水)两种前处理方法,制备检测样品浸提液作为溶剂,配制加胎牛血清的完全培养液,经与培养细胞接触之后,确认各检测样品浸提液是否能引起细胞毒性反应。
1 材料与方法
1.1 材 料
1.1.1 检测样品药用包装材料来自16个企业共23个样品,详见表1。将圆粒样品和橡胶样品剪切成≤25 mm×10 mm×5 mm;薄膜样品裁剪成25 mm×5 mm;如样品规格≤上述体积,不做剪切。用常温去离子水在2号标准筛中清洗2遍,置50℃恒温干燥箱中烘干备用。
1.1.2 培养基MEM干粉培养基,每袋93.9 g,购于美国Gibco公司。
1.1.3 浸提介质氯化钠注射液,由石家庄四药股份有限公司生产;自制超纯去离子水和MEM培养液。
1.1.4 对照品细胞毒性阴性对照品为高密度聚乙烯膜(面积25 mm×5 mm),由中国食品药品检定研究院提供。阳性对照品为二甲基亚砜(DMSO),分析纯,由天津市福晨化学试剂厂生产。
1.1.5 细胞株小鼠成纤维细胞L929,由中国科学院上海生物化学与细胞生物学研究所提供。
1.1.6 仪器及其他本研究使用的主要仪器和实验物品包括:CO2培养箱,倒置显微镜,酶标仪,分度值(d)0.001 g的电子天平,超纯水制备系统,pH计,渗透压分析仪;2G砂芯抽滤漏斗,0.22μm滤膜除菌器,96孔培养板,25 mL细胞培养瓶等。
1.1.7 实验室环境在100级洁净度的超净工作台中操作。室温20~25℃,相对湿度40%~70%。
1.2 方 法
1.2.1 细胞培养小鼠成纤维细胞L929采用含10%胎牛血清的MEM培养液(完全培养液),置于CO2培养箱中37℃条件下培养48~72 h,取生长旺盛的细胞用于当天试验[6]。
1.2.2 检测样品培养基浸提液制备分别称取5.0 g高压灭菌后的检测样品,按0.2 g/mL计算浸提液体积,加入无血清MEM培养液至25 mL。经37℃振荡浸提24 h,其浸提液用2G砂芯抽滤漏斗滤除浸提液粗沉淀物和检测样品后,加10%胎牛血清,经0.22 μm滤膜除菌器滤除细菌后用于试验[2]。
1.2.3 检测样品水浸提液制备分别称取5.0 g检测样品,按0.2 g/mL计算浸提液体积,加氯化钠注射液或超纯去离子水至25 mL。在高压灭菌锅中121℃(压力0.105 MPa)下浸提1 h,其浸提液用2G砂芯抽滤漏斗滤除浸提液粗沉淀物和检测样品后,作为溶剂配制MEM培养基,加10%胎牛血清,经0.22μm滤膜除菌器滤除细菌后用于试验[2,7]。
1.2.4 实验分组空白对照组为不加任何物质的完全培养液。阴性对照组为高密度聚乙烯膜按3 cm2/mL制备的水浸提液(方法同1.2.3)。阳性对照组是在完全培养液中加入10%的DMSO。试验组分为MEM培养基浸提液、氯化钠注射液浸提液和超纯去离子水浸提液。
1.2.5 检测浸提液制备条件对细胞毒性反应的影响选择2个细胞毒性反应为4级的氯化钠注射液浸提液检测样品,改变浸提温度和时间,制备121℃、20 min,121℃、30 min,121℃、1 h,70℃、24 h,50℃、72 h共5个条件下的浸提液,比较细胞毒性反应大小。
1.2.6 渗透压和p H值的测定为了解不同条件下制备的浸提液渗透压和PH值变化,制备121℃、20 min,121℃、30 min,121℃、1 h,70℃、24 h,50℃、72 h共5个条件下的氯化钠注射液和超纯去离子水浸提液,用渗透压分析仪和pH计测定浓度和pH值,确定数值变化范围[5]。
1.2.7 细胞毒性试验用完全培养液将L929细胞配制成浓度为1×104个/mL的细胞悬液接种于4个96孔培养板,每孔接种100μL。置于CO2培养箱(CO2体积分数为5%)37℃静置培养24 h,细胞贴壁生长后,弃除每孔中的上层液体。设空白对照、阴性对照、阳性对照、23个MEM培养基浸提液处理组和23个氯化钠注射液浸提液处理组,每组各设6孔,每孔加入100μL完全培养液或由浸提液配制的完全培养液,置于CO2培养箱继续静置培养。
细胞接触检测样品48 h,取出96孔培养板,于倒置显微镜下观察细胞形态。每孔加入20μL质量浓度为0.5%的MTT溶液,混合均匀后,继续培养4 h,弃除每孔中的上层液体。加入150μL DMSO,于振荡器上振荡10 min,用酶标仪在570和630 nm波长下测定吸光度值。
1.2.8 统计学分析用各试验组(包括阴性对照、阳性对照)和空白对照组测出的吸光度平均值计算细胞相对增殖率(relative growth rate,RGR)不进行组间数值差异性分析。
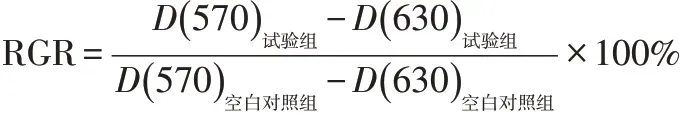
1.2.9 结果判定与评价细胞毒性反应分级标准[6]按:RGR≥100%为0级;RGR在80%(含)~100%为1级;RGR在50%(含)~80%为2级;RGR在30%(含)~50%为3级;RGR在0(含)~30%为4级。≤1级为阴性,2级为可疑阳性,≥3级为阳性。空白对照组细胞生长良好,阴性对照组的RGR>80%,阳性对照组的RGR<30%,本次试验结果成立。如果RGR不在此范围,则应重新进行试验。
2 结果
2.1 3种浸提液的细胞毒性试验结果
阴性对照组的RGR>91%,细胞毒性反应为0~1级;阳性对照组的RGR<16%,细胞毒性反应均为4级。检测样品MEM培养基浸提液的RGR为86%~109%,细胞毒性反应为0~1级;检测样品氯化钠注射液浸提液的RGR为6%~92%,细胞毒性反应为1~4级;其中氯化钠注射液浸提液≥2级的9个检测样品用超纯去离子水浸提液复试其RGR为45%~105%,细胞毒性反应为1~3级。见表2。
2.2 改变浸提温度和时间对细胞毒性试验的影响
氯化钠注射液浸提液细胞毒性反应为4级的2个检测样品,在低于121℃、30 min条件的浸提液,其RGR为72%~94%,细胞毒性反应为1~2级;而121℃、60 min浸提液RGR为15%~40%,细胞毒性反应为3~4级。见表3。

表3 氯化钠注射液不同浸提条件对细胞毒性试验的影响
2.3 改变浸提条件对浸提液渗透压和p H值的影响
随着温度和时间的增加,浸提液的渗透压有一定升高。在121℃、60 min条件下,氯化钠注射液浸提液配制的培养液溶出值最高为534.00 mol/L,超纯去离子水浸提液配制的培养液次之为352.33 mol/L;用两种浸提介质配制的完全培养液其浓度相差181.67 mol/L。其渗透压数值增加对表2试验结果存在一定影响,而上述条件的改变对pH值影响不大,其范围在0.25~0.37之间波动。见表4、5。

表2 3种浸提液的细胞毒性试验结果

表4 双向拉伸聚酯薄膜不同浸提条件对渗透压的影响
3 讨论
小鼠成纤维细胞L929的细胞毒性试验是一种体外检测方法,与体内试验方法相比具有简便、快速、重复性好、干扰少、敏感性高、可避免伦理问题等优点[7],已纳入国内、外生物材料临床前常规检测项目,在评价生物安全性方面发挥着重要作用。
随着现代细胞生物学与分子生物学技术的不断发展,新材料的不断涌现[8],用于临床的药用包装材料的风险性在提高[9]。由于绝大多数药用包装材料不易溶解,用前处理方法制备浸提液,在相关标准中均未明确说明。实际工作中,同样材料进行的细胞毒性试验,由于前处理方法不得当[10],很可能出现不同的试验结果。所用浸提介质和浸提条件应结合受试样品的特性和临床应用情况,在不改变材料物理和化学性能同时,在标准规定范围,使用能溶出物质更多的高浓度、高温度、长时间、搅拌等加严和加速浸提条件[2],能准确评估受试样品的风险。

表5 双向拉伸聚酯薄膜不同浸提条件对p H值的影响*
体外细胞毒性试验受外界因素影响较大,样品浸提方式及浸提介质的合理性,浸提液中浸提物质粒子大小、数量、pH值、渗透压、无菌性、稳定性、储存时间和温度的变化等存在多项不确定性,建议上述理化指标经预试验满足基本要求[11]后,再开始进行正式试验。
在本实验室条件下,小鼠成纤维细胞对23个原料样品用氯化钠注射液作为浸提介质在121℃、60 min浸提后进行检测,发现细胞毒性反应1级的14个;2级的6个;3级的1个;4级的2个。显示药品包装材料通过体外细胞毒性试验,能够发现存在毒性反应的受试样品。
用培养基浸提液作为浸提介质经37℃、24 h浸提后进行检测,发现细胞毒性反应全部是0级和1级;50℃和70℃所制备出的浸提液虽然延长了浸提时间,但溶出物质仍然有限,对浓度、渗透压比值、pH值等影响很小。证实该浸提条件不能最大限度的浸提出受试样品中的物质,容易漏判可检出阳性的医用材料,如不是对高温有影响的受试样品建议不作为首选。
用超纯去离子水作为浸提介质在121℃、60 min浸提后进行细胞毒性检测,是对溶出度较高、渗透压值增加,对试验结果存在一定影响的补充试验,前期需经过对浓度、渗透压比值、pH值以及粒子数量、大小等检测,如能符合试验要求,其结果能排除外来因素的影响,较准确发现存在毒性反应的物质。
综合以上结果,本实验在不改变检测样品物理和化学性能同时,使用最大可溶出物质的检测样品浸提液作为溶剂配制MEM培养基,发现3个检测样品的细胞毒性反应结果阳性。因此,临床如在高温、高湿、高压下灭菌使用这些样品,须进行毒理学安全性风险评估。
