STAT3 miR-146-b反馈回路抑制IL-6的NF-κB信号轴调控结直肠癌细胞的干性机制
2022-04-02韩嘉晟吴华星袁胜春
韩嘉晟 吴华星 袁胜春
【摘要】 目的:探究STAT3 miR-146-b反饋回路抑制IL-6的NF-κB信号轴调控结直肠癌细胞的干性机制。方法:用Dulbecco改良的Eagle培养基(DMEM)培养结直肠癌细胞HCT116和正常人结肠上皮细胞CCD 841 CoN细胞。通过免疫荧光检测IL-6和NF-κB信号轴。通过Western blot检测p-STAT3、p-JAK2和miR-146-b蛋白表达水平。通过Transwell分析法检测细胞迁移能力,通过TUNEL染色检测细胞凋亡。通过CCK-8评估不同处理组细胞活力。通过Western blot检测EMT间充质标志物波形蛋白(Vimentin,VIM),SNAIL和ZEB1及上皮标志物E-钙粘蛋白(CDH1)水平。通过PCR检测CRC标志物CD44、CD133、NANOG和Lgr5mRNA的表达。结果:与对照组相比,CRC组IL-6和NF-κB表达水平均升高(P<0.05),而IL-6抑制剂组较CRC组IL-6和NF-κB表达水平均降低(P<0.05)。与对照组相比,CRC组p-STAT3、p-JAK2和miR-146-b蛋白含量均升高(P<0.05),而IL-6抑制剂组较CRC组p-STAT3、p-JAK2和miR-146-b蛋白含量均降低(P<0.05)。与对照组相比,CRC组细胞迁移能力增加,细胞凋亡降低(P<0.05),而IL-6抑制剂组较CRC组细胞迁移能力降低,细胞凋亡增加(P<0.05)。与对照组相比,CRC组0 h细胞活力无差异(P>0.05),24、48和72 h细胞活力均增加(P<0.05),而IL-6抑制剂组较CRC组0 h细胞活力无差异(P>0.05),24、48和72 h细胞活力均降低(P<0.05)。与对照组相比,CRC组VIM、SNAIL和ZEB1蛋白含量均升高,CDH1蛋白含量降低(P<0.05),而IL-6抑制剂组较CRC组VIM、SNAIL和ZEB1蛋白含量均降低,CDH1蛋白含量升高(P<0.05)。与对照组相比,CRC组CD44、CD133、NANOG和Lgr5 mRNA的表达均升高(P<0.05),而IL-6抑制剂组较CRC组CD44、CD133、NANOG和Lgr5 mRNA的表达均降低(P<0.05)。结论:STAT3 miR-146-b反馈回路抑制IL-6的NF-κB信号轴调控结直肠癌细胞的干性。IL-6/STAT3/miR-146-b轴可以作为CRC的诊断标记,并为结肠癌治疗提供治疗靶标。
【关键词】 结直肠癌 STAT3 miR-146-b IL-6 NF-κB 增殖 凋亡
Mechanism by STAT3 miR-146-b Feedback Loop Inhibits NF-κB Signal Axis of IL-6 in Regulating Stemness of Colorectal Cancer Cells/HAN Jiasheng, WU Huaxing, YUAN Shengchun. //Medical Innovation of China, 2022, 19(06): 0-029
[Abstract] Objective: To explore the mechanism by STAT3 miR-146-b feedback loop inhibits the NF-κB signal axis of IL-6 in regulating the stemness of colorectal cancer cells. Method: Colorectal cancer cell HCT116 and Normal human colonic epithelial cells CCD 841 CoN cells were cultured with Dulbecco’s modified Eagle medium (DMEM). The IL-6 and NF-κB signal axis were detected by immunofluorescence. The expression levels of p-STAT3, p-JAK2 and miR-146-b protein were detected by Western blot. The cell migration ability was detected by Transwell analysis method, and cell apoptosis was detected by TUNEL staining. The cell viabilities of different treatment groups were evaluated by CCK-8. The levels of EMT mesenchymal markers vimentin (Vimentin, VIM), SNAIL and ZEB1 and epithelial marker E-cadherin (CDH1) were detected by Western blot. The expressions of CRC markers CD44, CD133, NANOG and Lgr5 mRNA were detected by PCR. Result: Compared with the control group, the expression levels of IL-6 and NF-κB in the CRC group were increased (P<0.05), while the expression levels of IL-6 and NF-κB in the IL-6 inhibitor group were decreased compared with the CRC group (P<0.05). Compared with the control group, the protein contents of p-STAT3, p-JAK2 and miR-146-b in the CRC group were all increased (P<0.05), while the protein levels of p-STAT3, p-JAK2 and miR-146-b in the IL-6 inhibitor group were decreased compared with the CRC group (P<0.05). Compared with the control group, the CRC group had increased cell migration ability and decreased cell apoptosis (P<0.05), while the IL-6 inhibitor group had decreased cell migration ability and increased cell apoptosis compared with the CRC group (P<0.05). Compared with the control group, there was no difference in cell viability of the CRC group at 0 h (P>0.05), and increased cell viability at 24, 48 and 72 h (P<0.05), while the IL-6 inhibitor group had no difference in cell viability at 0 h compared with the CRC group (P>0.05), 24, 48 and 72 h cells reduced vitality (P<0.05). Compared with the control group, the protein contents of VIM, SNAIL and ZEB1 in the CRC group were increased, and the CDH1 protein content was decreased (P<0.05), while the IL-6 inhibitor group had decreased VIM, SNAIL and ZEB1 protein content and increased CDH1 protein content compared with the CRC group (P<0.05). Compared with the control group, the expression of CD44, CD133, NANOG and Lgr5 mRNA in the CRC group were all increased (P<0.05), while the expression of CD44, CD133, NANOG and Lgr5 mRNA in the IL-6 inhibitor group were decreased compared with the CRC group (P<0.05). Conclusion: STAT3 miR-146-b feedback loop inhibits NF-κB signal axis of IL-6 to regulate the stemness of colorectal cancer cells. IL-6/STAT3/miR-146-b axis can be used as a diagnostic marker for CRC and provide a therapeutic target for the treatment of colon cancer.
[Key words] Colorectal cancer STAT3 miR-146-b IL-6 NF-κB Proliferation Apoptosis
First-author’s address: Liaoyang Central Hospital, Liaoning Province, Liaoyang 111000, China
doi:10.3969/j.issn.1674-4985.2022.06.006
癌症是西方世界主要的健康问题之一,转移是最关键的问题,它占癌症死亡率的90%以上[1]。原发性结肠直肠癌(colorectal cancer,CRC)起源于胃肠道内的上皮细胞。在转移过程中,癌细胞被认为具有间充质表型,从而使它们离开原发肿瘤的部位,侵入周围组织,并迁移到远处的器官。接种后,这些细胞转换回上皮表型并增殖形成转移灶。细胞在上皮和间充质表型之间转换的过程称为上皮-间充质转化(epithelial-mesenchymal transition,EMT)及其对应的间充质-上皮转化(mesenchymal-epithelial transition,MET)。炎症是在受伤后开始的生物学过程,以去除有害刺激并开始愈合过程,越来越多的证据表明炎症会促进EMT[2]。但是,如果炎症延长,则可能对机体有害并促进包括癌症在内的永久性疾病。大约25%的癌症是由于慢性感染或其他类型的慢性炎症而出现的。例如,炎症性肠病或结肠炎是CRC的重要危险因素。IL-6是炎症促肿瘤作用的重要介质,IL-6是由几种类型的免疫细胞和癌产生的促炎细胞因子,尤其是在肿瘤发生的后期[3]。血清中IL-6水平的升高与晚期阶段、肿瘤大小、转移和CRC患者生存率降低相关,但对这些关联的分子机制尚不甚了解。大量研究表明,微小RNA(microRNA,miRNA)在代表癌症特征的生物过程中具有重要的调控功能,包括癌细胞的增殖、凋亡、侵袭和转移。癌症干细胞(CSC)的许多标志物取决于癌症类型,例如在结肠癌中,据报道细胞表面标志物如CD133、CD44和ALDH是鉴定CSC的一类分子[4]。STAT3是STAT家族之一,参与细胞生长和存活、炎症、免疫反应和癌症进展。STAT3通过激活非受体蛋白酪氨酸激酶[如Janus激酶1(Janus kinase 1,JAK1)、JAK2、JAK3、EGFR和SRC信号传导]与核输入蛋白相互作用而二聚并进入细胞核。本文主要研究STAT3 miR-146-b反馈回路抑制IL-6的NF-κB信号轴调控结直肠癌细胞的干性的机制。现报道如下。
1 材料与方法
1.1 细胞培养 结直肠癌细胞HCT116(ATCC®HTB-247™)购自美国典型培养物保藏中心(ATCC公司,美国)。正常人结肠上皮细胞CCD 841 CoN购自赛默飞世尔科技(中国)有限公司(美国)。用Dulbecco改良的Eagle培养基(DMEM)培养HCT116和CCD 841 CoN细胞。此外,对于HCT116细胞系,应添加10%FBS和1%青霉素/链霉素(Gibco公司,美国)。正常结肠上皮细胞也在DMEM中生长。15%FBS,4 mM L-谷氨酰胺和1%青霉素/链霉素对于这些细胞的生长是必需的。具有5%CO2湿润气氛的细胞培养箱适用于所有细胞培养。
1.2 分组 对照组:正常结肠上皮细胞;CRC组:结直肠癌细胞;IL-6抑制剂组:经500 mg/mL的IL-6抑制剂(美国Sigma公司)处理结直肠癌细胞48 h。每组3个复孔。利用以上各组材料进行后续检测分析。
1.3 免疫荧光 不同处理组结直肠癌细胞用4%甲醛固定,在0.1%Triton X-100中透化。将固定的结直肠癌细胞用1×PBS洗涤,并在室温下用1×PBS中的2%牛血清白蛋白(BSA)封闭30 min。将固定的细胞与IL-6或NF-κB抗体的特异性一抗(Cell Signaling公司,美国)在4 ℃孵育过夜。洗涤后,将细胞与Alexa Fluor 546山羊兔IgG抗体(Life Technologies公司,美国)(1︰1 000)在室温下孵育1 h。洗涤两次后,用4,6-二mid基-2-苯基吲哚(DAPI,Sigma公司,美国)将细胞核染色。STAT3和DAPI染色的细胞图像是通过Delta Vision成像系统(Applied Precision公司,美国)拍摄的。
1.4 蛋白质印迹 将HCT116细胞在含有磷酸酶抑制剂(Sigma公司,美国)的RIPA缓冲液(50 mM Tris-HCl,150 mM NaCl,2 mM EDTA和1%Triton X-100)中裂解。蛋白酶抑制剂(Roche公司,德国)。将蛋白质样品在8%~15%的十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)上分离,并转移到硝酸纤维素膜上。将膜与PARP的一抗,裂解的PARP,裂解的p-STAT3、p-JAK2、miR-146-b、VIM、SNAIL、ZEB1、CDH1蛋白和GAPDH一起孵育(Sigma公司,美国)。将它们在3%牛血清白蛋白(BSA)和PBS-Tween 20(1︰500~1︰2 000)中于4 ℃稀释过夜,用PBS-Tween20洗涤3次,最后与HRP耦联的二抗孵育(1︰2 000)。通过使用ECL Western印迹检测试剂(GE Healthcare公司,英国)将表达可视化。
1.5 Transwell迁移测定 CRC细胞迁移的能力通过Transwell分析法(Thermo公司,美国)确定,将癌细胞铺在带有可渗透膜的細胞培养插入物的上层,将测试剂置于细胞渗透膜下方,将细胞孵育3~18 h并计数细胞。
1.6 TUNEL检测 为了检测细胞死亡,根据制造商的说明(Roche Molecular Biochemicals公司,德国)使用了DeadEnd™荧光TUNEL系统套件(Promega公司,美国)。将HCT116细胞用IL-6抑制剂处理24 h,用冷PBS洗涤。用4%多聚甲醛固定细胞30 min,并用PBS洗涤两次,2 min/次。洗涤通透溶液(0.1%Triton X-100和0.1%柠檬酸钠)中的固定细胞,并与TUNEL测定混合物孵育60 min。TUNEL染色的细胞通过Delta Vision成像系统(Applied Precision公司,美国)可视化。
1.7 CCK8分析 根据Cell Counting Kit-8分析(CCK-8)试剂盒(Dojindo公司,日本)评估细胞活力。将2×103细胞接种到96孔板中,并在37 ℃的含有5%CO2的潮湿室内孵育24、48或72 h。将CCK-8溶液(10 μL)加入每个孔中,并将板在37 ℃下孵育1 h。在酶标仪(Bio-Rad,美国)中测量450 nm处细胞的吸光度(OD450)。
1.8 RNA分离和定量实时聚合酶链反应(PCR) 使用ReliaPrep RNA Cell Miniprep System(Promega Corp.,Z6010,Madison,WI,United States)从HCT116细胞中提取总RNA 1 μg,以总RNA为模板,通过逆转录酶合成cDNA,再以cDNA为模板,采用Superscript One Step RT-PCR试剂盒(Invitrogen公司,美国)进行Platinum Taq聚合酶扩增。HB Nucleic mix(Heimbiotek公司,韩国)合成的引物序列。为了进行PCR扩增,进行以下步骤。最初的步骤是在50 ℃下进行30 min,在94 ℃下进行2 min,在94 ℃下进行30次循环15 s,在55 ℃下进行30 s,在72 ℃下进行1 min,最后一步在72 ℃下进行10 min。使用HB Real-Time PCR预混液试剂盒(Heimbiotek公司,韩国)进行RT-qPCR。
1.9 统计学处理 采用SPSS 20.0软件对所得数据进行统计分析,计量资料用(x±s)表示,组间比较采用单因素方差分析或者重复测量的方差分析,组间两两比较采用LSD-t检验;计数资料以率(%)表示,比较采用字2检验。以P<0.05为差异有统计学意义。
2 结果
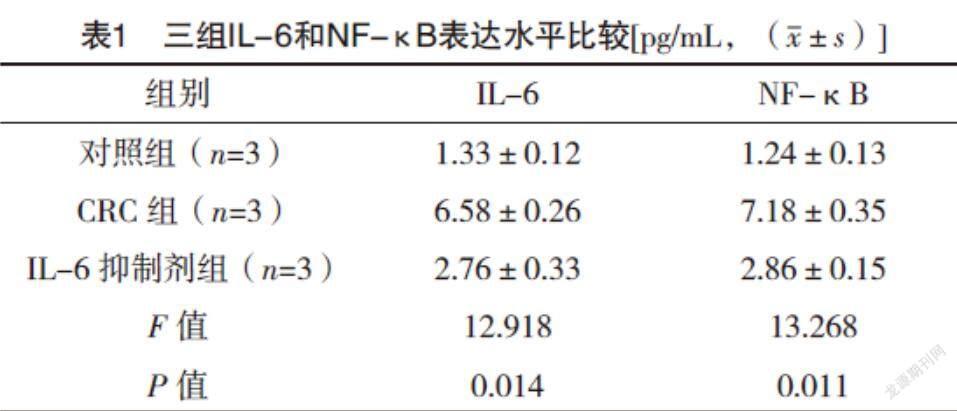
2.1 免疫荧光检测IL-6和NF-κB信号轴 与对照组相比,CRC组IL-6和NF-κB表达水平均升高(P<0.05),而IL-6抑制剂组较CRC组IL-6和NF-κB表达水平均降低(P<0.05),见表1。
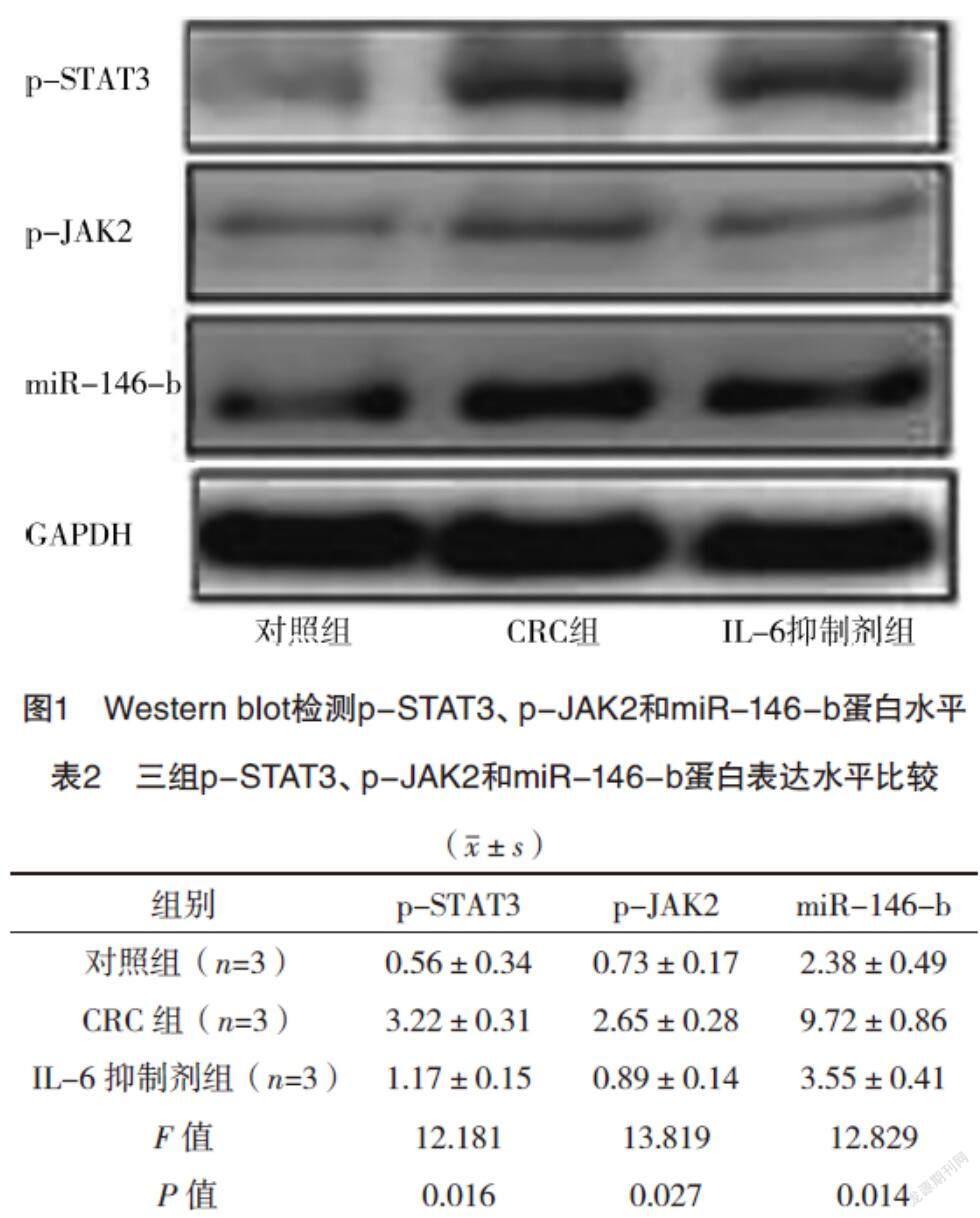
2.2 Western blot检测p-STAT3、p-JAK2和miR-146-b蛋白水平 与对照组相比,CRC组p-STAT3、p-JAK2和miR-146-b蛋白含量均升高(P<0.05),而IL-6抑制剂组较CRC组p-STAT3、p-JAK2和miR-146-b蛋白含量均降低(P<0.05),见图1、表2。
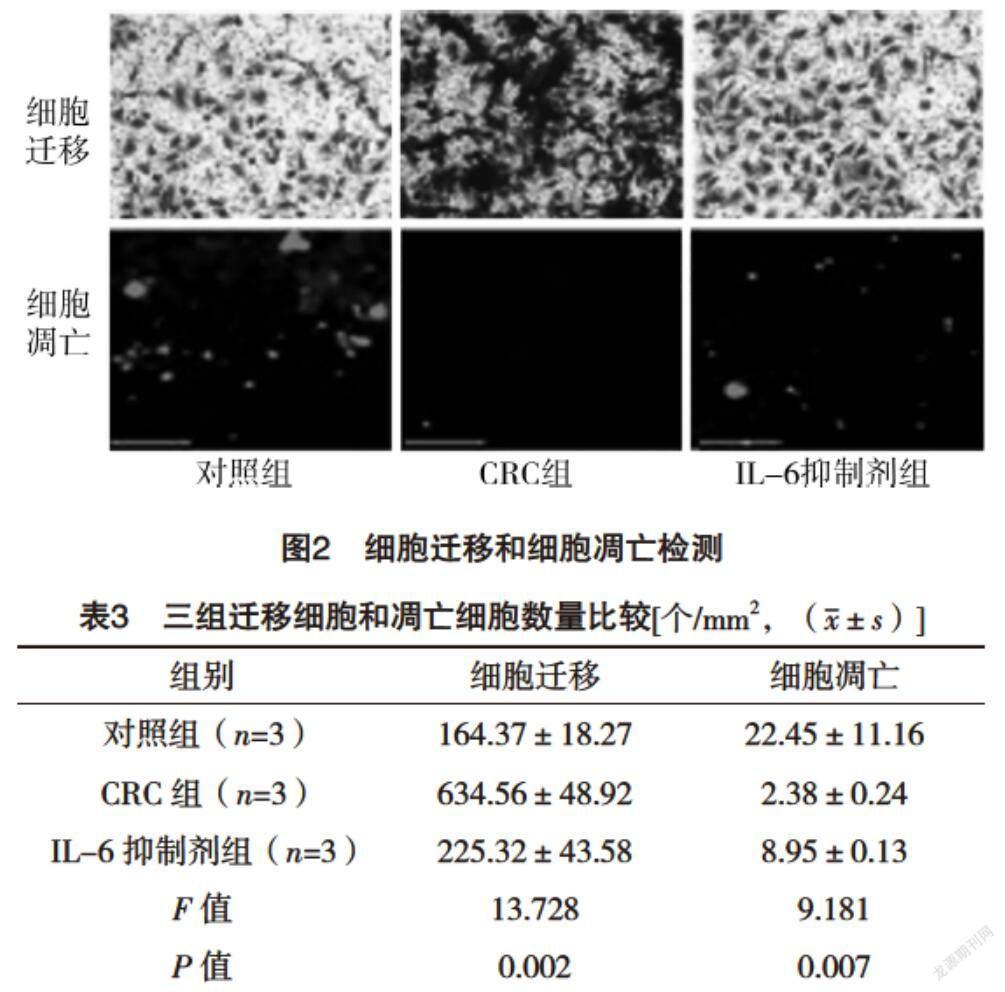
2.3 细胞迁移和细胞凋亡测定 与对照组相比,CRC组细胞迁移能力增加,细胞凋亡降低(P<0.05),而IL-6抑制剂组较CRC组细胞迁移能力降低,细胞凋亡增加(P<0.05),见图2、表3。
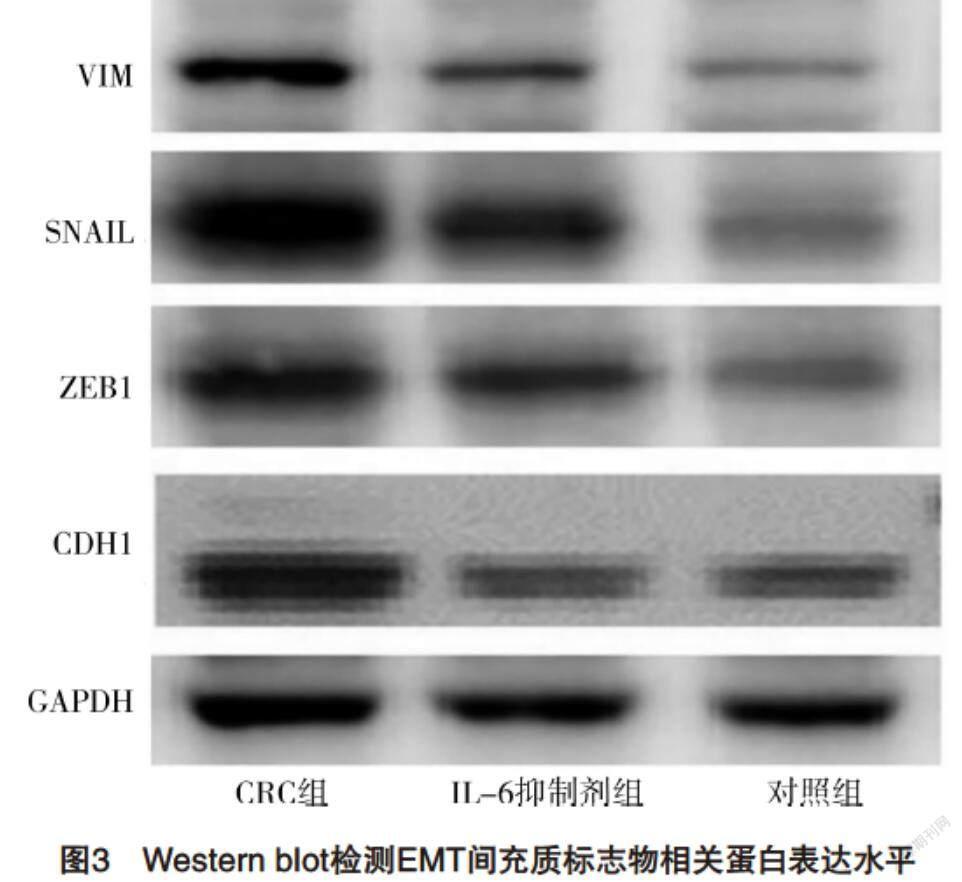
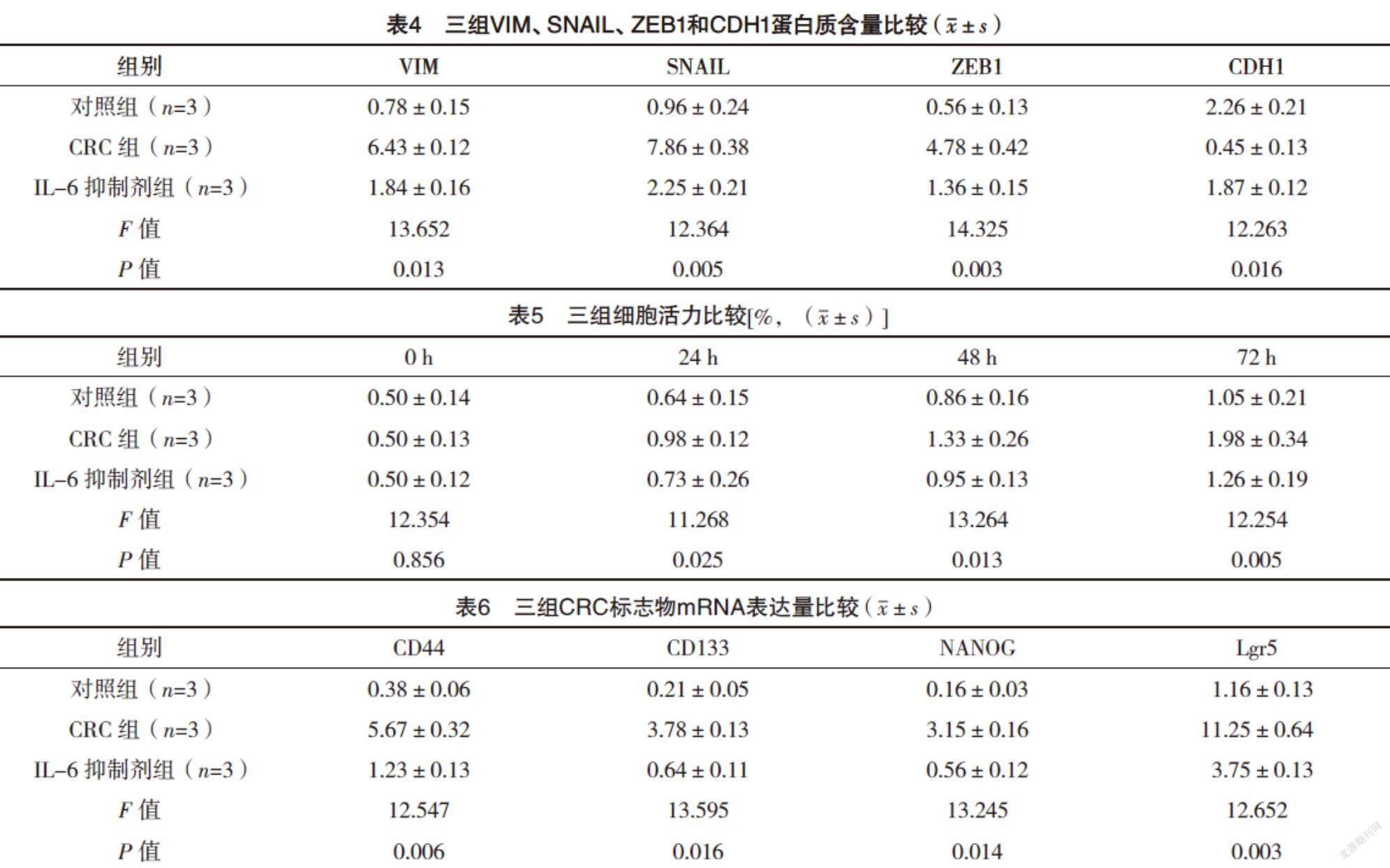
2.4 Western blot检测EMT间充质标志物相关蛋白表达水平 与对照组相比,CRC组VIM、SNAIL和ZEB1蛋白含量均升高,CDH1蛋白含量降低(P<0.05),而IL-6抑制剂组较CRC组VIM、SNAIL和ZEB1蛋白含量均降低,CDH1蛋白含量升高(P<0.05),见图3、表4。
2.5 CCK8分析細胞活力 CRC组0 h细胞活力与对照组相比,差异无统计学意义(P>0.05),24、48和72 h细胞活力较对照组均增加(P<0.05);而IL-6抑制剂组与CRC组0 h细胞活力比较,差异无统计学意义(P>0.05),24、48和72 h细胞活力较CRC组均降低(P<0.05)。见表5。
2.6 三组CRC标志物mRNA表达量比较 与对照组相比,CRC组CD44、CD133、NANOG和Lgr5 mRNA的表达均升高(P<0.05),而IL-6抑制剂组较CRC组CD44、CD133、NANOG和Lgr5 mRNA的表达均降低(P<0.05),见表6。
3 讨论
CRC是第三大常见癌症,约占所有癌症病例的10%,全世界每年诊断出的新病例超过100万[5]。手术是结直肠癌和化学疗法的主要治疗方法,分子靶向治疗是辅助治疗。越来越多的证据表明,在早期发现的CRC患者中大约有90%可以通过手术治愈,但是不幸的是,大多数患者被诊断为晚期,导致预后不良[6]。因此,迫切需要找到新的诊断和预后标志物。
miRNA是一种小型非编码RNA,它们通过与3’非翻译区(UTR)结合而与其靶基因mRNA相互作用,可减少蛋白质丰度并调节多种信号通路,与血管生成、增殖、骨重塑和癌症进展有关[7]。据报道,许多miRNA可以调节多种生物学过程,例如增殖、分化、迁移和凋亡。此外新出现的证据表明,miRNA是用于癌症诊断和预后的有前途的生物标志物。miRNA经常形成反馈环,因为它们本身受转录因子调控,它们直接或间接靶向[8]。这种自我稳定的电路可以是表观遗传开关的核心组成部分,其中细胞表型和表达模式从一种稳定的表观遗传状态转换为另一种,而DNA序列没有变化[9]。表观遗传开关需要启动事件(炎症),但是新细胞类型的表型在没有启动信号的情况下遗传并通过自我维持的反馈回路维持[10]。
大肠癌是全世界与癌症相关的死亡的主要原因之一[11]。几种致癌分子与大肠癌的发展有关,包括信号转导子和STAT3[12]。本研究中,确定了一个IL-6触发的反馈环,该环涉及STAT3介导的miR-146-b抑制,并控制EMT和结肠肿瘤的进展。笔者分析显示,IL-6/STAT3/miR-146-b环存在于所有具有间充质并因此具有转移性状的癌细胞中,这暗示它可能代表了一种新的致癌统一机制。尽管如此,IL-6/STAT3/miR-146-b环的活化可能存在组织和细胞类型特异性差异,因为STAT3活化可以通过多种其他信号途径来实现,例如在癌症中失活的受体酪氨酸激酶[13]。最近的观察表明,在转移过程中,肿瘤细胞获得了一种间充质表型,从而使它们离开原发肿瘤的部位,侵入周围组织,并迁移到远处的器官,而在播种后,这些细胞又转换回上皮表型,从而有效地转移[14-15]。IL-6对IL-6/STAT3/miR-146-b环的激活会诱导EMT,并可能使细胞表型向间质状态转移,这有利于转移级联的浸润,内渗和外渗步骤[16]。相反,IL-6抑制剂对环的干扰会诱导MET,并可能使细胞转换回上皮状态,从而造成转移的集落和向外生长[17]。IL-6/STAT3/miR-146-b环的可逆特性有望实现旨在阻止其前转移活性的多种治疗干预。
IL-6/STAT3/miR-146-b環成分的几个已知靶标可能对癌症进展很重要,例如STAT3可以直接诱导EMT激活剂ZEB1。此外,文献[18]表明,另一种公认的EMT诱导物SNAIL是miR-146-b的直接靶标。其他研究表明,SNAIL诱导IL-6,从而提供可能增强循环的其他反馈[19]。总的来说,这些结果表明SNAIL是IL-6/STAT3/miR-146-b环的重要效应子。IL-6还可以通过STAT3/SNAIL信号通路促进头颈部肿瘤转移和EMT。
CSC取决于癌症类型,占据不同的标志物,例如SOx2、CD133、EpCAM、CD166、CD24、CD29、Lgr5、Klf4和ALDH[20]。本研究结果显示,与对照组相比,CRC组CD44、CD133、NANOG和Lgr5 mRNA的表达均升高,而IL-6抑制剂组较CRC组CD44、CD133、NANOG和Lgr5 mRNA的表达均降低。
综上所述,STAT3 miR-146-b反馈回路抑制IL-6的NF-κB信号轴调控结直肠癌细胞的干性。IL-6/STAT3/miR-146-b轴可以作为CRC的诊断标记,并为结肠癌治疗提供治疗靶标。
参考文献
[1] ABDULRIDHA M K,AL-MARZOQI A H,GHASEMIAN A.The Anticancer Efficiency of Citrullus colocynthis Toward the Colorectal Cancer Therapy[J].J Gastrointest Cancer,2020,51(2):439-444.
[2] PERIASAMY S,WU W H,CHIEN S P,et al.Dietary Ziziphus jujuba Fruit Attenuates Colitis-Associated Tumorigenesis:A Pivotal Role of the NF-κB/IL-6/JAK1/STAT3 Pathway[J].Nutr Cancer,2020,72(1):120-132.
[3] LI Z W,SUN B,GONG T,et al.GNAI1 and GNAI3 Reduce Colitis-Associated Tumorigenesis in Mice by Blocking IL6 Signaling and Down-regulating Expression of GNAI2[J].Gastroenterology,2019,156(8):2297-2312.
[4] LEE J W,STONE M L,PORRETT P M,et al.Hepatocytes direct the formation of a pro-metastatic niche in the liver[J].Nature,2019,567(7747):249-252.
[5] XU K,ZHAN Y,YUAN Z,et al.Hypoxia Induces Drug Resistance in Colorectal Cancer through the HIF-1α/miR-338-5p/IL-6 Feedback Loop[J].Mol Ther,2019,27(10):1810-1824.
[6] WANG T,SONG P,ZHONG T,et al.The inflammatory cytokine IL-6 induces FRA1 deacetylation promoting colorectal cancer stem-like properties[J].Oncogene, 2019, 38(25):4932-4947.
[7] WANG S,DONG W,LIU L,et al.Interplay between bile acids and the gut microbiota promotes intestinal carcinogenesis[J].Mol Carcinog,2019,58(7):1155-1167.
[8] KUANG Y,GUO W,LING J,et al.Iron-dependent CDK1 activity promotes lung carcinogenesis via activation of the GP130/STAT3 signaling pathway[J].Cell Death Dis,2019,10(4):297.
[9] WANG J,ZHOU J,JIANG C,et al.LNRRIL6,a novel long noncoding RNA,protects colorectal cancer cells by activating the IL-6-STAT3 pathway[J].Mol Oncol,2019,13(11):2344-2360.
[10] XU J,QIAN J,ZHANG W,et al.LYPD8 regulates the proliferation and migration of colorectal cancer cells through inhibiting the secretion of IL-6 and TNF-α[J].Oncol Rep,2019,41(5):2389-2395.
[11] FANG W,ZHU S,NIU Z,et al.The protective effect of syringic acid on dextran sulfate sodium-induced experimental colitis in BALB/c mice[J].Drug Dev Res,2019,80(6):731-740.
[12] WEI J,MA L,LAI Y H,et al.Bazedoxifene as a novel GP130 inhibitor for Colon Cancer therapy[J].J Exp Clin Cancer Res,2019,38(1):63.
[13] ZHANG B,XU Y,LIU S,et al.Dietary Supplementation of Foxtail Millet Ameliorates Colitis-Associated Colorectal Cancer in Mice via Activation of Gut Receptors and Suppression of the STAT3 Pathway[J].Nutrients,2020,12(8):2367.
[14] TIAN Y,XU J,LI Y,et al.MicroRNA-31 Reduces Inflammatory Signaling and Promotes Regeneration in Colon Epithelium,and Delivery of Mimics in Microspheres Reduces Colitis in Mice[J].Gastroenterology,2019,156(8):2281-2296.
[15] WANG A,DENG S,CHEN X,et al.miR-29a-5p/STAT3 Positive Feedback Loop Regulates TETs in Colitis-Associated Colorectal Cancer[J].Inflamm Bowel Dis,2020,26(4):524-533.
[16] HUANG H,NIU J,WANG F,et al.A natural compound derivative P-13 inhibits STAT3 signaling by covalently inhibiting Janus kinase 2[J].Invest New Drugs,2019,37(3):452-460.
[17] RAJ V,BHADAURIA A S,SINGH A K,et al.Novel 1,3,4-thiadiazoles inhibit colorectal cancer via blockade of IL-6/COX-2 mediated JAK2/STAT3 signals as evidenced through data-based mathematical modeling[J].Cytokine,2019,118(23):144-159.
[18] FUJITA J,SAKURAI T.The Oncoprotein Gankyrin/PSMD10 as a Target of Cancer Therapy[J].Adv Exp Med Biol,2019,1164(5):63-71.
[19] KE Z,WANG C,WU T,et al.PAR2 deficiency enhances myeloid cell-mediated immunosuppression and promotes colitis-associated tumorigenesis[J].Cancer Lett,2020,469(15):437-446.
[20] MA H,WANG J,ZHAO X,et al.Periostin Promotes Colorectal Tumorigenesis through Integrin-FAK-Src Pathway-Mediated YAP/TAZ Activation[J].Cell Rep,2020,30(3):793-806.
(收稿日期:2021-06-24) (本文編辑:程旭然)
