采收方式对双孢菇采后品质与挥发性风味物质的影响
2022-04-01邵洋洋郜海燕刘瑞玲房祥军陈杭君
邵洋洋,郜海燕,刘瑞玲,房祥军,陈杭君
(浙江省农业科学院食品科学研究所,农业农村部果品采后处理重点实验室,浙江省果蔬保鲜与加工技术研究重点实验室,中国轻工业果蔬保鲜与加工重点实验室,浙江 杭州 310021)
双孢菇(Agaricus bisporus)又称口蘑、白蘑菇,其栽培历史悠久[1],是全球生产和消费量最多的食用菌[2],也是我国栽培产量最大的食用菌之一[3]。双孢菇质地嫩滑、营养丰富[4],具有很高的营养和药用价值,其活性物质有一定的医疗和保健作用[5]。
双孢菇水分含量高,采后呼吸代谢旺盛,菌盖无明显的保护结构,易受到机械伤害和微生物污染,导致其采后极易褐变腐败[6],货架期较短[7-8],从而商品价值降低。目前,双孢菇的保鲜技术主要集中在物理、化学等方面。如王相友等[9]研究发现高氧气调能够延长双孢菇货架期,维持其贮藏品质,Pan Jiefeng等[10]制备了交联聚乙烯醇/肉桂精油/环糊精纳米纤维薄膜,延缓了蘑菇在贮藏过程中的腐烂。而双孢菇在采收时采用切根处理,会对双孢菇造成严重的机械损伤,加快其贮放过程中营养物质的转化和消耗。有研究表明果蔬受到机械损伤后,真菌、细菌等会迅速侵蚀果肉,加速果实衰老、腐烂的速度[11]。李沛等[12]研究静压损伤对苹果呼吸强度、贮藏品质以及香气成分的影响。结果表明,随着贮藏时间的延长,静压损伤导致苹果果实呼吸强度上升果实品质迅速下降,降低了贮藏后期果实的风味,验证了上述结论。然而,切根处理受到的机械损伤是否会影响其贮藏品质,不同采收方式对双孢菇采后品质及风味物质的影响均鲜见报道。故本实验主要研究采收时切根与不切根对双孢菇贮藏过程品质及风味变化的影响,以期为双孢菇及其相关该产业高品质发展提供理论依据和技术指导。
1 材料与方法
1.1 材料与试剂
‘W192’双孢菇 浙江嘉善宁远农业有限责任公司。选取个体大小均一,平均质量为25 g,无机械损伤,表面洁白,无畸形和病虫害的菌菇进行实验。
三氯乙酸、盐酸羟胺、抗坏血酸、氢氧化钠、福林-酚、苯酚、磷酸、邻菲罗啉、无水乙醇、没食子酸(分析纯)上海凌峰化学试剂有限公司;C3~C20正构烷烃混合标准品、邻二氯苯(色谱纯) 上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
CR-400手持色差仪 日本SANYO公司;UV-9000型紫外-可见分光光度计 上海元析仪器有限公司;TA.XT plus质构仪 英国Stable Micro Systems公司;Stratos 64R高速低温冷冻离心机 美国贝克曼库尔特有限公司;TSQ9000气相色谱-质谱联用仪 美国赛默飞世尔科技公司;DDS-307A电导率仪 上海仪电科学仪器股份有限公司;e2695高效液相色谱仪 美国Waters公司;50/30 μm DVB/CAR/PDMS手动固相微萃取头美国Supelco公司。
1.3 方法
1.3.1 样品处理
将双孢菇分为两组,每组10 kg,一组为切根组,即在采摘时直接将菇柄切除,菇柄预留3~4 cm;另一组为不切根组,即在采摘时直接从菇床上带根采摘。采后立即运回实验室,4 ℃冷库预冷4 h后再进行后续实验。将两组样品分别装入聚乙烯袋(340 mm×240 mm)中挽口包装,每袋装入1.0 kg双孢菇。放入4 ℃冷库贮藏,每3 d取样一次,取至15 d。每次取样测定色泽、硬度、质量损失率等指标后,迅速用液氮速冻样品,置于-80 ℃下保存用于后续指标的测定。取样第0天和第15天观察双孢菇正面、背面和剖面并用尼康D90相机拍照。
1.3.2 色泽和褐变指数的测定
用手持色差计测定。每组处理每次分别随机选取8 个双孢菇,测定其菌盖顶部及两侧的3 个点,记录L*、a*、b*值。共测定24 次,分别计算平均值。褐变指数参考文献[13],按式(1)、(2)计算。
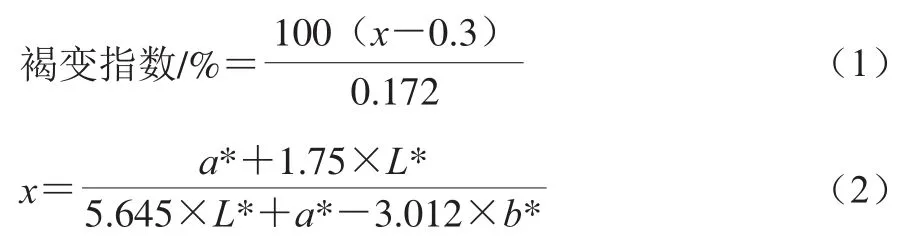
1.3.3 质量损失率的测定
每组随机取50 个双孢菇,测定初始质量m1/g和取样时的质量m2/g,按式(3)计算质量损失率。

1.3.4 硬度测定
采用质构仪对菌盖的表面进行测定,选择P/2型探头,参数为测试前速率5 mm/s,测试中速率2 mm/s,测试后速率5 mm/s,接触面积10%,接触力10 g。每个处理选取6 个双孢菇,每个菇测定3 个点。
1.3.5 相对电导率测定
参考文献[14]测定相对电导率,具体操作为用刀片切取2 mm双孢菇薄片,取2 g双孢菇薄片浸泡在25 mL的去离子水中,30 ℃水浴30 min后用电导率仪测定电导率P1/(μS/cm)。将溶液煮沸5 min,冷却至25 ℃左右后测定电导率P2/(μS/cm)。按式(4)计算相对电导率。
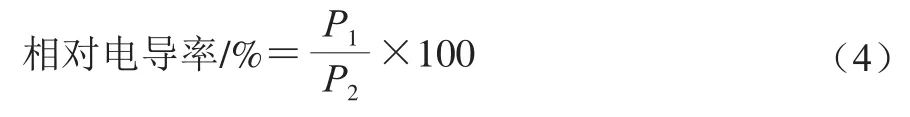
1.3.6 丙二醛含量测定
丙二醛(malondialdehyde,MDA)含量测定参考杨晋恒等[15]方法并稍作修改。新鲜样品加入液氮后研磨成粉末状,取0.2 g双孢菇粉末加入1.5 mL 100 g/L的三氯乙酸溶液,混匀。4 ℃下10 000 r/min离心20 min后得上清液。于1 mL上清液中加入1 mL 0.67%(质量分数)的硫代巴比妥酸溶液,混合后煮沸20 min,分别测定混合体系在450、532、600 nm波长处的吸光度A532nm、A600nm、A450nm,按式(5)计算上清液MDA浓度,然后代入式(6)计算样品MDA含量。
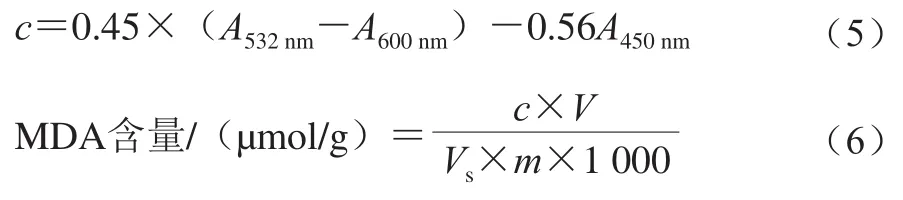
式中:c为反应混合液中MDA浓度/(μmol/L);V为样品提取液总体积/mL;Vs为测定时所取样品提取液体积/mL;m为样品质量/g。
1.3.7 可溶性蛋白含量测定
参照文献[16]采用考马斯亮蓝G-250法测定可溶性蛋白含量。
1.3.8 可溶性糖含量测定
参照文献[17]采用苯酚-硫酸法测定可溶性糖含量。
1.3.9 总酚含量测定
参照文献[18]采用福林-酚比色法测定总酚含量。
1.3.10 抗坏血酸含量测定
参考文献[19]测定抗坏血酸含量。
1.3.11 相关酶活力测定
1.3.11.1 多酚氧化酶活力
参考文献[20]测定多酚氧化酶(polyphenol oxidase,PPO)活力并稍作修改。准确称取双孢菇样品0.2 g,加入8 mL 0.05 mol/L、pH 6.5的磷酸盐缓冲液。4 ℃条件下10 000 r/min离心20 min后取上清液,低温保存。取10 mL离心管加入200 μL 50 mmol/L pH 5.5的乙酸-乙酸钠缓冲液、50 μL 50 mmol/L邻苯二酚溶液和50 μL酶液,30 ℃下反应10 min后测定420 nm波长处的吸光度A420nm,每隔15 s记录一次A420nm,测定3 min。以每分钟A420nm变化0.01作为1 个酶活力单位(U),单位为U/g。
1.3.11.2 过氧化物酶活力
过氧化物酶(peroxidase,POD)活力的测定参考文献[21]。测定580 nm波长处吸光度A580nm,以其变化量表示POD活力,每秒内A580nm变化0.001为1 个酶活力单位(U),单位为U/g。
1.3.12 挥发性风味物质测定
1.3.12.1 顶空固相微萃取方法
参考Tao Feng等[22]的方法,并稍作修改。准确称取1 g双孢菇样品,液氮研磨后加入10 mL顶空瓶中,加入1 μL 0.025 mL/L的邻二氯苯溶液作为内标物,将顶空瓶置于60 ℃水浴锅中平衡萃取30 min后,插入老化好的萃取头,吸附30 min后,快速收回萃取纤维,将萃取头插入气相色谱进样口,于250 ℃下解吸10 min。
1.3.12.2 气相色谱-质谱分析
色谱柱:DB-5 MS石英毛细管柱(30 m×0.25 mm,1.4 μm);升温程序:50 ℃保持0 min,4 ℃/min升至110 ℃,保持2 min;1 ℃/min升至115℃,保持1 min;4 ℃/min升至150 ℃,保持1 min;10 ℃/min升至250 ℃,保持1 min;载气为He(纯度99.999%),不分流进样。进样口温度250 ℃;传输线温度250 ℃;离子源温度250 ℃;电离方式电子电离,电子轰击能量为70 eV,扫描范围m/z29~400。参照文献[23]进行定性和定量分析。
1.3.12.3 确定关键风味化合物
采用相对气味活度值 (relative odor activity value,ROAV)法[24]评价双孢菇各挥发性成分的贡献度,ROAV≥1.00的组分为关键风味化合物,0.10≤ROAV<1.00的组分对双孢菇的总体风味具有重要的修饰作用。按式(7)计算各挥发性组分的ROAV。
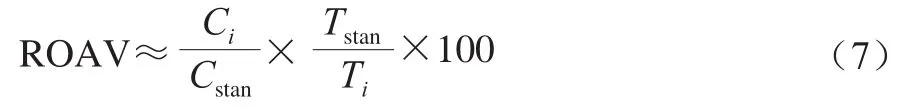
式中:Ci为各挥发性组分的相对含量/%;Ti为各挥发性组分的气味阈值/(μg/kg);Cstan和Tstan分别为对样品整体风味贡献度最大组分的相对含量与气味阈值。
1.4 数据处理与分析
除特殊标明外,实验设置3 个平行。采用Excel 2019软件进行数据处理,利用SPSS 24.0软件进行单因素方差分析,并通过Duncan多重比较进行显著性分析,P<0.05表示差异显著。采用Graphpad Prism 8.0软件绘制数据图表。
2 结果与分析
2.1 采收方式对双孢菇外观的影响
如图1所示,随着贮藏时间的延长,切根组双孢菇的菌盖、菌柄侧以及菌褶处颜色加深变成深褐色,且菌帽与菇柄间距离变大,有开伞的趋势,相对切根组,不切根组的双孢菇的菌帽表面褐变程度较小,内部菌柄与菌褶处也出现了褐变,程度较轻,且菌帽与菌柄能够保持紧实的状态。说明切根处理会加速蘑菇外部褐变程度,加速蘑菇的成熟与衰老。

图1 双孢菇采后0 d与15 d正面(A)、背面(B)和剖面(C)图Fig. 1 Front (A), back (B) and cross-sectional (C) views of Agaricus bisporus at 0 and 15 days after harvest
2.2 采收方式对双孢菇采后色泽和褐变指数的影响
色泽是衡量新鲜双孢菇品质的重要指标,褐变指数可反映其表面变质程度[25]。双孢菇在贮藏期间极易发生褐变,严重影响商品品质,由图2A可知,两组L*值总体都呈下降趋势,表明双孢菇在贮藏期间均发生了褐变。贮藏0~6 d时,切根与不切根组的L*值无显著性差异(P>0.05)。在贮藏后期,不切根组的L*值显著高于切根组(P<0.05)。如图2B所示,从第0天起,两组褐变指数都呈上升趋势,与不切根组相比,切根组褐变指数高,贮藏15 d时,切根组的褐变指数显著高于不切根组(P<0.05),由此说明不切根处理可以减轻双孢菇褐变程度。
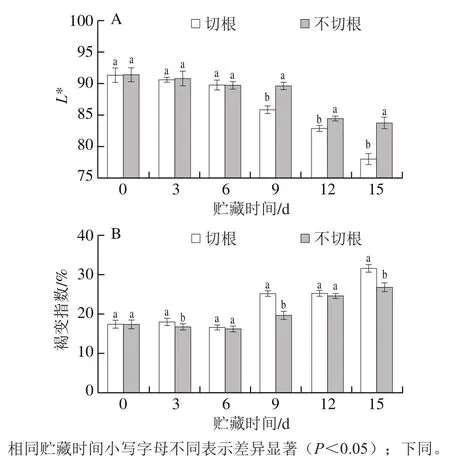
图2 双孢菇采后L*值(A)与褐变指数(B)的变化Fig. 2 Changes in L* value (A) and browning index (B) of Agaricus bisporus after harvest
2.3 采收方式对双孢菇质量损失率和硬度的影响
质量损失率和硬度是评价双孢菇品质的重要指标。由图3A可知,两组的质量损失率一直呈上升趋势,贮藏3 d后,切根组的质量损失率显著高于不切根处理组(P<0.05)。在贮藏期间,两组的双孢菇硬度呈现先上升后下降趋势,第9天时,切根组的双孢菇硬度达到最高值498.63 g,是不切根组的1.14 倍。双孢菇硬度升高可能因为子实体失水而发生木质化[26],本实验结果表明不切根处理能够维持双孢菇较好的硬度。
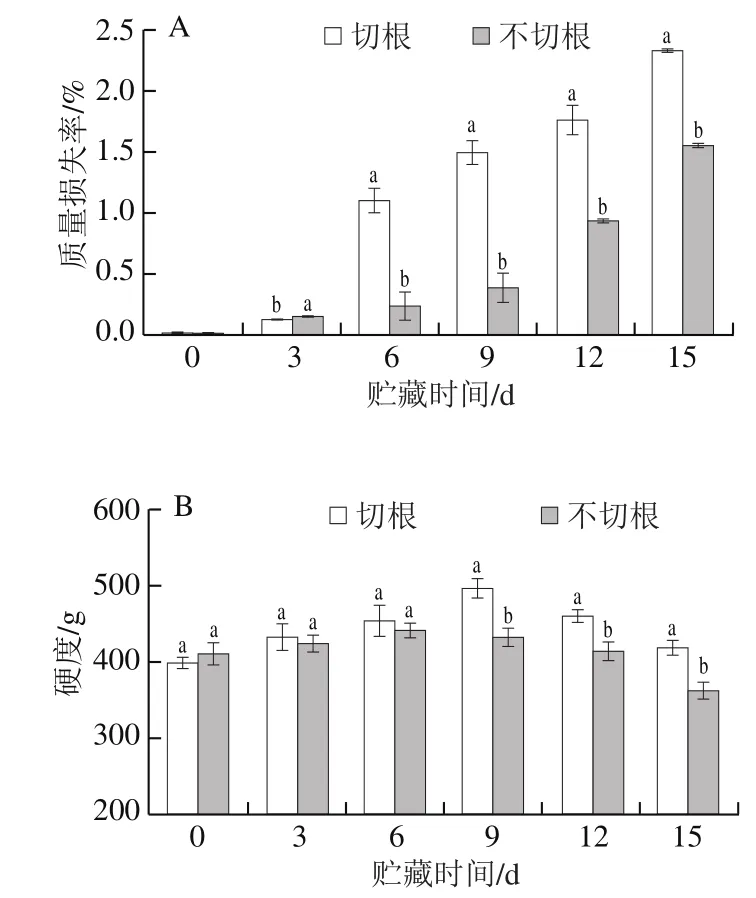
图3 双孢菇采后质量损失率(A)和硬度(B)变化Fig. 3 Changes in mass loss (A) and hardness (B) of Agaricus bisporus after harvest
2.4 采收方式对双孢菇相对电导率、丙二醛含量的影响
相对电导率普遍用于反映果蔬细胞膜和组织的完整性[27]。由图4A可知,切根与不切根组在贮藏期间都呈先下降后上升的趋势,切根组的相对电导率总体趋势要高于不切根组,在第12天时切根组比不切根组高45.50%,贮藏末期两组相对电导率差异显著(P<0.05),表明不切根处理能够抑制菇体膜透性的增加。MDA通常被看作是评价脂质过氧化程度的指标[28],图4B显示,两组不同处理的MDA含量呈上升趋势,说明在贮藏期间,两组都发生了脂质过氧化,与第0天相比,贮藏15 d时,MDA含量分别上升了63.20%和59.23%,但两组差异不显著(P>0.05),说明不切根组不能抑制双孢菇膜脂过氧化的发生。
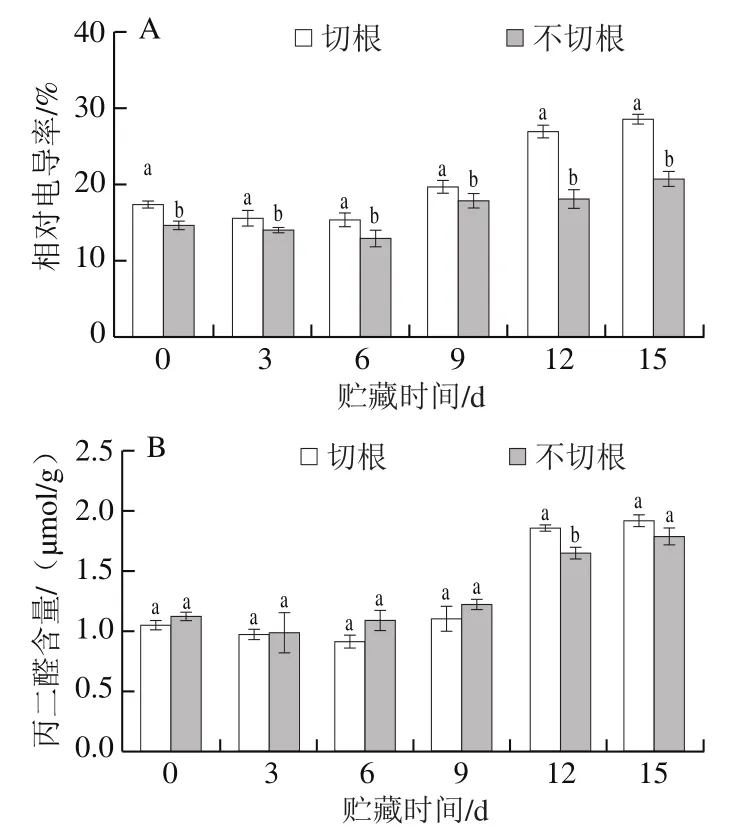
图4 双孢菇采后相对电导率(A)与MDA含量(B)的变化Fig. 4 Changes in relative conductivity (A) and MDA content (B) of Agaricus bisporus after harvest
2.5 采收方式对双孢菇采后可溶性蛋白、可溶性糖、抗坏血酸与总酚含量的影响
由图5A可知,在整个贮藏期间,可溶性蛋白的含量总体呈下降趋势,在贮藏0~6 d时,不切根组可溶性蛋白含量显著高于切根组(P<0.05);第3天时,不切根双孢菇可溶性蛋白含量是切根双孢菇的1.34 倍。可溶性糖含量是评价果蔬采后品质的重要指标,贮藏期间,两组总体呈下降趋势,贮藏3 d后,不切根组的可溶性糖含量下降趋势较缓于切根组;第6天时,不切根组可溶性糖含量高出切根组60.79%,表明不切根处理可以减缓双孢菇中可溶性糖含量的下降。由图5C可知,切根与不切根组的抗坏血酸含量呈先上升后下降的趋势,第0天时,不切根组的抑制效果较好,不切根组抗坏血酸含量高出切根处理的33.29%。研究表明,酚类化合物是双孢菇中提取的主要天然抗氧化成分,由图5D可知,双孢菇在采后贮藏期间,整体趋势呈先上升后下降的趋势,第3天时,两组均达到峰值,分别为1 166.24 μg/g和1 127.82 μg/g,且无显著性差异(P>0.05),在第6天后,切根组的含量急剧下降,不切根组的总酚含量显著高于切根组(P<0.05),说明不切根处理有利于总酚的积累。
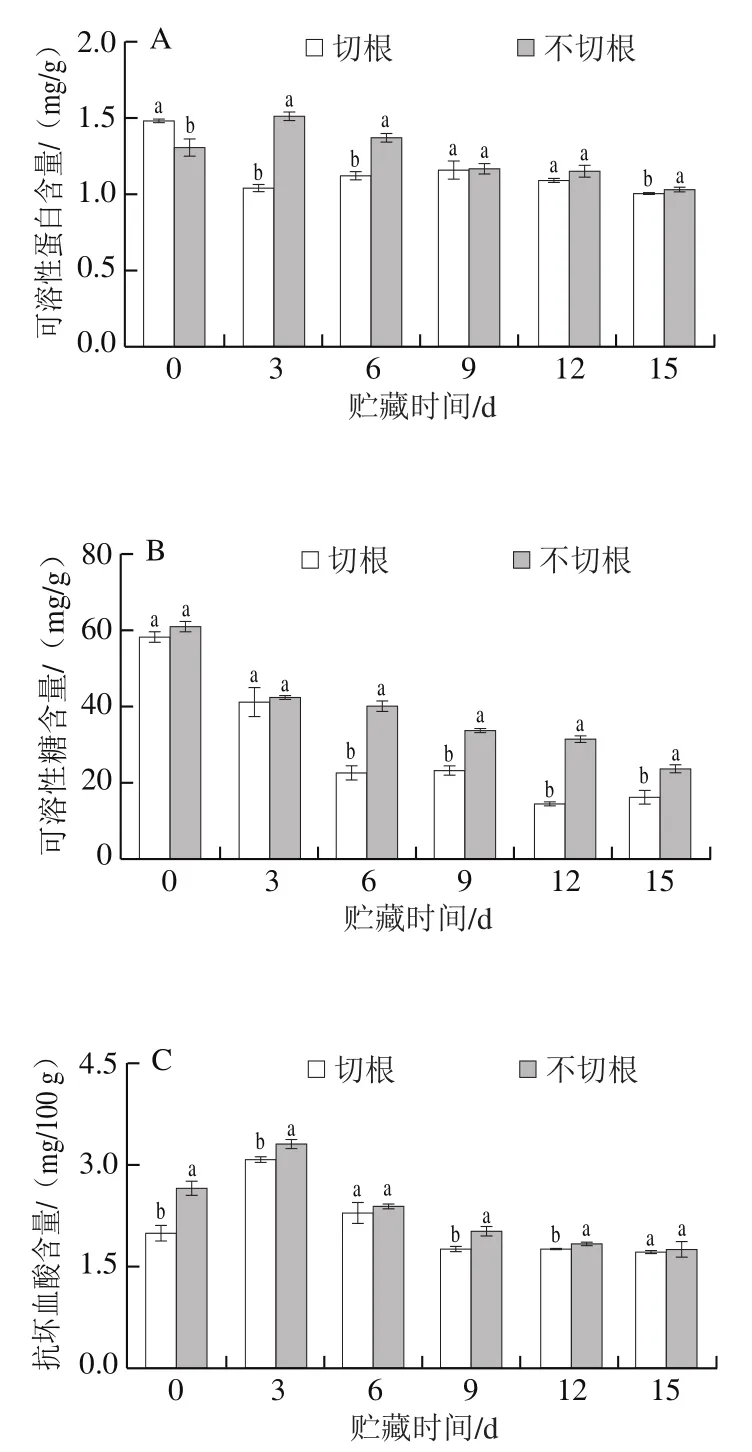

图5 双孢菇采后可溶性蛋白(A)、可溶性糖(B)、抗坏血酸(C)与总酚(D)含量的变化Fig. 5 Changes in soluble protein (A), soluble sugar (B), ascorbic acid (C)and total phenols (D) contents of Agaricus bisporus after harvest
2.6 采收方式对双孢菇采后褐变相关酶活力的影响
研究表明,PPO活力与褐变有很强的正相关[29]。如图6A所示,在整个贮藏过程中,两组PPO活力均呈现上升趋势,切根组整体的PPO活力要高于不切根组,贮藏12 d,切根组的PPO活力显著高于不切根组(P<0.05),说明不切根处理能够抑制双孢菇的褐变。POD作为引起植物褐变的酶之一,也可以在聚合的最后一步催化木质素的合成[30]。由图6B可知,两组处理的POD活力一直是下降的,贮藏第6天时,不切根组的活力要低于切根组,不切根处理抑制了POD活力。

图6 双孢菇采后PPO(A)与POD(B)活力变化Fig. 6 Changes in PPO (A) and POD (B) activity of Agaricus bisporus after harvest
2.7 采收方式对双孢菇采后挥发性风味物质变化
如表1所示,不同采收方式的双孢菇挥发性风味物质在贮藏期间呈动态变化,在贮藏期间两组处理共检测出60 种挥发性物质,其切根组检测出55 种,包括醛类27 种、醇类12 种、酮类6 种、其他类10 种(烯烃类2 种、烷烃类3 种、芳香类5 种);不切根组的双孢菇在贮藏期间共检测出50 种挥发性物质,包括醛类27 种、醇类8 种、酮类5 种、其他类10 种(烯烃类2 种、烷烃类2 种、芳香类6 种)。通过图7可知,随着贮藏时间延长,双孢菇挥发性醇、醛、酮类物质总含量呈现升高后下降的趋势,其中占总量最多的是醇类物质,其次是醛类物质。相同贮藏时间切根组的挥发性风味物质总含量普遍高于不切根组。
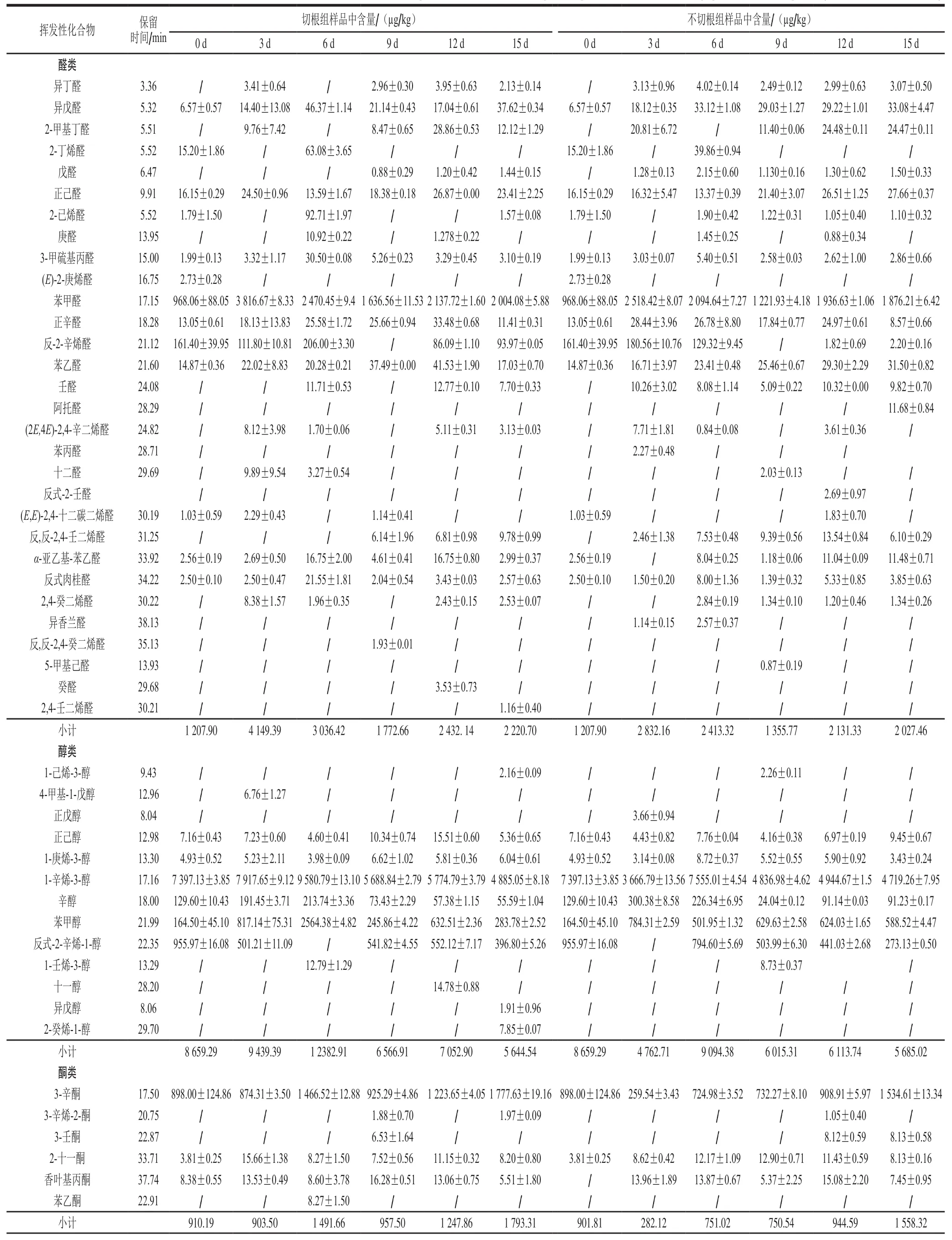
表1 切根与不切根组样品中挥发性成分的气相色谱-质谱联用检测结果Table 1 Contents of volatile components in samples from root-cutting and non-root-cutting root groups determined by gas chromatography-mass spectrometry
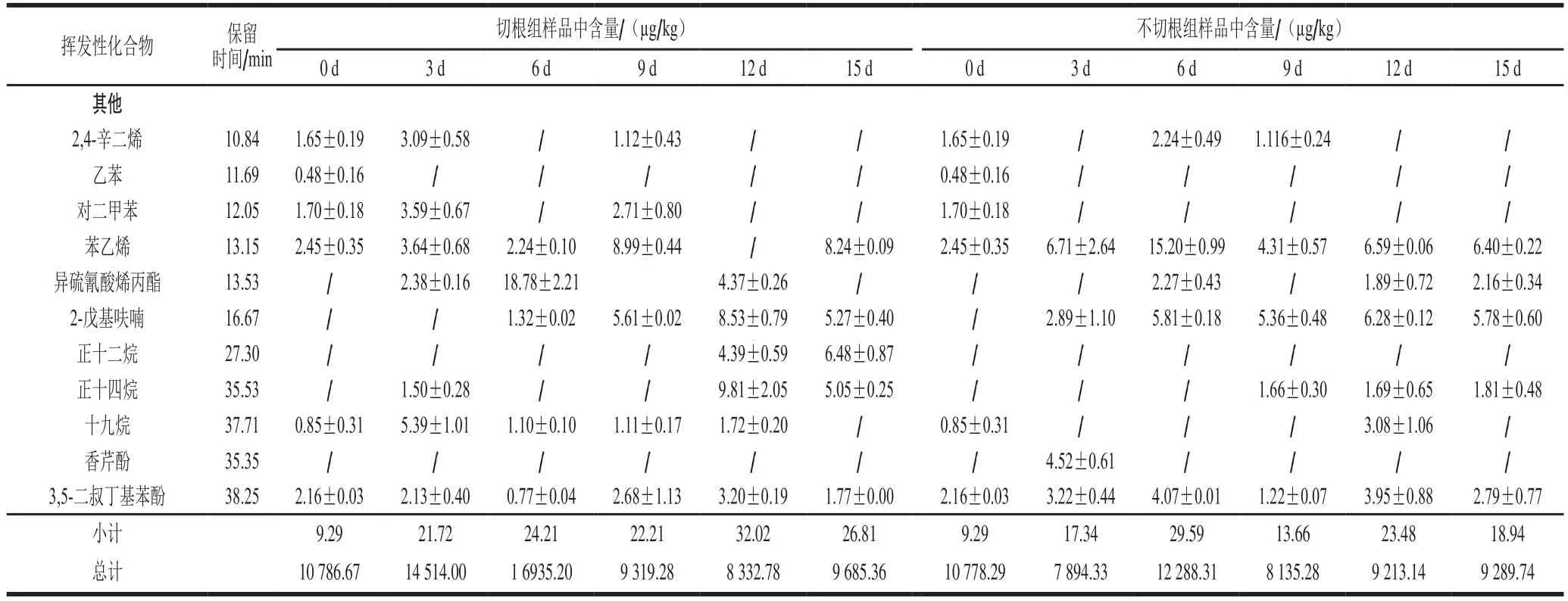
续表1
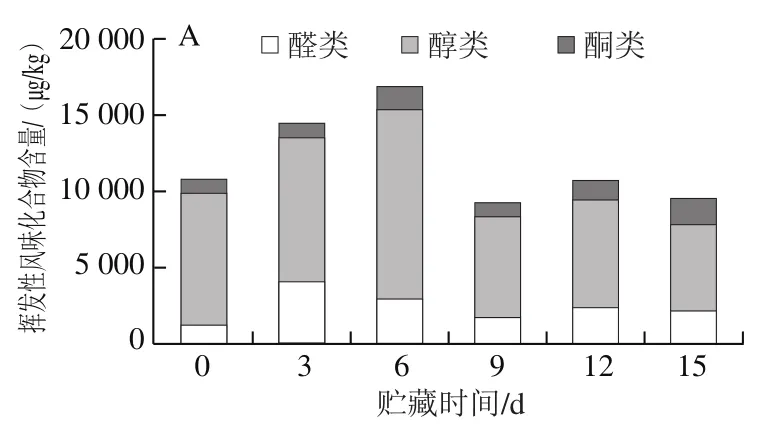
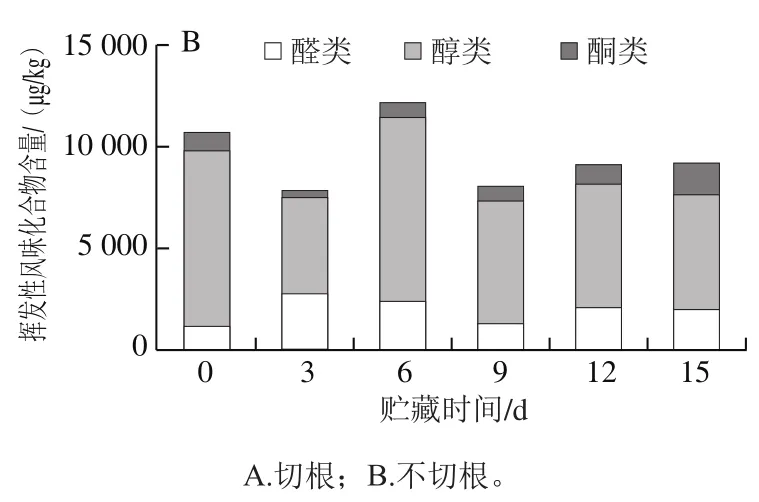
图7 贮藏期间不同采收方式双孢菇挥发性风味物质变化Fig. 7 Changes in volatile flavor compounds of Agaricus bisporus during storage
香气主要取决于挥发性成分的含量及其阈值,若只是以挥发性成分含量的高低定义该物质对香气的贡献是不准确的[31],故采用ROAV法对两组共有的挥发性风味成分进行分析。如表2所示,切根组双孢菇贮藏0~3 d时,ROAV在1.00~100.00之间的物质有1-辛烯-3-醇、苯甲醇、3-辛酮,在0.10~1.00之间的物质有异戊醛、正辛醛、苯甲醛;贮藏第6~9天,ROAV在1.00~100.00之间物质有异戊醛、1-辛烯-3-醇、苯甲醇和3-辛酮,在0.10~1.00之间的物质有正辛醛;贮藏12~15 d,ROAV在1.00~100.00之间的物质有异戊醛、1-辛烯-3-醇、苯甲醇,在0.10~1.00之间的物质有正己醛、苯乙醛、正辛醛、苯甲醛、3-辛酮。不切根组在0~3 d时,ROAV在1.00~100.00之间的物质有异戊醛、正辛醛、1-辛烯-3-醇、苯甲醇、3-辛酮,在0.10~1.00之间的物质有正己醛、苯乙醛、苯甲醛;第6~9天时,ROAV在1.00~100.00之间的物质有戊醛、1-辛烯-3-醇和苯甲醇,在0.10~1.00之间的物质有正己醛、苯乙醛、正辛醛、3-辛酮;12~15 d,ROAV在1.00~100.00之间的物质有异戊醛、1-辛烯-3-醇、苯甲醇,在0.10~1.00之间的物质有正己醛、苯乙醛、正辛醛、苯甲醛、3-辛酮。两组双孢菇中1-辛烯-3-醇、苯甲醇和3-辛酮的ROVA均在1.00~100.00之间,因此,这3 种物质可以作为双孢菇风味的特征性挥发性物质,同时3-辛酮、异戊醛在双孢菇采后贮藏后期ROAV在1.00~100.00,且含量明显增加,因此这两种物质可以作为双孢菇采后品质劣变过程中风味物质劣变的关键性挥发性物质。
3 讨 论
切根处理的双孢菇由于能保持洁净的外观,在销售时更易受到消费者的青睐。然而,切根处理会对双孢菇造成严重的机械损伤,易受到微生物侵染。研究发现,两组双孢菇在贮藏期间均发生了褐变,但褐变程度存在差异,与不切根组相比较,切根组褐变现象发展较迅速,褐变指数也较高,说明不切根处理可以减轻双孢菇褐变程度。质量损失率和硬度是评价双孢菇质地的重要指标[36],本实验中,不切根组能够维持双孢菇的硬度,延缓水分流失,防止其发生木质化。不切根组抑制了双孢菇相对电导率与MDA含量的上升,这一结果与季悦[37]的研究发现基本一致,可能原因是切根组直接导致细胞膜破裂,活性氧增多,膜脂过氧化产物生成,而细胞膜破裂导致的细胞液流出,有利于微生物的增长繁殖,进一步加剧了对细胞膜的损害,从而导致了MDA含量的上升。整个贮藏期间,两组可溶性糖、可溶性蛋白含量总体呈下降趋势,组间进行比较,不切根组的可溶性蛋白、总酚含量显著高于切根组,双孢菇在贮藏期间总酚、抗坏血酸含量整体趋势呈先上升后下降,不切根组的明显高于切根组,俞雅琼等[38]研究发现机械损伤会降低砀山梨的抗坏血酸的含量,与本研究结果一致。以上研究表明,不切根组可以较好地保持双孢菇中营养物质,可能原因是切根处理的双孢菇采后呼吸代谢旺盛,加速了菇体内营养物质的消耗。PPO和POD对棕褐色聚合物的形成有协同作用,人们普遍认为褐变是由于酚类物质被PPO和POD氧化,导致棕褐色物质的形成[39],本研究表明,切根因对双孢菇造成损伤,促使PPO的合成加快,而易发生褐变,这一结果在Ojeda等[40]研究中得以验证,不切根处理能够降低PPO和POD活力,抑制双孢菇酶促褐变。
双孢菇中挥发性风味物质的种类繁多,主要包括醛类、醇类、酮类等,而其中以亚油酸经过脂肪氧化酶氧化所形成的八碳化合物(C8H16O)最为重要[41]。双孢菇中最典型的风味物质是1-辛烯-3-醇,其具有由脂肪氧化酶催化亚油酸形成的熟蘑菇气味。采用GC-MS技术对切根与不切根组的双孢菇在贮藏期间的挥发性风味物质进行检测分析发现,1-辛烯-3-醇在双孢菇中含量最高,其具有浓烈的蘑菇气味,是双孢菇中的特征风味物质,这与Tao Feng等[22]研究结果相似。进一步研究发现,异戊醛与3-辛酮是双孢菇风味物质劣变的关键性挥发性物质,在贮藏过程中切根组的双孢菇异戊醛、3-辛酮含量要高于不切根组。
综上所述,与双孢菇采收时切根相比,不切根可以作为一种适宜的采收方式,可以有效延长双孢菇货架期、保持品质并延缓组织衰老与风味劣变。
