菊粉和大豆膳食纤维对牛肉饮食的小鼠肠道菌群及其代谢产物的改善作用
2022-04-01武明月孔祥丽张天阳冯熙瑞徐境含许晓曦
武明月,孔祥丽,张天阳,冯熙瑞,徐境含,许晓曦
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
肉类是人类饮食中重要的组成部分,含有高生物学效价的蛋白质、铁、锌、硒和VB[1]。随着经济发展,全球肉类消费持续增长,近年来红肉导致各类疾病风险和死亡率升高的报道与日俱增。研究表明,红肉的日摄入量每增加50 g/1 000 kcal,结直肠癌风险增加35%[2];总红肉和非加工红肉的日摄入量每增加1 份,冠心病风险分别升高12%和11%[3];除了提高心血管疾病风险以外,大量食用红肉也会增加消化道恶性肿瘤、非酒精性脂肪肝病、2型糖尿病及乳腺癌等疾病风险,其中牛肉对癌症发生的影响则更为显著[4-6]。完整的肠道黏膜屏障系统对保护机体健康和肠道稳态至关重要[7]。目前认为,肠黏膜屏障由肠黏膜上皮屏障、化学屏障、免疫屏障以及肠道菌群屏障构成[8],因此肠道菌群的失调也标志着肠屏障的损伤,进而可能引起慢性肠道炎症的发生[9]。如红肉的大量摄入会导致未消化的蛋白被肠道菌群发酵,产生腐胺和吲哚等物质[10],破坏肠稳态,导致肠屏障功能障碍及炎症等,从而增加结直肠癌和其他疾病的风险[11]。红肉中的肉毒碱和胆碱经肠道菌群代谢和酶的氧化作用生成有害产物氧化三甲胺(trimetlylamine oxide,TMAO),能增快血小板聚集、血栓形成及动脉粥样硬化,是预防和治疗心血管疾病的新靶点[12]。
近年来,通过饮食靶向肠道菌群来防治各类疾病成为了研究焦点。前瞻性研究结果分析表明,用含植物蛋白食物(豆类、坚果、大豆等)替换饮食中非加工红肉,冠心病风险会降低13%[3];抗性淀粉能缓解红肉导致的小鼠结肠DNA损伤和促结肠炎作用[13-14];但膳食纤维调节红肉饮食宿主肠道菌群从而降低患病风险的研究少有报道。研究表明,膳食纤维等复杂碳水化合物可降低结肠中微生物对蛋白质的代谢[15],抑制有害菌生长,促进有益菌生长并发酵产生乙酸、丙酸和丁酸等短链脂肪酸(short-chain fatty acids,SCFAs),调节宿主代谢及改善肠屏障功能,进一步减少心血管疾病、2型糖尿病、结直肠癌和乳腺癌等各类疾病的罹患风险[16]。其中菊粉作为最广泛使用的膳食纤维之一,能调节和改善结肠癌、心血管疾病和肥胖[17]。大豆膳食纤维作为大豆中重要的活性组分,可降低肥胖、糖尿病和结肠炎的发生率[18]。
目前为止,红肉仍具有无法替代的营养价值和适口性,因此,通过合理膳食调配以消除红肉对健康的负面影响是未来营养学探究的重要方向。本实验基于这一理念,旨在研究以牛肉(红肉)为蛋白来源的饮食对小鼠肠道菌群及其代谢产物的不良影响,以及菊粉和大豆膳食纤维对牛肉饮食导致的负面影响的改善作用。并通过肠道微生态特征明确不同饮食组合与疾病风险的相关性,探讨两种膳食纤维降低牛肉饮食罹患相关疾病风险的可能性。为合理膳食和未来个性化精准营养提供科学指导。
1 材料与方法
1.1 动物、材料与试剂
4 周龄SPF级雄性C57BL/6Cnc小鼠,体质量14~16 g,购自北京维通利华试验动物技术有限公司,实验动物生产许可证号:SCXK(京)2016-0006。
酪蛋白(纯度93%) 武汉诺梵生物科技有限公司;牛里脊肉(剔除脂肪和筋膜) 市售;菊粉(纯度94.3%) 卡尔迪克(上海)贸易有限公司;大豆膳食纤维(纯度87.9%) 西安恒基化工有限公司;依照AIN-93G标准定制饲料混合粉 南通特洛菲饲料科技有限公司;小鼠氧化三甲胺酶联免疫吸附测定试剂盒 上海江莱生物科技有限公司。
1.2 仪器与设备
BSA224S型分析天平 德国Sartorius公司;BPG-9070A鼓风干燥箱 上海一恒科技有限公司;3K15高速冷冻离心机 德国Sigma公司;VD-1320型无菌操作台北京东联哈尔仪器制造厂;RLE30086V型-80 ℃超低温冰箱 美国赛默飞世尔科技有限公司;Nexis GC2030/QP2020NX气相色谱质谱联用仪 日本岛津公司;HBS-1096A酶标仪 南京德铁实验设备有限公司。
1.3 方法
1.3.1 小鼠分组及饲养
实验小鼠以基础饲料适应性喂养2 周后,根据体质量随机分为空白对照组、牛肉组、牛肉与菊粉组和牛肉与大豆膳食纤维组,每组14 只,连续饲喂8 周。其中空白对照组饲喂含有20%酪蛋白的AIN-93G标准饲料,其他实验组同样依照AIN-93G标准饲料进行配方设计,饲喂20%牛肉蛋白代替20%酪蛋白,牛肉蛋白通过添加牛肉里脊获得。各实验组饲料含有质量分数5%的不同种类膳食纤维,空白对照组和牛肉组为纤维素,牛肉与菊粉组为菊粉,牛肉与大豆膳食纤维组为大豆膳食纤维。所有小鼠均处于室内温度(22±2)℃、相对湿度(50±10)%、12 h昼夜循环采光的适宜环境中,且自由进食、饮水。
1.3.2 样品采集
实验8 周后,断颈脱臼处死小鼠,取出肾脏并去除脂肪等其他杂质,放入离心管置于-80 ℃冰箱保存,用于后续检测。再于紫外无菌操作台解剖小鼠腹腔,完整分离肠道,取结肠末端2、3 颗内容物于灭菌后的EP管中,经液氮速冻后立即保存在-80 ℃冰箱用作后续高通量测序及SCFAs含量检测。
1.3.3 16S rRNA高通量测序
将小鼠结肠内容物样品进行基因组DNA抽提,利用质量分数1%琼脂糖凝胶电泳检测抽提后的基因组DNA,通过引物聚合酶链式反应(polymerase chain reaction,PCR)扩增细菌16S rRNA基因的V3~V4区,使用Agencourt AMPure XP试剂盒纯化PCR产物,再利用Real-Time PCR定量分析。构建MiSeq PE文库,在Illumina MiSeq PE 300平台上进行高通量测序。
使用QIIME和R语言软件对97%相似水平下聚类而成的操作分类单元(operational taxonomic units,OTUs)进行生物信息统计分析及作图[19],得到OTU数目Venn图、稀释性曲线、物种数目饱和度曲线、α-多样性指数、主成分分析(principal component analysis,PCA)图及门属水平物种组成。采用QIIME和Python软件分析并绘制线性判别分析效应量(linear discriminant analysis effect size,LefSe)图,其分析过程分为3 步:首先在多组样本中采用非参数Kruskal-Wallis检验组间丰度差异显著的物种,阈值为0.05;接着在所获得的显著差异物种中采用成组的Wilcoxon秩和检验进行组间差异分析,阈值为0.05;最后通过线性判别分析对数据进行降维,并评估差异显著物种的影响力分数,阈值设定2,即得到具有统计学差异的生物标志物。
1.3.4 小鼠结肠内容物SCFAs含量的测定
取50 mg小鼠结肠内容物,加5 mL超纯水,13 000 r/min离心10 min,取1 mL上清液,加10 μL体积分数50%硫酸溶液、0.5 g无水硫酸钠用于酸化盐析,再加无水乙醚定容至5 mL后,6 000 r/min离心5 min,取上清液过0.22 μm有机滤膜,采用外标法进行气相色谱-质谱联用法检测,根据稀释倍数按式(1)计算得到小鼠结肠内容物SCFAs含量[20]。
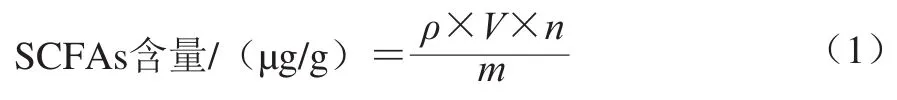
式中:ρ为仪器检测到的样品质量浓度/(μg/mL);V为定容后的体积/mL;n为稀释倍数;m为小鼠结肠内容物的质量/g。
色谱条件:色谱柱:DB-FFAP;升温程序:柱温起始温度为80 ℃,保持1 min,然后以10 ℃/min升温至170 ℃,再以20 ℃/min升温至200 ℃,维持2 min。载气为氦气,进样量为1 μL,分流比为50∶1。质谱条件:电子轰击离子源,离子源温度180 ℃,接口温度200 ℃,选择离子监测(selected ions monitoring,SIM)扫描方式,m/z分别为41、42、43、45、57、60、73,溶剂延迟1 min。
1.3.5 小鼠肾脏TMAO质量浓度的测定
用预冷的磷酸盐缓冲液(0.01 mol/L、pH 7.4)冲洗组织,去除残留血液,放入玻璃匀浆器中,按照1∶9(m/V)加入磷酸盐缓冲液,于冰上充分研磨。将匀浆液在5 000×g下离心5~10 min,取上清液,采用酶联免疫吸附测定试剂盒进行检测。用酶标仪在450 nm波长下测定标准品及样品的吸光度,根据标准品质量浓度和吸光度绘制标准曲线,按式(2)计算样品TMAO质量浓度。
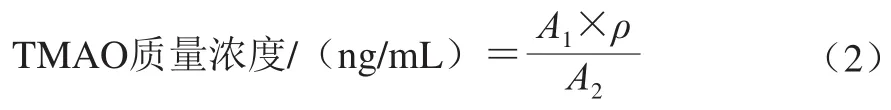
式中:A1为样品吸光度;A2为标准品吸光度;ρ为标准品质量浓度/(ng/mL)。
1.4 数据统计分析
实验数据采用平均值±标准差表示。采用Origin 9.5软件作图,SPSS 25.0软件进行统计分析,并运用邓肯检验对实验结果进行单因素方差分析,P<0.05认为差异显著并具有统计学意义。
2 结果与分析
2.1 肠道菌群结构分析
2.1.1 组间OTU分布比较
OTU与物种之间呈映射关系,是所有肠道菌群分析的基础。根据OTU聚类结果,可以进一步分析α-多样性、β-多样性、物种组成及差异性分析。不同分组之间OTU的相似性及重叠情况可以用Venn图展示。
由图1可知,各组共有OTU数目为172 个。牛肉与大豆膳食纤维组的OTU总数最多,达到544 个,特有OTU数目125 个;牛肉与菊粉组的OTU总数为465 个,特有85 个;空白对照组的OTU总数为371 个,特有20 个;牛肉组的OTU总数最少,为251 个,特有3 个。说明牛肉的摄入减少了肠道微生物的种类,而大豆膳食纤维与菊粉的添加分别促进了不同物种的增长,使物种丰富度明显提升。

图1 不同组别OTU数目的Venn图Fig. 1 Venn diagram showing unique and shared OTUs between different groups
2.1.2 物种多样性比较
肠道菌群多样性的降低,常伴随兼性厌氧菌比例上升及有害代谢物增多,与炎症性肠病、肝病、2型糖尿病和腹腔疾病多种疾病显著相关[21]。因此,物种多样性能够作为预测疾病的潜在指标。本实验采用α-多样性和β-多样性来展示不同样本或组别中的物种多样性。
α-多样性是度量单个样本内微生物物种多样性的指标,包含样品中的物种类别的多样性(丰富度)和每个物种所占比例(均匀度)两个因素。本实验采用基于OTU数据分析的稀释性曲线、物种数目饱和度曲线和α-多样性指数3 个方法评估α-多样性。稀释性曲线用来比较不同样本中物种的丰富度及评估样品的测序深度。由图2A可知,小鼠肠道菌群的稀释曲线趋于平坦,更多的测序数据量只会产生少量新的OTU,说明测序结果可以反映样本中绝大多数的微生物信息。在测序深度相同的情况下,牛肉与大豆膳食纤维组与牛肉与菊粉组的丰富度高于其他组,牛肉组的丰富度明显低于空白对照组。说明牛肉减少了小鼠肠道菌群的物种类别,而大豆膳食纤维和菊粉的添加提高了物种多样性。
物种数目饱和度曲线能从丰富度和均匀度两个方面来解释物种多样性,曲线的宽度反映物种丰富度,曲线的平滑程度反映物种均匀度。由图2B可知,在水平方向上,不同样品曲线在横轴上的范围不同,体现出各样品物种丰富度差异较大。其中牛肉组丰富度最低,牛肉与大豆膳食纤维组与牛肉与菊粉组丰富度更高。此外,牛肉组与其他组曲线相比坡度较大,物种分布均匀度较差。其他各组曲线平滑程度较好,整体趋势平缓,物种分布均匀。说明牛肉使小鼠肠道菌群的丰富度及均匀度降低,大豆膳食纤维和菊粉的添加有效改善了菌群的α-多样性,减少患病风险。

图2 肠道菌群的稀释性曲线(A)和物种数目饱和度曲线(B)Fig. 2 Rarefaction curves (A) and rank abundance curves (B) of intestinal flora
α-多样性指数包括一系列统计学分析指数,本实验采用Chao1指数、Observed species指数、Shannon指数及PD whole tree指数来评估各组的α-多样性。Chao1指数和Observed species指数与物种丰富度呈正相关;PD whole tree指数和Shannon指数越大,表明物种的丰富度和均匀度越好。由图3综合可知,4 种指数变化趋势相似,牛肉与大豆膳食纤维组和牛肉与菊粉组多样性显著高于牛肉组(P<0.05),牛肉与大豆膳食纤维组多样性显著高于空白对照组(P<0.05),空白对照组多样性显著高于牛肉组(P<0.05),牛肉与大豆膳食纤维组与牛肉与菊粉组之间差异不显著(P>0.05),牛肉与菊粉组与空白对照组之间差异不显著(P>0.05)。20%的牛肉蛋白水平饲粮导致小鼠肠道菌群多样性降低,这与Zhang Zhimin等[22]研究结果相似。而大豆膳食纤维和菊粉的添加能有效提高肠道菌群物种的丰富度和均匀度,更有利于维持肠道菌群稳态。
β-多样性是度量不同样本间菌群组成与分布相似度大小的指标。本实验采用PCA来评估β-多样性,其通过分析不同样本OTU组成对数据进行降维处理,找出数据中最“主要”的元素和结构,用于反映样本间的差异和距离,如样本组成越相似,则在PCA图中的距离越近。
由图4可知,横纵主坐标成分的贡献率分别是44.27%和24.24%,累计贡献率达68.51%,能很好地解释原样本中的信息。各组样本点之间分离明显,说明实验组和对照组之间肠道菌群构成存在较大差异,且菊粉和大豆膳食纤维的添加明显改变了牛肉饮食的肠道菌群组成和分布。由于两种膳食纤维的来源、结构等不同,故对肠道菌群结构的改变存在差异。
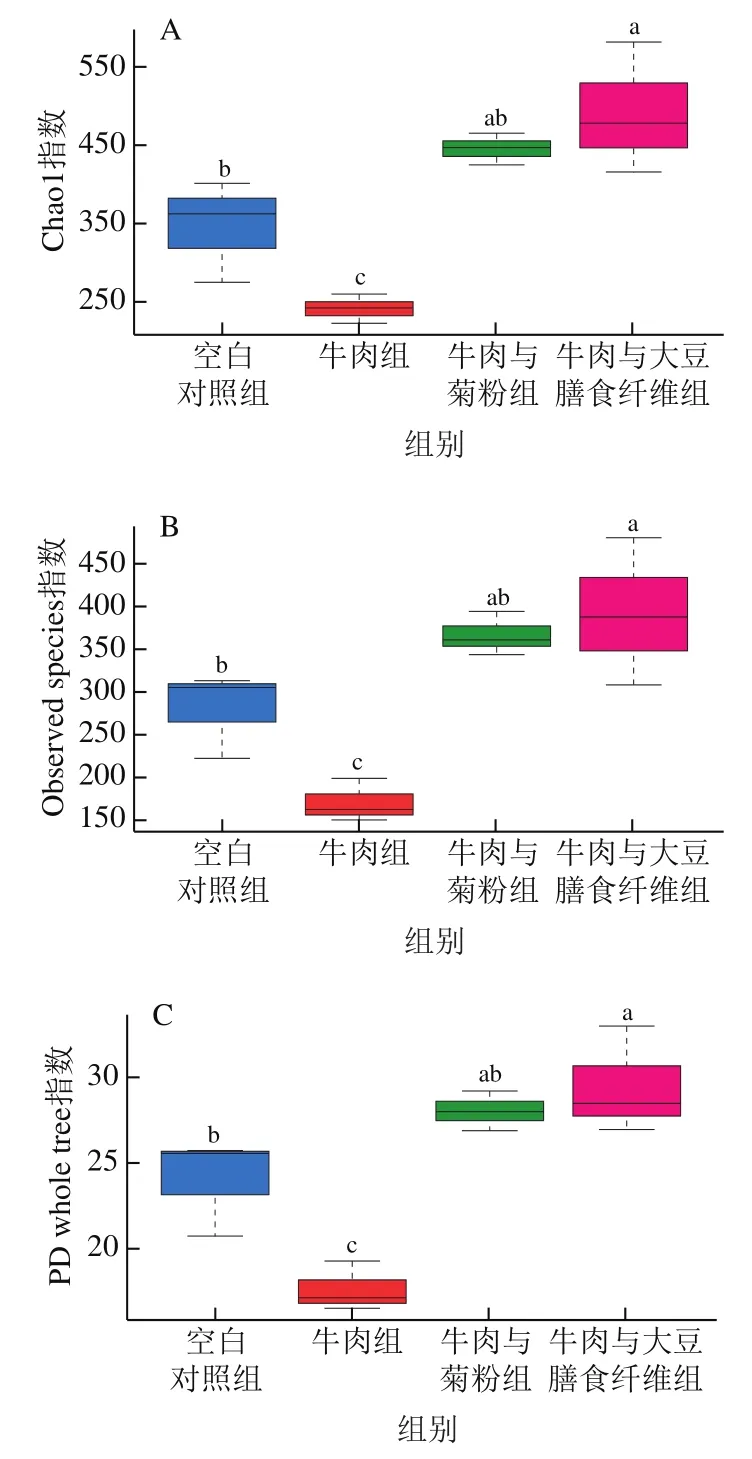
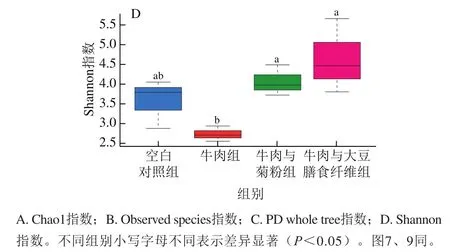
图3 肠道菌群的α-多样性指数Fig. 3 Alpha-diversity indexes of intestinal flora
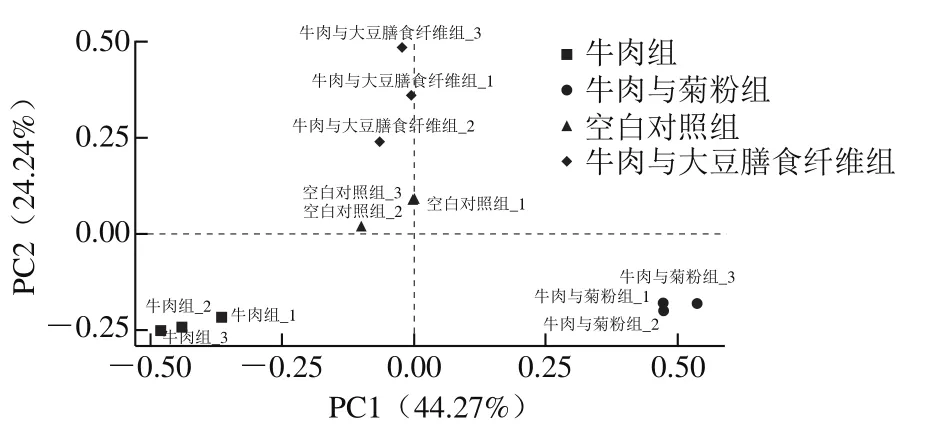
图4 小鼠肠道菌群的PCA图Fig. 4 PCA plot of intestinal flora of mice
2.1.3 物种组成和差异分析
本实验通过门、属水平的物种组成及LefSe进一步比较各组间群落构成的具体差异。LEfSe分析方法综合了统计学差异分析和该差异物种对分组结果的影响力得分,能得出各组在不同生物学水平上有显著差异的物种(即生物标志物)(图5)。
基于门水平的物种组成及差异分析如图6和表1所示,所有样品共注释4 个主要细菌门类,分别为厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和疣微菌门(Verrucomicrobia)。牛肉组与空白对照组相比,厚壁菌门相对丰度提高32.05%,是牛肉组中的差异物种。牛肉与菊粉组与空白对照组的门水平结构较为相似,且与牛肉组相比,牛肉与菊粉组放线菌门相对丰度升高24.09%。牛肉与大豆膳食纤维组与其他3 组相比,增加了5%左右相对丰度的疣微菌门,使菌群结构更稳定。另外,相较于牛肉组,牛肉与菊粉组和牛肉与大豆膳食纤维组都降低了厚壁菌门的相对丰度,提高了拟杆菌门的相对丰度。说明牛肉摄入导致肠道菌群结构失调,但菊粉和大豆膳食纤维的添加则改善了这种不良影响,更利于肠稳态的保持,与多样性分析结果相符。

图6 小鼠肠道菌群门水平物种组成分析柱状图Fig. 6 Composition of intestinal flora in mice at the phylum level
如图7所示,本实验中牛肉组的厚壁菌门与拟杆菌门相对丰度之比(Firmicutes/Bacteroidetes,F/B)显著大于其他3 组(P<0.05)。Kembra等[23]的研究也表明,牛肉摄入使变形菌门和厚壁菌门丰度增加,拟杆菌门丰度降低。有研究认为,F/B值与肥胖、肠易激综合症等疾病相关联[24-25];但也有研究认为,肠道菌群对肥胖的影响远比想象复杂,可能是由于某些细菌诱导了与脂质及碳水化合物代谢相关的基因表达导致体质量增加,因此F/B值很难被视为判别肥胖的标志[26]。但牛肉摄入引起的这种肠道菌群失调现象仍应该引起重视。

图7 各组厚壁菌门/拟杆菌门相对丰度比值Fig. 7 Relative abundance ratio between Firmicutes and Bacteroidetes in each group
属水平的物种组成及差异分析如图8及表2所示。属水平上牛肉与大豆膳食纤维组与空白对照组菌群组成更为相近,而牛肉组与其他3 组的菌群组成差距较大。说明大豆膳食纤维和菊粉的添加改善了牛肉饮食的属水平菌群构成,使其与常规饮食的菌群结构更加接近,与先前的多样性分析结果相印证。
与空白对照组相比,牛肉组中乳杆菌属、狭义梭菌属和Romboutsia丰度显著高于其他3 组。研究表明,常被认为是益生菌的乳杆菌同时亦是肠道菌群多样性较低时的主导细菌[27],肥胖者的肠道菌群中乳杆菌科的丰度显著高于正常人[28],某些乳杆菌属能促进肥胖的发生[29]。且乳杆菌属及梭菌属在胃癌患者中更加丰富,表现为胃癌特征性细菌[30]。狭义梭菌属与血压上升和坏死性肠炎相关[31]。Romboutsia能提高高密度脂蛋白胆固醇和超氧化物歧化酶水平[32];本实验牛肉组中乳杆菌属的丰度过高可能会导致肠道菌群失调,从而增大患病风险,且乳杆菌属和狭义梭菌属的相对丰度远高于Romboutsia相对丰度,意味着牛肉对菌群的负面影响会占据主导地位。且相较于空白对照组,牛肉组中双歧杆菌、粪杆菌属、瘤胃球菌科成员(Ruminococcaceae_UCG_014)、拟杆菌属、拟普雷沃菌属以及毛螺菌科成员(Lachnoclostridium、Lachnospiraceae_UCG_006和罗斯氏菌)的丰度降低。研究发现,双歧杆菌能调节免疫反应并增加阿克曼氏菌的丰度,与低度炎症、肥胖、胰岛素抵抗和2型糖尿病负相关[33-34];粪杆菌属是丁酸盐产生菌,在肠道炎症和肥胖个体中含量较低[35];瘤胃球菌科和拟普雷沃菌属具有抗炎作用,且Ruminococcaceae_UCG_014与血糖水平降低相关[36];而一些拟杆菌属表达的整合酶能模拟胰腺β-细胞上的抗原表位,召集相应的T细胞到肠道,从而抑制炎症发生[37];毛螺菌科与抗炎细胞数量正相关,能反转结肠炎的菌群失调和易感性[38]。其成员罗斯氏菌能抑制白细胞介素17(interleukin 17,IL-17)的表达并起到抗炎作用,在溃疡性结肠炎患者和高血压患者中丰度明显降低[39-40];Kembra等[23]研究表明,不同处理方式的牛肉可分别导致梭状芽胞杆菌、乳酸菌属和大肠杆菌丰度提高,毛螺菌科、双歧杆菌、阿克曼氏菌属、拟杆菌属和罗斯氏菌等有益菌丰度下降,对肠屏障产生不利影响。综上可知,牛肉饮食会对肠道菌群产生负面影响,引起轻度炎症、肥胖、结肠炎、高血压和2型糖尿病风险的提高。
牛肉与菊粉组相较于牛肉组,乳杆菌属和狭义梭菌属的丰度降低,明显提高了双歧杆菌、Ruminococcaceae_UCG_014、Lachnoclostridium、Lachnospiraceae_UCG_006、罗斯氏菌、拟杆菌属、拟普雷沃菌属和理研菌属的丰度。理研菌属是牛肉与菊粉组特有的一种黏蛋白降解菌,该菌与抑制肥胖功能正相关[28]。因此,菊粉的添加改善了牛肉饮食导致的有害菌增加及有益菌减少,具有降低低度炎症、2型糖尿病、结肠炎、高血压和肥胖风险的作用。
相较于牛肉组,牛肉与大豆膳食纤维组减少了乳杆菌属和狭义梭菌属的丰度,使粪杆菌属、阿克曼氏菌、戈登氏杆菌属、拟普雷沃菌属、安德克氏菌属、瘤胃球菌科成员(Ruminococcaceae_UCG_014、Ruminiclostridium_6和Ruminococcus_1)以及厌氧原体属的丰度升高。研究报道,阿克曼氏菌作为新兴益生菌,能够增强肠道屏障,减轻慢性低水平炎症,缓解肥胖、炎性肠病、高血压和糖尿病[41];厌氧原体属与血脂的生物标志物负相关[42],且可作为治疗慢性肠炎的潜在益生菌[43];粪杆菌属能够利用复杂多糖[35]。戈登氏杆菌属参与将木脂素转化为具有抗氧化和防治疾病功效的肠道木脂素的过程[44]。安德克氏菌属是具有免疫调节的细菌,与黄酮醇、黄烷醇的摄入量呈正相关[45]。因此,可能是大豆膳食纤维中的木脂素及黄酮类物质等植物活性成分促进了这些菌的生长。说明大豆膳食纤维的添加提高了与植物来源膳食有关的有益菌丰度,改善了牛肉对肠道菌群的负面影响。并与菊粉相似,能够减少肥胖、炎性肠病、心血管疾病和糖尿病的患病风险。
综上,菊粉和大豆膳食纤维的添加分别促进了不同种类的益生菌生长,改善了小鼠结肠菌群属水平的丰富度,使牛肉引起的患病风险概率降低,与上述多样性分析相印证。在本次实验期间内,小鼠未患有任何疾病,但牛肉饮食的小鼠肠道菌群揭示的各种疾病风险增加与流行病学研究表明的多种疾病风险升高相吻合,为调节肠道菌群的个性化营养疗法可行性提供了理论支持。

图8 小鼠肠道菌群属水平物种组成分析柱状图Fig. 8 Compositions of intestinal flora in mice at the genus level
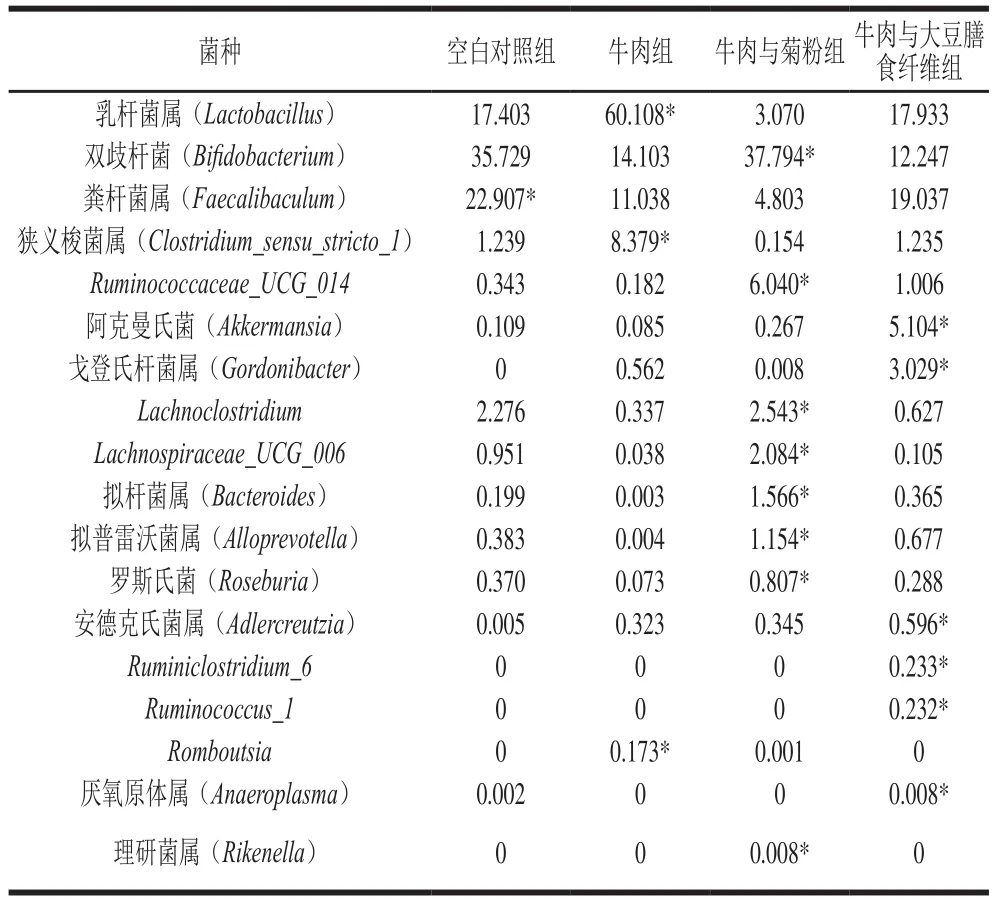
表2 属水平差异物种生物标志物在各组中的相对丰度Table 2 Relative abundance of biomarkers at the genus level in each group%
2.2 肠道代谢产物分析
2.2.1 小鼠结肠内容物SCFAs含量对比
SCFAs是肠道微生物种群发酵不易消化多糖形成的主要产物,对维持肠道正常功能和结肠上皮细胞的形态和功能具有重要作用。
研究发现,SCFAs可加强肠道屏障功能、参与免疫调节、降低胆固醇的合成,改善肥胖、预防心脑血管疾病、炎性肠病及2型糖尿病等[46],特别是丁酸具有抑制结肠上皮细胞肿瘤的作用[47]。如表3所示,本实验中牛肉与大豆膳食纤维组小鼠的结肠内容物总SCFAs含量显著高于其他3 组(P<0.05),牛肉与菊粉组小鼠的结肠内容物总SCFAs含量显著高于牛肉组(P<0.05)。牛肉与大豆膳食纤维组的乙、丙、丁酸含量显著高于其他3 组(P<0.05),异丁酸、异戊酸含量显著高于牛肉组(P<0.05)。牛肉与菊粉组的乙酸、丙酸含量显著高于牛肉组(P<0.05)。揭示单独饲喂牛肉减少了SCFAs的生成,但添加两种膳食纤维能明显改善牛肉饮食引起的SCFAs含量降低,其中大豆膳食纤维的效果更好。
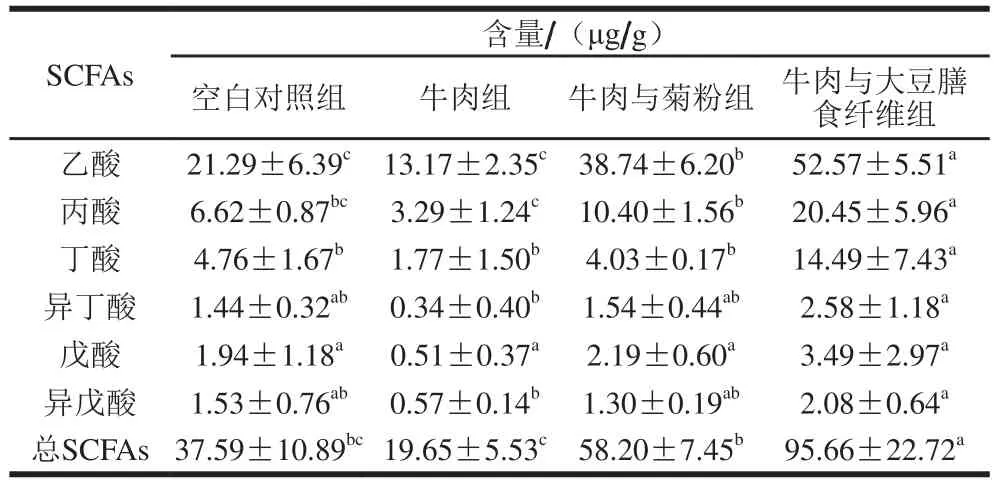
表3 小鼠结肠内容物短链脂肪酸含量Table 3 Concentrations of SCFAs in colon contents
有研究表明,相较于常规饮食,饲喂猪肉香肠的大鼠粪便中乙酸、丁酸和丙酸的浓度显著下降[1]。亦有研究显示,相比含有酪蛋白的普通饲料,饲喂牛肉蛋白的大鼠盲肠菌群代谢的丁酸和丙酸含量偏低[48]。本研究中牛肉组相比其他实验组各种SCFA水平均为最低,可能由于该组菌群多样性偏低,双歧杆菌属、粪杆菌属、瘤胃球菌科、毛螺菌科成员(Lachnospiraceae_UCG_006、罗斯氏菌)等SCFAs产生菌丰度较低。有报道指出,糖尿病患者服用菊粉可显著升高粪便中总SCFAs、乙酸和丙酸的浓度[49],这与本实验结果相符。因为菊粉的摄入增加了小鼠肠道双歧杆菌属、瘤胃球菌科、毛螺菌科、拟杆菌属、拟普雷沃菌属等SCFAs产生菌的丰度。目前的体外发酵研究表明,大豆膳食纤维产生的乙酸、丙酸和丁酸量比燕麦麸皮、玉米麸皮或麦麸纤维多1.5~8.0 倍[50],这与本研究结果基本一致。大豆膳食纤维显著提高了SCFAs产生菌的丰度,如粪杆菌属、阿克曼氏菌、瘤胃球菌科、拟普雷沃菌属、拟杆菌属及罗斯氏菌。
2.2.2 小鼠肾脏TMAO质量浓度对比
红肉中的肉毒碱和胆碱经肠道菌群代谢和酶的氧化作用生成有害产物TMAO,主要通过肾脏排出体外。研究表明,大量食用红肉能显著升高人体内的TMAO含量,降低其肾排泄率,进而提高心血管疾病、肾病、糖尿病和肥胖等风险[51-52]。如图9所示,本研究中牛肉组肾脏TMAO质量浓度显著大于其他3 组(P<0.05),牛肉与菊粉组和牛肉与大豆膳食纤维组肾脏TMAO质量浓度显著低于牛肉组和空白对照组(P<0.05)。目前已有的研究证实,植物乳杆菌可通过调节肠道菌群结构显著降低TMAO含量,表明益生菌可通过调控体内TMAO进而起到预防心血管等疾病的作用[53]。还有研究报道,补充丁酸盐可逆转TMAO促慢性肾病作用[54]。由此证明TMAO和SCFAs都对疾病的发生有重要影响。

图9 小鼠肾脏TMAO含量Fig. 9 TMAO content in mouse kidney
3 结 论
红肉是目前人类饮食中必不可少的一部分,虽然已有的研究表明其具有促炎、促癌等不良影响。但本研究证实,通过菊粉和大豆膳食纤维的添加可缓解牛肉(红肉)对小鼠肠道菌群和代谢产物的负面影响:菊粉可促进小鼠肠道双歧杆菌、Ruminococcaceae_UCG_014等丰度提升;大豆膳食纤维能增加阿克曼氏菌属、粪杆菌属等丰度。两种膳食纤维的摄入均降低了体内TMAO质量浓度,提高了结肠内容物的SCFAs含量。两种膳食纤维能够降低红肉饮食增加的肥胖、炎性肠病、心血管疾病和糖尿病的风险。本研究对红肉饮食增加疾病风险的机制进行了解析,并为未来合理膳食及个性化营养辅助治疗疾病提供了科学理论支持。
