鞣花酸对马兜铃酸I诱导小鼠急性肾损伤的保护作用
2022-04-01戴晨曦阿尔斯拉玉苏甫舒广文邓旭坤
孙 慧,付 千,戴晨曦,阿尔斯拉·玉苏甫,舒广文,邓旭坤
(中南民族大学药学院,民族药学国家级实验教学示范中心,湖北 武汉 430074)
马兜铃酸I(aristolochic acids I,AAI)是一种能够导致肾损伤的天然化合物[1]。一般认为,AAI所致肾毒性发生的主要原因是含有AAI的中草药或中成药的滥用[2]。在AAI的作用下,肾脏内肿瘤坏死因子(tumor necrosis factor,TNF)-α、白细胞介素(interleukin,IL)-1β和IL-6水平提高[3-4]。这将进一步导致肾脏内氧化应激、肾脏显微结构改变和肾功能异常[5]。由此可见,AAI的肾毒性与该化合物所致的肾内炎症反应紧密相关。
鞣花酸(ellagic acid,EA)是一种广泛存在于石榴、树莓、葡萄等水果中的天然多酚类化合物[6-7]。树莓不同部位中的EA含量差异较大,在10~1 000 μg/g之间[8]。健康人食用800 mg石榴提取物后,血浆中EA的平均质量浓度为(33.8±12.7)ng/mL[9]。研究发现,EA可下调脂多糖诱导的炎症因子表达,降低肾损伤动物血清中IL-1β、IL-6、TNF-α等炎性因子水平并呈现明显的肾脏保护活性[10]。EA亦可降低二型糖尿病大鼠体内的IL-6、TNF-α、核转录因子(nuclear factor,NF)-κB等炎症相关因子的水平并表现出对胰岛素抵抗的改善作用[11]。EA也可以抑制脂肪性肝病小鼠体内NF-κB、TNF-α、IL-6和环氧合酶-2等炎症相关因子的表达并发挥肝脏保护活性[12]。不仅如此,EA还可以抑制硫氧还蛋白互作蛋白(thioredoxininteractingprotein,TXNIP)、IL-1β炎症信号并起到保护糖尿病小鼠胰腺的作用[13]。以上研究结果提示,EA能有效缓解各种病理性脏器内炎症反应。另一方面的研究则发现,EA对顺铂或四氯化碳诱导的急性肾损伤具有很好的保护作用[14-15]。然而,目前关于EA干预AAI肾毒性的实验研究还比较缺乏。因此,本研究旨在探讨EA对AAI所致小鼠急性肾损伤的保护作用及其可能机制。
1 材料与方法
1.1 动物、材料与试剂
SPF级昆明小鼠40 只,体质量18~22 g,由湖北省疾病预防控制中心提供,实验动物生产许可号:SCXK(鄂)2016-0003。
EA(纯度≥98%) 宝鸡市辰光科技有限公司;AAI(纯度≥99%) 江苏永健科技医药有限公司。
尿素氮(blood urea nitrogen,BUN)试剂盒、肌酐(creatinine,Cr)试剂盒、还原型谷胱甘肽(glutathione,GSH)试剂盒、总超氧化物歧化酶(total superoxide dismutase,T-SOD)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒 南京建成生物技术研究所; TNF-α、IL-1β试剂盒 武汉贝莱茵生物科技有限公司。苏木精-伊红(hematoxylin-eosin,HE)和Masson染色试剂盒 南京森贝伽生物科技有限公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein,ASC)、半胱氨酸蛋白酶(Caspase)-1、IL-1β抗体 武汉爱博泰克生物科技有限公司;NF-κB p65、磷酸化NF-κB(phospho-NF-κB,p-NF-κB)p65、NF-κB抑制蛋白(inhibitor of NF-κB,IκB)α、磷酸化IκBα(phospho-IκBα,p-IκBα)抗体 上海碧云天生物技术有限公司;TRIzol试剂盒武汉赛维尔生物科技有限公司。
1.2 仪器与设备
TD4型低速离心机 上海卢湘仪离心机仪器有限公司;PB100-SP04型组织匀浆器 北京兰博康斯科技有限公司;荧光显微镜 上海光学仪器厂;7500实时定量聚合酶链式反应仪(quantitative polymerase chain reaction,qPCR) 美国应用生物系统有限公司;Western blot显影仪 上海天能公司;电泳仪 北京市六一仪器厂;低温高速离心机 美国SCILOGEX公司。
1.3 方法
1.3.1 实验动物分组及处理
小鼠每天给予充足的水和饲料,适应性饲喂1 周后开始实验。所有动物实验方案均通过中南民族大学实验动物伦理委员会审查(批文号:2018-SCUEC-AEC-014)。将40 只昆明小鼠随机分为健康组(10 mL/kgmb生理盐水)、模型组(10 mg/kgmbAAI)、EA低剂量组(10 mg/kgmbAAI+10 mg/kgmbEA)和EA高剂量组(10 mg/kgmbAAI+30 mg/kgmbEA),每组10 只,雌雄各半。小鼠按照10 mL/kgmb的给药体积进行给药,健康组小鼠每天灌胃生理盐水,持续12 d。EA不同剂量组小鼠每天灌胃不同剂量的EA,持续12 d。从第7天开始,模型组和EA组每天腹腔注射AAI,连续5 d。最后一次给药后,小鼠禁食不禁水12 h,然后收集小鼠尿液。麻醉小鼠,眼眶静脉丛采血并离心得到血清,-80 ℃保存用于生化检测。颈椎脱臼处死小鼠,取出其两侧肾脏,用预冷的生理盐水洗净、拭干并测定质量,计算肾脏指数(肾脏质量占体质量的百分比)。左肾放入组织固定液中,用于组织病理学等检查,右肾储存在-80 ℃下,用于后续各项指标的测定。AAI造模和EA干预的给药剂量参考已有的文献报道[16-18]。
1.3.2 生理生化指标测定
取小鼠尿液,用Bradford法检测尿蛋白质量浓度。参考相应的试剂盒说明书测定血清中Cr、BUN、TNF-α和IL-1β的水平以及肾组织中T-SOD、MDA和GSH的水平。
1.3.3 肾组织HE和Masson染色
取小鼠左肾按照HE和Masson染色试剂盒说明书描述的方法操作,在显微镜下观察拍照。
1.3.4 肾组织蛋白的提取及免疫印迹检测
取小鼠右肾进行免疫印迹检测,分析特定蛋白表达情况。采用蛋白抽提试剂盒按说明提取小鼠肾组织蛋白。免疫印迹的实验步骤参考文献[19]。使用p-IκBα、IκBα、p-NF-κB p65、NF-κB p65、NLRP3、ASC、Caspase-1、IL-1β、和GAPDH一抗室温孵育2 h。二抗采用山羊抗兔或山羊抗小鼠二抗室温下孵育1 h,然后进行显色,用Image J分析软件对蛋白质条带进行半定量分析。
1.3.5 qPCR检测相关基因的表达
取小鼠右肾进行特定蛋白的基因转录水平的检测。采用TRIzol试剂盒提取总RNA,然后参考文献[20]进行反转录与实时荧光qPCR,扩增引物的序列如表1所示。引物由生工生物工程(上海)股份有限公司合成。

表1 qPCR引物序列Table 1 Primer sequences used for qPCR
1.4 数据统计与分析
实验结果均以平均值±标准差表示。所有显示的实验数据代表或统计了至少3 个独立实验的结果,使用GraphPad Prism 6.0软件进行数据分析,通过单因素方差比较组间差异,通过Dunnett检验进行显著性分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 EA对AAI诱导的肾损伤小鼠肾功能的影响
如表2所示,与健康组相比,模型组小鼠肾脏指数、尿蛋白以及血清中BUN和Cr水平显著或极显著升高(P<0.05、P<0.01),说明AAI能够诱导小鼠肾脏肿大和引起小鼠肾功能异常。与模型组相比,EA预处理后,小鼠肾脏指数显著或极显著降低(P<0.05、P<0.01),尿蛋白以及血清中BUN和Cr水平显著或极显著下降(P<0.05、P<0.01)。

表2 EA对AAI诱导的肾损伤小鼠肾功能的影响Table 2 Effect of EA on renal function in mice with AAI-induced renal injury
2.2 EA对AAI诱导的肾损伤小鼠肾组织病理学的影响
如图1A所示,HE染色结果表明,健康小鼠的肾脏组织结构致密,无充血或水肿,鲜见炎性细胞浸润。模型组小鼠肾脏可见明显的充血与炎性细胞浸润。如图1B所示,Masson染色结果表明,模型组小鼠肾脏内可见明显的纤维增生。EA可改善AAI所致肾损伤小鼠的肾脏组织病理学变化。
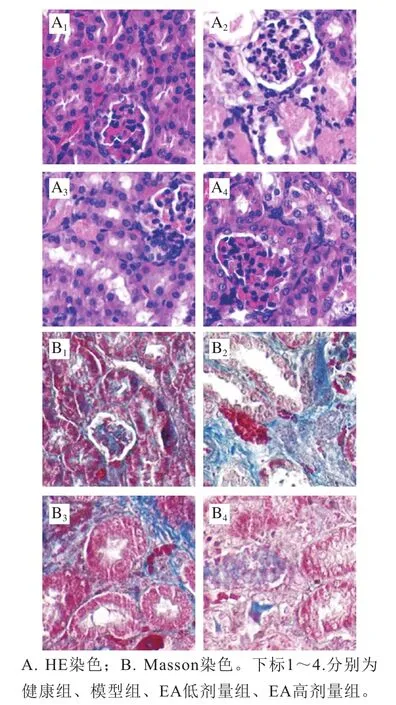
图1 EA对AAI诱导的肾损伤小鼠肾组织病理学的影响(200×)Fig. 1 Effect of EA on renal histopathology in mice with AAI-induced renal injury (200 ×)
2.3 EA对AAI诱导的肾损伤小鼠肾脏内氧化应激的影响
如表3所示,与健康组相比,模型组小鼠腹腔肾内的GSH和T-SOD水平较健康小鼠均极显著降低(P<0.01),而MDA含量则极显著升高(P<0.01),说明在AAI的作用下,小鼠肾内发生了氧化应激。与模型组相比,EA高剂量组小鼠肾中MDA含量显著下降(P<0.05),GSH和T-SOD水平极显著升高(P<0.01)。

表3 EA对AAI诱导的肾损伤小鼠氧化应激的影响Table 3 Effect of EA on oxidative stress in mice with AAI-induced renal injury
2.4 EA对AAI诱导的肾损伤小鼠炎症因子的影响
如图2A、B所示,与健康组相比,模型组小鼠血清中TNF-α和IL-1β水平极显著上升(P<0.01);而与模型组小鼠相比,不同剂量的EA处理则明显降低小鼠血清中TNF-α和IL-1β的水平。如图2C、D所示,与健康组相比,模型组小鼠肾脏内TNF-α和IL-1β的转录水平极显著升高(P<0.01);而与模型组小鼠相比,不同剂量的EA处理可极显著降低肾中TNF-α和IL-1β编码基因的转录水平(P<0.01)。
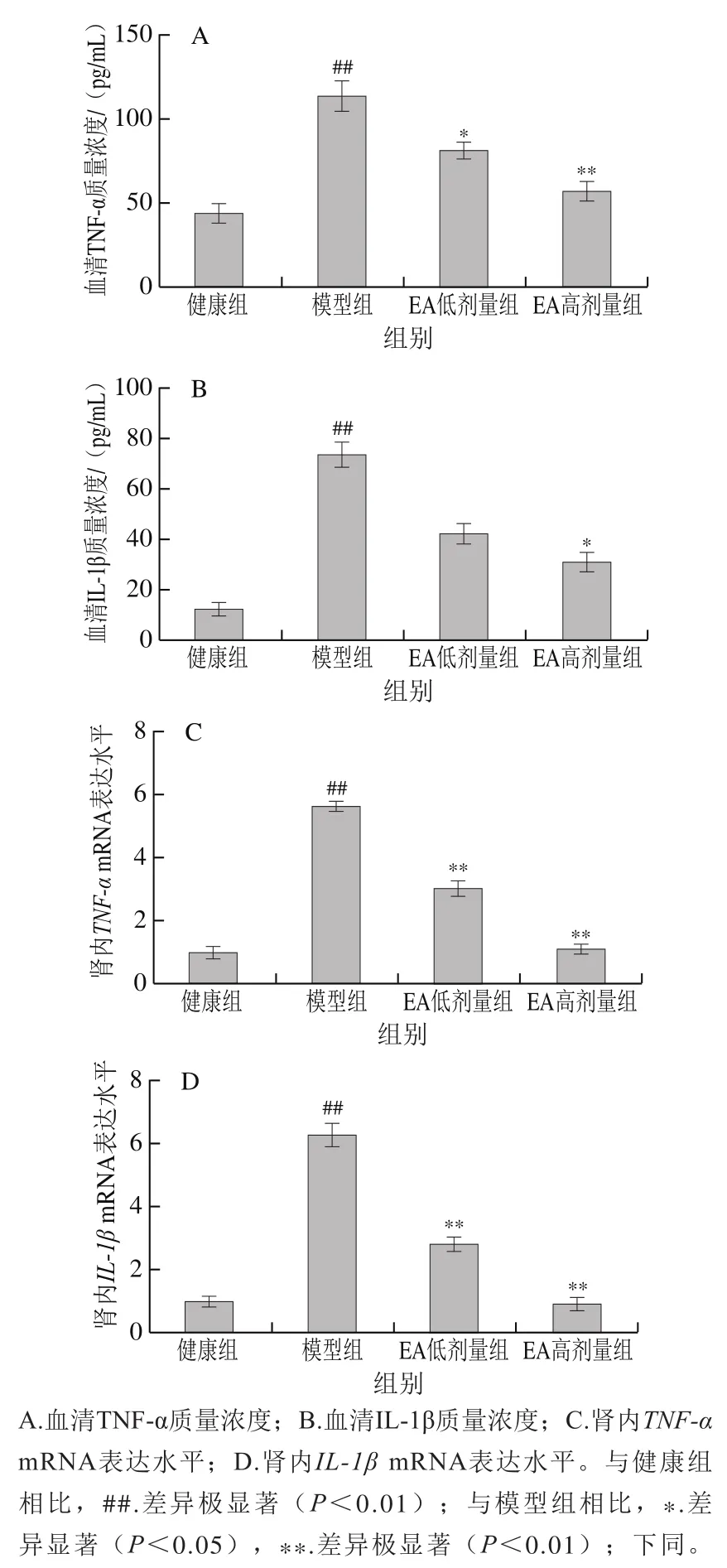
图2 EA对AAI诱导的肾损伤小鼠炎症因子的影响Fig. 2 Effect of EA on inflammatory factors in mice with AAI-induced renal injury
2.5 EA对肾损伤小鼠肾内NF-κB/NLRP3信号通路的影响
如图3A所示,与健康组小鼠相比,模型组小鼠肾脏内NF-κB p65亚基和IκBα的磷酸化水平(磷酸化蛋白与该蛋白灰度的比值)均极显著升高(P<0.01),提示AAI能激活肾脏内的NF-κB通路。与模型组相比,不同剂量EA显著或极显著地抑制了AAI对肾内NF-κB的激活作用(P<0.05、P<0.01)。NLRP3、ASC、Caspase-1和IL-1β是NLRP3炎性小体的主要组分,其表达受NF-κB调控[21]。如图3B、C所示,与健康组小鼠相比,AAI显著上调了肾内NLRP3、ASC、Caspase-1和IL-1β的转录和翻译(P<0.05)。而EA则能明显抑制AAI对NLRP3炎性小体各组分的表达诱导作用(P<0.05)。
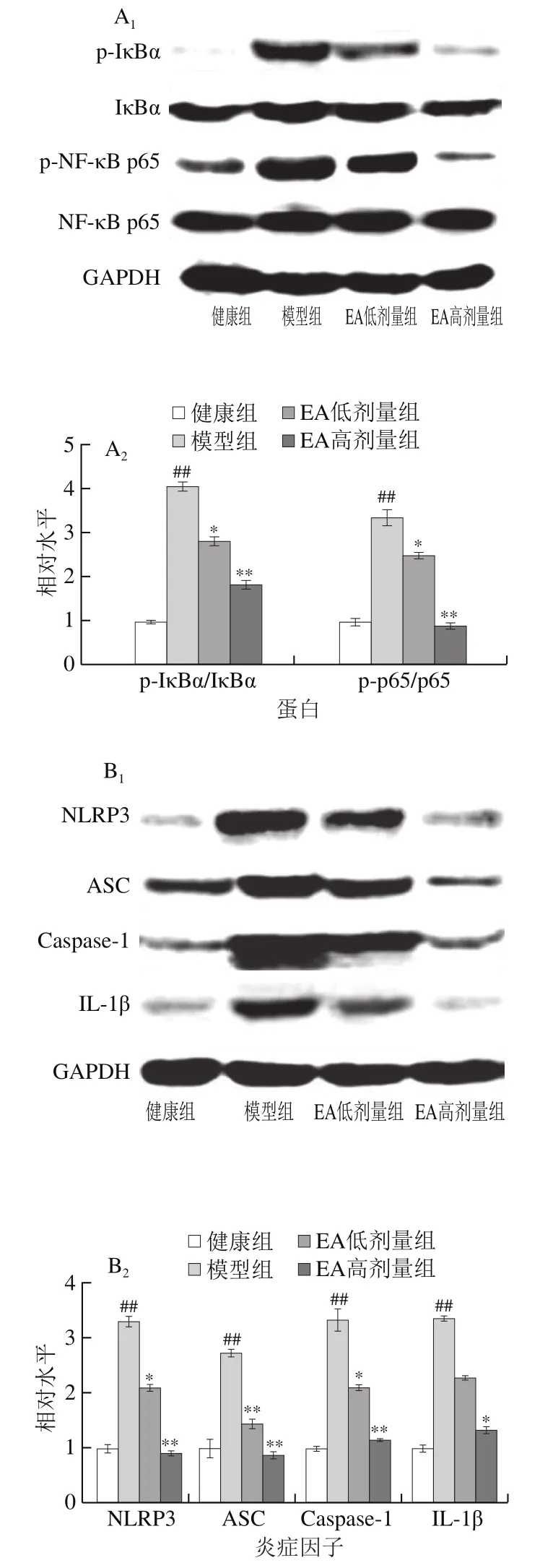

图3 EA对AAI诱导的NF-κB/NLRP3信号通路的影响Fig. 3 Effect of EA on NF-κB/NLRP3 signaling pathway in mice with renal injury induced by AAI
3 讨 论
血清BUN/Cr和尿蛋白水平是临床常用的肾功能指标[22]。与健康组相比,模型组小鼠血清BUN/Cr和尿蛋白水平明显升高,提示肾损伤模型建立成功;与模型组相比,EA显著降低了血清BUN/Cr和尿蛋白水平。肾脏HE及Masson染色显示,AAI可引起肾脏显微结构改变和肾间质纤维化。这和已有文献的报道[23]是一致的。EA能明显缓解AAI诱导的肾脏病理学变化。肾脏内的氧化应激在肾损伤发生发展过程中起到了关键性作用。一项临床研究显示,阿托伐他汀联合前列地尔可有效改善患者的肾脏氧化应激,提升肾功能[24]。本研究中,与健康组相比,模型组小鼠的T-SOD和GSH水平显著降低,MDA水平显著升高,提示AAI能诱导肾脏内的氧化应激。而与模型组相比,EA能显著提高T-SOD活性和GSH含量,降低MDA水平,改善肾脏内的氧化应激。以上研究结果提示,EA能有效缓解AAI诱导的小鼠肾损伤。
与健康组相比,模型组小鼠肾脏内TNF-α和IL-1β的转录水平明显上升,血清中这两个炎症因子的质量浓度也有相应的上升。EA则显著改善了AAI诱导的肾内炎症反应。NF-κB是调控机体炎症反应的关键性转录因子,其调节因子IκBα的磷酸化有利于NF-κB核心转录因子p65转位进入细胞核,而NF-κB p65的进一步磷酸化则能提高其启动下游基因转录的能力[25]。在糖尿病肾病小鼠的肾脏中,NF-κB p65、IL-6基因和蛋白的表达水平异常升高[26]。此外,研究发现缺血再灌注所致急性肾损伤大鼠的肾组织NF-κB信号通路相关蛋白TNF-α、p-NF-κB p65、NF-κB p65蛋白表达量显著上升[27]。以上研究结果提示,肾脏中NF-κB通路的异常激活与肾损伤的发生发展紧密相关。本研究发现,与健康组相比,模型组小鼠肾脏内IκBα和NF-κB p65亚基的磷酸化水平有明显提高。提示AAI能激活肾脏内的NF-κB通路。有研究表明,关木通中所含的马兜铃酸类化合物能上调大鼠肾内的NF-κB活性[28],与本研究的结果一致。与模型组相比,不同剂量的EA干预后,肾损伤模型小鼠肾内NF-κB通路活性明显下调。相似地,EA能通过抑制NF-κB减轻炎症反应,从而改善肾缺血再灌注所致的大鼠肾损伤[29]。以上研究结果提示抑制NF-κB介导的炎症反应在EA发挥肾脏保护活性过程中可能起到了关键性作用。
NF-κB是诱导NLRP3炎症小体活化的关键性上游信号之一。NLRP3炎症小体的活化在非病原体感染所致的肾脏内炎症反应及其后续肾损伤过程中起到了重要作用[30]。临床上糖尿病肾病患者常见外周血NLRP3炎症小体水平异常[31]。在免疫球蛋白A肾病大鼠血清内,也可以检测NLRP3的水平显著升高[32]。给予阿托伐他汀抑制NLRP3炎症小体的活化则有利于缓解IgA肾病大鼠的肾损伤[33]。相似地,白杨素可抑制NLRP3炎症小体的活化,减轻缺血再灌注诱导的小鼠肾损伤[34];小檗碱可干预NLRP3炎症小体活化并改善糖尿病相关的肾功能低下[35];降低NLRP3各组分的表达水平有利于缓解顺铂所致的肾损伤[36]。以上研究结果提示,抑制NLRP3炎症小体活化可作为改善肾损伤的一条可行的策略。在小胶质细胞中,EA可抑制NLRP3炎症小体的激活,缓解细菌脂多糖诱导的多巴胺神经毒性[37]。EA还被报道能够通过抑制NLRP3炎症小体活化改善毒物所致的大鼠肺动脉高压[38]。本研究发现,与模型组相比,在EA的作用下AAI所致肾损伤小鼠肾脏内NLRP3炎症小体各组分的mRNA和蛋白水平均有明显下降。与此相似的是,有研究表明,细胞因子IL-22可通过干预NLRP3炎症小体的活化缓解AAI所致的肾损伤[39]。以上研究结果提示,抑制NLRP3炎症小体可能与EA缓解AAI所致的肾损伤紧密相关。
综上所述,从肾脏指数、尿蛋白水平、血清BUN/Cr水平、肾脏显微结构、肾脏内氧化应激程度等多方面指标来看,EA能显著改善AAI引起的小鼠急性肾损伤。进一步研究表明,EA能抑制肾损伤模型小鼠肾脏内NF-κB通路,下调NLRP3炎症小体各组分的表达,降低炎症因子TNF-α和IL-1β水平。这提示AAI发挥肾脏保护活性的机制可能与通过靶向NF-κB和NLRP3干预AAI所致的肾脏内炎症反应有关。有研究表明,EA能显著降低IL-1β、IL-6和TNF-α等炎症因子的水平,从而缓解由D-半乳糖所致衰老大鼠的肝和脑损伤[40]。EA也可以通过干预环氧合酶-2炎症通路缓解酸诱导的急性肺损伤[41]。EA还可以通过抑制MAPK和STAT途径介导的炎症反应改善动物皮肤损伤[42]。以上研究结果提示EA对炎症性脏器损伤可能具有较为普遍的改善作用。
