特香型白酒大曲中一株耐热产淀粉酶地衣芽孢杆菌的分离和鉴定
2022-03-30吴晓玉廖家富吴生文胡余粮林钰宽孙辉凡丁忠涛
游 勇,吴晓玉,廖家富,吴生文,廖 昶,王 飞,胡余粮,林钰宽,孙辉凡,丁忠涛
(1.江西省农业微生物资源开发与利用工程实验室,江西 南昌 330045;2.江西农业大学生物科学与工程学院,江西 南昌 330045;3.四特酒有限责任公司,江西 樟树 331200)
我国白酒生产采用传统的固态发酵生产方式,用曲酿酒是我国白酒生产的特色。微生物制曲技术被誉为中国“第五大发明”。酿酒先辈们从实践中总结出了“曲乃酒之骨”“有好酒必有好曲”“曲定酒型”等精辟论断。大曲不仅是白酒固态发酵生产所必需的接种剂和糖化发酵剂,同时大曲生产过程中产生的大量微生物代谢产物和香味物质也直接或间接地形成白酒的风味成分,对白酒的香型和风格有决定作用。
在不同香型的白酒大曲中,微生物菌群结构具有明显的差异性。在高温白酒大曲中占优势地位的微生物菌群为耐热和嗜热微生物,比如芽孢杆菌和耐热的霉菌。目前已经从多种香型的白酒大曲中筛选分离到芽孢杆菌功能菌株。向慧平等从发酵阶段和储存阶段的浓香型大曲样品中均分离到了地衣芽孢杆菌。刘桂君等从清香型白酒大曲和酒醅中分离鉴定出12 株地衣芽孢杆菌。黄晓宁等从清香型大曲中优选出地衣芽孢杆菌B.L-1 和枯草芽孢杆菌B.S-1,并将其强化接种应用于白酒酿造过程,发酵结束的酒醅中四甲基吡嗪等代谢物的含量显著升高。在酱香型高温大曲中芽孢杆菌更是大量存在。朱德文等从酱香型高温大曲中分离到1 株产焦香、酱香可用于高温型大曲酒增香提质的解淀粉芽孢杆菌MT6。从茅台大曲核心层分离到的枯草芽孢杆菌、地衣芽孢杆菌和解淀粉芽孢杆菌能够产生众多茅台酒的特征香味化合物。
特香型白酒是中国白酒的十二大香型之一,形成了“浓头酱尾清中间,三香俱备犹不靠”的典型风格。特香型白酒的风味物质与酿造用的大曲密切相关。特香型大曲属于中偏高温曲,其制曲原料独特,由面粉、小麦麸和酒糟加水搅拌压制而成,在曲房中自然固态发酵的顶温在55 ℃左右。在特香型大曲制曲过程中掺入新鲜出窖酒糟,人为接种了酿造特香型白酒的特有微生物,调节曲坯的初始pH 值,使有益菌在固态发酵初期即处于竞争优势地位,具有明显的特色。虽然之前从特香型大曲中分离到一些微生物菌株,但目前还没有鉴定出代谢产生特香型大曲曲香和特香型白酒风味物质的菌种,影响特香型白酒品质的关键微生物还未确定。
本试验从特香型大曲火圈层中分离筛选出1株具有水解淀粉活性的耐高温细菌菌株,结合菌株形态学、生理生化特性鉴定和基因序列同源性分析对其进行了菌种鉴定,检测了其固态发酵产生的挥发性风味化合物,并测定了其液态发酵的淀粉酶活力。本研究为进一步研制强化大曲提供了菌种资源,同时为揭示功能细菌影响特香型大曲品质的机理提供了一定的科学依据。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 材料
特香型大曲曲块取自四特酒有限责任公司大曲生产曲房。
1.1.2 仪器设备
灭菌锅、超净工作台、中药粉碎机、涡旋混匀仪、恒温摇床、恒温培养箱、光学显微镜、酶标仪、扫描电子显微镜、电热恒温水浴锅、冷冻高速离心机、PCR 仪、凝胶成像仪、Agilent 7890A 气相色谱仪配备5975C质谱仪。
1.1.3 试剂和培养基
细菌基因组DNA 提取试剂盒、琼脂糖凝胶DNA 回收试剂盒和普通生化试剂购自北京索莱宝科技有限公司。PCR 扩增所用引物由湖南擎科生物公司合成。实验所用试剂均为分析纯。
筛选培养基(g/L):可溶性淀粉2.0,牛肉膏3.0,蛋白胨10.0,NaCl 5.0,琼脂20.0,pH 7.0~7.2。
LB 培养基(g/L):酵母粉5.0,蛋白胨10.0,NaCl 10.0,pH7.0~7.2,121 ℃灭菌20 min。
产酶培养基(g/L):可溶性淀粉5.0,蛋白胨10.0,酵母粉5.0,NaCl 5.0,葡萄糖1.0,KHPO2.0,MgSO·7HO 0.5,CaCl0.2,pH 7.0。
1.2 实验方法
1.2.1 耐高温细菌菌株的分离
选择四特酒大曲生产曲房的优质出房曲,用中药粉碎机将曲块的火圈层粉碎,称取2.0 g粉碎后的大曲于250 mL 锥形瓶中,加入50 mL 灭菌生理盐水,封口后将样品置于37 ℃恒温摇床中振荡30 min即得大曲悬液。将大曲悬液置于水浴锅中,55 ℃水浴处理2 d。取1 mL 处理后的大曲悬液,用无菌生理盐水将大曲悬液进行梯度稀释。将10到10稀释度的大曲悬液各吸取100 μL 到LB 固体平板上涂布均匀,每个稀释度做3 个平行,待悬液充分吸收后倒置于50 ℃恒温培养箱中培养2~3 d。
1.2.2 耐高温解淀粉细菌菌株的筛选
将LB 平板上的耐高温细菌单菌落点接种于筛选培养基上,37 ℃培养48 h 后将平板用卢戈氏碘液染色,选取菌落周围有透明圈产生的单菌落作为解淀粉细菌初筛菌株。复筛时随机选取每个初筛菌株的3 个单菌落分别测量透明圈直径(H)和菌落直径(C),根据两者比值的平均值大小初步确定初筛菌株淀粉水解酶活性的高低,挑取淀粉水解活性最大的单菌落进行纯种分离、斜面培养并编号保藏。
1.2.3 菌种鉴定
1.2.3.1 形态学观察
将分离到的具有淀粉水解活性的耐高温细菌菌株进行平板划线,倒置于37 ℃恒温培养箱中培养24 h,观察并记录菌落的形态特征,取单菌落培养物进行革兰氏染色后用光学显微镜观察。
扫描电子显微镜制片及观察:挑取培养平板上的细菌单菌落均匀涂于滴有蒸馏水的盖玻片上并在酒精灯火焰上方烘干,然后把盖玻片置于2.5 %的戊二醛磷酸缓冲液(pH7.0)中4 ℃固定过夜,取出盖玻片用0.15 %的戊二醛磷酸缓冲液(pH7.0)冲洗残余的戊二醛,再依次用30%、50%、60%、70%、80%、90%和100%的无水乙醇进行梯度脱水。然后用乙醇-叔丁醇溶液(V/V=1∶1)和100 %叔丁醇置换乙醇,将盖玻片进行干燥处理。盖玻片经离子溅射仪喷镀后在扫描电子显微镜下观察细胞形态。
1.2.3.2 生理生化实验鉴定
按《伯杰细菌鉴定手册》和《常见细菌系统鉴定手册》对获得的菌株进行生理生化实验,具体实验方法参照微生物学实验手册。
1.2.3.3 细菌总DNA提取和基因扩增
细菌总DNA 的提取:将保藏的菌株平板划线活化后挑取单菌落于LB 液体培养基中37 ℃摇床振荡培养,离心收集菌体。菌体基因组DNA 用Solarbio Bacteria DNA Kit 提取,具体操作步骤按照试剂盒说明书进行。PCR 扩增采用扩增芽孢杆菌基因的通用引物UP-1:5'-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3'和UP-2r:5'-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3'。PCR 扩增程序为:94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃复性1.5 min,反应30 个循环;72 ℃延伸5 min。
1.2.3.4 gyrB基因序列分析及系统发育树构建
用琼脂糖凝胶电泳检测PCR扩增的结果,将目的条带用Solarbio DNA Extraction Kit 回收,操作步骤按照试剂盒说明书进行。PCR 目的条带的回收产物送擎科生物公司测序。测序结果经序列拼接后用NCBI 在线工具Blast在Gene Bank 内与已公布其他细菌基因序列进行比对,采用MEGA5.0软件的Neighbor-Joining 算法构建系统发育树,通过Bootstraps法检测1000次。
1.2.4 发酵上清液淀粉酶活的测定
将菌株单菌落接种到装有50 mL LB 培养基的250 mL锥形瓶中,以37 ℃、180 r/min振荡培养12 h。以2 %(v∶v)的接种量接种到装有50 mL 产淀粉酶培养基的250 mL 锥形瓶中并在37 ℃、180 r/min 条件下培养60 h。取不同培养时间的菌液,4 ℃下以6000 r/min离心10 min,并用0.22 μm滤膜过滤获得发酵上清液,然后以DNS 法对上清液的淀粉酶活力进行测定。在40 ℃、pH5.6的条件下,以每分钟水解底物可溶性淀粉生成1 μmol 还原糖(以葡萄糖计)所需的酶量为一个酶活单位(U)。
1.2.5 菌体生物量的测定
取与上述测定发酵上清液淀粉酶活同批次、相同培养时间的菌液,用酶标仪测定经适当稀释的菌液在600 nm 波长下的吸光度值,以取样时间为横坐标,以OD值为纵坐标绘制菌株的生长曲线。
1.2.6 模拟大曲固态发酵
参照文献模拟大曲制作工艺,采用市售普通小麦和麦粉,用蒸熟小麦粒(麦粒∶麦粉=1∶1,与等量水混合浸泡过夜、蒸熟)作为大曲固态发酵培养基。每150 mL 锥形瓶中装入30 g 麦粒固体培养基,121 ℃灭菌30 min。将保藏的菌株平板划线活化后挑取单菌落接种于液体LB 培养基中,37 ℃、150 r/min 培养18 h,按2%的比例接种于麦粒固体培养基中。按照37 ℃,48 h;45 ℃,48 h;55 ℃,48 h的温度调节程序在培养箱中培养,然后分析模拟大曲的挥发性香气组分。
1.2.7 挥发性风味化合物分析
采用固相萃取-气相色谱/质谱联用法(SPEGC-MS)对固态发酵后模拟大曲的挥发性物质进行鉴定分析。用脂肪酸型萃取针置于三角瓶中发酵麦粒培养基上方0.5 cm处萃取20 min。萃取完毕后将萃取头插入GC 进样口,250 ℃热解吸3 min。气相色谱条件:采用Agilent 7890A/5975C 型气质联用仪,毛细管柱为DB-5(30 m×0.25 mm×0.25 μm),自动不分流进样,流动相为He,流速1 mL/min。进样口和检测器温度为250 ℃;柱温程序为35 ℃保持2 min,以2 ℃/min 的速率升温到85 ℃,然后以8℃/min 升温到250 ℃,保持5 min。质谱条件:采用EI(Electron Impact Ionization)离子源,电子轰击能量70 eV,接口温度250 ℃,离子源温度230 ℃,扫描范围30~450 u。用NIST 11 谱库对色谱峰进行检索定性分析。
2 结果与分析
2.1 耐高温解淀粉细菌菌株ZRF-1的分离
为了从特香型白酒大曲中分离筛选具有水解淀粉活性的耐高温细菌菌株,将55 ℃高温处理2 d的四特酒大曲悬液梯度稀释后在LB 平板上50 ℃恒温培养2~3 d。将获得的耐高温细菌单菌落点接种于筛选培养基上,37 ℃培养48 h 后将平板用卢戈氏碘液染色,选取菌落周围有透明圈产生的菌株作为初筛菌株。
进一步将初筛菌株分别点接种3 个单菌落于淀粉筛选平板上,通过比较淀粉水解透明圈直径和菌落直径的比值,筛选到淀粉水解活性相对最大的一种细菌菌株,编号为ZRF-1。图1 所示为ZRF-1菌株在筛选培养基上的淀粉水解透明圈。

图1 ZRF-1菌株的淀粉水解圈图
2.2 耐高温解淀粉菌株ZRF-1的鉴定
2.2.1 形态学鉴定
将ZRF-1菌株在LB固体培养基平板上进行划线,如图2 所示,37 ℃培养24 h 的ZRF-1 菌株菌落颜色为淡黄色半透明,黏稠呈蜡油状,表面湿润有光泽,边缘光滑,单菌落形状不规则。ZRF-1 菌株的革兰氏染色结果显示菌体细胞被均匀染成紫色,确定ZRF-1 菌株为革兰氏阳性细菌。如图3 所示,从扫描电子显微镜的形态观察结果来看,ZRF-1 菌株的细胞呈长杆状,菌体细胞直径为0.5~0.7 μm,长度为1.5~2.5 μm,确定ZRF-1细菌菌株为杆菌。

图2 ZRF-1菌株的菌落形态图
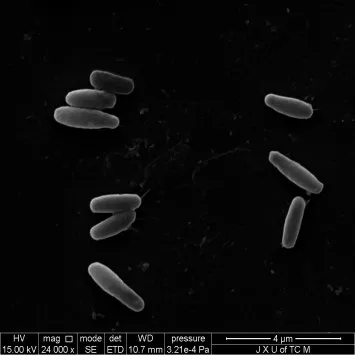
图3 ZRF-1菌株的扫描电镜图
2.2.2 生理生化实验鉴定
如表1 所示,生理生化实验鉴定结果发现ZRF-1 菌株酪蛋白水解和VP 试验结果呈阳性,最高耐盐浓度为10%,对葡萄糖、果糖、蔗糖、麦芽糖和甘露醇等的发酵实验均为阳性。参照《伯杰细菌鉴定手册》和《常见细菌系统鉴定手册》,ZRF-1 菌株的生理生化特性与革兰氏阳性芽孢杆菌属细菌一致,初步确定ZRF-1菌株为芽孢杆菌类细菌。在50 ℃恒温摇床液体培养条件下和50 ℃恒温培养箱中固体培养基平板培养条件下,ZRF-1 菌株均能够正常生长,证明ZRF-1菌株为耐热芽孢杆菌。

表1 ZRF-1菌株的生理生化特征
2.2.3 分子生物学鉴定
细菌中有许多在进化过程中保守的,且基因序列的变异速度比16S rDNA 基因快的功能基因。在大多数细菌中都存在的DNA 促旋酶(gyrase)中B 亚单位基因是这一类基因的典型代表。与可以从属水平上鉴定细菌的16S rDNA 基因相比,基因在近缘种和种以下分类单元的鉴定方面更具优越性。因此本试验选用gyrB 基因鉴定ZRF-1菌株的属种。
以ZRF-1 菌株的基因组DNA 为模板,采用扩增芽孢杆菌gyrB 基因的通用引物UP-1 和UP-2r进行PCR 反应,得到大小约为1.2 kbp 的特异性条带(图4)。测序结果显示ZRF-1 菌株的基因序列为1,188 bp。将此序列用NCBI 在线工具Blast同Gene Bank 数据库中的基因序列进行比对,选择其中的16 株标准菌株的基因参考序列,采用MEGA10.0 软件,用Neighbor-Joining 算法构建系统发育树。如图4 所示,根据系统发育树的结果,ZRF-1 菌株与多株地衣芽孢杆菌()聚集为一支。

图4 ZRF-1菌株gyrB基因扩增电泳图及基于gyrB基因构建的系统发育树
基于基因序列的系统发育分析,结合形态学特征、生理生化实验鉴定结果,可以确定ZRF-1 菌株为地衣芽孢杆菌,命名为ZRF-1。
2.3 菌株ZRF-1的生长曲线与淀粉酶合成规律
由于芽孢杆菌分泌的淀粉酶大多为胞外酶,将ZRF-1 菌株单菌落接种到产淀粉酶液体培养基中,在37 ℃、180 r/min 的摇瓶发酵条件下培养60 h,根据不同培养时间的菌体生物量和发酵上清液的淀粉酶活力绘制ZRF-1 菌株的生长曲线,同时探究ZRF-1菌株摇瓶发酵的淀粉酶合成规律。
由图5 可知,菌株ZRF-1 在摇瓶发酵的1~2 h快速进入对数期,在20 h 菌体浓度达到最大值。ZRF-1 菌株产淀粉酶活力在对数后期14 h 后快速增长,进入稳定期后ZRF-1菌株产淀粉酶活力高且较稳定,说明ZRF-1菌株产淀粉酶活力的大小与菌体的生长基本呈正相关。进入衰亡期52 h 后ZRF-1 菌株产淀粉酶活力仍有一定程度的增长,推测ZRF-1菌株发酵前期分泌的淀粉酶活性仍较高。
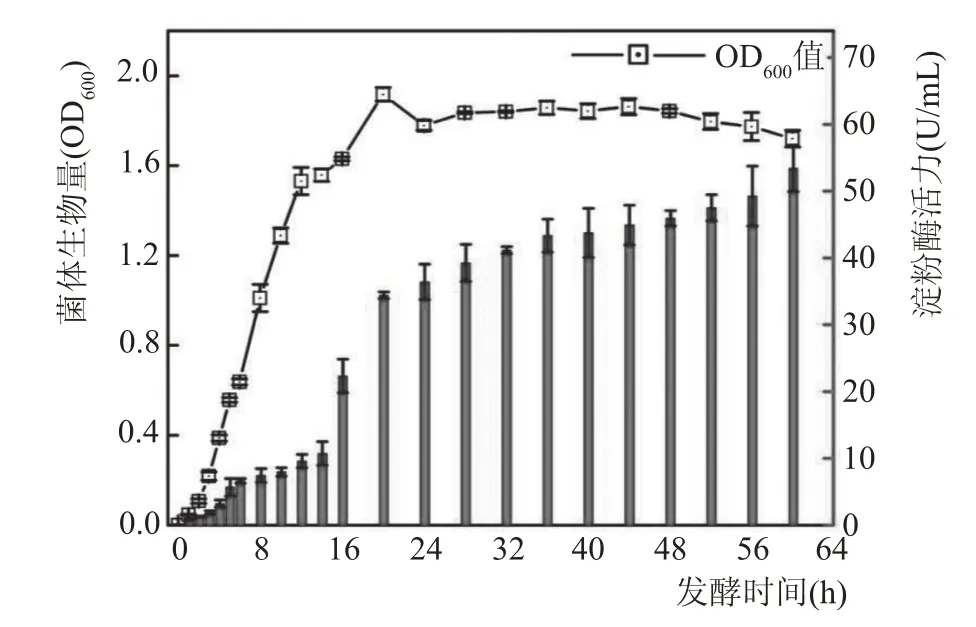
图5 ZRF-1菌株的生长曲线与产酶量
2.4 ZRF-1 菌株固态发酵产挥发性风味化合物活性分析
利用分离自特香型大曲火圈层的ZRF-1 菌株通过37 ℃,48 h;45 ℃,48 h;55 ℃,48 h 的温度调节程序在培养箱中进行了模拟大曲固态发酵的实验,并进一步对固态发酵产物的主要挥发性风味组分进行了测定,结果如图6 和表2 所示。ZRF-1 菌株固态发酵产生3-羟基二丁酮(乙偶姻)、[S-(R*,R*)]-2,3-丁二醇、2,5-二甲基吡嗪、2,3,5-三甲基吡嗪和四甲基吡嗪等挥发性风味化合物。乙偶姻在ZRF-1 菌株固态发酵产生的挥发性物质中的相对含量最高,其次是2,3-丁二醇和四甲基吡嗪等吡嗪类风味化合物。

表2 ZRF-1菌株及空白实验挥发性风味化合物的相对含量

图6 菌株ZRF-1固态发酵产物挥发性风味化合物的GC-MS分析色谱图
3 讨论
耐热和嗜热微生物是中高温白酒大曲中重要的优势功能菌。白酒大曲功能菌株与大曲中各种酶系的产生、大曲曲香的形成以及白酒特征风味物质的形成之间有着紧密的联系。本研究从中高温特香型大曲火圈层中分离筛选到1 株具有水解淀粉活性的耐高温细菌菌株ZRF-1 并结合菌株形态学鉴定、生理生化实验和分子生物学鉴定的方法将该菌株鉴定为地衣芽孢杆菌菌株。
大曲微生物产生的淀粉酶、糖化酶、蛋白酶和酯化酶等酶系在大曲固态发酵过程中降解底物并产生风味化合物或风味前体化合物。在利用产淀粉酶培养基对ZRF-1菌株进行摇瓶发酵过程中,从对数后期到稳定期直到衰亡期前期ZRF-1 菌株产生的淀粉酶活力一直不断增高且较稳定。说明ZRF-1 菌株产淀粉酶活力的大小与菌体的生长基本呈正相关,而且可以推测ZRF-1菌株分泌的淀粉酶稳定性较好,不会随着发酵过程的进行而快速失活。后续实验可以进一步克隆ZRF-1 菌株的淀粉酶基因,进行异源表达和纯化,挖掘潜在的淀粉酶资源。
芽孢杆菌在白酒酿造过程中除了分泌多种水解酶,同时能够产生重要的白酒特征风味物质。大量存在于高温大曲中的芽孢杆菌的代谢产物经高温条件产生的香味物质与酱香味有密切关系。例如从郎酒大曲中分离到的3 株大量产生四甲基吡嗪等吡嗪类及其前体化合物乙偶姻。张荣等从酱香型高温大曲中筛选到3 株地衣芽孢杆菌并在其纯培养发酵液中检测到乙偶姻、四甲基吡嗪和呋喃扭尔。本研究利用ZRF-1 菌株模拟大曲固态发酵过程,通过分析固态发酵产物的挥发性化合物组分发现ZRF-1 菌株固态发酵产生相对含量占85.86%的乙偶姻。乙偶姻是吡嗪环的前驱物,也是四甲基吡嗪最可能的前驱物。目前在酱香型白酒中检测出较高浓度的吡嗪类风味化合物,其中四甲基吡嗪的含量最高。本研究检测到四甲基吡嗪在ZRF-1 菌株固态发酵产生的挥发性化合物中相对含量达到3.45 %,也是远高于2,3,5-三甲基吡嗪和2,5-二甲基吡嗪等其他吡嗪类风味化合物的相对含量。除此之外还检测到相对含量占比达到8.61%的2,3-丁二醇,2,3-丁二醇是酒类中极少数呈香的多元醇之一,产生像黄油和奶油的香气。优质特香型大曲随着固态发酵过程的进行逐渐产生清晰的大曲外皮、火圈层和大曲核心三层结构,其中火圈层明显的特香型大曲具有显著的酱香味,而ZRF-1菌株分离自特香型大曲的火圈层,因此推测ZRF-1菌株参与特香型大曲曲香的形成,进一步可能对特香型白酒风味的形成产生一定的作用。
本研究从特香型大曲火圈层中分离筛选到1株具有水解淀粉活性的耐高温地衣芽孢杆菌菌株,鉴定出其固态发酵产生的挥发性风味化合物,并验证了该菌株液态发酵纯培养的淀粉酶活力。后续实验将继续对地衣芽孢杆菌ZRF-1菌株的耐热、产酶和产香特性做进一步的研究。本研究丰富了中高温大曲中产淀粉酶功能菌的菌种资源,为进一步研制强化大曲将其投入到实际应用中提供了一定的理论基础,同时为揭示功能细菌与特香型大曲曲香的形成以及特香型白酒风味物质形成之间的关系提供了一定的科学依据。
