AgSb2O5.18/Ag/Ag2S 等离子体-Z 型异质结构造及氧化还原性能
2022-03-29刘浩梅郝喜海刘跃军
刘浩梅,郝喜海,刘跃军
(湖南工业大学 包装与材料工程学院,湖南 株洲 412007)
充分利用太阳光能和室内常规光源,在可见光光谱范围内高效催化分解污水中的有机质,是光催化材料研究的重要领域[1-3]。半导体光催化材料是目前应用最广泛的光催化材料,包括氧化物[4]、硫化物[5-7]、氮化物[8]、硼化物[9]等。单一半导体材料容易发生光生电子和空穴复合现象,性能不稳定,对其进行掺杂[10]、负载金属[11]、构造异质结[12]等,是研究者目前实现光生电子-空穴对有效分离的主要手段。Z 型异质结半导体一般是在两种半导体材料之间引入一种导电性能优良的金属(如Au,Ag 等)构造而成的[13]。以TiO2-Au-CdS 为例,Au 纳米粒子首先沉积在TiO2表面,形成TiO2-Au 颗粒,再以Au 颗粒为反应位点分步沉积S2-和Cd2+,形成TiO2-Au-CdSZ 型异质结半导体,它的光催化性能比两个单一半导体均有明显增强[14]。大量新型Ag 基光催化材料被合成,包括单一Ag 化合物等;金属Ag-半导体复合材料等。有研究者将金属Ag 引入Z 型异质结,制备出Ag 基Z 型异质结半导体催化剂,如等。Ag2S 是一种热不稳定型半导体,在高温时Ag2S 易部分转化为金属Ag[5],而金属Ag 颗粒的生成增加了Ag2S 颗粒与Ag 颗粒的接触面,为构建性能优良的Ag 基Z 型异质结提供了良好基础。Sadovnikov 等[23]利用化学沉积法合成了Ag2S/Ag 异质结,并对其性能进行了研究。但关于以Ag2S 为基础构建等离子体-Z 型异质结半导体复合材料的报道较少。
本工作以可溶性AgNO3为Ag 源、以L-半胱氨酸为S 源、以焦锑酸钾(KSbO6H6)为Sb 源,通过水热法一步合成了AgSb2O5.18/Ag/Ag2S 粉末材料,并在250 ℃下进行焙烧,利用Ag2S 易转化为Ag 的性能,构造了AgSb2O5.18/Ag/Ag2S-250Ag 等离子体-Z 型异质结模型,并基于该模型阐述了电子-空穴转移规律以及氧化还原性能规律,为开发更多高性能光催化材料提供了借鉴。
1 实验部分
1.1 主要试剂及原料
L-半胱氨酸、KSbO6H6、AgNO3、尿素、十二烷基磺酸钠:分析纯,国药集团化学试剂有限公司。去离子水由Millipore Milli-Q 型超纯水仪(上海西格玛奥德里奇公司)制备。
1.2 试样的制备
分别将L-半胱氨酸(2.0 mmol)、KSbO6H6(2.0 mmol)和AgNO3(6.0 mmol)依次加入30.0,30.0,20.0 mL 去离子水中,得到溶液A,B,C;将溶液A缓慢引流到溶液B并置于磁力搅拌器中,在80 ℃下搅拌30 min,得溶液D;将溶液C 引流到溶液D 中,恒温80 ℃搅拌30 min,形成反应前体混合物;将该混合物全部倒入100.0 mL 反应釜中,在180 ℃下恒温反应24 h。反应物冷却后,洗涤所得粉末(三次去离子水洗+三次无水乙醇洗),然后在80 ℃下干燥10 h 得到AgSb2O5.18/Ag/Ag2S 产物。称取0.200 0 g 该产物,放入干净的瓷舟,在马弗炉中以2 ℃/min 的升温速率升温到250 ℃,焙烧3 h 得到试样AgSb2O5.18/Ag/Ag2S-250。
将8.0 mmol KSbO6H6加入70.0 mL 去离子水中,在80 ℃下恒温搅拌0.5 h,得溶液A;将1.0 mmol 的十二烷基磺酸钠加入溶液A 中;将8.0 mmol AgNO3溶解在10.0 mL 去离子水中,室温下搅拌得均匀溶液B;并将溶液B 缓慢加入溶液A中形成大量黑色混合物,再将其倒入100.0 mL 反应釜中,于120 ℃下恒温反应24 h。产物经6 次洗涤(去离子水和无水乙醇各3 次)后,在70 ℃下干燥3 h,得到AgSb2O5.18。
将AgNO3(4.0 mmol)加入80.0 mL 去离子水中,在室温下搅拌均匀,再将3.0 mmol L-半胱氨酸和2.0 mmol 的尿素加入上述溶液中搅拌,超声3 min。将溶液倒入100.0 mL 反应釜中180 ℃下恒温反应24 h,冷却后将沉积物洗涤6 次(去离子水和无水乙醇各3 次),在60 ℃的干燥箱中干燥6 h,得到Ag2S。
1.3 性能测试
采用德国Bruker 公司Bruker D8 Advance 型X射线衍射仪对试样物相进行表征;采用美国FEI 公司FEI Inspect F50 型扫描电子显微镜对试样形貌进行表征;采用日本电子株式会社JEOL JEM2010 型场发射透射电子显微镜对试样组成进行表征;采用美国Thermo Fisher公司ESCALAB 250Xi 型X 射线光电子能谱仪对试样结构进行表征;采用日本岛津公司UV-2600 CH 型紫外-可见漫反射分光光度计对粉体材料的光学性能进行表征;采用德国Bruker 公司Bruker A300 型电子自旋共振(ESR)光谱测定仪对试样进行表征。
2 结果与讨论
2.1 结构、形貌和组成表征结果
图1 为四个粉末试样的XRD 谱图。由图1可知,AgSb2O5.18的特征衍射峰符合标准数据库中JCPDS No.00-052-0263 空间群为Fd-3m(227),属于立方晶型AgSb2O5.18;Ag2S 的特征衍射峰符合标准数据库中JCPDS No.00-009-0422,属于单斜晶系Ag2S;AgSb2O5.18/Ag/Ag2S 和AgSb2O5.18/Ag/Ag2S-250 的特征衍射峰均显示含有单斜晶系Ag2S 和立方晶型AgSb2O5.18。
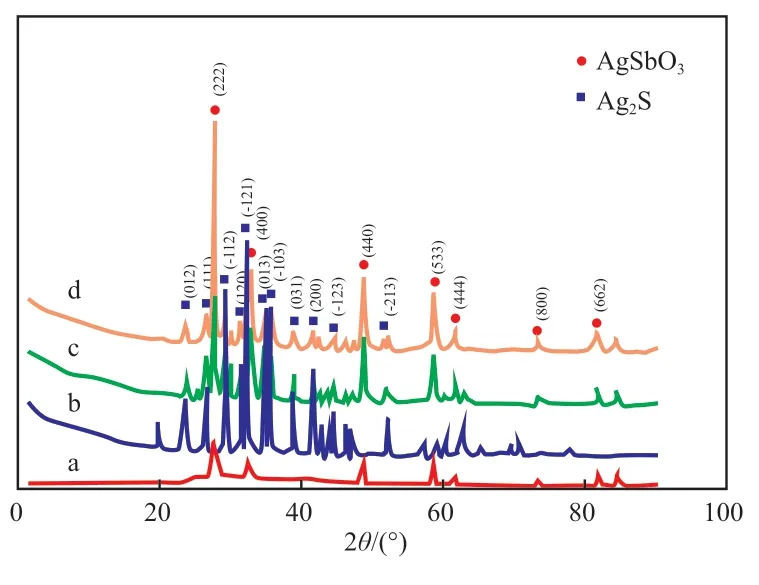
图1 试样的XRD 谱图Fig.1 XRD spectra of the samples.
本课题组[24]在前期研究中探讨了Ag-H2O 水热体系中金属Ag 的形成机理,并根据热力学计算结果作出了Ag-H2O 水热体系中部分化学反应的电势图,得出的反应机理(400 K,pH ≥6.8 时)见式(1)。

即水溶液中Ag+/Ag 电势对中的Ag+可与H+/H2电势对中的H2反应,生成金属Ag,这一研究表明,从水热路线中合成的AgSb2O5.18复合物中一定含有金属Ag。
在标准压力下,Ag 单质能与O2发生潜在反应,热化学反应方程见式(2)。

根据Gibbs-Helmholtz 方程[25](式(3)):



式中,vB为组分B 的化学反应计量系数;298 K)为组分B 在298 K 时的标准摩尔生成Gibbs自由能变,kJ/mol;为组分B 在298 K 时的标准摩尔熵,J/(mol·K)。
综上所述,试样AgSb2O5.18/Ag/Ag2S 在250 ℃焙烧时,反应式(2)不会正向发生,即其中的单质Ag 不会转化成Ag2O。但是,由于金属Ag 的含量很少,故在XRD 谱图中均未发现Ag 的衍射峰,这种现象在其他研究中也有发现[22]。
图2 为试样AgSb2O5.18/Ag/Ag2S 和AgSb2O5.18/Ag/Ag2S-250 的SEM 照片。由图2a 可知,AgSb2O5.18/Ag/Ag2S 颗粒为不规则球形,粒径在50 nm 左右,粒径分布较均匀,团聚较少;由图2b 可知,AgSb2O5.18/Ag/Ag2S-250 颗粒的主要变化为:1)颗粒形貌更不规则,有一些球形颗粒分布在一些更大的颗粒表面;2)颗粒团聚较多;3)颗粒粒径更大,分布不均匀;4)有一些柱状物从基底长出(红色箭头指示),这可能是Ag2S 热稳定性差,在焙烧时生成了金属Ag[5]。
模拟焙烧环境(密闭空间下,加温至250℃),将纯Ag2S 进行了SEM 条件(真空条件下将电子束集中打到硅片上的Ag2S 颗粒表面,温度也在250 ℃左右)下的反应。图3 为不同电子束聚焦时间下Ag2S 颗粒的SEM 照片及EDS 谱图。由图3a 可知,在电子束聚焦时间为5 s 内的SEM 照片中Ag2S 颗粒表面多处出现了小的芽苗状突起;试样中仅有Ag 和S,原子百分比为73.36∶26.64。由图3b 可知,同一试样在电子束照射了30 s 时,颗粒表面有大量柱状体从试样基体中长出;Ag 和S 的原子百分比为75.70∶24.30,要高于照射5 s 的试样。试样中Ag 和S 的原子百分比均大于Ag2S 的化学计量数比2∶1,表示均有单质Ag 存在。这一模拟焙烧实验,既印证了Ag2S 具有热不稳定性的结论,也与图2b 中AgSb2O5.18/Ag/Ag2S-250 复合材料中出现柱状Ag 的现象相吻合。

图2 AgSb2O5.18/Ag/Ag2S(a)和AgSb2O5.18/Ag/Ag2S-250(b)试样的SEM 照片Fig.2 SEM images of the AgSb2O5.18/Ag/Ag2S(a) and AgSb2O5.18/Ag/Ag2S-250(b) samples.

图3 Ag2S 颗粒的SEM 照片(a)及EDS 谱图(b)Fig.3 SEM images(a) and EDS spectra(b) of Ag2S particles.Voltage 15.00 kV.
图4 为试样AgSb2O5.18/Ag/Ag2S-250 的HRTEM 照片和元素能谱图。

图4 试样AgSb2O5.18/Ag/Ag2S-250 的HRTEM 照片(a)和元素能谱图(b~f)Fig.4 HRTEM image(a) and elemental energy spectra(b-f) of the AgSb2O5.18/Ag/Ag2S-250 sample.
由图4a 可知,复合颗粒中紧密堆积或掺杂了AgSb2O5.18晶体(晶面间距0.6 nm,与Sb2O5.18(111)晶面吻合,也与前面的XRD 表征结果吻合)、金属Ag(晶面间距0.23 nm,与Ag(111)晶面吻合)、Ag2S 晶体(晶面间距0.221 nm,与Ag2S(031)晶面吻合)、AgSbO3晶体(晶面间距0.3 nm,与AgSbO3(222)晶面吻合)。由图4b~4f 可知,Sb 和O 分布高度一致,分布区域密度大;Ag 分布最广,一些突出部位的小颗粒仅有Ag 元素,没有其他元素,表明是金属Ag;S 分布密度较弱,分布范围小于Sb 和O,更小于Ag。上述表征结果进一步证明了复合颗粒中有Ag 颗粒存在,且Ag 颗粒与AgSb2O5.18颗粒和Ag2S 颗粒呈紧密聚集状态。
图5 为试样AgSb2O5.18/Ag/Ag2S-250 的XPS谱图。由图5 可知,Ag 3d谱图包含了Ag 3d3/2和Ag 3d5/2两个主峰,在367.9,373.9 eV 处的峰对应Ag+,而在 367.4,373.5 eV 处的峰对应Ag0,表明试样中包含了Ag0和Ag+两种化学态,所制备的试样中存在单质Ag[26],这与前面SEM 和HRTEM表征结果一致;S 2p谱图包含了S 2p3/2和S 2p1/2两个主峰,S 元素仅有S2-这一化学态,表明试样中Ag+和S2-结合形成了Ag2S,这一结果与XRD表征结果一致;Sb 4d谱图包含了Sb 4d3/2和Sb 4d5/2两个主峰,拟合结果显示,Sb 在试样中仅存在一种化学态;O 1s谱图在529.9 eV 处仅有一个峰,归属于AgSb2O5.18的晶格氧[27]。因此,可以说明AgSb2O5.18,Ag 和Ag2S 成功复合。

图5 AgSb2O5.18/Ag/Ag2S-250 试样的XPS 谱图Fig.5 XPS spectra of the AgSb2O5.18/Ag/Ag2S-250 sample.
2.2 光学性能
图6 为试样的UV-Vis 谱图及能量带隙(Eg)曲线。由图6A可知,AgSb2O5.18的吸收带边为460 nm,位于可见光区;而Ag2S 及其复合物AgSb2O5.18/Ag/Ag2S,AgSb2O5.18/Ag/Ag2S-250的吸收带边分别为272,260,245 nm,已迁移到了紫外光区。由图6B 可知,AgSb2O5.18和Ag2S 的Eg应该为表观Eg,按式(7)[28]计算,结果分别为2.60 eV 和4.95 eV。

图6 试样的UV-Vis 谱图(A)及Eg 曲线(B)Fig.6 UV-Vis spectra and energy band gap(Eg) curves of the samples.

式中,α为吸收系数;A为常数。
2.3 ESR 表征结果
半导体中的光生电子和空穴能分别与有机废水中的O2分子和H2O 分子反应生成自由基和OH·,和OH·是将有机废水中的高分子物质分解为短链小分子的关键自由基,因此,衡量半导体光催化能力的标准是生成和OH·数量的多少。一般而言,生成越多,半导体的还原性越强;生成OH·越多,半导体的氧化性越强[29]。
为了探索试样AgSb2O5.18/Ag/Ag2S-250 在可见光条件下的氧化还原能力,采用5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)为捕捉剂进行ESR 表征,验证可见光照射下和OH·自由基的生成。图7 为不同试样的和DMPO-OH·的ESR谱图。由图7A 可知,AgSb2O5.18试样没有峰信号,显示AgSb2O5.18试样的还原能力不足以产生;Ag2S,AgSb2O5.18/Ag/Ag2S,AgSb2O5.18/Ag/Ag2S-250 试样在磁场强度为3 485,3 493,3 500,3 508,3 513,3 522 G 处均出现强峰,各试样的峰强度顺序由大到小为AgSb2O5.18/Ag/Ag2S-250>AgSb2O5.18/Ag/Ag2S>Ag2S,表明AgSb2O5.18/Ag/Ag2S-250 的还原能力最强。由图7B 可知,Ag2S 试样只有微弱的峰信号,表明氧化能力很弱;试样AgSb2O5.18,AgSb2O5.18/Ag/Ag2S,AgSb2O5.18/Ag/Ag2S-250 在3 482,3 498,3 513,3 527 G 处均有峰信号,各试样的DMPO-OH·峰强度顺序由小到大为AgSb2O5.18<AgSb2O5.18/Ag/Ag2S< AgSb2O5.18/Ag/Ag2S-250,表明试样AgSb2O5.18/Ag/Ag2S-250的氧化能力最强。

图7 不同试样的DMPO-·(A)和DMPO-OH·(B)的ESR 谱图Fig.7 ESR spectra of DMPO-·(A) and DMPO-OH·(B) for different samples.
2.4 AgSb2O5.18/Ag/Ag2S 等离子体-Z 型异质结模型
结合前人的研究[30],本工作提出了AgSb2O5.18/Ag/Ag2S 及其焙烧产物AgSb2O5.18/Ag/Ag2S-250 的等离子-Z 型异质结模型,并在此基础上对光催化过程中的电子-空穴转移机制进行了研究。图8 为AgSb2O5.18/Ag/Ag2S 等离子体-Z 型异质结光催化剂的电子-空穴分离示意图。由图8 可知,AgSb2O5.18半导体、Ag2S 与夹在两者之间的金属Ag 颗粒构成等离子体-Z 型异质结复合材料。在光的照射下,由于AgSb2O5.18的Eg=2.60 eV,可以吸收光子产生电子和空穴,形成光生电子-空穴对;而Ag2S 的Eg=4.95 eV,不能吸收光子产生光生电子和空穴;夹在两者之间的金属Ag 颗粒,由于具备表面等离子效应,能产生等离子激发电子和空穴。Ag 颗粒的等离子激发电子可以传导到Ag2S 的导带(CB)上,与有机废水中的O2分子生成·;汇聚在AgSb2O5.18中价带(VB)上的空穴,能与H2O 形成OH·。由于金属Ag 具有优良的电子传导性,且内部有电场存在,AgSb2O5.18中CB 上的电子可以快速传导到Ag,与Ag 的等离子体激发空穴复合,从而使得AgSb2O5.18中的光生电子和空穴难以复合,因此,AgSb2O5.18/Ag/Ag2S 具有较强的和DMPO-OH·信号峰。试样AgSb2O5.18/Ag/Ag2S-250 由于从Ag2S基体中长出更多的金属Ag,能形成更多的Z 型异质结复合体,或增加更多的反应位点,形成Ag 增强型(AgSb2O5.18/Ag/Ag2S-250)等离子体-Z 型异质结,表现在ESR 表征中就是试样AgSb2O5.18/Ag/Ag2S-250 比AgSb2O5.18/Ag/Ag2S 有更强的DMPO-和DMPO-OH·信号峰。

图8 AgSb2O5.18/Ag/Ag2S 等离子体-Z 型异质结光催化剂的电子-空穴分离示意图Fig.8 Schematic diagram of electron-hole separation of AgSb2O5.18/Ag/Ag2S plasma-Z-type heterojunction photocatalyst.
3 结论
1)采用水热法一步制备了AgSb2O5.18/Ag/Ag2S粉末材料,颗粒为不规则球形,粒径在50 nm 左右,粒径分布较均匀;在250 ℃下对该粉末进行焙烧处理,得到了AgSb2O5.18/Ag/Ag2S-250 粉末材料,焙烧工艺会使新的柱状Ag 颗粒从Ag2S 基体长出。
2)AgSb2O5.18的吸收带边为460 nm,位于可见光区;而Ag2S 及其复合物AgSb2O5.18/Ag/Ag2S,AgSb2O5.18/Ag/Ag2S-250 的吸收带边分别为272,260,245 nm,已迁移到了紫外光区。AgSb2O5.18和Ag2S 的Eg应该为表观Eg,分别为2.60 eV 和4.95 eV。
4)提出了AgSb2O5.18/Ag/Ag2S 等离子体-Z 型异质结模型,并基于模型解释了AgSb2O5.18/Ag/Ag2S 的电子-空穴转移规律,合理地解释了ESR表征结果。
