丘脑底核在机体运动功能调控中的作用机制及研究进展*
2022-03-28邢亚康王恺迪黎晓
邢亚康, 王恺迪, 黎晓
丘脑底核在机体运动功能调控中的作用机制及研究进展*
邢亚康, 王恺迪, 黎晓△
(赣南医学院,江西 赣州 341000)
丘脑底核;运动障碍;帕金森病;多巴胺;β振荡
丘脑底核(subthalamic nucleus, STN)又称Luys体,由法国神经科学家朱尔斯于1865年发现,位于丘脑下部或黑质背侧和内囊内侧,属于基底神经节(basal ganglia, BG)核团的重要组成部分[1]。大量文献表明,STN在大脑运动皮层-BG-丘脑-皮层神经回路中是不可或缺的结构。因此,无论就解剖位置还是功能角度而言,它都是BG系统发挥调控运动功能的关键点,也是临床治疗运动障碍性疾病的重要干预区域。随着老龄化社会的迈入,以帕金森病(Parkinson disease, PD)为代表的神经退行性疾病发生率正呈逐年上升趋势。因此,作为这类疾病的主要症状之一,探明运动功能障碍的发生发展机制已经成为当前需要迫切解决的难题。本文针对其在运动调控功能中的作用,从参与其中的神经递质、信号传导通路及神经元电活动改变等角度进行综述,为进一步研究STN调控运动功能的机制及潜在的干预靶点提供线索。
1 概述
1.1STN的位置及结构STN位于丘脑底部,在脑冠状面上呈双凸透镜形结构,位于间脑尾部的白质内部,两边基本对称,大体呈“八”字排列。从矢状面看,STN上方为丘脑,下方为黑质(substantia nigra, SN),紧贴乳头体(mammillary body)背外侧,前有动眼神经通过。从轴面看,外侧为苍白球(globus pallidus, GP),内侧上方为SN,内侧下方为红核(red nucleus, RN),内囊覆盖在STN上部且将苍白球内侧部(globus pallidus internus, GPi)与STN分隔开。从冠状面看,腹内侧为RN,腹外侧为SN,上方为背侧丘脑。内囊是由沿神经轴走行的纤维组成,所以在STN周围有密集的内囊纤维束。STN由三角形、梭形、锥形的多级细胞密集排列形成,且这些细胞都有类似突触一样的分支状的突起。正因为有丰富的神经纤维束围绕四周,且内部神经细胞活性较高,所以STN在神经信号的传输过程中起关键作用。
1.2STN的基本生理功能BG是脑深部的一组核团,与学习、运动和认知有关,其信息的输入主要靠纹状体接收来自大脑皮层或边缘区的谷氨酸(glutamate, Glu)能神经的投射,通过苍白球和黑质网状部(substantia nigra pars reticulata, SNr)的内侧段到达其它脑区来完成信息的输出,因此构成了皮层-BG-丘脑回路[2]。作为BG系统的组成部分,STN在此环路中对信息的“输入”和“输出”功能均起调节器作用[3-4]。当STN的生理功能发生改变时,该回路的信息输出将受阻,致使BG输出的信息异常,从而无法对其他脑区进行控制,进而引发运动、认知等功能的紊乱。通常,按照功能的不同将STN分成3个亚区:运动区(背外侧)、边缘区(内侧)和认知区(腹内侧),每个区对应的生理功能不同,因而发挥的作用也不同。目前的研究多聚焦于STN对运动、情感和认知等神经生理功能的调控作用[5],认知、运动等高级进程受皮层-BG-丘脑环路所精细调控,因而与STN密切相关。
2 STN对机体运动功能的调控及机制
2.1STN的纤维联系及相关神经递质作为皮层-BG-丘脑通路中的关键节点,STN还可与皮层直接发生联系,对信息输出过程起调控作用[6]。这些神经元之间的信息传递,则主要依赖于神经递质。在BG中,从大脑皮层投射到苍白球外侧部(globus pallidus externa, GPe)/GPi/SNr的神经递质主要为γ-氨基丁酸(gamma-aminobutyric acid, GABA);STN则主要接受来自大脑皮层的Glu能纤维、来自GPe的GABA能神经纤维及来自黑质致密部(substantial nigra pars compacta, SNpc)的多巴胺(dopamine, DA)能神经纤维(图1),这些神经纤维的投射加强了对STN生理活动的调控。此外,在啮齿动物的STN中还含有大量5-羟色胺(5-hydroxytryptamine, 5-HT)能纤维,注射5-HT1A受体能够抑制STN神经元异常放电,从而改善大鼠的运动能力;相反,注射5-HT2C和5-HT4受体则促进神经元的异常放电,因而大鼠表现为运动减弱。这些证据表明,5-HT与其不同的受体亚型结合可以通过改变STN的放电模式影响运动功能[7]。另一项研究显示,STN神经活动还受DA能神经支配控制,DA的非选择性受体激动剂D1和D2受体在正常大鼠中可减少STN的放电频率[8];在6-羟基多巴胺构建的PD小鼠模型中,选择性的D1受体激动剂可降低STN神经元的放电频率,选择性的D2样受体激动剂则会增加STN神经元的放电频率。这表明DA受体激动剂的选择可能是治疗PD运动功能障碍的一个重要靶点,使用DA受体激动剂改变STN神经元的放电频率,或许可在临床上作为诊断与治疗PD等运动功能障碍的手段。由此也可以明确,STN调节运动功能主要依赖于对神经环路中各种神经递质的调节,充分理解STN的神经元电生理活动及皮层-BG-丘脑神经环路中释放的神经递质水平是进一步认识STN正常生理功能的重要方面。

Figure 1.The fibers connection of subthalamic nucleus (STN) with surrounding nucleus and motor center. Motor center: an area primarily located in the anterior central gyrus to control the body's movement function. Glu: glutamate; DA: dopamine; SN: substantia nigra; GPe: globus pallidus externa; GPi: globus pallidus internus; GABA: gamma-aminobutyric acid.
2.2STN对运动功能的控制路径如前所述,运动控制受复杂的神经回路和神经纤维所调节。由皮层发出信息指令到达BG后,经BG内的结构进行编码和反馈,再产生机体的运动指令经环路到达运动皮层。其中,STN是BG调控运动通路中的关键结构[9],来自皮层的兴奋传递到BG后,再投射到GPi/SNr[10]神经环路,整个调控过程都离不开STN的中转作用。
目前认为,BG对信息的编码处理是通过“直接”通路和“间接”通路[11-12]完成的。其中“直接”通路是指初级运动皮层-纹状体-GPi/SNr-丘脑-皮层通路(图2A),“间接”通路是指初级运动皮层-纹状体-GPe-STN运动区-GPi/SNr-丘脑-皮层通路[13](图2B)。“直接”通路和“间接”通路都通过环路中的GPi/SNr,所以当运动指令从皮层传到该部分时,可通过这两种通路方式传播到下一脑区,执行不同运动功能的调节。“直接”通路激活可抑制GPi/SNr的活性来降低投射到丘脑-皮层通路的抑制效应,从而起到促进运动的作用;而“间接”通路激活后从皮层发出的信号要经过苍白球外侧部和STN,STN神经元兴奋后,该兴奋性继续传递到GPi/SNr,继而增强对丘脑-皮层通路的抑制,因而对运动功能起抑制作用。所以现在普遍认为,“直接”通路可以增强运动,但“间接”通路则抑制运动。此外,近年来随着研究的深入,有学者发现基底核还可对信息输出直接进行调控,即“超直接”通路,其直接由皮层-STN-GPi/SNr-丘脑-皮层的“超直接”通路对输出信息进行调控[14](图2C)。有研究发现[15],刺激PD患者额下回(inferior frontal gyrus, IFG)-STN环路中置入的电极,脑电图显示一种快速诱发的电位,该电位可介导运动活动的快速中止。这验证了“超直接”通路的快速时效性。
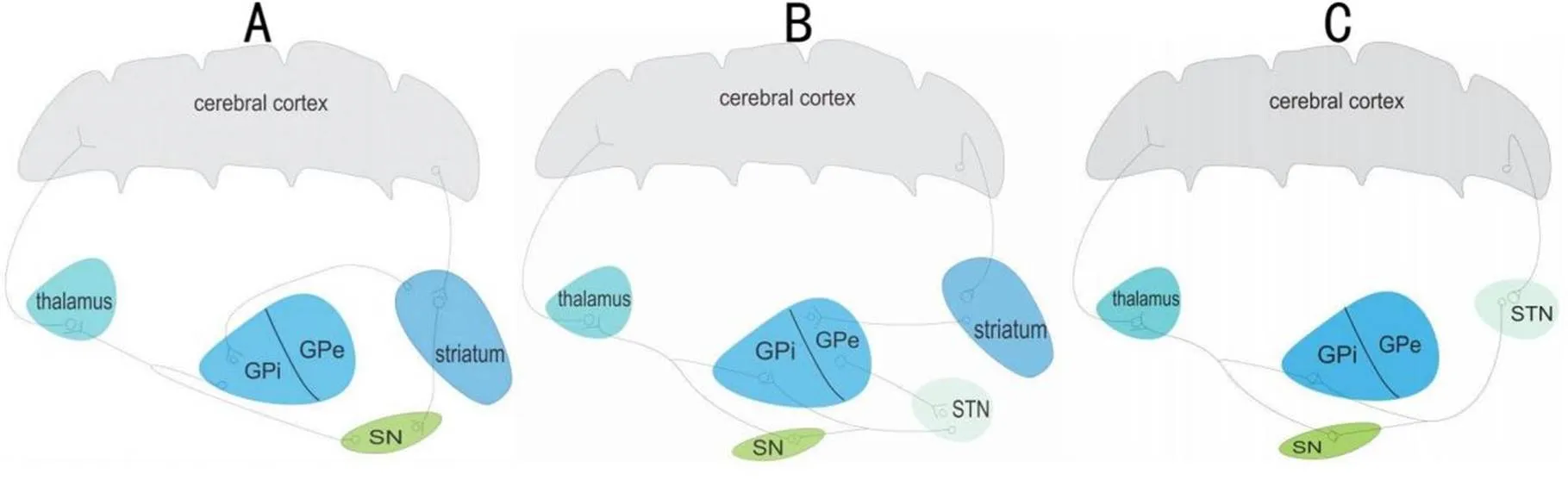
Figure 2.Three types of neural circuits for controlling movement. A: direct pathway, the motor command from cerebral cortex is transmitted to the striatum, the striatum transfers it to GPi/SN, and finally the signal is back to the cerebral cortex through the thalamus; B: indirect pathway, like direct pathway, striatum transfers the motor command to GPe, GPe transmits it to STN, STN conducts the signal to GPi/SN, and finally the signal is back to the cerebral cortex through the thalamus; C: hyperdirect pathway, the motor signal directly from the cerebral cortex is transmitted to STN, STN transfers it to GPi/SN, and finally the signal is back to the cerebral cortex through the thalamus.
目前认为,以上3种通路共同参与了BG信息输出的调控,由于运动信息在3条通路上所参与的神经递质不同,信息到达GPi/SNr后可引发这2个核团的神经元电活动出现一个“增强-抑制-增强”的动态变化过程[16]。这种变化也引起了大脑运动皮层出现一种相对应的引起动作改变的动态变化,即“抑制-增强-抑制”:“抑制”阶段表现为在“超直接”通路中,运动信息到BG后,STN被激活,且STN与GPi/SNr之间有广泛的纤维投射,可引起大范围的神经元电活动受到抑制而表现为运动抑制,通过这一过程可以抑制不必要的动作产生;“增强”阶段则表现在“直接”通路中,纹状体与GPi/SNr之间纤维投射少,经丘脑到皮层后,仅激活需要产生运动的部位,引起该部位神经元活跃因而产生运动;第2个“抑制”阶段则表现为“间接”通路,运动信息到达BG后,STN再度被激活,抑制环路中下游核团的神经元电活动,运动减弱。简言之,超直接通路和间接通路对运动产生抑制,而直接通路对运动促进增强,且都经STN,所以STN被认为是运动产生与中止的关键节点[17]。
值得注意的是,直接通路、间接通路和超直接通路这3条通路对神经活动的平衡调节可以直接决定运动的准确性和协调性。由于神经递质可直接跨血脑屏障,在维持传递通路中神经信息的完整性和促进神经支配的正常机体活动等具有重要作用[18-19],通过调控神经递质受体与配体相结合的方式,以达到控制运动的通路之间的一种平衡状态,可能是未来研究的方向之一。
3 运动功能障碍时STN的损伤机制研究进展
3.1STN的神经电活动异常神经系统对内外环境的信息进行编码和传输是通过神经元电活动完成的,评价神经元功能活动的重要指标则取决于放电频率和放电模式,目前认为,STN神经元电活动变化在调节皮层-丘脑-苍白球通路的兴奋性方面是关键[14]。病理状态下,STN放电模式的变化可导致该通路中神经元电活动也发生变化,因而引起运动功能的改变[17]。来自中脑腹侧神经元的多巴胺能投射是BG中DA的唯一来源[9],DA作为一种单胺类儿茶酚胺类神经递质,可因动作电位的激发而在突触间隙释放,在释放的周围区域诱导神经元活性增加[20]。例如,PD患者脑中DA缺失时导致BG的输出活动增加从而记录到神经元放电频率和模式的改变[21]。另外,DA释放减少在“间接”通路上,也可影响GPe对STN的抑制,导致STN对皮层传递的兴奋更加敏感,放电频率也明显增加,且放电模式呈现出连续性的非正常爆发式放电,随后引起GPi/SNr的兴奋,使投射的目标皮层区域出现过度抑制,表现为震颤、运动协调能力下降等运动障碍特征[22]。BG作为多巴胺释放的重要部位,可通过不同类型DA受体影响“直接”和“间接”通路对机体运动加以调节。有研究显示,STN中有DA受体[23],而DA受体又可通过其内在基因编码分为D1样受体(D1-like recptor, D1LR)和D2样受体(D2-like recptor, D2LR),2种受体都与记忆、认知和运动功能有关[24]。D1LR在直接通路上的激活可促进信息向皮层传递,而D2LR在间接通路上的激活则减少信息向皮层传递。因此,DA介导的直接通路活性增加和间接通路活性降低,将共同导致GPi/SNr神经元电活性的整体降低,可使BG的输出减少,从而维持人体的正常运动功能。研究表明,注射D1LR和D2LR激动剂可诱发快速发作的运动障碍;若注射D1LR和D2LR拮抗剂则会使运动功能得到改善[25]。D1LR激活可通过促进GABA的释放抑制STN从而降低STN的放电频率,而D2LR激活则使STN的放电出现先爆发后暂停[26]。因此,DA受体在介导运动行为上起关键作用,当神经元电活动异常时,DA传递不足且DA受体功能异常将共同导致STN调控信息的功能缺陷,进一步导致BG的信息输出异常,可能是引起运动功能障碍的主要原因之一。
3.2STN中Glu水平异常Glu是大脑中主要的兴奋神经递质,在大脑皮层、纹状体、苍白球和STN中均有重要生理学作用。其中,STN的活性既接受SNr投射的DA能纤维还接受丘脑投射的Glu能纤维调节,由于STN主要由Glu能神经元组成,这些神经元会将大部分Glu以神经递质形式依次传递到神经环路中的GPe/GPi/SNr;BG从大脑皮层和丘脑接受Glu能的投射也主要是通过STN实现[27]。因此,STN中Glu水平出现异常时也可能引起运动功能障碍。
通常,Glu可激活离子型和代谢型受体,离子型Glu受体主要为-甲基-D-天冬氨酸(-methyl-D-aspartate, NMDA)受体,而代谢型Glu受体可分为Ⅰ组(mGluR1、5)、Ⅱ组(mGluR2、3)和Ⅲ组(mGluR4、6、7、8)[28]。有研究表明,小胶质细胞(microglia, MG)可表达Glu代谢型受体,其中介导Ⅲ组的mGluRs主要表现为神经保护作用,介导Ⅱ组的mGluRs则表现为神经毒性,尤其是mGluR2可诱导TNF-α和Fas配体的释放,触发caspase-3激活(图3),从而导致神经元死亡[29]。MG作为中枢神经系统的主要免疫细胞,除了参与正常的大脑功能外,可在机体局部发生损伤时迅速聚集在损伤部位。例如,在脑缺血时,MG被激活,可释放各种炎性因子如IL-1β和TNF-α[30],继而导致中枢神经系统发生炎症反应。有趣的是,有研究发现在PD患者脑中的SNr部有大量被激活的MG聚集[31],这说明MG介导的神经炎症参与了PD的发病进程。因此,我们推测MG可能通过介导Glu代谢型受体来维持STN的稳态,当表达Ⅱ组mGluRs过多时可能会导致运动障碍的产生。
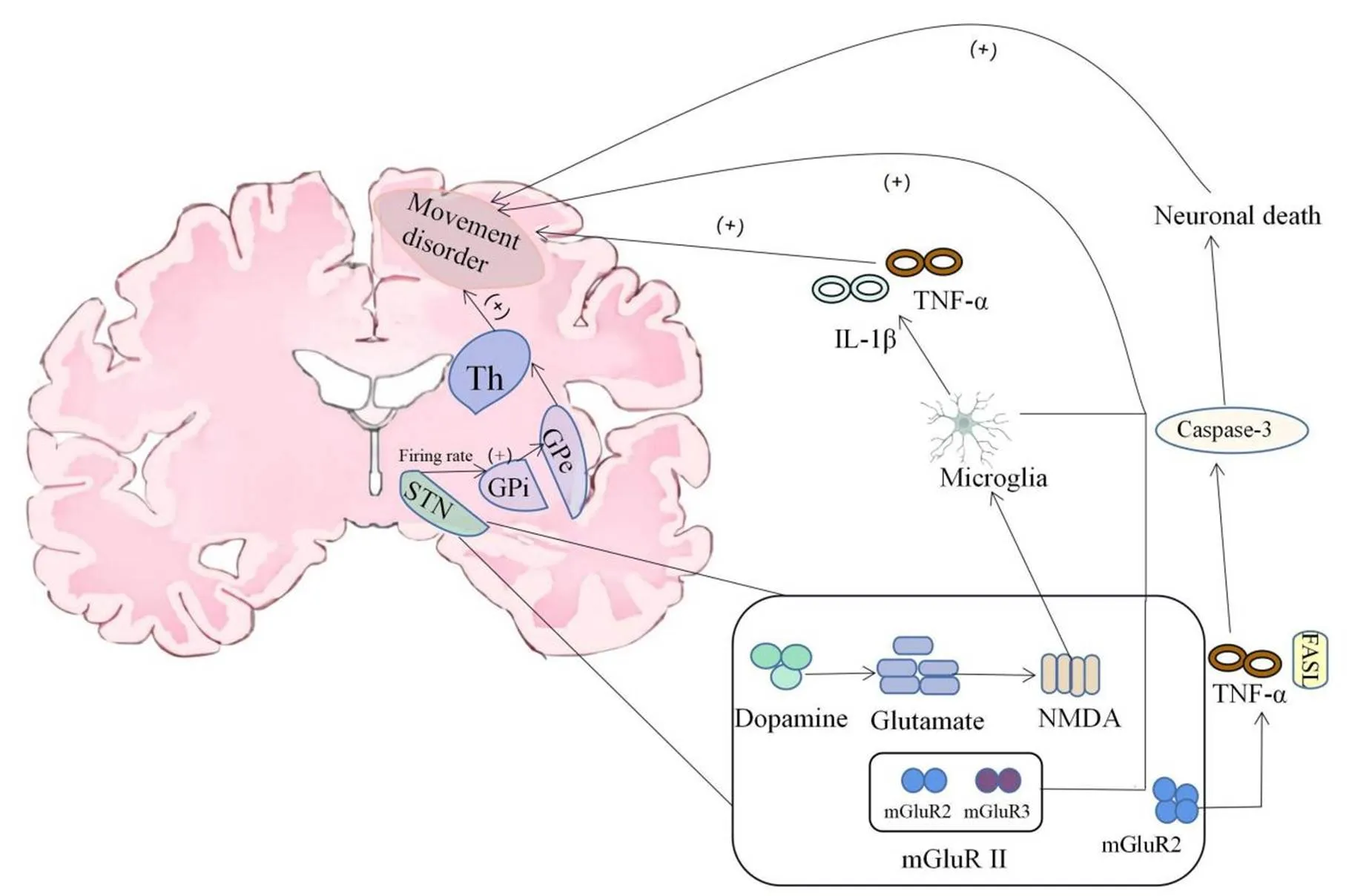
Figure 3.The mechanism of movement disorder caused by abnormal glutamate levels. Th: thalamus; NMDA: N-methyl-D-aspartic acid; mGluR II: metabotropic glutamate receptor II; IL-1β: interleukin-1β; TNF-α: tumour necrosis factor-α; FASL: FAS ligand.
此外,MG也是表达NADPH氧化酶(NADPH oxidase, Nox)的主要细胞,Nox激活后主要产生活性氧,后者将促进以PD为首的神经退行性疾病的进展。Nox由mGluR3激动剂所激活,可被mGluR5拮抗剂抑制[32],提示mGluR的不同亚型对Nox的活性调节可能减轻运动障碍。因此,MG通过调节Glu的表达水平也可以调节相应的运动功能分子机制,并且与mGluR的不同调节方式有关。如前所述,Glu能神经元可以同时表达D1和D2受体,PD患者脑中SNr的DA出现丢失,STN-Glu受D1受体刺激时将会导致Glu水平升高[33],后者可以激活NMDA受体[34]。Acarin等[35]通过将NMDA注射到大鼠的体感皮层,观察到MG的激活现象,继而引发大量促炎因子的释放,从而加快神经系统退行性疾病的发生。另一项研究也显示,STN中的Glu能神经元投射在间接通路,纹状体中DA丢失将会导致间接通路活性增加,STN的连续自发爆发式放电活动也增加,Glu活性也随DA的减少而增加[36];Glu能传递的增加还可导致BG输出部分GPi/SNr的激活,两者分别引起神经功能障碍和STN活性被抑制[37],因此,来自大脑皮层的Glu能投射增加和STN异常放电活动增多,共同使STN中的总Glu水平增加,从而发生运动障碍。Zlata等[38]通过局部注射GluR拮抗剂记录STN中的神经元电活动,发现由皮层-STN-GPi/SNr超直接通路介导的早期兴奋性降低,STN自发放电频率下降,可减少Glu投射,从而减轻运动障碍。
如前所述,STN中Glu水平的变化及其与各种因素的相互作用,间接证明了STN可通过Glu等神经递质发挥对运动功能的调控作用,但是影响STN活性的因素目前并不清楚,对神经递质及其在神经环路上的作用进行进一步阐述或许是新的思路。
3.3STN中β振荡异常夸张由STN的异常调控产生运动障碍的因素不仅仅与神经元放电频率和神经递质有关,还与神经元活动的异常振荡模式有关。在控制正常的行为过程中,β振荡活动在维持感觉、运动、认知状态中发挥着关键作用[39]。STN记录的夸张β活动被认为是运动功能障碍的一种特征性生物标记,且β振荡的幅度与运动症状的严重程度相关[40-41]。β活动从皮层升高,并在GPe-STN交互环内增强,并通过皮层-BG神经网络进行传播[42]。夸张的β活动可能会限制BG系统编码与行为相关的生理信息[43],促使PD患者运动障碍的产生。Peter等[44]的研究表明,MPTP可诱导DA耗竭,出现GABA能轻度升高,驱动GPe的放电频率降低,而在间接通路GPe-STN-GPi这个交互中,GPe的放电降低又可引起STN放电率增加,GPi的相位变化引起STN出现异常β振荡,STN放电率增加及异常振荡模式可改变其内部的信息流,导致异常信息指令释放,并通过BG输出引起运动障碍。在PD中,产生运动障碍的另一个原因是STN和其他BG的结构通过异常的、持续性相位锁定的方式针对β振荡,因而可以限制皮层-BG神经网络编码信息的能力[45]。Baaske等[46]用不同频率的恒定脉冲刺激PD大鼠皮层记录的STN响应,发现:(1)STN对皮层下β振荡的锁相方式呈幅度依赖性;(2)在正常或DA缺乏的大鼠中,STN更容易受到10~25 Hz范围内的刺激,从而产生高频放电,诱导运动障碍。这些结果验证了STN对β锁相导致运动功能障碍的观点,也揭示了在合适的刺激下,β振荡的表型会更加明显,同时STN对β振荡的敏感性也将更高。由此,在临床上对PD患者进行治疗时,可以选择合适的刺激以减少β振荡幅度和STN的高频放电,达到改善患者运动功能的目的。
4 深部脑刺激(deep brain stimulation, DBS)及磁共振成像(magnetic resonance imaging, MRI)技术在STN的应用及进展
当前,各种针对该疾病检测及诊断治疗的方式不断增加,如DBS、MRI等技术。DBS是将电极埋到脑深部的特定核团后,通过外部产生脉冲刺激电极达到治疗目的。高频的脉冲刺激可导致核团毁损,因而可用于改善PD的症状[47]。有研究表明,在STN周围植入电极,发射脉冲刺激可以关闭BG的部分神经元活性,并减少STN连续异常高放电模式来减缓PD的症状[39, 41]。另外,以β的振幅作为反馈的自适应DBS可以缩短β振荡的时间,减轻运动障碍,而传统的DBS则会抑制β的整体振幅[48],但是在准确治疗疾病、尽量减少副作用的这一前提下并不适用于现今,所以自适应DBS比传统DBS更有效、更具说服力[49]。随着神经影像学的发展,具有高分辨率的MRI技术引导下的立体定向系统对靶神经核团的精准定位,成为当前国内外治疗PD的主流技术[50]。
磁共振扩散张量成像(diffusion tensor imaging, DTI)可显示脑白质的纤维走行及脑组织内水分子流动,可通过分数各向异性(fractional anisotropy, FA)定量反映神经组织结构的完整性,被广泛应用于神经退行性疾病(如PD、阿尔茨海默病等)中[51]。DTI结果显示,PD患者双侧STN功能连接强度减弱,且右侧STN与左侧壳核的功能连接也减弱[52]。由于壳核是产生DA的主要部位之一,所以当DA不足时,功能连接减弱而出现运动障碍的表现,说明DTI用于检测STN与毗邻结构的功能连接是有效的。
如前所述,在临床治疗STN功能障碍时,在影像技术的引导下通过立体定向手术准确地将电极放置在STN部位行DBS(尤其是自适应DBS)或辅以DTI技术,可能值得向临床上推崇并具有较好的诊疗效果。
5 小结
本文综述了STN的生理功能、对运动控制的功能,以及在PD等病理条件下STN发生的部分电生理、神经递质和运动环路的改变及其与运动功能障碍之间的联系,并对一些新兴影像学技术的应用前景加以描述。STN作为中脑的一个小核团,因位置深、体积小,常规观察手段难以开展,所以目前对STN结构、生理功能以及与周围核团的联系等的研究工作均处于初级阶段。作为BG信息调控的重要结构,STN的神经元电活动变化在运动、认知、情绪等环节均起重要作用。然而,目前对运动障碍类疾病的药物治疗多为神经系统类药物,这种治疗方式往往仅关注到保护神经元之间信息的传递、促进神经元的存活,而对神经元电活动在时间和空间上的表达并未显示出明显优势,因而寻找能更为特异性地作用于STN区域神经元的多靶点药物是今后研究的重要方向。
[1] Bogousslavsky J, Tatu L. The history of basal ganglia anatomy[J]. Revue Neurologique, 2017, 173(10):605.
[2] Vicente AM, Martins GJ, Costa RM. Cortico-basal ganglia circuits underlying dysfunctional control of motor behaviors in neuropsychiatric disorders[J]. Curr Opin Genet Dev, 2020, 65:151-159.
[3] Xiao C, Ji YW, Luan YW, et al. Differential modulation of subthalamic projection neurons by short-term and long-term electrical stimulation in physiological and parkinsonian conditions[J/OL]. Acta Pharmacol Sin, 2021 (2021-12-08) [2022-01-20]. https://www.nature.com/articles/s41401-021-00811-4. DOI: 10.1038/s41401-021-00811-4.
[4] Mamaligas AA, Ford CP. Revealing a role for NMDA receptors in regulating STN inputs following the loss of dopamine[J]. Neuron, 2017, 95(6):1227-1229.
[5] Julie P, Sascha F, Leonardo C, et al. Structural and functional connectivity of the subthalamic nucleus during vocal emotion decoding[J]. Soc Cogn Affect Neurosci, 2016(2):349-356.
[6] Nakata KG, Yin E, Sutlief E, et al. Chemogenetic modulation reveals distinct roles of the subthalamic nucleus and its afferents in the regulation of locomotor sensitization to amphetamine in rats[J]. Psychopharmacology, 2021, 239(2):353-364.
[7] Shen KZ, Kozell LB, Johnson SW. Multiple conductances are modulated by 5-HT receptor subtypes in rat subthalamic nucleus neurons[J]. Neuroscience, 2007, 148(4):996-1003.
[8] Hassani OK, FégerJ. Effects of intrasubthalamic injection of dopamine receptor agonists on subthalamic neurons in normal and 6-hydroxydopamine-lesioned rats: an electrophysiological and c-Fos study[J]. Neuroscience, 1999, 92(2):533.
[9] Obeso JA, Rodríguez‐Oroz MC, Benitez‐Temino B, et al. Functional organization of the basal ganglia: therapeutic implications for Parkinson's disease[J]. Movement Disorders, 2010, 62(23):63-88.
[10] Barbier M, Risold PY. Understanding the significance of the hypothalamic nature of the subthalamic nucleus[J]. eNeuro, 2021, 8(5):1-19.
[11] Criaud M, Anton JL, Nazarian B, et al. The human basal ganglia mediate the interplay between reactive and proactive control of response through both motor inhibition and sensory modulation[J]. Brain Sciences, 2021, 11(5):560.
[12] Bevan MD. Motor control: a basal ganglia feedback circuit for action suppression[J]. Curr Biol, 2021, 31(4):191-193.
[13] Mitsunori O, Sano H, Sato S, et al. Optogenetic activation of the sensorimotor cortex reveals "local inhibitory and global excitatory" inputs to the basal ganglia[J]. Cereb Cortex, 2017, 27(12):5716-5726.
[14] Bosch C, Mailly P, Degos B, et al. Preservation of the hyperdirect pathway of basal ganglia in a rodent brain slice[J]. Neuroscience, 2012, 215(1):31-41.
[15] Chen W, de Hemptinne C, Miller AM, et al. Prefrontal-subthalamic hyperdirect pathway modulates movement inhibition in humans[J]. Neuron, 2020, 106(4):579-588.
[16] Nambu A, Tokuno H, Hamada I, et al. Excitatory cortical in⁃puts to pallidal neurons via the subthalamic nucleus in the monkey[J]. J Neurophysiol, 2000, 84(1):289-300.
[17] Cavanagh JF, Wiecki TV, Cohen MX, et al. Subthalamic nucleus stimulation reverses mediofrontal influence over decision threshold[J]. Nat Neurosci, 2011, 14(11):1462-1467.
[18] Lončar A, Negrojević L, Dimitrić Marković JM, et al. The reactivity of neurotransmitters and their metabolites towards various nitrogen-centered radicals: Experimental, theoretical, and biotoxicity evaluation[J]. Comput Biol Chem, 2021, 95:107573
[19] Südhof TC. Synaptic neurexin complexes: a molecular code for the logic of neural circuits[J]. Cell, 2017, 171(4):745-769.
[20] Rommelfanger KS, Wichmann T. Extrastriatal dopaminergic circuits of the basal ganglia[J]. Front Neuroanat, 2010, 4:139.
[21] Wang M, Qu Q, He T, et al. Distinct temporal spike and local field potential activities in the thalamic parafascicular nucleus of parkinsonian rats during rest and limb movement[J]. Neuroscience, 2016, 330:57-71.
[22] Karachi C, Grabli D, Baup N, et al. Dysfunction of the subthalamic nucleus induces behavioral and movement disorders in monkeys[J]. Mov Disord, 2010, 24(8):1183-1192.
[23] Jourdain VA, Morin N, Morin N, et al. Subthalamotomy-induced changes in dopamine receptors in parkinsonian monkeys[J]. Exp Neurol, 2014, 261:816-825.
[24] Martel JC, Mcarthur SG. Dopamine receptor subtypes, physiology and pharmacology: new ligands and concepts in schizophrenia[J]. Front Pharmacol, 2020, 11:1003.
[25] Andreoli L, Abbaszadeh M, Cao XY, et al. Distinct patterns of dyskinetic and dystonic features following D1 or D2 receptor stimulation in a mouse model of parkinsonism[J]. Neurobiol Dis, 2021, 157:105429.
[26] Galvan A, Hu X, Rommelfanger KS, et al. Localization and function of dopamine receptors in the subthalamic nucleus of normal and parkinsonian monkeys[J]. J Neurophysiol, 2014, 112(2):467-479.
[27] Parent A, Hazrati LN. Functional anatomy of the basal ganglia. I. The cortico-basal ganglia-thalamo-cortical loop[J]. Brain Res Rev, 1995, 20(1):91-127.
[28] Szpręgiel I, Wrońska D, Kmiecik M, et al. Glutamic acid decarboxylase concentration changes in response to stress and altered availability of glutamic acid in rabbit () brain limbic structures[J]. Animals, 2021, 11(2):455
[29] Taylor DL, Jones F, Kubota ES, et al. Stimulation of microglial metabotropic glutamate receptor mGlu2 triggers tumor necrosis factor alpha-induced neurotoxicity in concert with microglial-derived Fas ligand[J]. J Neurosci, 2005, 25(11):2952-2964.
[30] Yao NN, Chen XY. Research progress on the role of immune proteasome in central nervous system disease[J]. Chin J Geriatr Heart Brain Vessel Dis, 2021, 23(9):1001-1002.
[31] Block ML, Hong JS. Chronic microglial activation and progressive dopaminergic neurotoxicity[J]. Biochem Soc Trans, 2007, 35(5):1127-1132.
[32] Kimberly RB, Loane DJ, Stoica BA, et al. Delayed mGluR5 activation limits neuroinflammation and neurodegeneration after traumatic brain injury[J]. BioMed Central, 2012, 9(1):43.
[33] Morari M, Marti M, Sbrenna S, et al. Reciprocal dopamine-glutamate modulation of release in the basal ganglia[J]. Neurochem Int, 1998, 33(5):383-397.
[34] Arfani Anissa El, Bentea E, Aourz N, et al. NMDA receptor antagonism potentiates the L-DOPA-induced extracellular dopamine release in the subthalamic nucleus of hemi-parkinson rats[J]. Neuropharmacology, 2014, 85:198-205.
[35] Acarin L, González B, Castellano B, et al. Microglial response to-methyl-D-aspartate-mediated excitotoxicity in the immature rat brain[J]. J Comp Neurol, 1996, 367(3):361-374.
[36] Benazzouz A, Mamad O, Abedi P, et al. Involvement of dopamine loss in extrastriatal basal ganglia nuclei in the pathophysiology of Parkinson’s disease[J]. Front Aging Neurosci, 2014, 6:87.
[37] Hitomi A, Choudhury ME, Higaki H, et al. Microglia may compensate for dopaminergic neuron loss in experimental Parkinsonism through selective elimination of glutamatergic synapses from the subthalamic nucleus[J]. Glia, 2017, 65(11):1833-1847.
[38] Polyakova Z, Chiken S, Hatanaka N, et al. Cortical control of subthalamic neuronal activity through the hyperdirect and indirect pathways in monkeys[J]. J Neurosci, 2020, 40(39):7451-7463.
[39] Brittain J-S, Brown p. Oscillations and the basal ganglia: Motor control and beyond[J]. NeuroImage, 2014, 85:637-647.
[40] Deffains M, Iskhakova L, Katabi S, et al. Subthalamic, not striatal, activity correlates with basal ganglia downstream activity in normal and parkinsonian monkeys[J]. Elife, 2016, 5:e16443.
[41] Neumann WJ, Degen K, Schneider GH, et al. Subthalamic synchronized oscillatory activity correlates with motor impairment in patients with Parkinson's disease[J]. Mov Disord, 2016, 31(11):1748-1751.
[42] Atsushi N, Yoshihisa T. Mechanism of parkinsonian neuronal oscillations in the primate basal ganglia: some considerations based on our recent work[J]. Front Syst Neurosci, 2014, 8:74.
[43] Saed K, Gerd T, Ahmar SS, et al. Subthalamic nucleus activity dynamics and limb movement prediction in Parkinson's disease[J]. Brain, 2020, 143(2):582-596.
[44] Peter B, Antonio O, Paolo M, et al. Dopamine dependency of oscillations between subthalamic nucleus and pallidum in Parkinson's disease[J]. J Neurosci, 2001, 21(3):1033-1038.
[45] Sharott A, Gulberti A, Hamel W, et al. Spatio-temporal dynamics of cortical drive to human subthalamic nucleus neurons in Parkinson's disease[J]. Neurobiol Dis, 2018, 112:49-62.
[46] Baaske MK, Kormann E, Holt AB, et al. Parkinson's disease uncovers an underlying sensitivity of subthalamic nucleus neurons to beta-frequency cortical input[J]. Neurobiol Dis, 2020, 146:105119.
[47] Benabid AL, Pollak P, Gervason C, et al. Long-term suppression of tremor by chronic stimulation of the ventral intermediate thalamic nucleus[J]. Lancet, 2019, 337(8738):403-406.
[48] Bocci T, Prenassi M, Arlotti M, et al. Eight-hours conventional versus adaptive deep brain stimulation of the subthalamic nucleus in Parkinson's disease[J]. NPJ Parkinsons Dis, 2021, 7(1):88.
[49] HabetsJeroen GV, Heijmans M, Kuijf ML, et al. An update on adaptive deep brain stimulation in Parkinson's disease[J]. Mov Disord, 2018, 33(12):1834-1843.
[50] Wang XP, Wang XQ, Wu HM. Comprehensive application of precise localization of subthalamic nucleus in deep brain stimulation of Parkinson's disease[J]. Chin J Clin Res, 2018, 31(1):128-130.
[51] Siasios I, Kapsalaki EZ, Fountas KN, et al. The role of diffusion tensor imaging and fractional anisotropy in the evaluation of patients with idiopathic normal pressure hydrocephalus: a literature review[J]. Neurosurgical Focus, 2016, 41(3):E12.
[52] 姜广英. 基于fMRI及DTI的早期帕金森病中丘脑底核的研究[D]. 成都: 电子科技大学, 2013:29-31.
Jiang GY. FMRI and DTI based study of subthalamic nucleus in early Parkinson's disease[D]. Chengdu: University of Electronic Science and Technology of China, 2013:29-31.
The role of subthalamic nucleus in movement
XING Ya-kang, WANG Kai-di, LI Xiao△
(,341000,)
Movement dysfunction is very common in neurodegenerative diseases such as Parkinson disease. As a part of basal ganglia, the subthalamic nucleus plays an critical role in regulating movement. Here we review the structure and function of subthalamic nucleus in movement disorder models.
Subthalamic nucleus; Movement dysfunction; Parkinson disease; Dopamine; β oscillation
R742.01; R363
A
10.3969/j.issn.1000-4718.2022.03.022
1000-4718(2022)03-0559-07
2021-11-10
2022-01-25
[基金项目]国家自然科学基金资助项目(No. 31760290; No. 82160688);赣南医学院心脑血管疾病防治教育部重点实验室项目(No. XN201923)
Tel: 0797-8169808; E-mail: lixiao7979@163.com
(责任编辑:宋延君,罗森)
