源于尿道上皮细胞的诱导多能干细胞构建阿尔茨海默病研究模型*
2022-03-28王旎刘舜杰孟洋阳雷清锋韦睿李中
王旎, 刘舜杰, 孟洋阳, 雷清锋, 韦睿,2, 李中,3,4△
源于尿道上皮细胞的诱导多能干细胞构建阿尔茨海默病研究模型*
王旎1, 刘舜杰1, 孟洋阳1, 雷清锋1, 韦睿1,2, 李中1,3,4△
(1中山大学附属第六医院神经科,广东 广州 510655;2中国科学院广州生物医药与健康研究所, 广东 广州 510530;3广东省脑功能与脑疾病重点实验室,广东 广州 510080;4中山大学深圳研究院,广东 深圳 518057)
阿尔茨海默病(AD)是常见的神经退行性疾病之一,目前仍未有理想的研究模型,这使得其发病机制尚不完全清楚。因此,本研究将利用非侵袭性方法收集的尿道上皮细胞重编程为诱导多能干细胞(iPSC)从而构建AD疾病研究模型。本研究选取3名男性AD患者作为实验组和2名正常男性作为对照者组,通过分离实验组和对照组的尿道上皮细胞,并将其重编程成为iPSC,利用碱性磷酸酶染色、RT-qPCR及畸胎瘤形成实验等验证其干细胞特性。随后将iPSC定向神经分化成为神经细胞,采用ELISA方法验证AD特异性标志物的表达水平。同时,将基因在iPSC细胞系中过表达,采用ELISA方法验证AD特异性标志物的表达水平,以上实验每组研究对象均进行2~3次重复实验。尿道上皮细胞被成功地重编程成iPSC,且具有分化为三种不同胚层来源组织的多能性。定向分化患者来源的神经细胞分泌AD标志物的水平与正常对照比较没有显著差异(>0.05)。但是,过表达后的iPSC细胞系和分化的神经细胞,AD相关标志物表达水平较对照组显著增高(<0.05),说明该细胞系作为AD模型的可行性。本研究成功地将AD患者的尿道上皮细胞重编程为iPSC,并将其与正常来源的iPSC进行比较,观察到患者来源的iPSC具有相对正常的蛋白表达谱,提示该细胞的临床应用价值。同时,过表达基因的iPSC能检测到高表达的AD相关标志物,提示该细胞可以作为研究AD发病机制的细胞模型。
阿尔茨海默病;尿道上皮细胞;诱导多能干细胞;神经分化;基因
阿尔茨海默病(Alzheimer disease, AD)是最常见的神经系统退行性疾病之一,同时也是导致老年性痴呆最常见的原因之一。目前,全球罹患AD的病人大约有3.5亿,而该数据预计每20年将会翻1倍[1]。研究表明衰老是AD发病的最大危险因素[1],同时有调查显示85岁以上的老人中AD的患病率可高达30%以上[2]。明确AD发病机制是寻找新的更有效的治疗方案前提之一,而发病机制的研究依赖于理想的疾病研究模型。之所以AD发病机制的研究和相关的药物研发不尽人意,其重要原因之一在于缺乏理想的疾病模型。早在20世纪70年代,研究者对AD患者尸体进行解剖检测到脑内有特殊的淀粉样斑块和神经纤维缠结。后续的研究表明其主要成分为β淀粉样蛋白(β-amyloid, Aβ)和磷酸化的Tau蛋白[3]。但是,这些病变只提示了疾病终末状态,却无法解释淀粉样斑块和神经纤维缠结如何形成的。由于活体标本无法获得的局限性,研究者只能通过构建动物模型和细胞模型来探索其发病机制。
常用的动物模型有加速衰老动物模型,可以通过手术或神经毒性药物损毁纹状体区域神经元从而构建有痴呆状态的模型,也可以导入家系AD突变基因(、、等)的转基因动物模型等。前者仅仅模拟了认知障碍的临床表现,并没有引入AD的致病过程,因此对于机制的研究意义不大。由于越来越多的家系AD和相关的致病基因(、、)被发现[4],研究者们将该致病基因导入动物体内从而建立AD疾病模型。但是,由于种属间的差异性,该模型也具有一定的局限性。例如,转基因小鼠高表达了Aβ,在其脑组织内可观察到淀粉样斑块形成,但该模型脑内的神经纤维缠结形成却尚未有相关报道[5],这也限制了该小鼠模型的疾病机制研究。也有一些细胞模型被用于研究AD的发病机制,主要包括:来源于神经肿瘤的细胞株(如人神经母细胞瘤SH-SY5Y细胞系)和动物胚胎脑组织中分离出的原代神经细胞。不过这些模型仍有其不足之处。首先,虽然人神经母细胞瘤SH-SY5Y细胞系来源于人神经细胞,但它属于肿瘤细胞与正常神经细胞仍具有区别。其次,胎脑分离的神经细胞数量较少,很难对其进行基因改造后建立成熟的细胞系。因此,由于AD疾病模型存在着种种问题,这阻碍了疾病研究进展和药物研发。这样使得我们需要寻求新的技术来建立更准确的疾病模型。
近年来,诱导多能干细胞(induced pluripotent stem cell, iPSC)技术的诞生为疾病的研究提供了新的思路。从患者体细胞重编程获得的iPSC携带了患者来源的疾病特异性治病基因,这样的细胞具有多向分化潜能和克隆性是建立疾病模型的潜在细胞来源和良好工具。例如,Yagi等[6]利用带有和基因突变的家系AD患者的体细胞(成纤维细胞)重编程成为iPSC,将其诱导分化成神经细胞并检测到高表达的Aβ。该研究首次证明了家系AD患者来源的iPSC诱导分化的神经细胞可能作为家系AD发病机制的研究模型。另外,Kondo等利用1例散发AD患者的体细胞重编程成为iPSC和诱导分化成神经细胞,也观察到类似的结果,即Aβ寡聚体形成[7]。这提示利用重编程技术构建的iPSC和定向分化的神经细胞具有模拟疾病发生发展的潜能。因此,本项工作旨在利用iPSC技术构建阿尔茨海默病的研究模型。
材料和方法
1 材料
本研究的尿道上皮细胞来自于2名正常者对照和3名AD患者,均获得本人或家属同意并签字知情同意书,具体信息详见表1。本研究所用的人胚胎干细胞(H1)、正常iPSC(UMC3)和过表达的iPSC(UMC3-21)由广州生物医药与健康研究院惠赠。本研究iPSC及其定向神经分化实验等获得广州生物医药与健康研究院动物实验中心伦理委员会审批。

表1 细胞捐赠者信息
2 方法
2.1尿道上皮细胞培养收集中段尿液400×离心10 min,弃上清后用PBS清洗1次后400×离心10 min。将清洗后的尿液细胞重悬于3 mL的培养液并接种于6孔板(预先明胶铺板)中,置于37 ℃培养箱内培养。
2.2尿道上皮细胞重编程与iPSC纯化用0.25% Trypsin-EDTA消化尿道上皮细胞并离心(200×,5 min),重悬于电转反应液和相应体积的pCEP4-E02S-ET2K和pCEP4-has-miR-302-367 cluster质粒的混合液中。用于重编程的质粒由广州生物医药与健康研究院惠赠。将反应体系转入电转杯中,使用LONZA电转仪(Nucleofector™ 2b Device,AAB-1001)及其配套的电转试剂盒(LONZA Primary Cell Nucleofector™ Kit,VVPI-1005)进行电转,将电转后的细胞转入包被好Matrigel胶的6孔板内,继续置于37 ℃培养箱培养,需每日换液。当细胞密度达到70%~80%时予以传代并继续放入37 ℃培养箱进行培养。由于干细胞具有分化潜能,在增殖过程中可能出现分化。若出现非iPSC细胞形态时,加入胶原酶Ⅳ消化60 min,将漂起的iPSC收集,离心后种植于新的培养板内继续培养。
2.3碱性磷酸酶(alkaline phosphatase, AP)染色移出培养液后用PBS清洗细胞,加入4% PFA室温固定2 min后,用TBST缓冲液洗三次后去除液体。加AP缓冲液(BCIP/NBT碱性磷酸酯酶显色试剂盒)室温染色5 min后,加入显色液避光作用15 min。PBS洗3次后加入甘油在显微镜下观察拍照。
2.4核型鉴定选取生长密度约60%~80%的iPSC,加入秋水仙素(终浓度为0.2 g/L)后继续置于37 ℃培养箱中孵育130 min。PSB洗2次后加入0.25% Trpsin-EDTA胰酶消化,使其分离成单个细胞后离心去上清。加入预热的氯化钾溶液(0.075 mol/L,37 ℃)重悬细胞并置37 ℃水浴处理20 min后,加入新鲜配制固定液(甲醇∶冰醋酸比例为3∶1),固定3 min后离心(1 000×,5 min)弃上清,再次加入固定液,置于37 ℃水浴箱中固定40 min。离心后弃上清后重悬细胞并滴片转移至75℃烘箱,烤片3 h。0.5%胰蛋白酶消化液处理8 s后迅速放入生理盐水终止消化。Giemsa染液染色处理5 min后自来水轻轻冲洗并吹干,随后在电动正置显微镜下观察和分析核型。
2.5实时荧光定量PCR根据产品说明书抽提总RNA,每孔加入1 mL的Trizol室温裂解5分钟,加入200 μL氯仿冰上孵育15 min后离心(10 000×,10 min)取上清转移至新EP管。加入1 mL的无水乙醇离心(10 000×,10m in)后用1 mL的75%乙醇洗沉淀。离心(7 500×,10 min)后去上清,加入DEPC水溶解RNA并测定浓度。根据产品说明书将RNA逆转录成cDNA。根据产品说明书检测三个内源性多能性标志物[八聚体结合转录因子4(octamer-binding transcription factor 4, OCT4)、SRY盒转录因子2(SRY-box transcription factor 2, SOX2)和同源框蛋白NANOG]的表达,以GAPDH作为内参照。该实验重复3次。所用引物序列如下:OCT4的上游引物序列为5'-GACGCCATCAACACCGAGTT-3',下游引物序列为5'-CTTTGTCGTTGGTTAGCTGGT-3';SOX2的上游引物序列为5'-CCCAGCAGACTTCACATGT-3',下游引物序列为5'-CCTCCCATTTCCCTCGTTTT-3';NANOG的上游引物序列为5'-TTTGTGGGCCTGAAGAAAACT-3',下游引物序列为5'-AGGGCTGTCCTGAATAAGCAG-3';GAPDH的上游引物序列为5'-GGAGCGAGATCCCTCCAAAAT-3',下游引物序列为5'-GGCTGTTGTCATACTTCTCATGG-3'。
2.6畸胎瘤形成试验本研究用于畸胎瘤试验的8~12周龄的NOD-SCID免疫缺陷小鼠(品系代码406,Elite/SPF级)购买于广州生物医药与健康研究院动物实验中心,共20只。将冻存的细胞(细胞数约3×106以上)复苏后,用Matrigel溶液重悬并注射入小鼠体内,注射每只小鼠双后肢,大约1个月后可见畸胎瘤长出。待畸胎瘤直径约为1 cm时处死小鼠进行HE染色观察三个胚层典型的组织。本研究动物实验已通过广州生物医药与健康研究院动物实验中心伦理委员会审批。
2.7iPSC定向分化为神经干细胞(neural stem cell, NSC)与鉴定将未分化的iPSC接种于Matrigel包被的6孔板中,当密度达到60%~70%时更换为神经分化培养基,开始诱导其向NSC分化。在分化的第8 天停止加入两个抑制剂SB431542(Sigma)和dorsomorpin(Sigma)。分化后第16天可见神经花环结构形成或隆起的小丘状。用免疫荧光鉴定NSC特异性标志物[配对盒蛋白6(paired box 6, PAX6)、SRY盒转录因子1(SRY-box transcription factor 1, SOX1)、SOX2和巢蛋白(nestin)]的表达情况。抗体信息如下:PAX6(1∶1 000,Millipore-AB2237),nestin(1∶1 000,Millipore-MAB5326),SOX1(1∶1 000,Abcam-ab87775),SOX2(1∶1 000,Abcam-ab97959)。
2.8诱导NSC向神经细胞分化及鉴定为了明确尿道上皮细胞来源的iPSC是否能定向分化为神经细胞,本研究参考文献报道将尿道上皮来源的iPSC诱导分化为NSC[8]。NSC正常传代1~2次后用accutase消化成为单个细胞,以每孔1×105个的密度接种于Matrigel包被的12孔板内,隔天换液。利用免疫荧光方法鉴定分化60 d后神经细胞的相关标志物[TUJ1、微管相关蛋白2(microtubule-associated protein 2, MAP2)和胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein, GFAP)]的表达情况。抗体信息如下:TUJ1(1∶1 000,Sigma-MAB1637),MAP2(1∶500,Sigma-M4403),GFAP(1∶1 000,Millipore-AB5804)。
2.9ELISA分化60 d后的神经细胞培养于12孔板中,加入1 mL培养基培养48 h后取上清。根据ELISA试剂盒说明书,检测Aβ1-40、Aβ1-42、总Tau和p-Tau水平。将100 µL抗体标记液加入孔中室温孵育60 min后,清洗三次移除上清。加入显色溶液避光室温孵育30 min。加入终止液停止反应,使用酶标仪测定450 nm波长的吸光度。同时收集细胞并提取总蛋白并检测其浓度,对结果进行标准化,该实验重复3次。
3 统计学处理
使用SPSS 20.0软件进行统计学分析处理,数据用均数±标准差(mean±SD)表示。Shapiro-Wilk方法判断数据是否为正态分布,Levene方法判断各组数据间是否方差齐性。对于正态分布且方差齐性的数据,使用单因素方差分析来比较组间差异,若单因素方差分析结果提示<0.05,则进一步使用LSD-检验进行组间两两比较。若数据不符合正态分布或非方差齐性,则使用Kruskal-Wallis方法分析比较组间差异,若结果提示<0.05,则进一步使用Bonferroni法进行组间两两比较,以<0.05表示差异具有统计学意义。
结果
1 尿道上皮细胞重编程的iPSC
从3名临床表型典型的AD患者和2名同年龄段的正常对照者的中段尿液中分离和培养了尿道上皮细胞(图1A)。利用电转技术转染了编码4种转录因子(OCT4、KLF4、NANOG和SV40LT)的外源质粒,对尿道上皮细胞进行重新编程。重编程的尿道上皮细胞在转染后第7天逐渐聚集,形态从纺锤状变为圆形(图1B)。在转染后18~21 d细胞形态呈现出典型的iPSC,并采用碱性磷酸酶染色检查方法判断出该细胞具有多克隆性(图1C)。通过对体外的4种重编程因子(OCT4、SOX2、KLF4和SV40LT)进行PCR扩增和凝胶电泳证实外源质粒的DNA并未整合入iPSC中(图1D)。此外,通过对不同个体来源的iPSC进行核型分析,并将具有正常核型的iPSC用于后续研究(图1E)。
随后,通过检测OCT4、SOX2和NANOG(三个常用的干细胞相关标志物)的mRNA表达水平,进一步验证了正常核型的iPSC细胞系的干细胞特性,该实验将人类胚胎干细胞(H1细胞)作为阳性对照(图1F)。实验结果表明不论正常对照来源的iPSC,还是AD患者来源的iPSC细胞系表达OCT4、SOX2和NANOG的水平与H1细胞没有显著差异(图1F)。这说明了重编程iPSC细胞系具备干细胞的特性。此外,将iPSC注射到8~12周龄的NOD-SCID小鼠双侧后肢。畸胎瘤形成后处死小鼠,HE染色分析畸胎瘤的组织成分证实了重编程的iPSC细胞系具有体内分化为三个原始层的能力,包括来源于外胚层的神经组织、来源于中胚层的肌肉组织、和来源于内胚层的消化腺(图1G)。
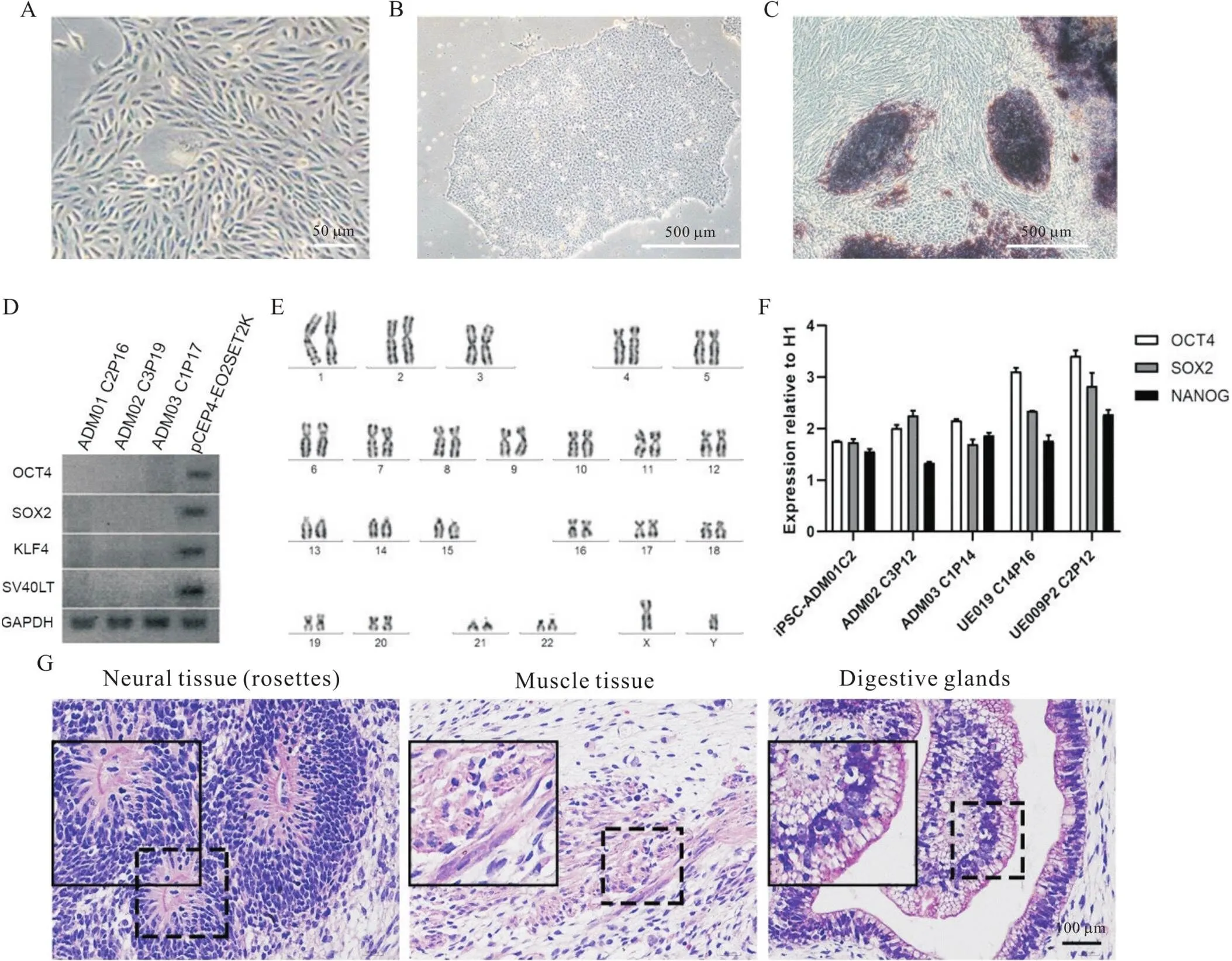
Figure 1.iPSC derived from urethral epithelial cells of the AD patients. A: morphological changes of urethral epithelial cells; B: morphological changes of iPSC; C: alkaline phophatase staining; D: PCR identification of non-integration of episomal DNA (the episomal plasmid pCEP4-EO2SET2K is used as a positive control); E: normal karyotype of AD patient-derived cell lines; F: endogenous hESC-specific gene expression in iPSCs from patients (ADM01, ADM02 and ADM03) and controls (UE019 and UE009P2) by real-time qPCR (mean±SD; n=3); G: HE staining of iPSCs-formed teratomas in the NOD-SCID mice.
2 iPSC诱导分化的NSC和神经细胞
正常对照与AD患者来源分化形成的iPSC在形态学方面没有明显差异。在此过程中,iPSC逐渐失去了干细胞的典型形态,在诱导分化后第8天形成了难以辨认细胞核的小细胞(图2A)。分化后第16天,这些细胞聚集形成玫瑰花结或山丘状突起,最终悬浮于培养液中形成NSC球(图2A)。随后,本研究检测了该球形细胞团是否是NSC,分离了细胞团并采用免疫荧光染色方法检查了NSC特异性标志物的表达,包括PAX6、nestin、SOX1和SOX2。结果表明iPSC在诱导分化16 d后可能形成NSC(图2B)。在培养液中加入0.1 ng/L BDNF、0.1 ng/L GDNF和0.1 ng/L cAMP,进一步将这些NSC诱导分化成为神经细胞,包括神经元(TUJ1标记未成熟的神经元、MAP-2是成熟神经元的标志物)和神经胶质细胞(GFAP是一种星形胶质细胞特异性标志物),见图2C。
3 定向分化神经细胞的阿尔兹海默病相关标志物表达情况
本研究成功地将正常对照者和AD患者的尿道上皮细胞重编程成为iPSC,并定向分化为神经细胞。为了验证AD患者来源的iPSC细胞系诱导分化的神经细胞是否能够作为AD的疾病模型,检测了这些神经细胞是否高表达AD相关的标志物。利用ELISA检测AD患者来源诱导分化的神经细胞分泌Aβ和磷酸化Tau蛋白的情况。与正常对照相比,AD患者来源的神经细胞分泌的Aβ1-40和Aβ1-42水平没有显著差异(>0.05)。通过检测两组间的Aβ1-42与Aβ1-40的比率表明AD组和对照组之间没有显著的差异(>0.05)。此外,ELISA方法进一步检测到AD患者和对照的神经细胞分泌的t-Tau和p-Tau水平并没有显著差异。同时,与正常对照的细胞相比,t-Tau与p-Tau的比率也没有显著差异(>0.05),见图3。

Figure 3.Examination of AD-associated markers secreted by iPSC-induced neural cells. Mean±SD. n=3.
4 尿上皮细胞来源的iPSC对阿尔茨海默病进行细胞建模
本研究后续将基因(与家系AD的致病机理有关)过表达于尿道上皮细胞来源的iPSC中。结果表明过表达的细胞系中表达量高于正常对照细胞(UMC3)。随后,进一步验证了编码的蛋白β-secretase 1在iPSC诱导分化的NSC和神经细胞中高表达。此外,本研究检测到iPSC过表达细胞系中的AD相关标志物Aβ1-42有较高的表达水平(<0.05),见图4。

Figure 4.Establishment of AD model using urethral epithelial cells-derived iPSC. Mean±SD. n=3. *P<0.05 vs UMC3.
讨论
人口老龄化是近年来严峻的问题,也是导致老年人痴呆重要的危险因素。阿尔兹海默病是老年痴呆的常见的原因,因此,针对AD的发病机制研究和药物研发显得极其紧迫。但是,目前临床上治疗AD的药物仅能缓解患者的症状,并不能延缓疾病的进展。之所以治疗AD药物的研发进展缓慢,是因为其确切的发病机制尚不清楚。目前对于AD的病理变化的认识,仅来源于患者尸体的解剖分析,而这些检测结果只能说明疾病的终末状态病理改变,却不能阐述真正的病理生理变化。随着iPSC技术的日渐成熟,基于该技术构建疾病模型等研究具有应用前景。本研究成功地将三名AD患者和两名正常对照者的尿道上皮细胞重新编程为iPSC,并定向诱导分化为神经干性细胞和神经细胞。此前,也有研究者将AD患者皮肤成纤维细胞重编程成iPSC[9],但是该方法体细胞的获得具有侵入性。然而,本研究通过采集AD患者的尿道上皮细胞是无创的,这种方式对于AD患者及其家属来说更容易被接受。由此可见,AD患者尿道上皮细胞很可能是重编程的细胞来源。外源质粒的表达水平会在传代超过10代后最终被稀释掉[10]。本研究也验证体外的四种重编程因子(OCT4、SOX2、KLF4和SV40LT)并未整合到AD患者和正常对照的尿道上皮来源细胞系(超过10次传代)的内源基因组中。虽然本研究结果显示AD患者来源的iPSC细胞系中干细胞特异性标志物表达水平与人胚胎干细胞H1细胞系存在差异,但是对照组(UE019和UE009P2)中干细胞标志物的表达水平也与H1细胞系不同。类似的结果也被 Israel等[11]报道过。这些差异可能是由于不同iPSC细胞系本身的变异引起的,而不是由AD发病机制引起的。
本项目进一步将iPSC定向分化成为NSC和神经细胞,试图构建AD疾病模型。Aβ1-40、Aβ1-42及Aβ1-42与Aβ1-40的比率增加是提示AD相关的重要生物标志物[12]。此外,Tau蛋白的过度磷酸化和神经纤维缠结形成是AD患者脑组织中的标志性的病理改变[13]。但是,通过检测AD患者来源诱导分化60天后的神经细胞分泌AD表型相关标志物水平(Aβ和磷酸化的Tau蛋白)观察到来源于AD患者和正常对照者的神经细胞分泌这些蛋白的水平没有显著差别,这些结果提示AD患者来源的iPSC诱导分化60天后的神经细胞具有相对正常的AD相关蛋白谱表达水平。这同时也可能提示AD患者来源的iPSC作为细胞治疗的潜能。此外,这一结果并不能完全否认AD患者来源的iPSC作为AD研究模型的可能性。据报道神经细胞的诱导分化时间大约需要21~90天[7, 11],而本研究诱导分化了60天,这有可能提示该细胞系尚未完全分化成为神经细胞;AD患者的发病需要相当长的时间,这使得神经细胞的定向分化可能需要更长的时间(或许大于90天)才能达到模拟AD起病的作用。2012年,Israel等[11]重编程了2例家系AD患者和2例散发AD患者来源的iPSC,也成功地诱导分化成为神经细胞,两例家系患者和一例散发患者来源的iPSC诱导分化的神经细胞表现出与AD表型相关的标志物水平上调。然而,这项研究结果有1例散发AD患者来源神经细胞分泌的AD相关标志物(Aβ1-40和磷酸化Tau蛋白)的水平并没有增高。散发AD患者来源的神经细胞分泌的AD相关标志物与正常对照没有明显差异[11, 14],这可能由于散发AD患者的异质性导致其iPSC诱导分化的神经细胞出现不同的表型。其实,家系AD患者相对罕见(大约占AD患者的1%~2%),而由遗传因素和环境因素相互作用的散发性AD占绝大多数[15-16]。但是,目前的研究仅包含了很小样本的散发AD患者,这在很大程度上限制了散发AD表型的探索。因此,建立散发AD患者特异性iPSC细胞库对于全面了解AD发病机制具有重要意义。
[1] GBDD Collaborators. Global, regional, and national burden of Alzheimer's disease and other dementias, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016[J]. Lancet Neurol, 2019, 18(1):88-106.
[2] Hirtz D, Thurman DJ, Gwinn-Hardy K, et al. How common are the "common" neurologic disorders?[J]. Neurology, 2007, 68(5):326-337.
[3] Hart MNJSN. Degenerative diseases of the central nervous system[M] // Nelson JS, Parisi JE, Schochet SS Jr. Principles and practice of neuropathology. St.Louis: Mosby, 1993:345-349.
[4] Seshadri S, Fitzpatrick AL, Ikram MA, et al. Genome-wide analysis of genetic loci associated with Alzheimer disease[J]. JAMA, 2010, 303(18):1832-1840.
[5] Choi SH, Tanzi RE. iPSCs to the rescue in Alzheimer's research[J]. Cell Stem Cell, 2012, 10(3):235-236.
[6] Yagi T, Ito D, Okada Y, et al. Modeling familial Alzheimer's disease with induced pluripotent stem cells [J]. Hum Mol Genet, 2011, 20(23):4530-4539.
[7] Kondo T, Asai M, Tsukita K,et al.Modeling Alzheimer's disease with iPSCs reveals stress phenotypes associated with intracellular Aβ and differential drug responsiveness[J]. Cell Stem Cell, 2013, 12(4):487-496.
[8] Chambers SM, Fasano CA, Papapetrou EP, et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling[J]. Nat Biotechnol, 2009, 27(3):275-280.
[9] Hossini AM, Megges M, Prigione A, et al. Induced pluripotent stem cell-derived neuronal cells from a sporadic Alzheimer's disease donor as a model for investigating AD-associated gene regulatory networks[J]. BMC Genomics, 2015, 16:84-103.
[10] Gu H, Huang X, Xu J, Song L, et al. Optimizing the method for generation of integration-free induced pluripotent stem cells from human peripheral blood[J]. Stem Cell Res Ther, 2018, 9(1):163-172.
[11] Israel MA, Yuan SH, Bardy C, et al. Probing sporadic and familial Alzheimer's disease using induced pluripotent stem cells[J]. Nature, 2012, 482(7384):216-220.
[12] Molinuevo JL, Ayton S, Batrla R, et al. Current state of Alzheimer's fluid biomarkers[J]. Acta Neuropathol, 2018, 136(6):821-853.
[13] Iqbal K, Liu F, Gong CX, et al. Mechanisms of tau-induced neurodegeneration[J]. Acta Neuropathol, 2009, 118(1):53-69.
[14] Birnbaum JH, Wanner D, Gietl AF, et al. Oxidative stress and altered mitochondrial protein expression in the absence of amyloid-beta and tau pathology in iPSC-derived neurons from sporadic Alzheimer's disease patients[J]. Stem Cell Res, 2018, 27:121-130.
[15] Chiasseu M, Fesharaki-Zadeh A, Saito T, et al. Gene-environment interaction promotes Alzheimer's risk as revealed by synergy of repeated mild traumatic brain injury and mouse App knock-in [J]. Neurobiol Dis, 2020, 145:105059.
[16] Long JM, Holtzman DM. Alzheimer disease: an update on pathobiology and treatment strategies[J]. Cell, 2019, 179(2): 312-339.
Potential Alzheimer disease model of induced pluripotent stem cells derived from urethral epithelial cells
WANG Ni1, LIU Shun-jie1, MENG Yang-yang1, LEI Qing-feng1, WEI Rui1,2, LI Zhong1,3,4△
(1,,,501655,;2,,510530,;3,,,510080,;4,,518057,)
Alzheimer disease (AD) is the most common neurodegenerative disorder. There is currently no effective treatment for AD, which may be attributed in part to lack of effective AD models. A non-invasive method to generate induced pluripotent stem cells (iPSC) from urethral epithelial was used in current study.Urethral epithelial cells from three male AD patients and two male normal subjects were reprogrammed into iPSC. iPSC are tested by alkaline phosphatase (AP) staining, RT-qPCR, and teratoma. Then the iPSC was induced into neural cells. ELISA was used to test AD-associated markers secreted by neural cells. Meanwhile,gene was over-expressed in iPSC and AD-associated marker was examined by ELISA.The urethral epithelial cells were successfully reprogrammed into iPSC, which can differentiate into tissues derived from three different germ layers. There is no significance in secreted AD-associated markers between neural cells and iPSC (>0.05). However, over-expression ofin iPSC and its neural differentiation cells expressed higher level of AD-associated marker than controls (0.05).Urethral epithelial cells from AD patient urine samples are reprogrammed into iPSCs. Over-expression ofgene in iPSC stimulate the expression of AD-related markers, suggesting it is an ideal disease model for AD .
Alzheimer disease; Urethral epithelial cells; Induced pluripotent stem cells; Neural differentiation;gene
R363.2; R741.02
A
10.3969/j.issn.1000-4718.2022.03.013
1000-4718(2022)03-0487-08
2021-09-14
2022-02-10
[基金项目]广东省自然科学基金(No. 2020A1515010111)
Tel: 020-38254072; E-mail: lzhong@mail.sysu.edu.cn
(责任编辑:卢萍,余小慧)
