水曲柳CUC1 基因克隆及瞬时表达分析
2022-03-26崔靖弘梁楠松宋婷婷吕义品纪欣童赵福江詹亚光
崔靖弘,于 磊,梁楠松,宋婷婷,吕义品,纪欣童,徐 亮,赵福江,詹亚光*
(1.东北林业大学东北盐碱植被恢复与重建教育部重点实验室,黑龙江 哈尔滨 150040;2.黑龙江省头雁创新团队计划(林木遗传育种创新研究团队),黑龙江 哈尔滨 150040;3.吉林省临江林业局,吉林 临江 134600)
CUCs(CUP-SHAPED COTYLEDONs)基 因在调控植物营养生长到生殖生长中发挥着核心作用,如参与植物顶端分生组织建成[1];与生长素、miRNA 等相互调控影响叶边缘形态[2];通过调控下游LAS(LATERALSUPRESSOR)基因促进腋生分生组织起始,进而影响侧枝发育[3];在拟南芥根外植体培养中,CUC1和CUC2基因表达量可与根形成不定芽的能力成正相关,可见,CUC基因可作为一个预测性标志基因,筛选根形成芽的最佳组培条件[4]。CUC1属于植物特有的NAC 家族NAM 超家族成员[5],具有NAC 家族典型的N 端高度保守NAC-domain 和C 端高度多变序列,NACdomain 是一个包含约150 至160 个氨基酸[6],分为5 个亚结构域(A-E),其中,A、C、D 保守性高,B、E 保守性低,且D、E 是DNA 结合所必需的亚结构域[7]。CUC1基因在愈伤组织再生出芽中发挥着重要作用,Daimon 等[8]在愈伤组织中过表达CUC1基因,可促使芽的再生率从30%提高到80%。进一步研究表明,通过对CUC亚家族和ATAF1亚家族NAC-domain 互换实验中发现,ATAF1的NAC-domain 不能诱导愈伤组织再生出芽,这是由于其自身特异的NAC-domain 所决定的[9]。Aida等[10]研究中发现,CUC1和CUC2基因双突变体植株可呈现雄蕊、萼片和子叶愈合,很难产生SAM(顶端分生组织)。进一步研究发现,CUC1和CUC2可通过调控STM(SHOOT MERISTEMLESS对于分生组织起始和维持SAM 中心区的未分化细胞是必需的)的表达来决定分生组织中心的建立[11]。如STM首先在CUC基因表达原基的细胞环中表达,当SAM 形成时,STM将CUC基因的表达限制在SAM 的外周区,进而形成反馈调节环[12]。此外,CUC1基因的表达受到其他转录因子和表观遗传修饰调控,如PLT3(PLETHORA3)、PLT5、PLT7可以促进CUC1的表达[13],ESR1(ENHANCER OF SHOOT REGENERATION1)也可以促进CUC1的表达[14];在离体器官再生过程中,CUC1基因表达与其启动子区和3′端的DNA 甲基化修饰水平呈明显负相关性[15],且CUC1的表达也受到了H3K4 乙酰化水平调控[16]。目前,CUC1基因的研究大多集中于拟南芥等模式植物,而在木本植物中鲜有研究。
水曲柳(Fraxinus mandshuricaRupr.)系木犀科(Oleaceae)白蜡树属,是东北地区重要的珍贵用材树种,由于地域特征水曲柳能够耐寒、耐旱、耐盐碱,且木材优良,用途广泛,具有较高的经济价值[17-19]。其作为黑龙江省主要的造林树种,再生困难造成遗传转化效率低的现象一直困扰着育种工作者,而瞬时转化是一种快速有效的遗传转化方法,对研究植物基因功能具有重要意义,如邹全程等[20]利用农杆菌介导刚毛柳(Tamarix hispida)ThCBL4基因瞬时过表达可提高转基因植株耐盐性;Wu 等[21]证实,在桑叶中瞬时过表达MaFT基因可能促使桑树(Morus albaL.)早熟开花等。因此,为了提高水曲柳遗传转化效率,解决再生难等问题,可见从分子水平研究再生相关的基因是必要的。本研究从水曲柳中克隆获得了FmCUC1基因,对其分子特征、组织特异性、亚细胞定位进行分析,测定其在不同激素信号下的基因表达情况,同时构建了FmCUC1基因表达载体(pNC-Cam1304-SubC-FmCUC1),利用农杆菌介导水曲柳FmCUC1基因瞬时过表达72 h 后,分析比较其通路相关基因表达情况以初步鉴定FmCUC1基因功能。该研究将有助于为水曲柳转基因工作提供新思路。
1 材料与方法
1.1 试验材料
试验所用材料均为水曲柳种子种植。将水曲柳种子接种于WPM 固体培养基中(pH5.8~6.0),培养于人工气候室(湿度为60%~80%,温度为22 ±2℃,光照15 h)。以生长30 d,长势均一的实生幼苗为实验材料。根、茎、叶取自30 d 组培苗,顶芽取自3 年生盆栽苗。
1.2 试验方法
1.2.1 基因克隆 根据水曲柳CUC1基因的编码区(CDS)设计引物(表1),以生长30 d 的水曲柳组培苗cDNA 为模板进行FmCUC1基因的PCR 扩增(反应体系:上下游引物各1.0 μL,cDNA 模板1.0 μL,2 × Es MasterMix 10 μL,ddH2O 7.0 μL。PCR 扩增程序为:94℃预变性3 min;94℃变性35 s,56℃退火30 s,72℃延伸30 s,30 个循环;72℃延伸2 min,4℃保存)。将目的片段回收纯化,连接至pEASY-T5-Zero 载体上,转化至大肠杆菌DH5α 感受态细胞中,将阳性克隆送至擎科生物科技有限公司测序。
1.2.2FmCUC1基因生物信息学分析 根据FmCUC1基因序列分析其理化性质、亲疏水性、保守结构域及构建系统进化树,具体操作步骤参考郭依萍等[22]。
1.2.3FmCUC1基因表达载体构建及亚细胞定位
根据FmCUC1基因CDS 序列设计引物(表1),以阳性克隆质粒为模板进行PCR 扩增,将扩增产物回收纯化后使用Nimble Cloning MIX 试剂将其连接至pNC-Green-SubC 表达载体中,构建植物表达载体pNC-Green-SubC-FmCUC1,将阳性菌液送至擎科生物科技有限公司测序。将检测正确的pNC-Green-SubC-FmCUC1质粒转化农杆菌GV3101感受态细胞。利用农杆菌介导法分别将pNC-Green-SubC-FmCUC1和空载pNC-Green-SubC 转入到洋葱内表皮细胞中,使用荧光共聚焦显微镜观察并照相。

表1 引物序列及用途Table 1 Primer sequence and Application
1.2.4FmCUC1基因组特异性表达 分别以水曲柳根、茎、叶、顶芽组织为cDNA 模板,以水曲柳微管蛋白FmTU[23]为内参基因对FmCUC1基因表达进行荧光定量PCR。
1.2.5FmCUC1基因在下胚轴芽再生与种子萌发过程中的差异表达 以水曲柳下胚轴和种子为实验材料,分别在培养6、12、18、24、30、36 d 与接种0、3、4、5、7、8、10、14、18、21 d 进行取样,待取样完毕后,使用Tris-CTAB 法提取RNA,反转录,对水曲柳下胚轴芽再生与种子萌发过程中FmCUC1基因表达进行荧光定量PCR。
1.2.6FmCUC1基因在激素信号下的差异表达 分别对长势均一的组培苗喷施6-BA(100 μmol·L-1)、BR(1 μmol·L-1)、IAA(100 μmol·L-1)激素处理,每个处理设3 个重复,每重复5 株水曲柳苗,于0 h、10 min、1 h、3 h、6 h、12 h、24 h、48 h进行整株取样。对8 个取样点FmCUC1表达进行荧光定量PCR。
1.2.7FmCUC1基因表达载体构建、瞬时侵染水曲柳及相关基因表达 以阳性克隆质粒为模板进行PCR 扩增,将扩增产物回收纯化后使用Nimble Cloning MIX 试剂[24]将其连接至pNC-Cam1304-SubC 表达载体中,构建植物表达载体pNCCam1304-SubC-FmCUC1,将阳性菌液送至擎科生物科技有限公司测序。将检测正确的pNC-Cam1304-SubC-FmCUC1质粒转化农杆菌GV3101 感受态细胞,保存菌种备用。
利用农杆菌介导的瞬时转化法,方法参照杨少彤等[25];将pNC-Cam1304-SubC-FmCUC1-GV3101和转化液(对照)分别对生长30 d 的整株水曲柳组培苗进行瞬时侵染。为了检验FmCUC1基因及其通路 的ESR1(ENHANCER OF SHOOT REGENERATION1)、PLT3(PLETHORA3 )、PLT5(PLETHORA5)、B型ARR12(ARABIDOPSIS RESPONSE REGULATOR12)、STM(SHOOT MERISTEMLESS)基因表达情况,提取72 h 的FmCUC1瞬时过表达植株的总RNA,进行荧光定量PCR。
1.2.8 数据处理与分析 每个实验至少3 次生物学重复;基因相对表达量使用7 500 Software v 2.0.6 软件获取,按照基因相对定量法(2-ΔΔCt)对基因相对表达量进行计算;利用SPSS version 22.0软件采用Duncan’s 多重比较法进行显著性分析。
2 结果与分析
2.1 FmCUC1 基因克隆及基因结构分析
由图1A 可知:PCR 扩增获得1 条约800 bp的目的基因条带,经测序,证实得到目的基因即为FmCUC1基因(登录号:MH060997.1),其CDS 序列为807 bp,编码269 个氨基酸(图1B)。

图1 FmCUC1 基因克隆Fig.1 Cloning of FmCUC1 gene
使用ProtParam 预测FmCUC1 蛋白脂肪系数为32.71,不稳定系数值为35.02,属于稳定蛋白。进一步使用TMHMM 对FmCUC1 蛋白的亲/疏水性分析可知:该蛋白的最大亲水性为-0.663、最大疏水性为2.189,有 43 个氨基酸亲水数峰在0 以下,有438 个氨基酸疏水数峰在0 以上,亲水性氨基酸数目明显少于疏水性氨基酸,为疏水蛋白。通过CD-Search 对FmCUC1 蛋白保守结构域和功能域预测可知:FmCUC1 蛋白近N 端的第49-423 位氨基酸为典型的NAC-domain 结构域。
2.2 FmCUC1 编码蛋白的同源性分析
使用NCBI 中的Blastp 对FmCUC1氨基酸进行同源序列比对表明:水曲柳CUC1(NAC92)氨基酸序列与同科的木犀榄CUC1(NAC92)氨基酸序列相似度较高,为86.17%;同时对水曲柳、木犀榄、拟南芥、水稻等16 个物种的CUC1 蛋白氨基酸序列构建系统发育树(图2),结果显示进化树聚为2 类,其中,水曲柳与木犀榄位于同一进化分支上,说明目前水曲柳CUC1与木犀榄CUC1 亲缘关系较近。

图2 FmCUC1 与其他物种的CUC1 蛋白进化分析Fig.2 Evolutionary analysis of FmCUC1 and CUC1 proteins in other species
2.3 FmCUC1 基因表达载体构建、亚细胞定位
以SFmCUC1-F 和SFmCUC1-R 为引物,测序正确的FmCUC1基因阳性克隆质粒为模板,成功构建植物表达载体pNC-Green-SubC-FmCUC1(图3)。

图3 pNC-Green-SubC-FmCUC1 表达载体结构图Fig.3 Structure of pNC-Green-SubC-FmCUC1 expression vector
利用农杆菌介导法分别将pNC-Green-SubCFmCUC1-GV3101 和空载pNC-Green-SubC-GV3101转入到洋葱内表皮细胞中,使用荧光共聚焦显微镜观察侵染后得到的洋葱内表达细胞。实验结果(图4)表明:对照组在细胞核与细胞膜中均发现绿色荧光,FmCUC1-EGFP 融合蛋白只在细胞核中有明显的绿色荧光,且与DAPI 核染色位置一致,表明FmCUC1基因定位于细胞核中。

图4 FmCUC1 蛋白亚细胞定位Fig.4 Subcellular localization of FmCUC1 protein
2.4 FmCUC1 基因组织特异性表达分析
采用荧光定量PCR 技术对水曲柳FmCUC1基因在根、茎、叶、顶芽中的表达进行检测。结果表明:该基因在根、茎、叶、顶芽中均有表达,以根表达量作为参考,茎表达量低于根组织,为根表达量的75%,叶片的表达量高于根,为根表达量的3.27 倍,顶芽的表达量最高,为根表达量的6.43 倍(图5)。以上结果表明,FmCUC1基因在水曲柳顶芽中表达量最高。
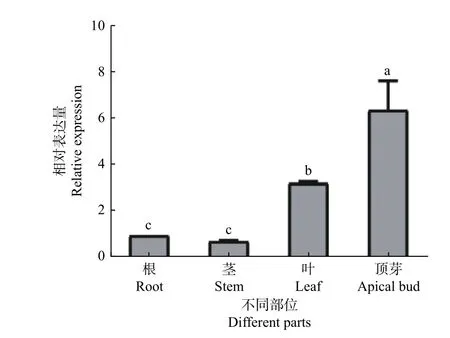
图5 FmCUC1 基因在根、茎、叶、顶芽中的表达差异Fig.5 Expression difference of FmCUC1 gene in roots,stems,leaf and apical bud
2.5 FmCUC1 基因在下胚轴芽再生与种子萌发过程中的差异表达分析
在水曲柳下胚轴芽再生过程中发现:FmCUC1基因在6~36 d 均有表达,以第6 天表达量作为参考,培养6 d 时可发现下胚轴端部开始膨大(图6C),生长12 d 时可以发现有芽点产生(图6D),此时FmCUC1基因表达量为对照的1.98 倍(图6A);进一步观察可发现12~36 d 为丛枝形成期,待生长至36 d 时FmCUC1基因表达量达到峰值,为对照的11.33 倍(图6A)。以上结果表明:FmCUC1基因参与水曲柳下胚轴芽再生过程,并促进不定芽的分化。同样,在种子萌发过程中,通过定量分析得出:FmCUC1基因在第4 天和第8 天分别达到2 个峰值,分别为0 d 的8.56 倍和8.46 倍(图6B)。结果表明,这2 个峰值与水曲柳种子芽的发生阶段及伸长阶段相互对应。上述结果均可推测,FmCUC1基因在水曲柳芽再生过程具有重要作用。

图6 FmCUC1 基因在下胚轴芽再生与种子萌发过程中的表达分析Fig.6 Expression analysis of FmCUC1 gene during hypocotyl bud regeneration and seed germination
2.6 FmCUC1 基因在激素信号下的表达模式
水曲柳在激素信号处理下,随着处理时间的延长,发生了明显的表达变化(图7),其中,在IAA 与BR 处理后,FmCUC1呈现升-降-升的表达模式;在处理1 h 与10 min 时显著上调,分别为对照的27.65 倍和11.38 倍,随后表达量逐渐下降;处理72 h 后表达量均达到峰值,分别为对照的45.72 倍和20.36 倍。在6-BA 处理后,FmCUC1的表达量亦呈现升-降-升的趋势,其中,在处理48 h 后达到最高值,为对照的59.40 倍。以上结果说明FmCUC1基因响应了IAA、6-BA、BR 的信号刺激。

图7 FmCUC1 基因在不同激素处理下的表达情况Fig.7 Expression of FmCUC1 gene under different hormone treatments
2.7 FmCUC1 基因表达载体构建、瞬时侵染水曲柳及相关基因表达情况分析
以SFmCUC1-F 和SFmCUC1-R 为引物,以测序正确的FmCUC1基因阳性克隆质粒为模板,成功构建植物表达载体pNC-Cam1304-SubC-FmCUC1(图8)。

图8 pNC-Cam1304-SubC-FmCUC1 表达载体结构图Fig.8 Structure of pNC-Cam1304-SubC-FmCUC1 expression vector
利用农杆菌介导的瞬时转化法,能够快速鉴定基因功能。FmCUC1瞬时过表达72 h 后(图9),基因表达量明显高于对照(FmCUC1基因相对表达量 > 1),FmCUC1的过表达显著上调了细胞分裂素信号转导通路关键基因STM与B 型ARR12的表达分别为对照的2.82 倍和1.42 倍,而ESR1则下调表达;相反生长素信号转导通路关键基因PLT3、PLT5基因均下调表达,可能是因为生长素与细胞分类素在植物体内的微变化才更有利于芽的分化。进一步验证了CUC1基因通过调控下游STM基因的表达进而促进顶端分生组织的建立。

图9 CUC1 基因通路相关基因表达情况Fig.9 Expression of genes related to CUC1 gene pathway
3 讨论
近年来,由于分子技术的发展使人们对植物再生的基本过程有了新的认识,再生相关基因功能已在模式植物中逐渐被验证[26]。本研究从水曲柳中克隆获得FmCUC1基因,该基因与同科植物木犀榄亲缘关系较近。蛋白序列分析发现,FmCUC1基因含有保守的NAC-domain 蛋白结构域与以往研究结果类似[11],这表明FmCUC1属于NAC 基因家族。已有研究报道,拟南芥AtCUC1定位于细胞核[9],亚细胞定位结果显示,FmCUC1基因定位于细胞核中,与上诉研究结果一致,表明FmCUC1可作为转录因子在细胞核中行使功能。FmCUC1基因在水曲柳3 年生盆栽苗的芽中表达量最高,这与刘超逸[27]研究结果类似;在水曲柳下胚轴芽再生过程中,进一步探究FmCUC1基因的表达模式,结果(图6A)显示其在芽点产生与丛枝形成期均上调表达。张佳薇等[23]关于水曲柳FmPHV基因克隆及在形成层愈伤组织中的表达分析研究中可知,芽再生过程中关键基因会出现2 次表达峰值的现象。本研究发现,FmCUC1基因在种子萌发的第4 天和第8 天分别达到2 个峰值,分别为第0 天的8.56 倍和8.46 倍,与上述结果类似。因此,推测FmCUC1基因在芽再生过程中发挥着重要作用。
植物的再生机制是一个复杂的调控网络,往往依赖植物激素间的相互作用[28]。研究表明[29],生长素与细胞分裂素可直接或者间接地加速植物再生过程。因此,探究了FmCUC1基因对生长素与细胞分裂素的响应模式,结果显示,在IAA 处理后,FmCUC1的表达水平与对照相比明显升高。研究表明[27,30],CUC1基因表达受PIN1(生长素输出运输蛋白)基因调控,促进SAM 的起始,参与其形态建成,可推测FmCUC1同样响应生长素信号,这与惠麦侠[6]在白菜中的研究结果一致。外源施加生长素与细胞分裂素可协同增强ESR1[31](芽再生中关键基因)表达,进而增强其下游基因CUC1的表达,促进芽再生[13]。本课题组发现,FmCUC1基因同样响应了6-BA 信号,推测在外源施加细胞分裂素同样可促进芽再生。此外,已有研究表明[32],低浓度BR 可诱导SAM 中CUC基因的表达,进而促进芽再生。本研究发现,在1 μmol·L-1BR 处理后,与对照相比FmCUC1的表达水平明显升高,与上述研究结果一致。可推测在水曲柳芽再生过程中添加少量BR,有利于茎端分生组织形成,提高不定芽分化。
CUC1基因受生长素、细胞分裂素信号转导通路中多个关键基因调控[29],共同促进植物的芽再生能力。生长素通路中的PLT3、PLT5和PLT7三个转录因子可激活下游芽再生特征因子CUC1和CUC2的表达,进而促进植物具有再生出芽能力[13]。WUS突变体可使植物丧失芽再生能力,表明WUS同样是芽再生的关键调节因子,而WUS的表达又受细胞分裂素信号途径关键因子B 型ARR的调控,ARR基因可直接结合到WUS启动子区域激活其表达,进而影响植物的芽再生能力[33-35],随着研究的深入,发现WUS与STM基因的缺失均会影响SAM的形成[34]。在拟南芥中,CUC1和CUC2基因在SAM 形成过程中冗余地发挥作用,CUC1与CUC2基因双突变体才会导致幼苗缺失SAM,进而表现出杯状子叶[11]。Wang 等[7]关于水稻CUC1基因研究表明,OsCUC1与OsCUC3基因对于维持SAM活性起到关键作用,当OsCUC1与OsCUC3基因功能缺失时,会导致水稻停止生长最终在苗期死亡。STM基因在SAM 表达较高,可调控SAM 中的干细胞活性[28],激活细胞分裂素途径相关基因表达,进而影响植物生长[36]。研究表明[6],CUC1可促进下游STM基因在SAM 中表达,起始SAM。本研究发现,在水曲柳中过表达CUC1基因,其下游STM的表达上调,说明FmCUC1基因可能通过调控下游STM基因的表达,进而促进顶端分生组织的建立,影响芽再生能力。因此,可能正是由于生长素与细胞分类素在植物体内的这种微变化才会更有利于芽的分化。
4 结论
综上所诉,FmCUC1基因属于NAC 家族转录因子,参与水曲柳芽再生过程,响应了IAA、6-BA、BR 植物激素信号诱导,在水曲柳植株中过表达FmCUC1能促进其下游STM基因的表达显著上调,进而促进芽再生。本研究可为进一步研究CUC1基因在水曲柳芽再生过程中的作用机制奠定基础,但其具体分子机制及调控网络有待进一步深入分析。
