红鳍东方鲀(Takifugu rubripes)耐低温相关微卫星标记的初步筛选
2022-03-23袁晨浩刘志峰马爱军
袁晨浩, 刘志峰, 马爱军
红鳍东方鲀()耐低温相关微卫星标记的初步筛选
袁晨浩1, 3, 刘志峰2, 3, 马爱军2, 3
(1. 浙江海洋大学, 浙江 舟山 316000; 2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室, 山东 青岛 266071; 3. 青岛海洋科学与技术试点国家实验室海洋生物学与生物技术功能实验室, 山东 青岛 266237)
采用微卫星结合混合群体分离分析法技术(SSR-BSA)对红鳍东方鲀群体进行耐低温相关微卫星标记的筛选。首先对300尾红鳍东方鲀幼鱼进行低温处理, 分别获得34尾耐低温(S组)和不耐低温个体(D组)。分别在两组中随机挑选15尾提取基因组DNA, 构建耐低温和不耐低温DNA混池, 然后用148对微卫星引物对其进行扫描。结果发现4个标记(fms45、fms82、fms100和fms182)在耐低温和不耐低温DNA混池中扩增出差异条带。用S组和D组全部个体对4个标记进行单个体验证, 结果显示由fms100扩增, 携带有116 bp条带的个体在S组和D组的出现频率分别是53%和18%, 132 bp条带的出现频率分别是59%(S组)、24%(D组); 由fms182扩增, 携带有125 bp的个体在S组和D组出现的频率分别是12%和35%, 经卡方检验值均小于0.05, 差异显著。本文关于红鳍东方鲀耐低温分子标记的报道, 为研究红鳍东方鲀耐低温的遗传基础以及相关分子机制提供了依据, 也为开展红鳍东方鲀耐低温分子标记辅助选育提供了良好的基础。
红鳍东方鲀; 耐低温; 微卫星标记; SSR-BSA
红鳍东方鲀()是一种重要的海水养殖鱼类, 隶属于鲀形目(Telraodontiformes)、鲀科(Tetradontidae)、东方鲀属(), 是暖温性、广盐性底栖肉食性鱼类, 主要分布在日本沿海, 在朝鲜半岛、俄罗斯也有分布, 中国自然数量主要分布在黄海、渤海和东海, 是我国北方海水养殖和出口创汇的重要鱼类。其适宜生长温度为16~25 ℃, 过低的温度会造成生长性能的下降甚至死亡现象[1], 然而在我国北方养殖红鳍东方鲀时, 陆海接力以及越冬过程必然会遇到温度降低的状况, 另外使用加热提高水温的方式也会遇到成本升高和环保压力等问题, 因此通过选育具有耐寒性状的品系可减少因温度降低而造成的经济损失。
水产动物耐温品种的选育工作已取得一定的进展, 在大菱鲆、暗纹东方鲀、中国明对虾、凡纳滨对虾、刺参以及大黄鱼都有相关的研究[2-7], 针对耐温性状, 目前的选育方式多采用传统群体选育和家系选育等方式。分子标记辅助育种(molecular marker- assisted breeding, MAS)是借助与性状紧密相关的分子标记对具有性状优势的等位基因或基因型的个体进行直接选择育种, 是分子生物学和基因组学的研究结果应用到水产养殖品种选育的技术。分子标记技术作为一种常规辅助选育手段具有选择强度大、准确率高、遗传稳定的特点[8], 在水产、畜牧、作物等很多领域得到广泛应用[9-11]。在常见的分子标记技术中, 微卫星分子标记(simple sequence repeats, SSR)作为分析与重要经济性状的遗传连锁关系理想的分子标记, 已经被广泛应用于水产动物的育种[12-14]。
目前关于红鳍东方鲀分子标记的研究多涉及遗传评估与系谱认证[15], 有关红鳍东方鲀耐低温相关的微卫星分子标记的研究在国内尚未报道。本研究采用SSR结合混合群体分离分析法(bulked segregant analysis) 技术, 筛选与耐低温性状相关的分子标记, 以期为红鳍东方鲀经济性状的间接选择提供参考数据, 为培育红鳍东方鲀耐低温品种奠定基础。
1 材料与方法
1.1 实验材料
实验所用的红鳍东方鲀样品来自大连天正实业有限公司, 在室内养殖池中挑选300尾体格健壮、无损伤、活力好的幼鱼, 体长(15.1±0.5) cm, 体重(150±9) g, 于6个实验桶(2 000 L)中暂养, 暂养2周, 水温(23±0.5) ℃, 同暂养前保持一致, 使用加热棒维持温度。该群体已在本课题组进行过遗传多样性分析, 其期望杂合度(Excepted heterozygosity,e)大于0.7, 遗传多样性丰富。
1.2 实验设计
暂养结束后, 通过自然海水流水(水温5 ℃)降温的方式, 每天降温3 ℃, 持续降温6 d (23 ℃, 20 ℃, 17 ℃, 14 ℃, 11 ℃, 8 ℃, 5 ℃), 最终达到5 ℃后维持。在降温期间每隔20 min观察实验鱼的状态, 发现濒死鱼及时取出, 剪尾鳍置于无水乙醇后冻于−40 ℃冰箱中备用。在温度降至8 ℃后陆续有死鱼出现, 在温度维持5 ℃经2 d后, 死亡数量达到50% (150尾)时停止实验, 存活个体剪尾鳍置于无水乙醇后冻于−40 ℃冰箱中备用。在死亡个体中选取最早死亡的34尾幼鱼记为不耐低温组(D组), 在存活个体中选取34尾状态活跃的幼鱼记为耐低温组(S组)。
1.3 微卫星引物
根据Takagi等[16]和古川聡史[17]报道的红鳍东方鲀微卫星位点, 选取148个能够覆盖整个微卫星图谱的位点, 根据其侧翼保守序列设计引物, 由上海生工公司合成。
1.4 基因组DNA制备
利用天根生化科技(北京)有限公司生产的海洋动物DNA提取试剂盒, 提取红鳍东方鲀S组和D组的尾鳍DNA。采用1%琼脂糖凝胶电泳测定提取DNA的质量及完整性, 采用紫外分光光度计进行浓度测定, 最后用双蒸水稀释至质量浓度为5×10–2g/L左右, 保存于−40 ℃冰箱。
1.5 BSA基因池的建立
从D组选取最先开始死亡的15个个体和S组选取更具活力的15个个体, 每个个体取等量5 μL DNA溶液, 分别构成耐低温DNA池和不耐低温DNA池。
1.6 PCR扩增和聚丙烯酰胺凝胶电泳
利用148对微卫星引物分别对耐低温DNA池和不耐低温DNA池进行PCR扩增, 寻找差异条带。PCR反应体系为20 μL: 1 μL DNA溶液, 1 μL上游引物, 1 μL下游引物, 10 μL 2 × Taq PCR Mix, 7 μL灭菌双蒸水。PCR扩增反应条件: 94 ℃预变性10min; 94 ℃变性5 s, 按每对引物实际退火温度反应50 s, 72 ℃延伸50 s, 共35个循环; 72 ℃延伸10 min。在扩增出来的20 μL产物中加入5 μL 6 × LoadingBuffer, 95 ℃ 5 min, 立即冰浴10 min。产物在5%的非变性聚丙烯酰胺凝胶(30%丙烯酰胺预混液83.3 mL、尿素 210.2 g、10 × TBE 50 mL, 加蒸馏水定容至500 mL), 上样量4 μL, 恒压100 V, 电泳6 h。电泳结束后, 采用银染法(4 g硝酸银, 2 000 mL蒸馏水)对PAGE胶进行摇床染色10 min, 用双蒸水冲洗1 min, 减少背景色, 用显影液(30 g 氢氧化钠, 4 mL甲醛, 2 000 mL蒸馏水)进行摇床显影, 待出现浅色条带, 立即停止显色并用大量双蒸水冲洗1 min, 然后立即在白光下进行拍照保存电泳结果。
1.7 差异条带个体验证
通过2个混池DNA的PCR扩增情况, 初步筛选出能在2个池中能扩增出差异等位基因片段的微卫星位点, 按照上述PCR扩增反应条件对所有68个红鳍东方鲀DNA样本进行PCR扩增, 分析差异等位基因片段在个体上具体的扩增情况。
1.8 数据分析
通过Bandscan软件对电泳结果进行分析, 获取差异条带的分布情况、碱基数以及泳动位置。用SPSS 18.0软件对微卫星引物在S组、D组个体中所扩增出的差异条带频率进行卡方检验, 若卡方检验< 0.05 就认为这个条带在红鳍东方鲀耐、不耐低温个体中分布差异显著。
2 实验结果
2.1 BSA分池PCR扩增结果分析
用148对微卫星引物对所构建的耐低温和不耐低温DNA池进行PCR扩增, 扩增产物用1%琼脂糖凝胶电泳检测, 均能发现扩增产物。对扩增产物用5%聚丙烯酰胺凝胶电泳并银染, 有4个微卫星位点(fms45、fms82、fms100和fms182)在S组、D组基因池间扩增出差异条带(图1)。使用Bandscan软件计算出了差异条带碱基数, 其中位点fms45的差异条带碱基数为125 bp和137 bp, 位点fms82差异条带碱基数为98 bp和102 bp, 位点fms100差异条带碱基数为116 bp和132 bp, 位点fms182差异条带碱基数为125 bp。
2.2 差异条带在个体中的扩增验证
针对上述4个微卫星位点, 在所有68个红鳍东方鲀DNA样本(包括混池样本)进行PCR扩增, 分析差异等位基因片段在个体上具体的扩增情况。4个微卫星位点在红鳍东方鲀验证的个体扩增情况如图2—图5, 经卡方检验, 只有引物fms100和fms182的扩增结果具有显著差异, fms100扩增的116 bp和132 bp 的值分别为0.001和0.003, fms182扩增的125 bp条带的值为0.045(图6)。

图1 微卫星位点fms45、fms82、fms100、fms182在耐低温和不耐低温基因池扩增情况
注: M: 50 bp Marker; S: 耐低温基因池; D: 不耐低温基因池

图2 微卫星位点fms100的个体扩增验证情况
注: M: 50 bp Marker; S: 耐低温基因池; D: 不耐低温基因池
3 讨论
红鳍东方鲀是我国重要的经济鱼类, 由于其不耐低温的特点, 目前北方多采用室外池塘和网箱养殖结合室内池塘越冬的方式, 而越冬的成本偏高制约了红鳍东方鲀产业的发展, 因此红鳍东方鲀抗寒选育的需求愈发强烈。分子标记辅助育种是借助与性状紧密相关的分子标记对具有性状优势的等位基因或基因型的个体进行直接选择育种, 是分子生物学和基因组学的研究结果应用到水产养殖品种选育的技术[8-11], 与传统的表现型选择相比, 不受等位基因间的显隐性关系、其他基因效应和环境因素的影响, 选择结果可靠, 能够提高选择效率缩短育种年限, 克服了很多常规育种方法中的困难。

图3 微卫星位点fms45的个体扩增验证情况
注: M: 50 bp Marker; S: 耐低温基因池; D: 不耐低温基因池

图4 微卫星位点fms82的个体扩增验证情况
注: M: 50 bp Marker; S: 耐低温基因池; D: 不耐低温基因池

图5 微卫星位点fms182的个体扩增验证情况
注: M: 50 bp Marker; S: 耐低温基因池; D: 不耐低温基因池
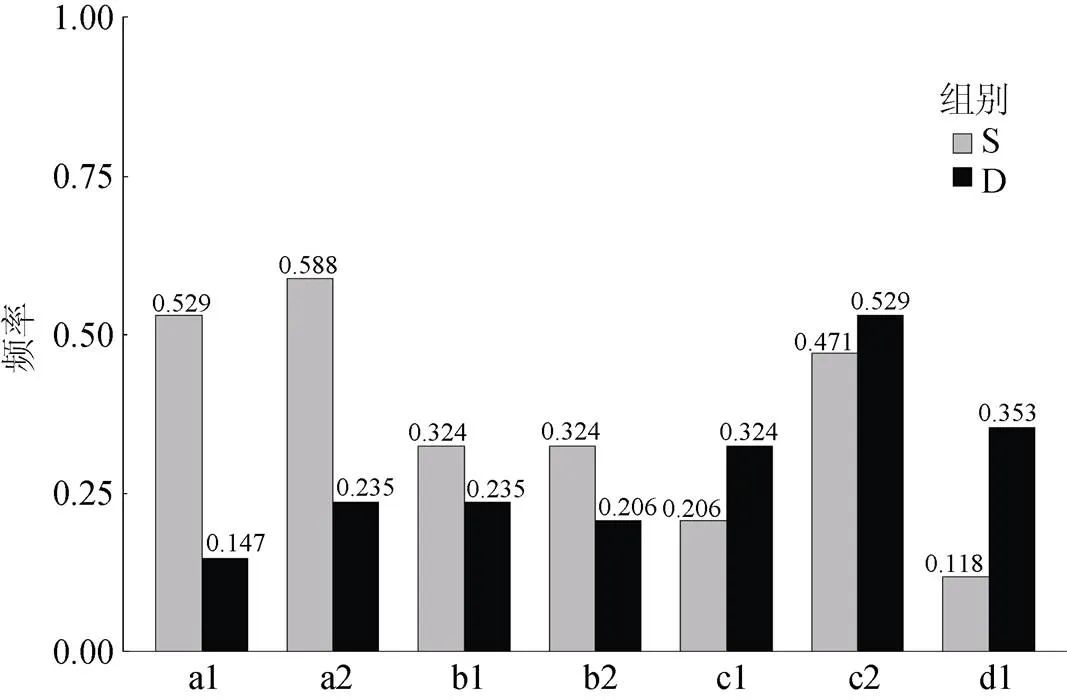
图6 差异条带在多个体验证中的出现频率统计
注: a1, a2分别为由fms100扩增的116 bp和132 bp条带统计情况; b1, b2分别为由fms45扩增的125 bp和137 bp条带统计情况; c1, c2分别为由fms82扩增的98 bp和102 bp条带的统计情况; d1为由fms182扩增125b p条带统计情况; S, D分别为耐低温基因池和不耐低温基因池
SSR分子标记作为分析与重要经济性状的遗传连锁关系理想的分子标记, 在水产动物的育种方面也得到了广泛的应用[18-19]。李彩娟等[20]基于第二代测序技术对大鳞副泥鳅转录组数据进行分析获得了15 106 个核心序列大于 12 bp 的 SSR, 并随从中机选取400对SSR标记, 91%有扩增产物。于洋等[21]使用微卫星和线粒体控制区标记用来对凡纳滨对虾新品种进行鉴定, 准确率达到了89%。关于红鳍东方鲀SSR的研究也有部分报道, 多集中在筛选性别差异标记和分析遗传多样性方面[22-23]。本研究针对红鳍东方鲀耐低温性状, 筛选与之显著相关的SSR分子标记, 以期为后期的耐低温选育工作提供科学的依据。
为了更好地获得与红鳍东方鲀耐低温显著相关的SSR分子标记, 本研究根据Takagi等[16]和古川聡史[17]的报道, 选取了148个微卫星标记进行筛选, 这些标记能够完全覆盖红鳍东方鲀微卫星连锁图谱的23个连锁群, 目前已有的相关研究大多涉及的标记量较少或者缺少染色体的覆盖信息[24-26], 而本研究中使用大量的覆盖所有连锁群的SSR标记进行筛选, 能够使标记的筛选工作更加细致全面, 更大概率获得显著性相关标记。另一方面, 这样的筛选方式也导致标记数量较多, 若按照普通的微卫星标记筛选方案逐一进行验证, 工作量会非常大, 耗时耗力。而分群分离分析法BSA的运用大大减少了聚丙烯酰胺凝胶电泳的重复过程, 有效减少了工作量, 提升了工作效率。BSA是Michelmore等针对SSR标记技术开发了分群分析法, 它首先利用具有表型差异的分离群体构建具有目标性状差异的DNA池, 然后选择合适的分子标记对两DNA池进行目标标记的筛选, 最后用该分子标记进行单个体验证[27]。此方法具有效率高、耗费少等优点, 被广泛应用于相关标记的筛选[27]。在作物培育领域, 陈艳萍[28]等利用SSR-BSA技术筛选出2个可能与玉米粗缩病抗性相关的分子标记。高轶静[29]等利用高抗和感病亲本杂交的后代群体为材料, 采用SSR-BSA技术筛选出一个与甘蔗抗黑穗病性基因连锁的SSR标记。在鱼类选育方面, 黄智慧等[30]采用SSR-BSA技术分析大菱鲆()耐高温相关特性, 发现了3个与大菱鲆耐高温性状存在负相关性微卫星位点, 并将获得的两个分子标记 Sam-Usc27和saml-125INRA用于构建耐大菱鲆品系, 显著提高了大菱鲆整体的耐温性能。邹杰等[31]采用SSR-BSA技术对暗纹东方鲀生长性状相关微卫星标记进行筛选, 经验证实验后获得与生长性状显著相关的fms15、fms75两个位点。
在我们的实验结果中发现, 通过对148个微卫星位点在耐低温和不耐低温DNA池中的差异分析, 只有4个SSR标记出现差异, 但进一步的个体验证后, 仅有2个标记出现统计学差异。这可能是由于我们选择的群体来自养殖群体, 并非家系群体, 个体遗传背景不同, 遗传差异较大。一般说来遗传背景单一的群体更容易获得性状相关的分子标记, 这一点在很多鱼类的家系内分子标记筛选中有所体现, 但筛选到的标记往往是家系内特异的, 并不具有广泛的适用性。本实验选用的群体来自养殖群体, 遗传多态性分析发现, 其e大于0.7, 遗传多样性丰富。从遗传差异较大的群体中筛选得到的分子标记具有更广泛的适用性, 也就意味着本实验筛选到的标记可能具有更大的育种潜力。
综上, 本研究采用SSR-BSA技术, 初步获得了两个与红鳍东方鲀耐低温相关的分子标记。这是国内第一次关于红鳍东方鲀耐低温分子标记的报道, 这为研究红鳍东方鲀耐低温的遗传基础以及相关分子机制提供了依据, 也为开展红鳍东方鲀耐低温分子标记辅助选育提供了良好的基础。
[1] 刘永新, 周勤, 张红涛, 等. 温度对红鳍东方鲀早期生长和性别分化的影响[J]. 南方水产科学, 2014, 10(5): 9-24.
LIU Yongxin, ZHOU Qin, ZHANG Hongtao, et al. Effect of temperature on growth and sex differentiation at early developmental stage of redfin puffer ()[J]. South China Fisheries Science, 2014, 10(5): 9-24.
[2] 闫兵兵, 陈义培, 卢玉平, 等. 暗纹东方纯“中洋1号”新品种育种技术[J]. 科学养鱼, 2019(7): 6-7.
YAN Bingbing, CHEN Yipei, LU Yuping, et al. Breeding technique of puffer fish new variety “Zhongyang No 1”[J]. Scientific Fish Farming, 2019(7): 6-7.
[3] 马爱军, 黄智慧, 王新安, 等. 大菱鲆()耐高温品系选育及耐温性能评估[J]. 海洋与湖沼, 2012, 43(4): 797-804.
MA Aijun, HUANG Zhihui, WANG Xinan, et al. The selective breeding of thermal tolerance family and appraisal of performance in turbot ()[J]. Oceanologia et Limnologia Sinica, 2012, 43(4): 797-804.
[4] 赵欢, 刘石林, 杨红生, 等. 刺参高温定向选育群体子一代耐温性状的分析[J]. 海洋科学, 2014, 38(9): 1-6.
ZHAO Huan, LIU Shilin, YANG Hongsheng, et al. The study on thermo tolerance of juvenile offspring(Selenka) with directive breeding[J]. Marine Sciences, 2014, 38(9): 1-6.
[5] 胡志国, 刘建勇, 袁瑞鹏, 等. 3个凡纳滨对虾引进群体对温度和盐度耐受力的配合力分析[J]. 海洋科学, 2016, 40(1): 25-31.
HU Zhiguo, LIU Jianyong, YUAN Ruipeng, et al. Analysis of combining ability of survival of importedpopulations under temperature and salinity stress[J]. Marine Science, 2016, 40(1): 25-31.
[6] 王明珠, 孟宪红, 孔杰, 等. 低温胁迫条件下中国明对虾生长性状和耐低温性状的遗传参数评估[J]. 渔业科学进展, 2018, 39(3): 96-102.
WANG Mingzhu, MENG Xianihong, KONG Jie, et al. Evaluation of genetic parameters for growth and cold tolerance traits inunder low- temperature stress[J].Progress in Fishery Sciences, 2018, 39(3): 96-102.
[7] 苗亮, 李明云, 陈炯, 等. 快长耐低温大黄鱼新品种东海1号的选育[J]. 农业生物技术学报, 2014, 22(10): 1314-1320.
MIAO Liang, LI Mingyun, CHEN Jiong, et al. Breeding of fast growth and low temperature tolerance of new variety Donghai No.1 large yellow croaker ()[J]. Journal of Agricultural Biotechnology, 2014, 22(10): 1314-1320.
[8] 鲁绍雄, 吴常信. 动物遗传标记辅助选择研究及其应用[J]. 遗传, 2002, 24(3): 359-362.
LU Shaoxiong, WU Changxin. Research and application of animal genetic marker-assisted selection[J]. Hereditas, 2002, 24(3): 359-362.
[9] 鲁翠云, 匡友谊, 郑先虎, 等. 水产动物分子标记辅助育种研究进展[J]. 水产学报, 2019, 43(1): 38-55.
LU Cuiyun, KUANG Youyi, ZHENG Xianhu, et al. Advances in molecular marker-assisted breeding of aquatic animals[J]. Journal of Fisheries of China, 2019, 43(1): 38-55.
[10] 曹立勇, 占小登, 庄杰云, 等. 利用分子标记辅助育种技术育成优质高产抗病杂交稻国稻1号[J]. 杂交水稻, 2005, 20(3): 8-16.
CAO Liyong, ZHAN Xiaodeng, ZHUANG Jieyun, et al. Breeding of indica hybrid rice Guodao 1 with good quality, high yield and resistance to bacterial leaf blight by marker-assisted selection technique[J]. Hybrid Rice, 2005, 20(3): 8-16.
[11] 张建军, 薛科邦, 何茂昌, 等. 动物分子标记辅助QTL育种及育种进程[J]. 中国畜禽种业, 2014(12): 57.
ZHANG Jianjun, XUE Kebang, HE Maochang, et al. Animal molecular marker assisted QTL breeding and breeding process[J]. The Chinese Livestock and Poultry Breeding, 2014(12): 57.
[12] 安泉泉, 刘海金, 王桂兴, 等. 牙鲆骨骼生长性状与微卫星标记的相关性分析[J]. 水产学报, 2012, 36(5): 641-646.
AN Quanquan, LIU Haijin, WANG Guixing, et al. Correlation analysis of microsatellite DNA markers with skeletal growth traits of Japanese flounder ()[J]. Journal of Fisheries of China, 2012, 36(5): 641-646.
[13] 邵艳卿, 方军, 田野, 等. 泥蚶生长性状与SSR标记的相关性[J]. 水产学报, 2020, 44(5): 827-835.
SHAO Yanqing, FANG Jun, TIAN Ye, et al. Correlation analysis of SSR markers with growth-related traits of mud clam ()[J]. Journal of Fisheries of China, 2020, 44(5): 827-835.
[14] 刘永新, 刘奕, 周勤, 等. 利用微卫星标记指导红鳍东方鲀亲本选配[J]. 大连海洋大学学报, 2015, 30(2): 113-119.
LIU Yongxin, LIU Yi, ZHOU Qin, et al. Application of microsatellite markers in parental apolegamy of redfin puffer[J]. Journal of Dalian Ocean University, 2015, 30(2): 113-119.
[15] 刘永新, 周勤, 张红涛, 等. 基于标记系谱的红鳍东方鲀生长性状遗传分析[J]. 水产学报, 2017, 41(1): 21-30.
LIU Yongxin, ZHOU Qin, ZHANG Hongtao, et al. Genetic analysis of redfin puffer () for growth traits by using a marker-based pedigree[J]. Journal of Fisheries of China, 2017, 41(1): 21-30.
[16] TAKAGI M, SATO J, MONBAYASHI C, et al. Evaluation of microsatellites identified in the tiger pufferDNA database[J]. Fisheries Science, 2003, 69(6): 1085-1095.
[17] 古川聡史.トラフグの高成長に関する遺伝学的および分子生物学的研究[D]. 东京: 东京大学, 2009.
FURUKAWA Satoshi. Genetic and molecular biological studies on the high growth of tiger puffer[D]. Tokyo: The University of Tokyo, 2009.
[18] LU X, WANG H X, LIU B Z, et al. Three EST-SSR markers associated with QTL for the growth of the clamrevealed by selective genotyping[J]. Marine Biotechnology, 2013, 15(1): 16-25.
[19] QIU Y, LU H, ZHU J T, et al. Characterization of novel EST-SSR markers and their correlations with growth and nacreous secretion traits in the pearl oyster(Dunker)[J]. Aquaculture, 2014, 420/421(S1): 92-97.
[20] 李彩娟. 基于第二代测序的大鳞副泥鳅微卫星分子标记的开发与应用[D]. 苏州: 苏州大学, 2014.
LI Caijuan. Development and application of microsatellite molecular markers forbased on second generation sequencing[D]. Suzhou: Soochow University, 2014.
[21] 于洋. 凡纳滨对虾分子标记的开发及其在遗传育种中的应用[D]. 北京: 中国科学院大学, 2014.
YU Yang. Development of molecular markers and their applications in selective breeding of the Pacific white shrimp,[D]. Beijing: University of Chinese Academy of Sciences, 2014.
[22] 岳亮, 马爱军, 赵艳飞, 等. 红鳍东方鲀()性别差异微卫星标记的筛选[J]. 海洋与湖沼, 2014, 45(1): 172-177.
YUE Liang, MA Aijun, ZHAO Yanfei, et al. Screening of microsatellites gender-indicative markers of[J]. Oceanologia et Limnologia Sinica, 2014, 45(1): 172-177.
[23] 陆丽君, 马爱军, 王新安, 等. 5个红鳍东方鲀养殖群体微卫星DNA遗传多态性分析[J]. 渔业科学进展, 2013, 34(4): 27-33.
LU Lijun, MA Aijun, WANG Xinan, et al. Polymorphisms analysis of five populations ofwith microsatellite[J]. Progress in Fishery Sciences, 2013, 34(4): 27-33.
[24] 马爱军, 许可, 黄智慧, 等. 大菱鲆与耐高温性状相关的微卫星标记筛选[J]. 海洋科学进展, 2011, 29(3): 370-378.
MA Aijun, XU Ke, HUANG Zhihui, et al. Screening of microsatellite molecular marker associated with heat- resistance of turbot (L.)[J]. Advances in Marine Science, 2011, 29(3): 370-378.
[25] 刘改艳, 陈昆慈, 郑光明, 等. SSR-BSA技术对乌鳢性别差异标记的初步筛选[J]. 水产学报, 2011(2): 170- 175.
LIU Gaiyan, CHEN Kunci, ZHENG Guangming, et al. Screening and identification of female-specific DNA fragments inusing SSR-BSA[J]. Journal of Fisheries of China, 2011(2): 170-175.
[26] 卢钟磊, 池信才, 王义权, 等. 褐牙鲆耐热性状相关的微卫星分子标记筛选[J]. 厦门大学学报(自然科学版), 2007(3): 106-112.
LU Zhonglei, CHI Xincai, WANG Yiquan, et al. The screening of microsatellites molecular markers with correlationship to heat-resistance of[J]. Journal of Xiamen University(Natural Science), 2007(3): 106-112.
[27] MICHELMORE R W, PARAN I, KESSELI R V. Identification of markers linked to disease-resistance genes by bulked segregant analysis: a rapid method to detect markers in specific genomic regions by using segregating populations[J]. Proceedings of the National Academy of Sciences, 1991, 88(21): 9828-9832.
[28] 陈艳萍, 孟庆长, 袁建华. 利用SSR-BSA技术筛选玉米粗缩病抗性基因分子标记[J]. 江苏农业学报, 2008(5): 590-594.
CHEN Yanping, MENG Qingchang, YUAN Jianhua. Identification of the molecular markers linked to the MRDV- resistance locus in maize using SSR-BSA technique[J]. Jiangsu Journal of Agricultural Sciences, 2008(5): 590- 594.
[29] 高轶静, 张荣华, 张革民, 等. 与甘蔗抗黑穗病基因连锁的SSR标记筛选[J]. 热带作物学报, 2013, 34(11): 2222-2226.
GAO Yijing, ZHANG Ronghua, ZHANG Gemin, et al. Screening of SSR marker linked to smut resistance gene in sugarcane[J]. Chinese Journal of Tropical Crops, 2013, 34(11): 2222-2226.
[30] 黄智慧. 大菱鲆耐高温性状选育及遗传机理研究[D]. 青岛: 中国海洋大学, 2014.
HUANG Zhihui. Studeis on thermal tolerance breeding and genetic mechanism research on turbot ()[D]. Qingdao: Ocean University of China, 2014.
[31] 邹杰. 暗纹东方鲀养殖群体遗传多样性分析及生长性状微卫星标记筛选[D]. 上海: 上海海洋大学, 2014.
ZOU Jie. Studying genetic structure among cultured populations and screening growth-related DNA markers in[D]. Shanghai: Shanghai Ocean University, 2014.
Screening and identification of microsatellite markers related to low temperature tolerance in
YUAN Chen-hao1, 3, LIU Zhi-feng2, 3, MA Ai-jun2, 3
(1. Zhejiang Ocean University, Zhoushan 316000, China; 2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China; 3. Laboratory for Marine Biology and BiotechnologyPilot National Laboratory for Marine Science and Technology (Qingdao),Qingdao 266237China)
Microsatellites, combined with bulked segregation analysis (BSA), were used to screen for markers of low temperature tolerance in. A total of 68 individuals comprising 34 individuals from the low temperature tolerant group (S group) and 34 from the non-tolerant group (D group) were used in this study. Two DNA pools were constructed using 15 individuals each from the S and the D groups. The DNA pools were screened for low temperature tolerance markers using 148 pairs of microsatellite primers. Four primers pairs (fms45, fms82, fms100, and fms182) amplified differential bands in the S and the D groups. All 68 individuals were used to perform a single experience certificate for 4 markers. The results showed that the frequencies of the 116bp band from the fms100 primer in the S and the D groups were 53% and 18%, respectively The frequencies of the 132bp band from the fms100 primer were 59% (S Group) and 24% (D Group). The frequencies of the 125bp band from the fms182 primer in the S and the D groups were 12% and 35%, respectively. All p values from the chi-square test were 0.05, indicating significant differences among the band frequencies. This is the first report on molecular markers of low temperature tolerance in, which provides a baseline for (1) studying the genetic basis and related molecular mechanisms of low temperature tolerance inand (2) molecular marker–assisted breeding of the species.
; low temperature tolerance; microsatellite markers; SSR-BSA
Sep. 18, 2020
S917.4
A
1000-3096(2022)02-0097-08
10.11759/hykx20200918001
2020-09-18;
2020-10-30
国家重点研发计划子课题-红鳍东方鲀耐低温的遗传基础(2018YFD0900301-12);中国水产科学研究院科技创新团队(2020TD25)
[The Key Research and Development Plan of Nation, Genetic basis of low temperature tolerance in, No. 2018YFD0900301-12; The Central Public-interest Scientific Institution Basal Research Fund, CAFS, No. 2020TD25]
袁晨浩(1995—), 男, 浙江绍兴人, 学士, 研究方向为鱼类遗传育种, 电话: 18868018166, E-mail: 625029259@qq.com; 马爱军(1971—),通信作者, 研究方为鱼类种质创制与遗传改良, E-mail: maaj@ysfri.ac.cn; 刘志峰(1987—), 通信作者, 博士, 研究方向为鱼类繁育与育种, E-mail: liuzf@ysfri.ac.cn
(本文编辑: 杨 悦)
