毛萼乙素调控lncRNA CPS1-IT1表达抑制膀胱癌T24细胞增殖、迁移、侵袭的机制研究
2022-03-22熊涛王慧黄梦婷陈铮锐
熊涛 王慧 黄梦婷 陈铮锐
膀胱癌是与泌尿生殖道癌症相关死亡的主要原因,也是男性治疗中最昂贵的恶性肿瘤[1]。外科手术、放射疗法和化学疗法是膀胱癌患者的主要治疗方法[2]。然而,这些推荐疗法的治疗效果仍然有限,并且在过去的几十年中,膀胱癌患者的5年总生存率一直处于较低水平,死亡率并未发生明显变化[3]。因此,迫切需要早期诊断标记和新的治疗策略来治疗膀胱癌。毛萼乙素(Eriocalyxin)是从传统中草药毛萼香茶菜(Isodon eriocalyx)提取的对映体-月桂烯二萜类化合物,具有多种功能,如抗癌和抗炎[4]。研究表明,毛萼乙素可抑制宫颈癌细胞C-33A的增殖[5],降低乳腺癌细胞的生存能力,诱导细胞凋亡[6]。毛萼乙素可通过升高促凋亡蛋白Bcl-2相关X蛋白(Bcl-2 Associated X Protein,Bax)的表达,促进肝癌细胞HepG2的凋亡,从而抑制其增殖[7]。长链非编码RNA(long noncoding RNA,lncRNA)氨甲酰磷酸合成酶1-内含子转录本1(carbamoyl-phosphate synthase 1 intronic transcript 1,CPS1-IT1)在上皮性卵巢癌组织和细胞中下调表达,过表达lncRNA CPS1-IT1可促进卵巢癌细胞的增殖,诱导细胞凋亡[8]。lncRNA CPS1-IT1在肺癌组织中低表达,过表达lncRNA CPS1-IT1抑制肺癌细胞的增殖和侵袭[9]。lncRNA CPS1-IT1在结直肠癌组织和细胞中下调表达,可抑制结直肠癌细胞的增殖、迁移和侵袭,促进细胞凋亡[10]。但毛萼乙素和lncRNA CPS1-IT1对膀胱癌T24细胞增殖、迁移和侵袭的影响,且毛萼乙素是否通过调控lncRNA CPS1-IT1的表达影响膀胱癌T24细胞的增殖、迁移和侵袭能力,目前仍然未知。本研究探讨毛萼乙素在膀胱癌细胞增殖和转移行为中的作用,并结合lncRNA CPS1-IT1评估其在膀胱癌中的生物学调控机制。
1 材料与方法
1.1 材料 膀胱癌细胞株T24(美国典型培养物保藏中心ATCC),毛萼乙素、二甲基亚砜(Dimethyl sulphoxide,DMSO)(上海源叶生物),lncRNA DNA-CPS1-IT1过表达质粒pcDNA-CPS1-IT1、空载质粒pcDNA、LipofectamineTM2000(美国Invitrogen),针对lncRNA DNA-CPS1-IT1小干扰RNA si-CPS1-IT1、其阴性对照si-NC、Dulbecco’s Modified Eagle’s Medium(DMEM培养基)、TRIzol试剂(美国Thermo Fisher Scientific),PrimeScript RT、SYBR Premix ExTaq II试剂盒(北京Takara),四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)(上海Bio Basic),硝酸纤维素膜(英国Amersham Bioscience),ECL检测试剂(美国Millipore)。
1.2 细胞培养与处理 T24细胞在含有10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的DMEM培养基中培养,在5% CO2湿润的环境中于37℃孵育。在对数生长期的T24细胞中加入2.5 μmol/L、5 μmol/L、10 μmol/L浓度的毛萼乙素[7],分别记为ERB-L组、ERB-M组、ERB-H组。同时设立未给药的T24细胞为对照(Con组)。配制不同浓度的毛萼乙素时,以少量的DMSO助溶,以DMEM培养基稀释成2.5 μmol/L、5 μmol/L、10 μmol/L的浓度备用。
1.3 细胞转染与分组 在6孔板中培养T24细胞(1×106个/孔)以达到80%融合度,然后使用LipofectamineTM2000试剂用pcDNA、pcDNA-CPS1-IT1、si-NC、si-CPS1-IT1转染T24细胞,根据具体的说明进行操作。转染孵育24 h后,通过qRT-PCR分析转染效率,然后用于进一步的测定。其中,转染si-NC和si-CPS1-IT1的T24细胞加入10 μmol/L毛萼乙素作用24 h。转染后的T24细胞分别记为pcDNA组、pcDNA-CPS1-IT1组、ERB+si-NC组、ERB+si-CPS1-IT1组。
1.4 细胞增殖测定 使用MTT测定法测定T24细胞增殖抑制率。在96孔板中培养T24细胞,每孔约5×103个细胞,T24细胞粘附在培养皿壁上,根据1.2和1.3方法进行毛萼乙素或转染处理。孵育48 h后,在每个孔中将10 μl MTT(5 μg/ml)与培养基混合,再培养4 h形成甲瓒结晶,并再次溶于100 μl DMSO中。最后,使用BioTek自动酶标仪在490 nm处测量吸光度OD值,计算抑制率(%)。
1.5 免疫印迹法(Western blot) 将不同分组的T24细胞在200 μl RIPA裂解液中裂解,裂解液中含有蛋白酶抑制剂。然后,用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白质,转移到硝酸纤维素膜上,脱脂奶封闭后,将膜与抗细胞核相关抗原Ki-67(nuclear associated antigen Ki67,Ki-67),基质金属蛋白酶(matrix metalloproteases,MMP)-2,MMP-9和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)的一抗(均为1∶1 000稀释)孵育过夜。与二抗(为1∶2 000稀释)孵育后,化学发光信号使用ECL检测试剂可视化,GAPDH用作对照,ImageJ软件分析Ki-67、MMP-2和MMP-9蛋白表达。
1.6 细胞迁移、侵袭检测 通过Transwell测定法确定不同分组的T24细胞迁移和侵袭。在Transwell底部腔室中装入600 μl含10%胎牛血清的DMEM培养基。将T24细胞重悬于不含胎牛血清的培养基中,并将100 μl T24细胞(1×104)置于上腔室中。温育24 h后,将细胞用PBS洗涤3次,并用甲醇固定10 min,然后用结晶紫染色5 min。 通过计数穿过过滤器向腔室下表面迁移的细胞来量化细胞迁移。在显微镜下计算5个随机视野的平均值为迁移细胞数。为进行侵袭测定,将腔室的上表面在37℃的培养箱中用Matrigel预处理6 h。之后的步骤同迁移测定。
1.7 RNA分离和qRT-PCR 使用TRIzol试剂从膀胱癌T24细胞(2×106个)中提取总RNA。按照说明,使用带有gDNA Eraser的PrimeScript RT试剂盒,将每个RNA(1 μg)逆转录为互补DNA(cDNA)。之后,在ABI 7900实时PCR系统上使用SYBR Premix ExTaq II试剂盒进行PCR,以定量lncRNA CPS1-IT1的相对表达。GAPDH用作内部对照。2-ΔΔCt方法分析数据并计算lncRNA CPS1-IT1的相对表达。引物序列为lncRNA CPS1-IT1 正向5’-CAC AGA TGA TCC ACGCGCGTT-3’和反向5’-GCG TGC ATC AAT GAC ACT TCA-3’;GAPDH 正向5’-CGG AGT CAA CGG ATT TGG TCG TAT TGG-3’和反向5’-GCT CCT GGA AGA TGG TGA TGG GAT TTC C-3’。
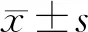
2 结果
2.1 毛萼乙素对膀胱癌T24细胞增殖的影响 MTT和Western blot检测结果显示,2.5 μmol/L、5 μmol/L、10 μmol/L浓度的毛萼乙素作用于膀胱癌T24细胞后,ERB-L组、ERB-M组、ERB-H组T24细胞的增殖抑制率均高于Con组,Ki-67蛋白表达量低于Con组(P<0.05);与ERB-L组比较,ERB-M组、ERB-H组T24细胞的增殖抑制率升高,Ki-67蛋白的表达量降低;ERB-H组较ERB-M组提高T24细胞的增殖抑制率,降低Ki-67蛋白的表达量,差异均有统计学意义(P<0.05)。见图1,表1。

图1 Ki-67蛋白表达

表1 毛萼乙素对膀胱癌T24细胞增殖的影响
2.2 毛萼乙素对膀胱癌T24细胞迁移、侵袭的影响 Transwell和Western blot检测结果显示,2.5 μmol/L、5 μmol/L、10 μmol/L浓度的毛萼乙素作用于膀胱癌T24细胞后,ERB-L组、ERB-M组、ERB-H组T24细胞的迁移、侵袭细胞数、MMP-2、MMP-9蛋白的表达量均低于Con组(P<0.05);与ERB-L组比较,ERB-M组、ERB-H组T24细胞的迁移、侵袭细胞数、MMP-2、MMP-9蛋白的表达量减少(P<0.05);ERB-H组较ERB-M组降低T24细胞的迁移、侵袭细胞数、MMP-2、MMP-9蛋白的表达量(P<0.05)。见图2,表2。
图2 迁移侵袭相关蛋白表达

表2 毛萼乙素对膀胱癌T24细胞迁移、侵袭的影响
2.3 毛萼乙素对膀胱癌T24细胞中lncRNA CPS1-IT1表达的影响 qRT-PCR检测结果显示,ERB-L组、ERB-M组、ERB-H组T24细胞中lncRNA CPS1-IT1表达量均高于Con组(P<0.05);与ERB-L组比较,ERB-M组、ERB-H组T24细胞的lncRNA CPS1-IT1表达量增加(P<0.05);ERB-H组较ERB-M组提高T24细胞内lncRNA CPS1-IT1表达量,差异均有统计学意义(P<0.05)。见表3。

表3 毛萼乙素对膀胱癌T24细胞中lncRNA CPS1-IT1表达的影响
2.4 lncRNA CPS1-IT1过表达对膀胱癌T24细胞增殖、迁移侵袭的影响 qRT-PCR检测转染pcDNA-CPS1-IT1后的效率,发现pcDNA-CPS1-IT1组T24细胞中lncRNA CPS1-IT1的表达量高于pcDNA组(P<0.05),提示成功构建lncRNA CPS1-IT1过表达的T24细胞。MTT、Transwell和Western blot检测结果表明,pcDNA-CPS1-IT1组T24细胞的抑制率高于pcDNA组,迁移、侵袭细胞数、Ki-67、MMP-2和MMP-9蛋白表达量低于pcDNA组,差异均有统计学意义(P<0.05)。见表4,图3。

表4 lncRNA CPS1-IT1过表达对膀胱癌T24细胞增殖、迁移侵袭的影响
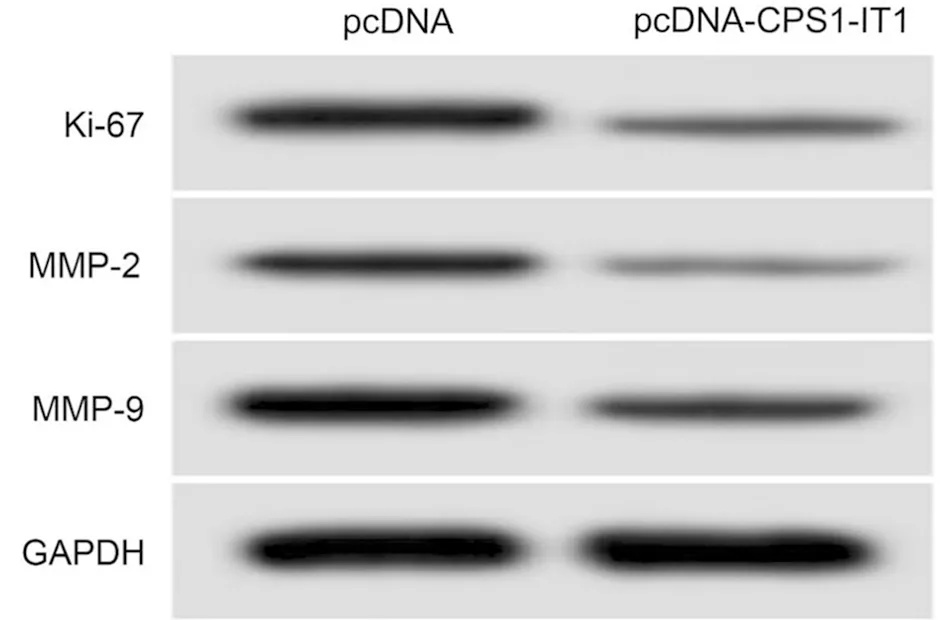
图3 增殖、迁移侵袭相关蛋白表达
2.5 抑制lncRNA CPS1-IT1表达逆转了毛萼乙素(10 μmol/L)对膀胱癌T24细胞增殖、迁移、侵袭的作用 qRT-PCR、MTT、Transwell和Western blot检测显示,与ERB+si-NC组比较,ERB+si-CPS1-IT1组T24细胞的CPS1-IT1表达量、抑制率降低,迁移、侵袭细胞数、Ki-67、MMP-2和MMP-9蛋白表达量升高,差异均有统计学意义(P<0.05)。见图4,表5。

图4 增殖、迁移侵袭相关蛋白表达

表5 抑制lncRNA CPS1-IT1表达逆转了毛萼乙素对膀胱癌T24细胞增殖、迁移、侵袭的作用
3 讨论
膀胱癌是常见的恶性肿瘤之一,发病率和死亡率较高。吸烟是膀胱癌的最强危险因素,占所有病例的50%~65%[11]。尽管近年来全球膀胱癌死亡率有所降低,但膀胱癌患者容易发生癌症转移,转移性膀胱癌的预后仍然很差[12]。目前,尚未阐明膀胱癌的发生和发展的分子机制。因此,描述膀胱癌发展中涉及的分子机制,以发现潜在的新颖和重要的诊断标志物和治疗策略。
毛萼乙素具有许多药理活性,包括抑制炎性反应,调节免疫细胞分化,抑制肿瘤细胞增殖,引起细胞周期停滞,影响血管生成并促进癌细胞凋亡[4]。毛萼乙素已被证实可有效对抗多种癌症,例如在前列腺癌PC-3和22RV1细胞中,毛萼乙素以时间和剂量依赖性的方式抑制细胞增殖并诱导其凋亡和自噬,潜在机制与抑制蛋白激酶B(protein kinase B,Akt)和雷帕霉素靶蛋白(mTOR)的磷酸化有关[13]。毛萼乙素可增强吉西他滨对胰腺癌的细胞毒性和凋亡作用[14]。毛萼乙素通过抑制核转录因子-κB p65,信号转导与转录因子3(signal transducers and activators of transcription 3,STAT3)磷酸化来诱导三阴性乳腺癌MDA-MB231细胞凋亡[15]。但是,毛萼乙素的详细作用及其在膀胱癌中涉及的机制尚不清楚。本研究显示毛萼乙素对膀胱癌T24细胞增殖和转移的抑制能力,即2.5 μmol/L、5 μmol/L、10 μmol/L浓度的毛萼乙素显著增加T24细胞的增殖抑制率,减少迁移、侵袭细胞数、Ki-67、MMP-2、MMP-9蛋白的表达量,并呈一定的浓度依赖性,表现出一定的抗膀胱癌增殖和转移活性。这些为进一步开展毛萼乙素体内研究提供了依据,毛萼乙素也被证明是开发针对膀胱癌的新型疗法的潜在候选药物。
lncRNA代表一类新颖的非编码RNA,其长度超过200个核苷酸,并且不具有蛋白质编码潜能。研究发现lncRNA失调,并参与多种癌症生物学过程,例如增殖,凋亡,迁移和侵袭[16]。越来越多的lncRNA已被证明在癌症的发生和发展中起癌基因或抑癌作用[17]。lncRNA CPS1-IT1最近被鉴定多种癌症类型发展和进程的基因调节剂。研究显示,与配对的正常脑组织和人星形胶质细胞相比,神经胶质瘤组织和细胞中的lncRNA CPS1-IT1水平分别降低;lncRNA CPS1-IT1表达的上调导致神经胶质瘤细胞的增殖,迁移和侵袭能力下降[18]。Zhou等[19]观察到lncRNA CPS1-IT1在人黑素瘤组织和细胞系中低表达,与转移和肿瘤分期显著相关。此外,还指出lncRNA CPS1-IT1的过度表达抑制黑素瘤细胞的细胞迁移、侵袭,上皮-间质转化和血管生成,揭示了lncRNA CPS1-IT1作为预后预测者的潜力。lncRNA CPS1-IT1在结直肠癌组织和细胞系中低表达,可能通过抑制缺氧诱导因子1α的激活来抑制缺氧诱导的自噬,从而抑制结直肠癌转移和上皮间质转化[20]。本研究进行细胞增殖测定,细胞迁移和侵袭测定,来揭示lncRNA CPS1-IT1在膀胱癌中的功能。结果显示,lncRNA CPS1-IT1的过表达显著抑制了膀胱癌T24细胞的增殖、迁移和侵袭,以及相关蛋白Ki-67、MMP-2和MMP-9的表达,意味着lncRNA CPS1-IT1可以抑制膀胱癌的发展。同时也表明,lncRNA CPS1-IT1是一种潜在的生物标志物,可作为膀胱癌的肿瘤抑制基因。
有证据表明,lncRNA介导一些中药活性成分的抗肿瘤功能,例如白藜芦醇苷、黄芩素[21]等。根据报道,冬凌草甲素下调lncRNA AFAP1-AS1抑制胰腺癌细胞上皮向间充质转化、迁移、侵袭和增殖[22]。lncRNA癌症易感性候选物2(CASC2)通过在转录后水平上抑制B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)表达来介导小檗碱诱导的促大肠癌细胞凋亡作用[23]。本研究首先发现,2.5 μmol/L、5 μmol/L、10 μmol/L毛萼乙素以浓度依赖方式显著上调lncRNA CPS1-IT1表达,由此猜想lncRNA CPS1-IT1可能参与毛萼乙素的抗膀胱癌T24细胞增殖和转移进程。进一步的功能实验检测到,si-CPS1-IT1与毛萼乙素共同作用时,膀胱癌T24细胞的增殖抑制率减少,迁移、侵袭细胞数、Ki-67、MMP-2和MMP-9蛋白表达量增加,可见抑制lncRNA CPS1-IT1表达可以逆转毛萼乙素对T24细胞增殖、迁移、侵袭的影响。这些结果表明,膀胱癌中lncRNA CPS1-IT1是毛萼乙素机制的关键靶标,介导毛萼乙素抗膀胱癌发生发展过程。
综上所述,毛萼乙素可降低膀胱癌T24细胞增殖、迁移和侵袭。此外,毛萼乙素通过增加lncRNA CPS1-IT1的表达水平发挥其在膀胱癌中的抗癌作用。因此,毛萼乙素可能是膀胱癌患者的一种潜在的替代治疗药物,而lncRNA CPS1-IT1可以作为改善毛萼乙素抗癌作用的重要治疗靶点。
