流行性乙型脑炎病毒SA14-14-2株囊膜蛋白的原核表达及其兔抗血清的制备
2022-03-22冯继伟孟玉娇陈玉明王龙康王寅彪
徐 飞,冯继伟,李 鹏,孟玉娇,陈玉明,王龙康,王寅彪
(1.新乡医学院公共卫生学院,河南 新乡 453003;2.新乡学院生命科学与基础医学学院,河南 新乡 453003)
流行性乙型脑炎是由流行性乙型脑炎病毒(epidemic encephalitis B virus,EEBV)感染引起的一种经蚊虫传播的急性人畜共患病[1],在我国流行性乙型脑炎发病率为(2~10)/10万,其临床表现以头痛、高热、呕吐、意识障碍、呼吸衰竭等中枢神经系统感染症状为主要特征,病死率较高[2-3]。近年来,随着疫苗的广泛使用,流行性乙型脑炎在我国的整体发病率有所下降,但其在西南部农村地区的发病率仍然较高,是重要的公共卫生问题[4]。开展大规模抗体筛查以确定人群感染和免疫情况,对于防控流行性乙型脑炎具有重要意义。本研究利用大肠杆菌原核表达系统表达了EEBV的囊膜(envelope,E)蛋白,并通过免疫印迹(Western blot)、酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)及免疫荧光分析(immunofluorescence assay,IFA)对E蛋白的免疫原性进行了评价,旨在为建立诊断EEBV感染的免疫学检测方法提供参考。
1 材料与方法
1.1 动物3只健康雌性新西兰大白兔购自郑州大学实验动物中心,分笼饲养于新乡医学院公共卫生学院实验动物房,实验过程中均以正常饲料喂养,动物免疫实验获得新乡医学院伦理委员会同意(伦理审查批件号:XYLL-2020018)。
1.2 病毒、质粒与细胞株EEBV病毒株SA14-14-2、仓鼠肾细胞(baby hamster kidney cell line,BHK)-21、载有E蛋白基因片段(1~1 248碱基对)的pET32a-E质粒由河南省动物免疫学重点实验室提供,大肠杆菌BL21(DE3)感受态细胞由本实验室制备保存。
1.3 主要试剂与仪器抗EEBV单克隆抗体由河南省动物免疫学重点实验室提供,氨苄青霉素购自美国Amresco公司,镍离子金属螯合亲和层析介质(nickel-charged nitrilotriacetic acid,Ni-NTA)购自美国ThermoFisher公司,异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)购自德国Merck公司,化学发光法(enhanced chemiluminescence,ECL)检测试剂盒、3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine,TMB)购自北京索莱宝科技有限公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔免疫球蛋白G(immunoglobulin G,IgG)、山羊抗小鼠IgG及异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的山羊抗兔IgG、山羊抗小鼠IgG购自英国Abcam公司。
1.4 EEBV E蛋白生物化学特性分析利用DNAStar软件中的蛋白质序列分析模块(Protean)分析E蛋白的二级结构、抗原性、亲水性等生物化学特性。
1.5 pET32a-E质粒转化在冰浴中缓慢融解大肠杆菌BL21(DE3)感受态细胞(100 μL),待细胞完全融解后,向其中加入1 μL pET32a-E质粒(10 mg·L-1),轻轻用手指弹动离心管以混匀细菌和质粒,在冰浴中静置30 min后,将离心管置于42 ℃水浴热激90 s,然后快速将离心管转入冰浴中静置10 min,向离心管中加入900 μL LB液体培养基,37 ℃摇床振荡培养2 h,5 000 r·min-1离心5 min,弃去800 μL上清。之后,使用剩余培养基重悬管底的菌体沉淀并将重悬液加至含50 mg·L-1氨苄青霉素的LB培养基固体平板上,使用无菌弯头玻璃棒轻轻将细胞均匀涂开,然后将平板倒置放于37 ℃培养箱中培养16 h,次日,挑取单一菌落,于LB液体培养基中扩增培养后,进行E蛋白的诱导表达。
1.6 EEBV E蛋白表达与纯化将10 mL转化有pET32a-E质粒的大肠杆菌BL21(DE3)感受态细胞接种于1 L含50 mg·L-1氨苄青霉素的LB液体培养基,37 ℃、250 r·min-1摇床摇菌3~4 h,待菌液在600 nm波长处的吸光度(absorbancy,A)值达到0.4~0.6时,取2 mL菌液作为未诱导对照。向剩余菌液中加入诱导剂IPTG至终浓度为0.5 mmol·L-1,于37 ℃、250 r·min-1摇床摇菌8 h,取2 mL菌液作为诱导对照;然后,6 000 r·min-1离心20 min,收集菌体沉淀,以1/10菌液体积的10 mmol·L-1Tris-HCl(pH 8.0)缓冲液重悬沉淀,于冰浴中超声裂解。9 000 r·min-1离心20 min,收集沉淀并使用变性结合缓冲液(100 mmol·L-1NaH2PO4、10 mmol·L-1Tris-HCl、8 mol·L-1尿素,pH 8.0)溶解沉淀;之后,在变性条件下采用Ni-NTA亲和层析法纯化重组E蛋白:首先,使用2 mL变性结合缓冲液平衡Ni-NTA亲和层析柱,然后将2 mL变性样品加入层析柱,使E蛋白与Ni-NTA介质发生亲和结合,再以8倍柱床体积的变性洗涤缓冲液(100 mmol·L-1NaH2PO4、10 mmol·L-1Tris-HCl、8 mol·L-1尿素,pH 6.3)洗涤层析柱,最后以3倍柱床体积的变性洗脱缓冲液(100 mmol·L-1NaH2PO4、10 mmol·L-1Tris-HCl、8 mol·L-1尿素,pH 4.5)洗脱目的蛋白,收集各组分进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)检测蛋白纯度。之后,将变性蛋白液装入透析袋并依次置于含7、6、4、2、1、0 mmol·L-1尿素的复性缓冲液(100 mmol·L-1NaH2PO4、10 mmol·L-1Tris-HCl,pH 8.0)中,于4 ℃下进行透析复性。在每种缓冲液中透析4 h,最后以9 000 r·min-1离心10 min,收集上清,于-80 ℃保存备用。
1.7 Western blot法检测重组E蛋白的生物活性将按上述方法培养收集的未诱导和诱导菌体沉淀按1/10菌液体积的比例重悬于Tris-HCl缓冲液中,进行SDS-PAGE电泳。之后,通过半干法将蛋白转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,将PVDF膜置于50 g·L-1的脱脂奶中,37 ℃封闭1 h,使用含体积分数0.05%吐温-20的磷酸盐缓冲液(phosphate buffered saline containing Tween-20,PBST)洗涤3次后,加入抗EEBV单抗,37 ℃反应1 h,使用PBST洗涤6次后,加入HRP标记的山羊抗小鼠IgG于37 ℃下反应1 h。同上洗涤后,加入ECL试剂进行显影,在预测的相对分子质量处观察蛋白条带,确定其与抗EEBV单抗的反应性。
1.8 EEBV E蛋白兔抗血清的制备和鉴定
1.8.1 EEBV E蛋白兔抗血清的制备取体质量约2.5 kg的新西兰大白兔,免疫前3 d经耳缘静脉采血制备阴性对照兔血清。首次免疫时,将200 μg复性后的E蛋白与弗氏完全佐剂混合乳化,以1.0 mL的剂量进行皮内及皮下注射免疫;再次免疫时使用相同剂量的E蛋白与弗氏不完全佐剂进行乳化,同上注射免疫。后续免疫均使用弗氏不完全佐剂乳化E蛋白,以4周作为免疫间隔共进行4次免疫后,经耳缘静脉采血1.0 mL,采用ELISA法测定抗体效价,采用IFA法检测兔抗血清与EEBV的反应性。之后进行心脏采血,4 000 r·min-1离心20 min,收集血清,-80 ℃保存。
1.8.2 ELISA法测定兔抗血清抗体效价使用碳酸盐缓冲溶液(pH 9.6)在4 ℃条件下过夜,将E蛋白包被于ELISA反应孔,次日以PBST洗涤3次后,每孔加满50 g·L-1脱脂奶,37 ℃作用2 h,然后以二倍稀释法稀释E蛋白兔抗血清和阴性兔血清并加入反应孔,于37 ℃下反应30 min。PBST洗涤6次,每孔加入110 000稀释的HRP标记的山羊抗兔IgG,于37 ℃下反应30 min。同上洗涤后,加入TMB显色5 min,以2 mol·L-1H2SO4终止反应并使用酶标仪测定A450值。每组样品设立3个重复,以样品A450平均值与阴性对照A450平均值的比值≥2.2作为阳性反应判定依据,兔抗血清的效价为给出阳性反应的最高稀释度的倒数。
1.8.3 IFA法检测兔抗血清与EEBV的反应性在37 ℃、体积分数5% CO2条件下培养BHK-21细胞至汇合度为80%~90%时,接种EEBV SA14-14-2,感染24 h;同时预留未接种EEBV的细胞,继续培养24 h,作为未感染对照。利用预冷的无水乙醇(含体积分数 1%~2% H2O2)室温固定15 min,每孔加满50 g·L-1的脱脂奶,37 ℃封闭1 h,PBST洗涤3次后,加入11 000稀释的抗EEBV单抗或E蛋白兔抗血清,37 ℃反应1 h,然后以PBST洗涤6次,向各孔加入1500稀释的FITC标记的山羊抗小鼠IgG或FITC标记的山羊抗兔IgG,37 ℃反应1 h,PBST洗涤6次后,在荧光显微镜下观察结果,出现绿色荧光点时说明抗EEBV单抗或E蛋白兔抗血清与EEBV发生了特异反应。
2 结果
2.1 EEBV E蛋白的生物化学特性结果见图1。DNAStar软件分析表明,E蛋白具有丰富的二级结构,含有较多的α螺旋和β折叠结构,绝大部分区域的抗原指数较高,亲水性较强,抗原指数高低与亲水性强弱具有较高一致性。
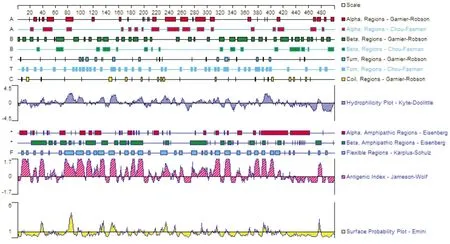
图1 EEBV E蛋白的生物化学特性
2.2 重组E蛋白的表达与纯化结果结果见图2。SDS-PAGE鉴定显示,与未诱导对照组相比,IPTG诱导组在相对分子质量约 53 000处出现了清晰的特异性条带,与预测的蛋白相对分子质量一致,蛋白经变性纯化后,纯度较高。复性后,从1 L培养物获得了23.8 mg E蛋白。

M:预染蛋白质分子量标准;1:pET32a-E未诱导;2:pET32a-E诱导;3、4:纯化后的E蛋白。
2.3 E蛋白生物活性检测结果结果见图3。未诱导组菌液与抗EEBV单抗的反应未出现任何条带,诱导组菌液与抗EEBV单抗反应时,在相对分子质量 53 000处出现了特异性条带,表明抗EEBV单抗与重组E蛋白发生了特异性反应。

M:预染蛋白质分子量标准;1:pET32a-E诱导;2:pET32a-E未诱导。
2.4 E蛋白兔抗血清抗体效价测定结果结果见图4。ELISA检测结果显示,阴性兔血清不与E蛋白发生反应,制备的兔抗血清能与E蛋白在体外发生特异性结合,抗体效价高达1×51 200。

图4 ELISA法测定兔抗血清抗体效价
2.5 兔抗血清与EEBV反应结果结果见图5。抗EEBV单抗能与EEBV感染的BHK-21细胞发生特异性反应,不与未接种病毒的细胞反应。同时,兔抗血清能与EEBV感染的BHK-21细胞发生特异性反应,呈现特异性绿色荧光信号,不与未接毒的细胞发生反应。

A:抗EEBV单抗与接种EEBV病毒的BHK-21细胞发生反应;B:抗EEBV单抗与正常BHK-21细胞不发生反应;C:兔抗血清与接种EEBV病毒的BHK-21细胞发生反应;D:兔抗血清与正常BHK-21细胞不发生反应。
3 讨论
流行性乙型脑炎主要分布于东亚、东南亚及太平洋西部地区,每年有5万~10万人发病[5]。目前,流行性乙型脑炎仍是我国发病率较高、分布较广、危害较重的蚊媒疾病之一,严重威胁人体健康[3]。当前尚无治疗流行性乙型脑炎的特异性药物,除了控制蚊虫媒介外,疫苗免疫是防控流行性乙型脑炎最有效的手段[6-7]。随着流行性乙型脑炎疫苗纳入我国国家免疫规划,儿童流行性乙型脑炎发病率持续下降;但2014~2018年监测数据显示,40岁以上成人流行性乙型脑炎病例构成比由14.45%上升至64.04%[8-9]。鉴于此,开展健康人群尤其是高发地区成人群体的流行性乙型脑炎抗体水平监测,对流行性乙型脑炎防控至关重要。EEBV属于黄病毒科黄病毒属,是一种单股正链RNA病毒,基因组长度约11 kb,编码3种结构蛋白和7种非结构蛋白[10]。E蛋白是EEBV重要的结构蛋白,是病毒粒子表面的主要成分,能够诱导机体产生中和抗体,决定着病毒进入细胞的能力、病毒毒力、组织嗜性及血清特异性等[11-12]。E蛋白的高效表达对于EEBV感染检测以及疫苗免疫水平评价等具有重要意义。
到目前为止,E蛋白在毕赤酵母、哺乳动物细胞等表达系统中均获得了表达[13-14]。然而,上述表达系统制备外源蛋白的成本较高,而且产量较低;相对而言,大肠杆菌表达系统具有成本低廉、生产率高、操作简便等优点,故本研究利用大肠杆菌表达系统对E蛋白进行了表达。经IPTG诱导表达后,在预测的相对分子质量处出现了特异条带,表明本研究成功表达了E蛋白。本研究以终浓度为 0.5 mmol·L-1的IPTG在37 ℃条件下诱导蛋白表达 8 h后,E蛋白以包涵体形式表达。包涵体不具有生物活性,因此,为获得具有生物活性的E蛋白,本研究对包涵体形式的E蛋白进行了复性,复性过程中采用逐渐降低尿素含量的方式进行透析复性,有效避免了因变性剂的含量下降过快导致蛋白再次错误折叠形成沉淀的情况,最终从1 L培养物中获得了23.8 mg的复性E蛋白。为确定复性后的E蛋白具有生物活性,本研究利用Western blot对复性E蛋白与抗EEBV单抗的反应性进行了分析,结果发现,复性E蛋白能被抗EEBV单抗特异识别,表明复性后的E蛋白含有与病毒粒子表面天然E蛋白相同的表位,具有良好生物活性。为制备特异性好、亲和力高的兔抗血清,本研究以E蛋白为免疫原,采用低免疫剂量、长免疫间隔的方式对新西兰兔进行了4次免疫;ELISA检测结果显示,兔抗血清能与E蛋白发生特异反应,抗体效价达到1×51 200,说明表达的E蛋白能有效刺激抗体产生,具有良好的免疫原性,同时也表明本研究成功制备了高亲和力的兔抗血清。
此外,原核表达系统往往因为缺少必要的蛋白修饰而导致外源蛋白的结构不同于天然蛋白,为进一步确定表达的E蛋白具有和天然蛋白相同的表位,本研究对兔抗血清与EEBV的反应性进行了检测,首先以抗EEBV单抗与EEBV的特异反应为基础建立了有效的IFA分析方法,采用此方法对E蛋白兔抗血清与EEBV的反应性进行分析,结果显示,兔抗血清能够与EEBV发生特异反应,说明表达的E蛋白含有与天然蛋白相同的表位,也表明本研究制备的兔抗血清特异性强。
综上所述,本研究利用大肠杆菌原核表达系统成功表达了SA14-14-2株的E蛋白,同时制备了特异性强、亲和力高的兔抗血清,为建立诊断EEBV感染的免疫学检测方法准备了材料,为开展健康人群流行性乙型脑炎抗体水平监测、进而更加有效地防控流行性乙型脑炎奠定了基础。
