左肾巨大黏液样小管状和梭形细胞癌1例
2022-03-20尹宏宇
尹宏宇, 张 继
(1. 大连医科大学研究生院, 辽宁 大连, 116044;2. 江苏省泰州市人民医院 医学影像科, 江苏 泰州, 225300)
肾脏黏液样小管状和梭形细胞癌(MTSCC)是一种罕见、恶性程度低、预后较好的恶性肿瘤, 2004年首次被确认为世界卫生组织(WHO)泌尿系统和男性生殖器官肿瘤分类中一种多形性肾上皮肿瘤。MTSCC具有特殊的病理、免疫组化及分子遗传特征,并具有一定的影像学特征。本院收治1例MTSCC患者,现结合相关文献,总结临床表现、影像学特征及临床病理学、免疫组织化学、分子遗传学特征。
1 临床资料
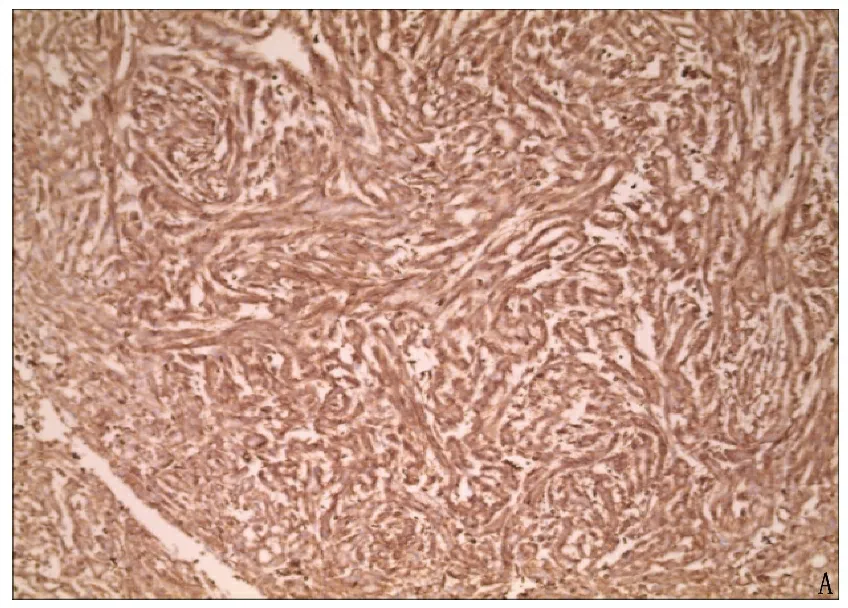
患者女, 51岁,因左腰腹疼痛伴肉眼血尿于2021年1月至江苏省泰州市人民医院就诊,无尿频、尿痛。既往史: 9年前行左肾血管平滑肌脂肪瘤血管栓塞术。查体: 左腹部膨隆,左肾区轻叩痛。CT检查: 左肾上极16.2 cm×15.0 cm×11.2 cm巨大肿块,平扫CT值约为25 HU, 边界尚清,内部密度不均,可见斑片样高密度影及结节状致密影,周围脂肪间隙模糊,增强后呈不均匀强化,皮质期、髓质期及排泄期CT值分别为37、49、63 HU, 邻近肾实质、肾盏及肠管受压,左肾血管、下腔静脉未见受侵,见图1。考虑为左肾占位伴出血,遂行左肾切除术,术中见左肾上极直径约15 cm巨大肿物伴部分破裂出血,周围充满血块。病理肉眼所见: 肿块约16 cm×15 cm×10 cm, 边界尚清,表面呈分叶状,剖面呈灰白、灰红或暗红色,实性质中等,局部质软嫩,中央大面积出血。镜下见肿瘤细胞呈管状、条索状排列,周围分布大量黏液基质。术后病理诊断为左肾MTSCC。免疫组织化学检查: 癌细胞CKpan()、波形蛋白(Vimentin)()、上皮细胞膜抗原(EMA)()、CK7()、E-钙黏附蛋白(E-Cad)()、α-甲基酰基-辅酶A消旋酶 (AMACR)()、PAX-8()、P53(), 肾母细胞瘤基因(WT-1)、CD10、绒毛蛋白 (Villin)、CD34、CD117、转录因子E3(TFE3)、平滑肌肌动蛋白(SMA)均为阴性表达, Ki-67呈低表达,见图2、图3。随访至2021年8月未见转移。



A: HE染色(放大倍数40倍); B: HE染色(放大倍数100倍)。
2 讨 论
肾癌是泌尿系统最常见的恶性肿瘤之一, MTSCC是2016年WHO最新分类中12个亚型之一,较为罕见[1-2]。MTSCC由比例、数量不等的小管和梭形细胞以及黏液样间质组成,恶性程度低,预后相对较好。罕见病例可伴肉瘤样转化,可出现局部复发、转移。目前诊断MTSCC主要依靠病理检查,临床表现及影像表现缺乏明确特异性,诊断及鉴别诊断有一定难度。与其他肾脏恶性肿瘤不同,大多数患者预后良好,复发和转移可能性较小,治疗方式主要采取手术切除,选择根治性肾切除或部分切除肾切除时需要综合考虑患者情况。对于需要保留肾功能的患者(如对侧肾功能不全或对侧肾脏良性病变),如果术前影像学检查可以诊断为MTSCC, 则能避免行根治性肾切除术,保护患者肾功能,提高生存质量[3]。因此,充分认识MTSCC的临床特征、影像学表现及病理学特征具有重要临床价值。

A: 角蛋白CK7()(放大倍数40倍); B: Vimentin ()(放大倍数100倍)。
MTSCC好发于17~82岁患者,男女发病比例约为1∶4, 患者大多无明显临床表现,一般在体检或检查其他疾病时偶然发现。若肿瘤体积较大,可出现腰痛、腹部肿块和血尿等症状,但无特异性[4]。MTSCC发病原因尚不明确,研究[5]表明,肾结石和终末期肾病导致的肾结石可能与其发生有关。目前,对MTSCC的影像学特征研究[6-8]有限,结合该病例及相关文献将MTSCC的CT特征总结如下: 肿瘤常位于肾实质,多为单侧单发肿块,膨胀性生长推挤周围肾盂肾盏,一般不会侵犯肾盂和肾周组织,也无淋巴结肿大。CT平扫较小的肿瘤表现为密度均匀肿块影,可能因肿瘤起源不同, CT值等于或高于肾实质[9]。肿瘤较大时可发生出血或囊变坏死,有时可见钙化,较小的肿瘤(直径小于5 cm)一般呈均匀强化,较大的肿瘤常呈不均匀、缓慢、渐进性强化,但所有期像上的强化程度均低于肾实质,且肿瘤与正常肾实质的增强比略高于0.25,这与肾癌的其他类型不同[10-11]。
肾脏恶性肿瘤常见亚型主要有肾透明细胞癌、乳头状肾细胞癌,肾嫌色细胞癌、集合管癌,常见的良性肿瘤亚型有嗜酸细胞腺瘤、后肾性腺瘤、血管平滑肌脂肪瘤等[12]。① 肾透明细胞癌是最常见的肾癌亚型,多位于肾皮质,密度不均,常发生囊变坏死、出血及钙化,部分肿瘤见假包膜生长,增强后呈典型的“速升速降”,与MTSCC较易区分。② 乳头状肾细胞癌是第二常见的肾癌亚型,可多发或者双侧肾脏发病,有家族性特征。乳头状肾细胞癌为乏血供肿瘤,体积较小,平扫表现为较均匀低密度肿块,增强后呈轻度延迟强化,与MTSCC相似,但乳头状肾细胞癌密度较均匀。③ 肾嫌色细胞癌多位于肾髓质,可见假包膜,囊变坏死少见,增强后呈渐进性强化,皮质期强化程度介于肾皮质与肾髓质之间。嫌色细胞癌的强化程度较MTSCC更加明显,肿瘤较大时会出现放射状或星芒状强化。④ 集合管癌发病年龄小,病灶主要位于肾髓质,易发生坏死及周围组织浸润,通常伴有肾内、淋巴结及远处转移,恶性程度高,预后差。平扫表现为不均匀低密度肿块,边界欠清,可伴囊变和钙化,增强后呈轻度强化[13]。平扫上集合管癌CT值高于MTSCC, 并且增强后各个期像的强化程度均高于MTSCC。⑤ 嗜酸细胞腺瘤多位于肾皮质,边界清晰,平扫表现为均匀低密度肿块,增强后明显强化,有时会出现辐轮状强化。⑥ 后肾性腺瘤多位于肾皮质内,边界清晰,肿瘤较大时可发生囊变、出血、坏死,部分可见“沙砾样”钙化。CT平扫呈等或稍高密度,增强后呈渐进性、轻中度强化。⑦ 血管平滑肌脂肪瘤: 该病例有左肾血管平滑肌脂肪瘤病史,在CT平扫上可看到钙化,需与乏脂质血管平滑肌脂肪瘤进行鉴别,乏脂质血管平滑肌脂肪瘤增强后血管成分明显强化。关于MTSCC的磁共振成像特征的报道较少。目前研究[14-15]表明, MTSCC在T1WI上呈等低信号,在T2WI上表现因其成分不同有所差异,大部分肿瘤在T2WI上呈不均匀中高信号,信号强度与肿瘤内黏液或黏液样基质的比例相关; 少部分肿瘤呈低信号,代表肿瘤内出血或钙化。增强后也表现为不均匀、缓慢、渐进性强化。乳头状肾细胞癌在T2WI上通常为均匀低信号,而MTSCC强化程度更高,当有含铁血黄素沉积时,两者在同相位和反相位图像上信号均下降。
MTSCC病理特征为排列成管状或索状的立方细胞和梭形细胞分布于黏液样间质中,本病例也看到了这些特征。但MTSCC成分复杂,组织成分比例不同可能会导致误诊。若主要成分是管状排列的立方细胞可能被误诊为1型乳头状肾细胞癌或后肾性腺瘤; 若主要成分是梭形细胞则可能被误诊为肾细胞肉瘤、平滑肌肿瘤或者以平滑肌为主的血管平滑肌脂肪瘤。关于MTSCC的起源学说目前尚无定论。MACLENNAN G T等[16]研究认为,具有MTSCC和低级别集合管癌特征的肿瘤起源于集合管上皮, PARWANI A V等[17]认为具有细长的管状排列上皮细胞、梭形细胞和黏液样基质组织学特征的肿瘤起源与Henle环有关。联合应用免疫组织化学有助于MTSCC的诊断。研究表明, AMACR、低分子细胞角蛋白、EMA、PAX-2、PAX-8、E-Cad、细胞角蛋白AE1/AE3表达多呈阳性, Vimentin、高分子细胞角蛋白、肾细胞癌标记物(RCC Ma)、CD10、CD15 表达可呈阳性也可呈阴性,而SMA、HMB45、S-100、CK20、P63、荆豆凝集素(UEA-1)及GATA3 均为阴性,其中AMACR、CK7、EMA和Vimentin阳性表达支持远端小管起源, RCC Ma、AMACR、CD15阳性表达支持起源于近端小管。本病例中, Vimentin、EMA、CK7、E-Cad、AMACR、PAX-8呈阳性表达, WT-1、CD10、Villin、CD34、CD117、TFE3、SMA均为阴性表达,与之前报道相似,推测该病例可能是远端小管起源。研究[18-19]表明,高表达Ki-67及p53可能是MTSCC不良预后的预测因子; 部分病例具有神经内分泌功能,可阳性表达神经内分泌标记物(嗜铬粒蛋白A、突触素和神经元特异性烯醇化酶)。基因组研究[20]发现, MTSCC存在染色体的变异,但在不同研究中存在差异,最常见的分子特征包括Hippo途径突变和多个染色体丢失,可表现为NF2基因突变和1、4、6、8、9、11、13、14、15、18、22及X染色体(部分)缺失以及2、3、4、5、7、9、10、12、15、16、17、18、19、20、22号染色体(部分)重复。
MTSCC是一种罕见的低度恶度肿瘤,术前诊断较难,病理检查是诊断的主要手段,免疫组织化学可作为诊断辅助手段。术前影像学检查有一定特征性,有助于与其他肾脏肿瘤鉴别。因此,正确、全面认识MTSCC的临床、影像及病理特征有助于指导临床诊疗。
