注射用美罗培南的质量评价
2022-03-18周震宇程继业陈沫沈心姚玲
周震宇 程继业 陈沫 沈心 姚玲
(苏州市药品检验检测研究中心,苏州 215014)
美罗培南由日本住友株式会社研发,第二代广谱碳青霉素烯类抗生素,通过抑制细菌细胞壁的合成而产生抗菌作用[1-2]。制剂注射用美罗培南为美罗培南和无水碳酸钠按处方比例无菌分装制成,临床多用于治疗混合感染和严重感染,其不良反应以皮肤及皮下组织类疾病和胃肠系统疾病为主[3]。
1994年,美罗培南以商品名“Mepem®”在意大利上市,1999年在中国境内上市,商品名为“美平”(规格0.5 g)。2020年,深圳市海滨制药有限公司生产的注射用美罗培南在国内首家通过仿制药质量与疗效的一致性评价。根据国家药品监督管理局进口药品和国产药品数据库的查询结果,目前国内共有11家生产企业取得注射用美罗培南的生产批件,涉及批准文号25个,有3个规格(0.25、0.5和1.0 g),其中国内药品生产企业10家,进口药品生产企业1家。
注射用美罗培南为2021年国家药品评价性抽验品种。本次抽验范围覆盖 20个省、3个直辖市和4个自治区,共抽取到100批样品,涉及生产企业11家、批准文号20个和规格3个,其中抽自使用单位26批,批发经营单位74批。通过现行法定标准检验结合探索性研究,综合评价国内外不同生产企业的注射用美罗培南质量现状,分析可能存在的质量问题,明确提高产品质量的方向。
1 仪器及试药
1.1 仪器
高效液相色谱仪(Waters e2695-2998,配有四元泵、在线脱气机、自动进样器、DAD检测器和Empower pro工作站),AA-7000型原子吸收分光光度计(岛津公司),安捷伦7890B/7697A气相色谱仪(Agilent OpenLab Acquisition CDS2.4色谱数据处理工作站),Thermo Xseries2电感耦合等离子体质谱仪,Agilent 7697A顶空进样(安捷伦公司),Agilent 7890B/7200 Accurate Q-TOF GC/MS(安捷伦公司)(Mass Hunter workstation数据处理工作站),电子天平(梅特勒托利多XSE205DU),超纯水仪(Millipore Milli-Q)。
1.2 试药
美罗培南对照品(中国食品药品检验研究院,批号:130506-202004),美罗培南杂质A对照品(杭州卓越科技生物有限公司,批号:20200723),美罗培南杂质B对照品(杭州卓越科技生物有限公司,批号:20201110),钠单元素标准溶液(1000 μg/mL,中国计量科学研究院,批号20124),硝酸(苏州晶瑞化学股份有限公司,批号210205081),丙酮(99.5%,分析纯,国药集团化学试剂有限公司,批号20140107),铝、砷、镉、铬、铜、铁、锰、铅、锡、锑、锌单元素标准溶液(1000 μg/mL,国家有色金属及电子材料分析测试中心),钡元素标准溶液(100 μg/mL,中国计量科学研究院,批号:19041-GBW(E)08043)。
2 实验方法
2.1 法定检验
按各执行标准对注射用美罗培南进行法定检验。主要检验项目包括鉴别、有关物质、碱度、澄清度与颜色、含量均匀度和含量测定等。
2.2 探索性研究
2.2.1 有关物质
参照《中国药典》2020年版二部注射用美罗培南有关物质项下色谱条件[4],采用特定杂质加校正因子的自身对照法计算有关物质的含量,杂质A和杂质B的校正因子参考欧洲药典10.0版,对所有批次抽样进行检验,建立统一的判定标准,评估产品的优劣。
2.2.2 碳酸钠含量
照《中国药典》2020版四部通则0406原子吸收法[5],在330.3 nm波长处测定系列标准钠溶液和空白溶液吸光度,以浓度为横坐标,以相应的吸光度为纵坐标,绘制标准曲线。同法测定供试品溶液,按所列公式计算供试品中碳酸钠含量。

2.2.3 丙酮残留量
照残留溶剂测定法(《中国药典》2020年版四部通则0861第二法)[6],气相外标法测定产品中丙酮残留量。色谱条件:以6%-氰丙基苯基-94%二甲基聚硅氧烷为固定相的毛细管气相色谱柱(DB-624 30 m×0.32 mm,1.80 μm),载气为氮气,流量为1 mL/min,柱温为40℃,进样口温度为140℃,检测器(FID)温度为250℃,采用顶空分流进样,分流比为5:1,顶空瓶平衡温度为90℃,平衡时间30 min。
2.2.4 药用玻璃金属元素浸出量
建立ICP-MS方法,内标定量法对注射用美罗培南药用玻璃中的12种元素杂质(As、Sb、Pb、Cd、Al、Ba、Cr、Cu、Fe、Mn、Sn、Zn)浸出量进行考察,选取同位素为27Al、52Cr、55Mn、56Fe、65Cu、66Zn、75As、111Cd、118Sn、121Sb、137Ba和208Pb,按照内标同位素质量数与待测元素质量数相近的原则,其中27Al、52Cr、55Mn、56Fe以45Sc作为内标,65Cu、66Zn、75As、以72Ge作为内标,111Cd、118Sn、121Sb以115In作为内标,137Ba以159Tb作为内标,208Pb以209Bi作为内标。ICP-MS工作参数:一般测定模式,用调谐溶液对仪器条件进行优化;同心雾化器,射频功率为1500W,等离子体氩气流速为 15.0 L/min,载气流速为 1.05 L/min,采样深度为10.0 mm,蠕动泵速为 0.2 r/s,雾化室温度为2℃ ;分析模式为全定量,重复次数为3次;扫描次数为100次。内标元素通过T型三通管在线引入等离子体。
2.2.5 胶塞相容性
采用GC-Q TOF对注射用美罗培南所用胶塞中的迁移物进行了考察。色谱条件:固定液为5%苯基/95%甲基硅氧烷的非极性毛细管色谱柱(DB-5MS,30.0 m×0.25 mm×0.25 μm),载气为高纯氦气,流速为每分钟1.0 mL;分流比为10∶1;起始柱温50℃,保持10 min,以10 ℃/min升至170℃,维持20 min。顶空平衡时间30 min,平衡温度120℃。质谱条件:电子轰击离子源(EI),轰击电压70 eV;离子源温度为250℃,接口温度250℃;质量分辨率1 amu,全扫描方式,扫描的质量数范围 50~650。
3 结果与讨论
3.1 法定检验结果与分析
按现行质量标准对100批注射用美罗培南进行检验,全部检验项目均符合规定;与2015年国家评价性抽验结果(检验合格率为99.1%,1批样品溶液的颜色不符合规定[7])比较,产品整体质量趋好。
3.2 探索性研究
围绕药品的安全性和有效性开展探索性研究工作,针对该品种现行标准多的现状,力求统一各企业标准,设置合理的检验检测项目;并采用统一的评价方法对不同生产企业的产品进行分析,助力药品质量的提高。
3.2.1 有关物质
按照2.2.1项下方法对100批次样品的有关物质进行测定。结果显示,杂质A的含量均值为0.27%,杂质B的含量均值为0.26%,其他最大单杂的含量均值为0.03%,杂质总量的均值为0.64%,可见国内上市产品有关物质的总体质量良好(表1)。原研药(日本住友)的杂质A和杂质B的含量均控制在0.2%以下,杂质总量均值低于0.5%;国内企业的产品仅企业H的产品杂质含量控制达到原研药的水平,其他企业的产品与原研药相比较,在杂质控制水平上仍有差距。

表1 各生产企业样品的有关物质测定结果Tab.1 Results of relevant substances in samples of various manufacturers
现行国内的注射用美罗培南标准中,仅国家药品标准YBH02582015有关物质项下规定杂质A的校正因子为1.62、杂质B的校正因子为1.98[8],其他标准均未涉及杂质校正因子;欧洲药典标准在有关物质项下规定杂质A的校正因子为1.6,杂质B不适用校正因子校正[9]。本实验室验证(表2),杂质A的校正因子约为1.6,杂质B的校正因子约为1.2。建议在有关物质测定时,引入杂质A的校正因子,并对杂质B应用校正因子的合理性开展进一步的探讨。
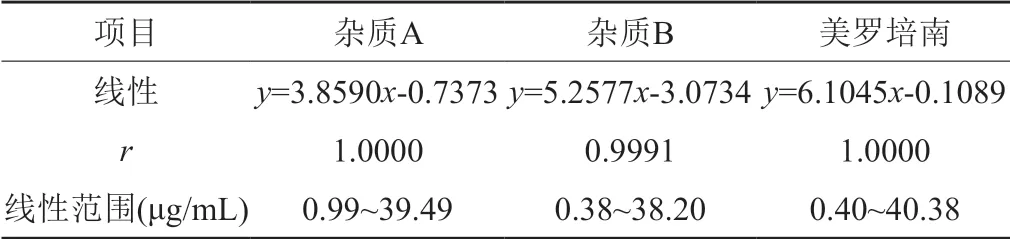
表2 美罗培南和杂质A线性方程及范围Tab.2 Linear equation and range of meropenem and impurity A
注射用美罗培南溶液的稳定性较差,但仅部分标准在有关物质测定中注明供试品溶液应临用新制,《中国药典》2020年版及部分国家药品标准均没给予提醒。考察供试品溶液24 h的稳定性,结果表明,杂质A、杂质B以及总杂质含量在24 h内均呈线性增长。因此,在有关物质测定时供试品溶液应临用新制,以免造成有关物质检验结果偏高。
3.2.2 碳酸钠含量
美罗培南在水中的溶解度较小,制剂中需要加入碳酸钠作为助溶剂。美国药典(USP)2021年版[10]对碳酸钠的含量进行了控制,国内现行质量标准中仅国家药品标准YBH02582015及国家药品标准YBH12332020[11]进行注射用美罗培南中碳酸钠的含量测定,其他标准均并未对制剂中碳酸钠的加入量进行检查。
采用原子吸收分光光度法检测注射用美罗培南中的碳酸钠含量。由表3可知,不仅各生产企业产品中碳酸钠的含量不尽相同,且其批间差异(RSD)也不一致。其中,企业G的注射用美罗培南中碳酸钠含量均值偏高(测定结果与该企业提供的处方存在一定的差距),批间差异也较其他企业大;企业I产品的批间差异(RSD)也相对偏大,其在提供的反馈资料中强调,产品中碳酸钠的量可根据美罗培南原料的pH值而调整,用量为一个可变范围,故产品的批间存在差异。但这显然与当前质量源于设计(QbD)的理念不相符合。建议类似企业应加强对美罗培南原料药的质量控制,以使得生产过程更加可控、产品质量更加稳定。

表3 各生产企业样品的碳酸钠含量测定结果Tab.3 Assay of sodium carbonate in samples of various manufacturers
3.2.3 丙酮残留量
仅原研企业(日本住友)执行的进口药品标准JX20160020对产品中的丙酮残留量[12]进行了控制,限度为0.5%。根据各生产企业反馈的调查问卷结果,丙酮在美罗培南的生产过程中被广泛使用,丙酮的残留量,可以间接反映各企业原料药的生产工艺路线和质控水平。
按照“2.2.3”丙酮残留量测定方法对本次抽验的100批次样品进行了检测,部分企业产品中除检出残留丙酮外,还同时检出乙酸乙酯与乙醇。注射用美罗培南为直接混粉灌装工艺生产,其制剂中的残留溶剂应全部来自原料药。原研企业的产品中,除丙酮外,未检出乙酸乙酯、乙醇等其他残留溶剂,提示国内部分生产企业在原料药的合成工艺方面与原研企业存在差异。
对仅检出残留丙酮的产品的测定结果作统计分析(图1),可以看出,原研药的丙酮残留量均值为0.02%,明显低于其他生产企业产品;企业J通过一致性评价的产品相比于未通过一致性评价的产品丙酮残留量显著减小,丙酮残留量均值由0.1%降至0.001%,残留溶剂控制水平优于原研药;企业F产品的丙酮残留量偏高。丙酮残留量的测定,可以作为一致性评价的一个重点考察项目,用来评价国内各企业生产的注射用美罗培南与原研药之间的差异。
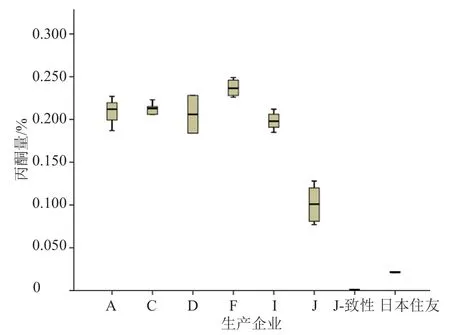
图1 各生产企业样品的丙酮残留量箱式图Fig.1 Box-plot of acetone residue in samples of various manufacturers
3.2.4 药用玻璃金属元素浸出量
依据《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则》[13],参考目前药用玻璃的原材料、添加剂以及生产工艺的情况,建立ICP-MS方法对注射用美罗培南药用玻璃中金属元素杂质浸出量进行考察。试验样品共9批,由各生产企业提供,种类均为无色西林瓶,玻璃材质包括低硼硅玻璃、中性硼硅玻璃和钠钙玻璃。
结果表明(图2),中硼硅玻璃浸出物种类和浸出量明显低于低硼硅玻璃,钠钙玻璃浸出物的种类和浸出量最少。由于注射用美罗培南水分含量为10%左右,辅料为碳酸钠,产品本身为弱碱性,在长时间碱性条件下,钠钙玻璃表面易产生碎屑颗粒,影响产品质量。故该品种应避免使用钠钙玻璃,建议选用化学性质更稳定、浸出物更少的中硼硅玻璃。
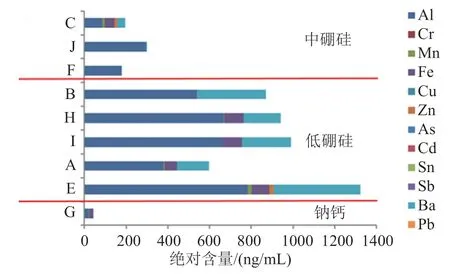
图2 各生产企业药用玻璃瓶中各元素杂质的绝对含量Fig.2 Absolute content of impurities in medicinal glass bottles of various manufacturers
3.2.5 胶塞相容性
丁基胶塞作为注射用粉针剂常用的药品包装材料,其生产过程中加入的化学助剂、反应剩余物等会残留在胶塞的本体中,导致丁基胶塞的质量存在很多不可控因素。由丁基胶塞引起的质量问题有溶液的澄清度、可见异物和不溶性微粒等等,严重影响药品的质量。采用GC-Q TOF对11家企业33批次样品中的胶塞迁移物进行了考察(表4),结果可见,企业C、D、G等企业使用的胶塞中挥发物硅氧烷类(环硅氧烷类)含量较高,提示胶塞在清洗硅化过程中使用了较高比例的二甲硅油。鉴于他们的残留量明显高于原研产品胶塞中的残留量,残留的挥发物硅氧烷类物质是否具有导致样品在储存期存在潜在的澄清度指标下降的风险,应引起关注。
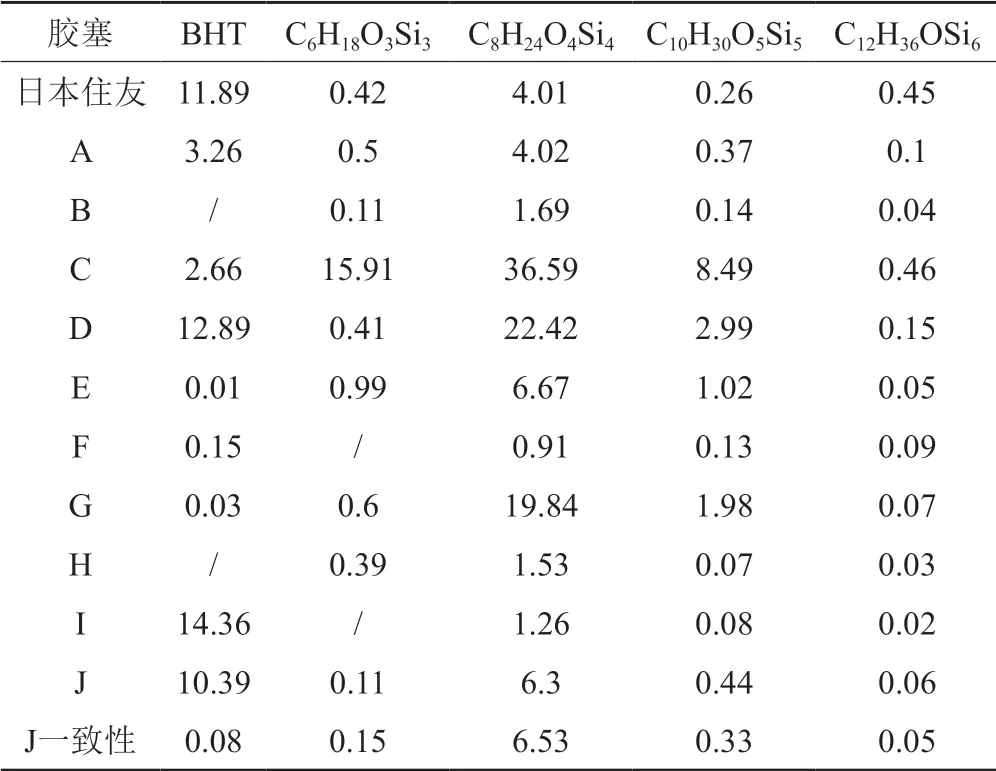
表4 各企业胶塞挥发物相对峰面积平均值(%)Tab.4 Average relative peak area of rubber stopper volatiles of various manufacturers(%)
由各生产企业反馈的问卷调查结果可知,A、B、E和G 4家企业的胶塞为相同的供应商,其中企业G使用的是未覆膜溴化丁基胶塞,其他3家企业均使用覆PTFE膜的氯化丁基胶塞。检验结果显示,覆膜后的胶塞,其中八甲基环四硅氧烷的含量明显下降。此外,企业J通过一致性评价的产品,其使用的胶塞中2,6-二叔丁基-4-甲基苯酚(BHT)的残留量明显较其他胶塞低;但原研企业的产品没有使用覆膜胶塞,也没对胶塞中残留的BHT进行严格的控制;上述结果提示,BHT可能不是注射用美罗培南胶塞残留物控制的关键指标。
11家企业样品在40℃/75%RH条件下放置1个月后的加速试验表明,各企业样品的溶液澄清度、碱度和有关物质均符合规定,提示本品种胶塞挥发物尚未对产品质量产生相关影响。但仍建议相关企业在长期稳定性实验中进一步关注胶塞相容性的影响。
4 结论
本次注射用美罗培南抽验,全部样品按法定标准检验,结果均符合规定,产品整体质量状况“良好”。然而,探索性研究结果揭示,普通国产制剂与原研产品及通过仿制药一致性评价的产品间仍存在一定的质量差异,通过对制剂中碳酸钠的用量和丙酮残留量的控制,可进一步提高产品的有效性和稳定性。
注射用美罗培南现行质量标准共有7个,质量标准间存在明显差异,建议在《中国药典》2020年版的基础上,统一各质量标准,增加碳酸钠含量测定和丙酮残留量测定,在有关物质项下增加供试品“临用新制”的要求,同时引入杂质A的校正因子。
