抗感染药物杂质对照品的研发策略与展望
2022-03-18姚尚辰冯艳春张夏胡昌勤
姚尚辰 冯艳春 张夏 胡昌勤
(中国食品药品检定研究院,北京 100050)
药物杂质因其可能对药品安全性、有效性和质量产生影响,目前已成为国内外药品监管机构重点关注的内容之一。人用药品注册技术要求国际协调会(ICH)颁布了多项针对杂质的研究指导原则,如原料药、制剂杂质研究指导原则(ICH Q3A、ICH Q3B)、残留溶剂研究指导原则(ICH Q3C)、元素杂质研究指导原则(ICH Q3D)等[1-4]。近年来在国内开展的仿制药质量与疗效一致性评价中,药品审评中心也颁布了一系列评价技术指导原则/要求,其中杂质的研究是关注的重点。在药品审评审批要求的推动下,加之化学分析检验检测技术的不断提升,近年来药物杂质谱的研究得以蓬勃发展。
目前,中国药典和国外通用药典基本都采用高效液相色谱法(HPLC)检测化学药品中的有关物质。伴随着药品质量标准中对杂质控制力度的加大,对复杂体系样本中杂质的分离分析成为杂质谱控制的关键技术问题之一[5],如何快速有效地对杂质进行定位进而定量,成为亟待解决的热点问题。此外,在标准执行过程中,如何对方法进行评价、确认和转移,也成为药品质量控制的难点[6]。鉴于传统的抗生素类药品多来源于发酵或半合成,其组分、杂质组成复杂,纯度相对较低,上述问题尤为突出。而采用适宜的杂质对照品则可以较为直接地解决上述难题[7-8]。为解决日益凸显的杂质检测、定位、控制以及复杂体系方法评价等问题,杂质对照品的研制成为近年来中检院标准物质研制的重点,其主要围绕着研制特定杂质对照品和混合杂质对照品两个方向展开。本文重点介绍抗感染药物杂质对照品的研制策略与方法。
1 特定杂质对照品
1.1 单个特定杂质对照品
对于任一活性物质(API),其杂质通常有多个来源,包括工艺杂质、降解杂质、原辅料混入的杂质等,在其系列杂质中,究竟着力于研究哪些特定杂质并建立对照品是这一工作的关键。对现行质量标准中尚未控制特定杂质的API,科学地研制特定杂质对照品,可以促进药品质量标准的提升,提高药品的内在质量。目前,特定抗感染药物杂质对照品的研制主要考虑以下3个因素:①杂质是否具有明确的毒性反应或与临床中特定副反应密切相关,如遗传毒性杂质和β-内酰胺类抗生素中的聚合物杂质等;②杂质是否具有特定的毒性功能基团,并与母体化合物相比相对毒性反应明显增大;③杂质是否可作为与工艺稳定性密切相关的指针性杂质。此外,对拟进行研制的杂质对照品,还需具有来源清晰、结构明确、候选原料的合成工艺路线简单、合成产物稳定性良好等特点。基于上述原则,近年来,抗感染药物标准物质研制了多个单独或一系列具有质控价值的特定杂质对照品。
以头孢唑林钠品种为例,2-巯基-5-甲基-1,3,4-噻二唑(MMTD)是头孢唑林钠的3位侧链,它不仅是头孢唑林钠合成时用到的中间体,也是其主要降解产物之一。在对头孢唑林和杂质ADMET的预测与安全性评估中发现,头孢唑林钠的毒性作用主要与3-位侧链的MMTD结构相关,MMTD的毒性作用较头孢唑林的毒性强约10倍[9]。基于上述特点,在国内药品质量标准尚未对MMTD进行控制时,中检院2010年率先建立了MMTD定量测定用对照品。头孢唑林钠主要生产企业继而使用该对照品,以MMTD为指针调整和优化生产工艺,修订内控质量标准,使头孢唑林钠出厂时的主要毒性杂质MMTD含量均低于0.1%。中国药典2010年版开始控制头孢唑林钠中的杂质MMTD(杂质E,限度为1.0%)。2003年的国家药品抽检中,国产注射用头孢唑林钠中杂质E的含量为0.1%~0.6%,较2009年数据已经有所提高[10];而2020年国家药品抽检结果显示,在200余批国产注射用头孢唑林钠中杂质E基本均为未检出(未发表资料),提示该品种的质量得以较大幅度地提高。
药物生产过程中使用的中间体及试剂等的残留物也是药品的杂质来源之一。针对毒性残留物等,也需建立相应的特定杂质对照品对其加以控制。2-萘酚是头孢拉定和头孢氨苄等原料合成过程中常用的沉淀剂。2009年国家药品抽检中发现,213批头孢氨苄制剂中有187批检出了2-萘酚,残留量多为0.01%~0.05%,残留量在0.05%~0.1%的样品约占12.7% ,而部分样品中2-萘酚含量已超过0.1%;168批头孢拉定胶囊样品检出了2-萘酚,占总批数的44.2%,最大含量为0.00684%;2-萘酚对皮肤、黏膜有强烈的刺激作用,易经皮肤吸收,对肾脏有强烈的刺激作用,对机体的免疫系统也有一定的抑制和损伤作用,还能通过胎盘屏障、血脑屏障[11]。药品中残留的2-萘酚进入人体存在严重的安全隐患。基于此,中检院开始研制2-萘酚定量测定用杂质对照品,并推动中国药典2015年版在头孢拉定和头孢氨苄各论项下开始收载2-萘酚检查,提高了上述品种的质控水平。
1.2 系列特定杂质对照品
为解决杂质对照品等以往都是在质量标准修订后才开始研制的被动局面,按质量源于设计的理念,中检院提出了抗感染药物先于质量标准研制系列杂质对照品的理念,即按抗感染药物的类别,合成同类不同品种的系列杂质对照品,如喹诺酮类和康唑类[12-13]等系列杂质对照品。这类特定杂质对照品可满足仿制药一致性评价和药品注册对API杂质谱研究的需求,同时也适用于药品质量标准的提高。
系列特定杂质对照品的研制大多需经特殊合成和制备,其研制思路可概括为:首先结合API的结构、生产工艺、降解规律等特点,初步确定目标杂质的结构;再设计合成路线确定合成工艺;得到目标杂质后,按要求开展结构确证;并采用质量平衡法或其他可靠的方法赋值。此外,还应测定杂质的校正因子(响应因子),为后续替代成本较高或稳定性不理想的实物对照品做储备。其主要研制流程见图1。

图1 特定杂质对照品研制流程Fig.1 Development process of specific impurity reference standards
按上述研制思路,目前我们对抗感染药物中的喹诺酮类、康唑类[11-12]、磺胺类等共19个品种建立了70个系列杂质对照品(见表1),如伊曲康唑系列杂质对照品,包括伊曲康唑A、B、C、D、E、F和G共7个杂质对照品,涉及伊曲康唑合成中的副产物、中间体以及降解杂质等。
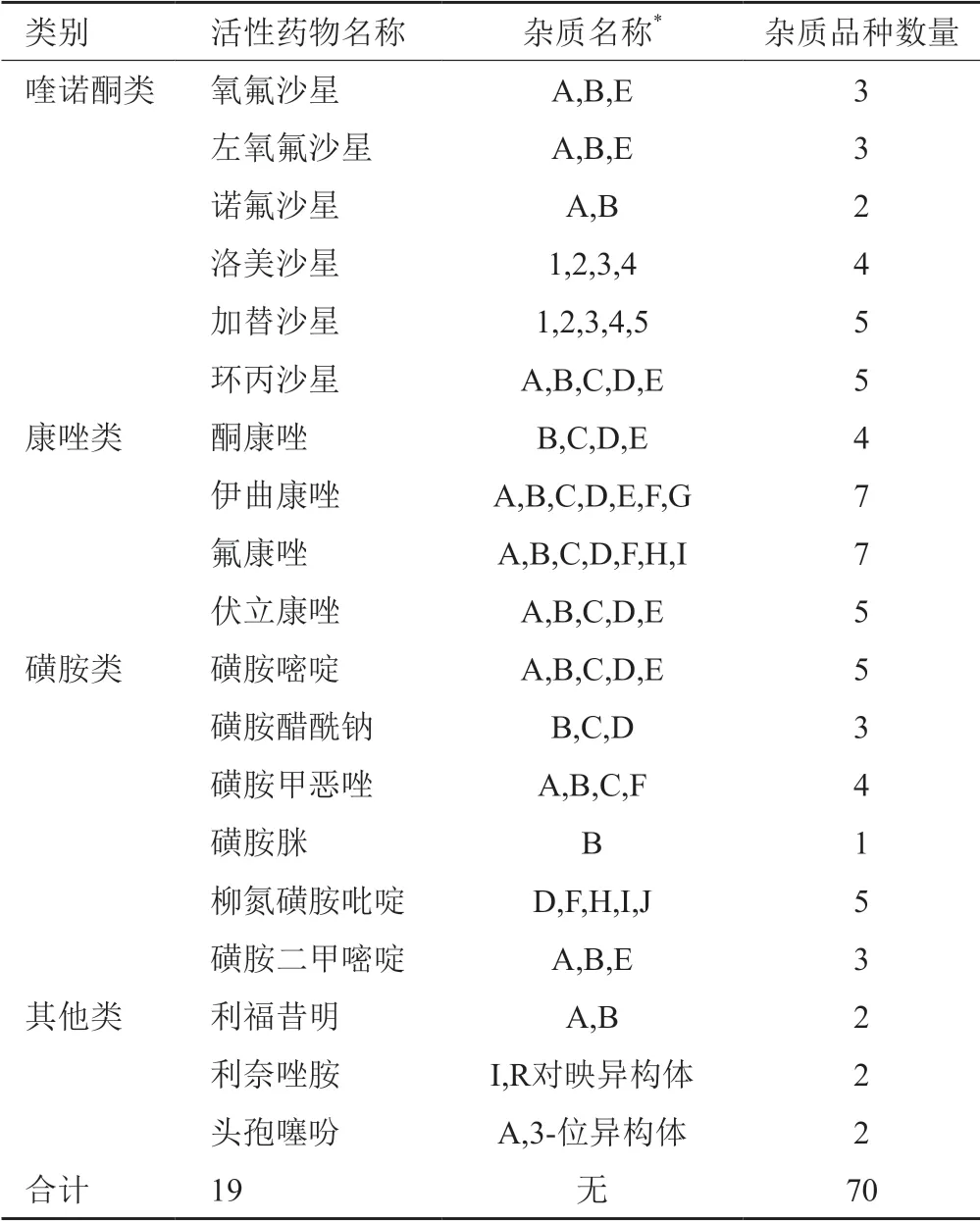
表1 部分系列杂质对照品品种Tab.1 Some species of serial impurity reference standards
此类杂质对照品的建立,为后续相关药物的质量标准提高工作提供了坚实的基础。如在进行加替沙星原料及制剂质量标准的提高时,借助所建立的5个杂质对照品,优化了液相色谱条件,并选择能够有效表征色谱分离情况且易获得的杂质对照品(N-甲基加替沙星、8-羟基加替沙星、8-氟加替沙星和加替沙星N-甲基物)进行系统适用性试验,较原进口注册标准采用2-甲基哌嗪加替沙星杂质对照品进行分离度考察更具有合理性和可行性。
2 混合杂质对照品
制备特定杂质对照品,往往需要耗费大量的人力、物力,且可能仍然无法满意对诸多杂质对照品的需求。目前,各国药典在HPLC有关物质检测中,采用原位降解技术对特定杂质进行定位,或利用杂质与主成分的相对保留时间进行定位是常用的策略。但色谱峰的相对保留时间容易受到不同实验室、不同色谱柱、不同品牌仪器以及实验条件等差异的影响。采用原位降解的方式,通常降解制备过程较为繁琐、产生杂质有限且重现性较差。如何有效地对多个杂质快速进行定位和归属,一直是药品质控中亟待解决的热点和难点问题[7-8]。利于混合杂质对照品进行系统适用性试验,集对色谱系统有效性的评价/确认、杂质的定位于一体,已经越来越多地应用于解决复杂实验体系有关物质分析中杂质的定位、方法的确认和转移等问题。我们也在探讨建立抗感染药物混合杂质对照品的一般方法[14]。
针对不稳定抗生素药品的特点,我们提出了制备不稳定API混合杂质对照品及其应用的思路,其研制流程见图2。应用时,利用混合杂质对照品进行系统适用性试验,评价色谱系统对各杂质的分离情况;利用混合杂质对照品中提供的特定杂质的色谱保留信息和紫外光谱信息等可对样品中的特定杂质进行定位。为加强混合杂质对照品的实用性,在混合杂质对照品的说明书中附标准色谱图谱,并给出获得该色谱图时所采用的色谱柱,以便于使用实验室之间进行比对。目前混合杂质对照品的研制主要针对不稳定的β-内酰胺类抗生素、发酵和半合成来源的大环内酯类抗生素等。从中国药典2010年版起,在中国药典和国家药品质量标准中,已有12个抗生素品种收载了系统适用性对照品(表2)。
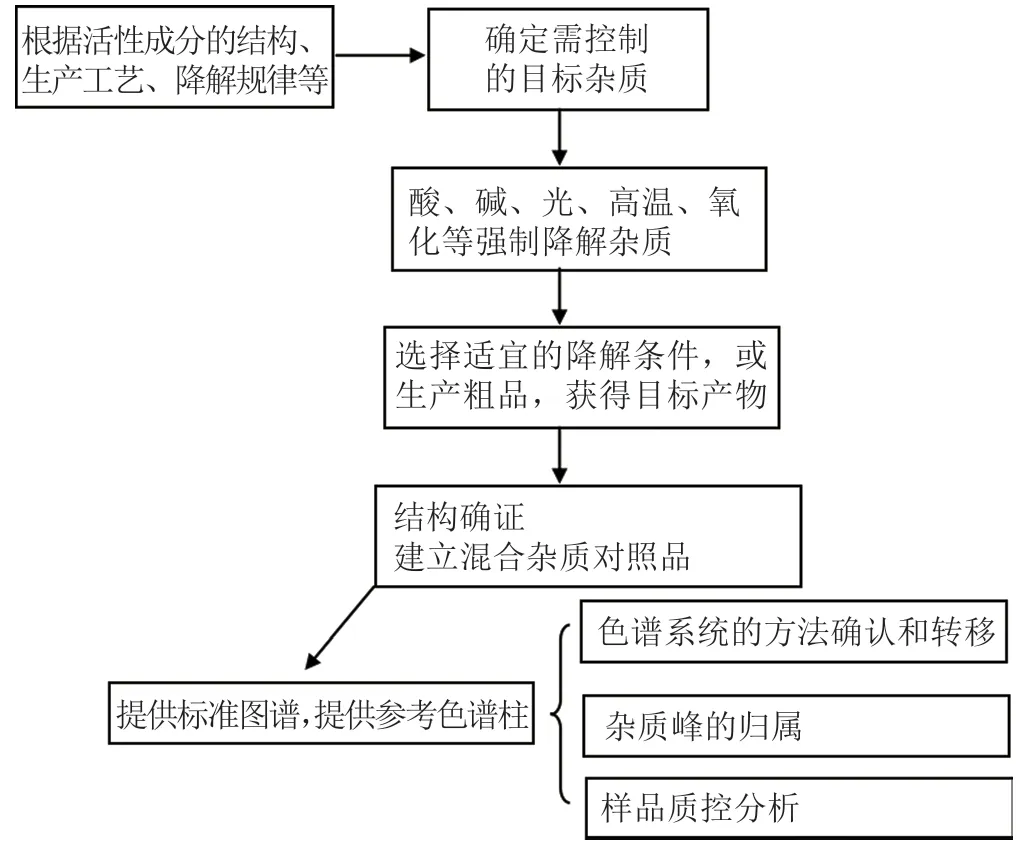
图2 混合杂质对照品研制流程Fig.2 Development process of mixed impurity reference standards
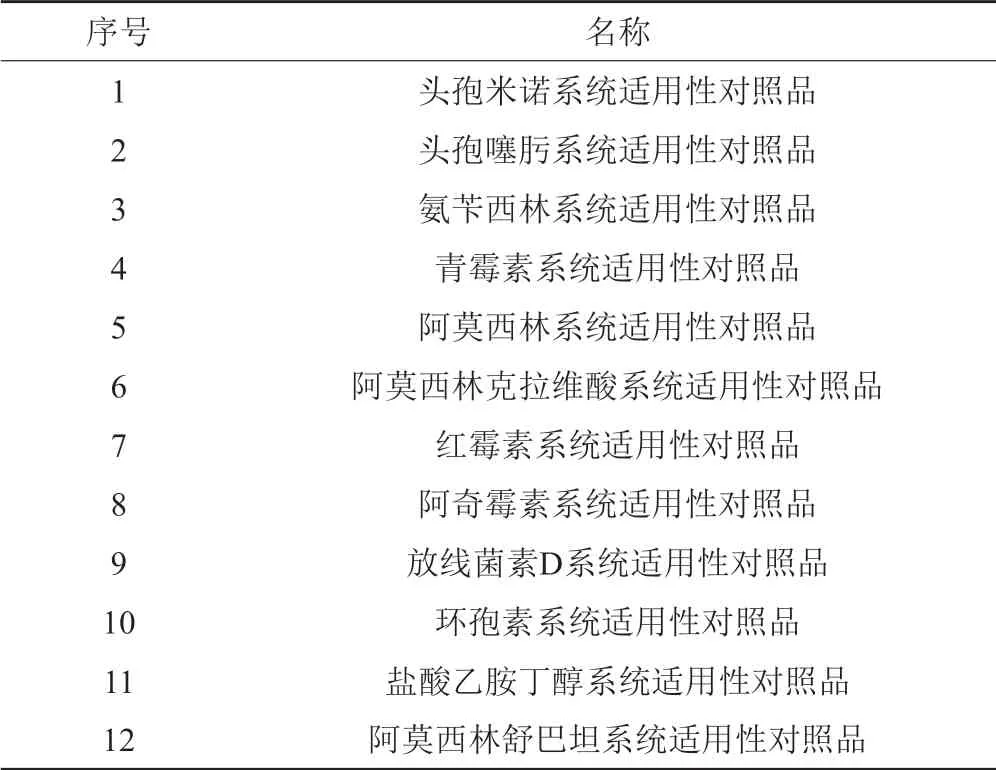
表2 国家药品标准中收载的混合杂质(系统适用性)对照品Tab.2 Mixed impurity reference standards(or system suitability reference standards)contained in the national drug standards
β-内酰胺类抗生素因其稳定性较差,制备混合杂质对照品时主要关注其降解杂质,标准色谱图中需要对重点关注的已知杂质如聚合物杂质等进行定位。由于β-内酰胺类抗生素实际产品中聚合物类杂质采用相对保留时间定位较困难[15],采用原位降解的方法制备该杂质一般需摸索特殊的条件,且常需要放置较长的时间。在制备混合杂质对照品时,通常选择样品宜发生聚合反应的条件,如阿莫西林(图3a)、氨苄西林品种混合杂质对照品(图3b),色谱条件见表3~4,其中的主要聚合物(二聚体、三聚体)色谱峰明显且易被识别,用该混合杂质对照品进行聚合物的定位,增加了检验方法的实用性[8]。

表3 阿莫西林混合杂质(系统适用性)对照品色谱条件Tab.3 Chromatographic conditions of amoxicillin mixed impurity reference standards(or system suitability reference standards)
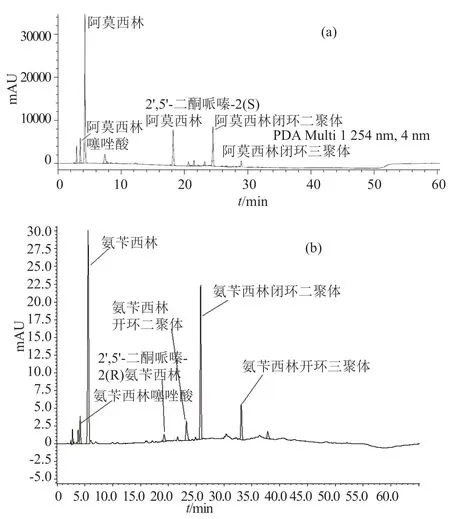
图3 β-内酰胺类品种混合杂质(系统适用性)对照品典型图谱Fig.3 Typical chromatogram of amoxicillin mixed impurity reference standards(or system suitability reference standards)
大环内酯类抗生素多为发酵和半合成来源的品种,杂质谱复杂。制备混合杂质对照品时主要关注发酵过程中产生的工艺杂质、副产物和降解杂质。如阿奇霉素混合杂质对照品,通过在粗品原料中添加部分专门合成的特定杂质而制成(图4a);红霉素混合杂质对照品为特定菌株发酵产生的红霉素粗品(图4b)。上述混合杂质对照品在质量标准中用于系统适用性试验,色谱条件见表5~6,通过控制难分离色谱峰的分离度,不仅可有效地表征色谱系统的有效性,且可以方便地对特定杂质进行定位[16]。

表5 阿奇霉素混合杂质(系统适用性)对照品色谱条件Tab.5 Chromatographic conditions of azithromycin mixed impurity reference standards(or system suitability reference standards)

图4 大环内酯类抗生素混合杂质(系统适用性)对照品典型图谱Fig.4 Typical chromatogram of azithromycin mixed impurity reference standards(or system suitability reference standards)
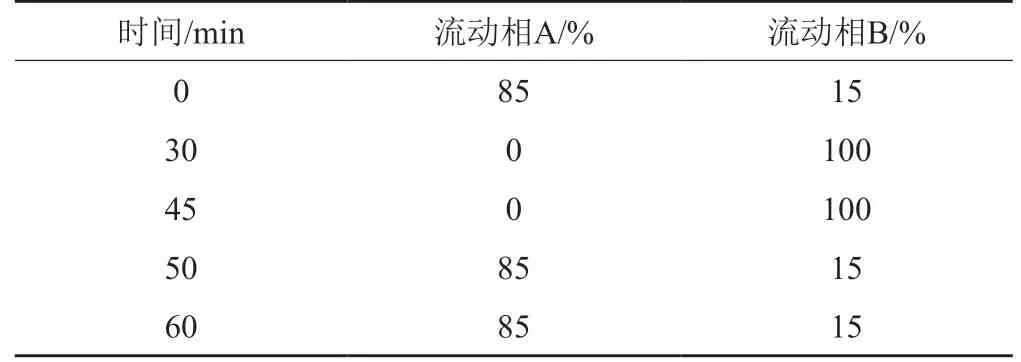
表4 氨苄西林混合杂质(系统适用性)对照品色谱条件Tab.4 Chromatographic conditions of ampicillin mixed impurity reference standards(or system suitability reference standards)
3 需进一步开展的工作
从保证药品的安全性和药品注册的角度,杂质谱研究仍然是当前药品质量研究的重点。目前我们已经基本确定了通过杂质对照品的研制促进药品质量标准提高的策略。但伴随着对杂质谱的全面、深入研究,诸杂质的毒性特性等将更加清晰、明确,是简单地将所有发现的杂质全部列入质量标准,还是根据各个杂质的特性,针对性地选择毒性较强、能够代表工艺或产品稳定性的指针性杂质纳入标准,是杂质谱控制面临的挑战。从提高质量标准的有效性,提高质控效率,降低检验成本的角度,后者更具有优势。因而,杂质对照品的研制不仅是单纯的制备、标定工作,而需要融入药品质量控制的全过程。
在药品质量标准中通过对特定杂质的控制保证产品的安全、有效是产品质量控制的发展方向。利用特定杂质对照品和混合杂质对照品虽然可以解决色谱分析中部分杂质定位、定量方面的问题,但对于性质不稳定或不易获得的杂质,一味强调利用实物对照品也会给药品生产企业带来巨大的压力。中国药典2020年版已在四部通则0512高效液相色谱法中增订了利用光谱相似度定性和利用质谱检测器定性的一般要求[17];鉴于此,开展和推进杂质对照品的数字化研究,即将杂质的相关定性和定量信息,如色谱行为、UV、MS、校正因子等形成数据库[18],用于药品的杂质研究和检测中,是提高药品质量研究效率和科学性的有效途径。

表6 红霉素混合杂质(系统适用性)对照品色谱条件Tab.6 Chromatographic conditions of erythromycin mixed impurity reference standards
