碳水化合物结合域CBM3对外切葡聚糖酶性质的影响
2022-03-17胡艳梅周姗娜乔琦茗李华南江正兵
胡艳梅,周姗娜,乔琦茗,李华南,江正兵
(湖北大学生命科学学院,省部共建生物催化与酶工程国家重点实验室, 湖北 武汉 430062)
0 引言
目前世界范围内化石燃料的迅速枯竭,造成了一种紧迫的局面,需要一种潜在的替代品来克服目前的能源危机.木质纤维素生物质由于其巨大的可获得性、廉价和可再生的特性而成为工业规模开发的合理候选者.利用木质纤维素生物质来生产生物燃料和其他有价值的化学品是一种利润丰厚、可持续和有前景的方法[1-2].而纤维素酶的酶促水解可以将木质纤维素水解为可发酵的糖,是将木质纤维素生物质转化为有价值的产品的前提.纤维素酶的高成本是限制酶水解的主要因素,因此需要纤维素酶具有较高的催化活性,从而实现纤维素材料的高效水解过程[3-4].纤维素酶是由各种微生物产生的,包括细菌、真菌和放线菌.纤维素酶是通过水解β-1,4-糖苷键来分解纤维素的酶类,根据其作用方式可以分为3大类:内切葡聚糖酶(EG)、外切葡聚糖酶(CBH)和β-葡萄糖苷酶(BG)[5].
大多数的真菌纤维素酶,特别是外切葡聚糖酶具有模块化的结构,包括催化结构域(CD)和碳水化合物结合域(CBM),两者之间通过高度糖基化的柔性接头连接[6].CBM是具有自主折叠和熟练识别异质复杂碳水化合物排列的辅助域,它可能存在于生命的任何领域,主要存在于识别多糖的蛋白质中[7].它以单个或多个域的形式存在于蛋白质的催化结构域的C端或者是N端,只具有结合能力不具有催化活性.碳水化合物结合域一般含有30~200个氨基酸,大小为20~40 kD[8].根据其氨基酸序列的相似性,可以将其划分为为88个家族.根据其配体结合位点的拓扑结构与它们识别的配体的种类,可以将碳水化合物结合域划分为3种类型:A型、B型和C型[9].A型CBM具有有芳香族残基组成的平坦或平台疏水状表面,A型CBM的结合位点的平面构象与结晶多糖如纤维素的平面相互作用,识别并结合结晶多糖.与A型CBM相反,B型CBM结合非晶态纤维素或木聚糖,其结合位点结构呈现出芳香族残基与自由单链多糖作用的裂缝排列.C型CBM由于结合位点的空间位阻,他们只能结合单糖、二糖或三糖[10].文献表明CBM的主要功能是识别并特异性地结合不溶性的纤维素,将纤维素酶的催化结构域靶向纤维素底物,从而增加纤维素酶对底物的亲和性和水解活性[11].目前CBM促进纤维素酶水解的机制尚未完全明确,推测CBM通过两种可能的机制增强纤维素酶对不溶性底物的催化活性:CBM能够增加纤维素酶对底物的可及性,从而增加底物上的有效酶浓度,导致催化速率的增加[12];CBM破坏了底物的晶体结构,暴露出更多的纤维素酶结合表面,从而促进酶与更多可用底物分子的接触[13].基于CBM这样的功能,将不同的CBM与纤维素酶的催化结构域融合开发嵌合酶是改善酶的水解效率的有效方法.在多项研究中,嵌合酶已被证实可以改善催化效率、热稳定性及底物特异性[14-15].
1 材料与方法
1.1 菌株、质粒、试剂大肠杆菌克隆菌株E.coliDH5α和E.coli. XL10-Gold均为本实验室保存;毕赤酵母(Pichiapastoris)表达菌株X33和表达质粒pPICZαA均购买自湖南丰晖生物科技有限公司.pINA1297-CBH和pET-23a-CBM3质粒为本实验室保存.DNA聚合酶Phanta Max Super-Fidelity DNA Polymerase购自南京诺唯赞生物科技股份有限公司、T5核酸外切酶及限制性核酸内切酶等都购买自Takara和NEB代理商武汉友名生物技术有限公司;所有的化学试剂均购买自Sigma-Aldrich公司和国药集团化学试剂有限公司.磷酸膨胀纤维素(P-Avicel)为本实验室制备.
1.2 方法
1.2.1 表达载体的构建 以pINA1297-CBH质粒为模板,通过引物CBH-F和CBH-R扩增出CBH基因;以pPICZαA质粒为模板,通过引物来反扩载体pPICZαA,扩增引物如表1所示.将扩增的CBH片段与pPICZαA载体用DpnI消化,再用T5核酸外切酶进行消化,以获得重组表达载体pPICZαA-CBH.

表1 引物序列
以pET-23a-CBM3质粒为模板,通过相应的引物将CBM3片段扩增下来;再通过相应的引物进行重叠延伸PCR,扩增出片段CBM3+CBH.再将扩增的CBM3+CBH片段与反扩的pPICZαA载体分别DpnI进行消化,再用T5核酸外切酶进行消化,以获得重组表达载体pPICZαA-CBM3-CBH.
1.2.2 酶的表达与纯化 毕赤酵母菌株X33用于克隆基因的表达.将活化的毕赤酵母重组菌株接种到BMGY培养基进行二次活化,再转接到BMMY培养基进行诱导表达.每隔24 h向BMMY液体培养基中加入0.8%的甲醇诱导,连续诱导5 d.诱导完成后将菌液上清用塞多利斯超滤膜包(购自德国塞多利斯股份公司)进行浓缩,将浓缩的上清用Ni柱进行纯化.将纯化的蛋白用12% (w/w) SDS-PAGE进行分析.
1.2.3 结合实验分析 CBH、CBM3-CBH对Avicel结合能力的测定.将适量的重组蛋白与50 mg Avicel和磷酸盐缓冲液(pH 7)置于离心管中,充分混合,使最终体积为1 mL,蛋白的初始浓度为0.5 mol/L.置于圆周摇床上于4 ℃孵育1 h.孵育后在12 000 r/min离心5 min,测定上清的蛋白浓度.比较结合前后蛋白浓度的差值,分析酶对Avicel的结合能力.
1.2.4 酶活性的分析 外切葡聚糖酶的酶活性由3,5-二硝基水杨酸(DNS)法测定,使用滤纸(FP)、玉米秸秆(CS)、羧甲基纤维素钠(CMC-Na)、微晶纤维素(Avicel)和预处理的微晶纤维素(P-Avicel)作为底物.将50 μL纯化的酶液(CBH、CBM3-CBH)和450 μL的0.1 mol/L的柠檬酸盐缓冲液加入到含有底物的1.5 mL的离心管中,充分混合.将混合物置于55 ℃水浴锅中反应10 min,反应后立即取出,放入100 ℃沸水浴中处理10 min灭活.12 000 r/min离心5 min,取上清与DNS于100 ℃反应10 min,置于冰上冷却至室温,然后测定OD540处的吸光值.酶活单位(U)的定义为每分钟反应生成1 μmol还原糖所需要酶的量.
1.2.5 温度和pH对酶活性的影响 为了研究pH对外切葡聚糖酶活性的影响,反应在不同pH值下进行(pH 3~6, 0.1 mol/L柠檬酸盐缓冲液; pH 7~8, 0.1 mol/L的磷酸盐缓冲液; pH 9~11, 0.1 mol/L的甘氨酸-氢氧化钠缓冲液),在60 ℃下使用50 mg的Avicel作为底物.为了研究温度对纤维素酶活性的影响,反应在不同的温度梯度下进行(35~75 ℃),在pH为6的0.1 mol/L柠檬酸盐缓冲液中,使用50 mg的Avicel作为底物.
2 结果分析
2.1 酶的表达与纯化外切葡聚糖酶CBH及其融合酶CBM3-CBH在毕赤酵母X33中成功表达(图1),根据分子量估计纯化的CBH和CBM3-CBH大小分别是56.5 kD和77 kD.通过SDS-PAGE分析,结果显示CBH和CBM3-CBH的目的条带均与预期大小相符(图2).

图1 CBM3与CBH融合结构示意图
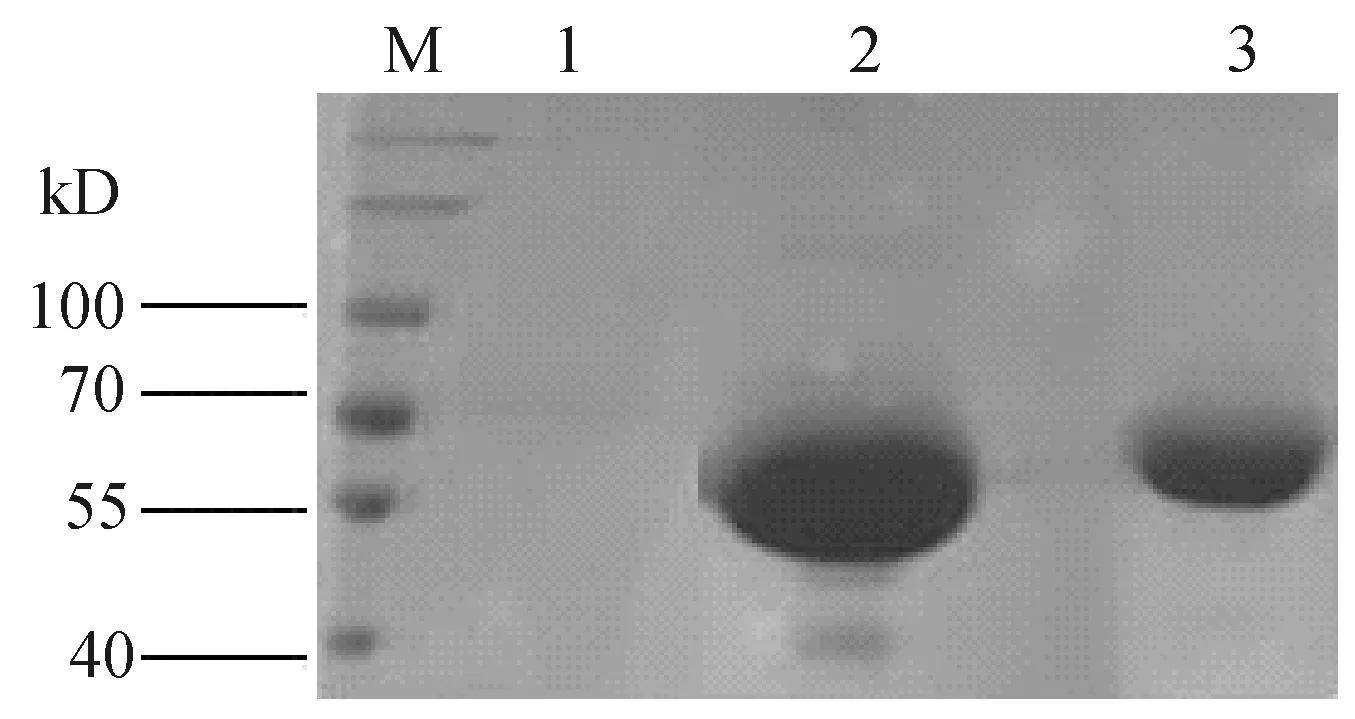
M:蛋白分子标准;1:X33空白对照;2:纯化的CBH;3:纯化的CBM3-CBH图2 SDS-PAGE分析纯化的酶
2.2 外源的CBM对外切葡聚糖酶催化活性的影响分析比较了外切葡聚糖酶融合酶CBM3-CBH和天然外切葡聚糖酶CBH对FP、CS、CMC-Na、Avicel和P-Avicel这几种底物的催化活性,探究外源的碳水化合物结合域对外切葡聚糖酶催化活性的影响(图3).结果表明,CBH和CBM3-CBH对FP和CS无活性,对CMC-Na有比较微弱的活性,对Avicel有较高的活性,对P-Avicel的活性最高.CBH和CBM3-CBH对于CMC-Na的活性分别为0.138 U/mL和0.137 U/mL;对于Avicel的活性分别为1.19 U/mL和1.11 U/mL;对P-Avicel的活性分别为3.23 U/mL和3.25 U/mL.从上述数据可以看出CBM3-CBH和CBH两者对不同底物的催化活性无显著差异,说明融合外源的碳水化合物结合域对天然外切葡聚糖酶CBH的催化活性无实质性影响.

图3 外切葡聚糖酶及其融合酶对不同底物的催化活性
2.3 外源的CBM对外切葡聚糖酶底物结合能力的影响分析比较了外切葡聚糖酶融合酶CBM3-CBH和天然外切葡聚糖酶CBH对Avicel的结合能力,探究外源的碳水化合物结合域对外切葡聚糖酶底物结合能力的影响(图4).经3次平行试验结果分析,CBH和CBM3-CBH与Avicel结合前后蛋白浓度的差值分别为0.32 mg/mL和0.348 mg/mL,CBM3-CBH对Avicel的结合能力比CBH高约8%,说明外源的碳水化合物结合域能够在一定程度上提高外切葡聚糖酶对底物的结合能力.

图4 外切葡聚糖酶及其融合酶对Avicel的结合
2.4 外源的CBM对外切葡聚糖酶最适反应温度及pH的影响分析比较了外切葡聚糖酶融合酶CBM3-CBH和天然外切葡聚糖酶CBH的最适反应温度和最适反应pH,探究外源的碳水化合物结合域对外切葡聚糖酶最适反应温度及pH的影响.结果表明,CBH和CBM3-CBH适宜的pH范围均为5~7,最适反应pH均为6,当pH高于7时,酶活力下降的很快,当pH为10时,酶活力仅为最适pH的20%左右(图5A).从CBH和CBM3-CBH两者适宜的温度范围都是50~65 ℃,最适反应温度都是60 ℃,当反应温度高于65 ℃时,酶活力显著下降,反应温度为80 ℃时,酶活力仅为最适反应温度的20%(图5B).说明外源的碳水化合物结合域不影响外切葡聚糖酶的最适反应温度与最适反应pH,也不影响其适宜的反应温度范围与pH范围.

图5 外切葡聚糖酶及其融合酶的最适反应温度和pH
3 讨论
居多研究表明,通过CBM与不同的糖苷水解酶(如脂酶、纤维素酶、木聚糖酶等)的融合,可以促进酶与底物的结合,提高酶的催化效率,从而促进酶的水解[16-17].在我们的研究中,探究了融合外源的CBM对外切葡聚糖酶的催化活性、对底物的结合能力及最适反应温度及pH的影响.CBM3-CBH和CBH对于不同底物的催化活性,未表现出显著的差异;但是CBM3-CBH对Avicel的结合能力比CBH高8%.这表明融合外源的CBM在一定程度上能促进外切葡聚糖酶对底物的结合,但是对其催化活性没有影响.本研究结果与之前文献报道的融合CBM可以提高纤维素酶的催化活性[14, 18],影响纤维素酶的最适反应温度、热稳定性及pH稳定性[19-20]这一结论不相符,CBM在纤维素酶催化过程中的作用及其作用机制有待进一步探究.后期将选择不同家族的CBM,通过其与纤维素酶CD区融合、自身CBM替换、自身CBM缺失等多种方式,系统比较不同家族的CBM对纤维素酶催化活性及酶学性质的影响,并通过结构分析阐述其可能的作用机制.
4 结论
在本研究中,探究了外源的CBM对外切葡聚糖酶性质的影响,比较了天然外切葡聚糖酶CBH和其融合酶CBM3-CBH对Avicel的结合能力,对不同底物的催化活性,最适反应温度及pH.结果显示CBM3-CBH和CBH对不同底物的催化活性没有显著差异,但是CBM3-CBH对Avicel的结合能力略高于CBH.表明融合外源的CBM能在一定程度上提高外切葡聚糖酶对底物的结合能力,对其催化活性没有影响.CBM3-CBH和CBH两者的最适反应温度都是60℃,最适反应pH都是6,并且两者适宜的温度范围及pH范围都相同,表明融合外源的CBM对外切葡聚糖酶的最适反应温度与最适反应pH无影响.本研究为探究CBM在纤维素酶催化过程中的作用机制奠定了良好的基础.
