长链非编码RNA TTY15通过海绵miR337-3p上调JAK2促进舌鳞状细胞癌的生长和转移
2022-03-16张婷郑见宝
张婷 郑见宝
舌鳞状细胞癌(tongue squamous cell carcinoma,TSCC)是口腔鳞癌(oral squamous cell carcinoma,OSCC)最常见的类型,以其高转移、高增殖能力而著称[1]。尽管近年来在舌鳞状细胞癌治疗管理方面取得了进展,舌鳞状细胞癌的死亡率仍然很高[2]。长链非编码RNA(long non-coding RNAs,lncRNAs)是一种长度>200 nt、无蛋白质编码能力的非编码RNA。据报道,lncRNAs参与了肿瘤发生的一系列调控,包括癌变、细胞增殖、迁移、侵袭和凋亡等[3]。TTTY15作为一种致癌的lncRNA,在癌症中有被报道。例如,TTTY15可通过海绵 microRNA let-7促进前列腺癌的发展[4]。然而,与舌鳞状细胞癌有关的TTTY15的生物学功能和机制还未阐明。研究表明miRNAs参与调节各种基本的生物学过程,并与肿瘤学的进展有关[5]。此外,研究发现miR-337-3p可通过下调Rap1A蛋白的表达抑制宫颈癌细胞的增殖、迁移和侵袭[6]。然而,miR-337-3p在舌鳞状细胞癌中的效应尚未阐明。调控细胞凋亡和增殖的信号通路的分子往往对肿瘤进展有重要影响。JAK2是一种非受体酪氨酸激酶,参与了许多调控细胞凋亡和增殖的信号通路,是肿瘤组织中表达最显著的基因[7,8]。有研究显示,miR-337-3p可通过靶向作用于JAK2抑制肝癌细胞的增殖和侵袭[9]。然而,作用于JAK2的miR-337-3p在舌鳞状细胞癌中的作用尚未完全阐明。本研究中,我们探讨TTTY 15在舌鳞状细胞癌中的潜在作用,并在体外研究TTTY15对舌鳞状细胞癌细胞的生物学作用。
1 材料与方法
1.1 病理组织收集 选取我院收治的舌鳞状细胞癌患者40例,通过手术获得了40份舌鳞状细胞癌样本和相应的癌旁正常组织,样本经病理检测为舌鳞状细胞癌。纳入标准:(1)术前未接受放疗、化疗;(2)手术切除肿瘤,术后经病理诊断证实为舌鳞状细胞癌;(3)临床病理资料完整;(4)签署知情同意书。排除标准:(1)合并慢性疾病(如冠心病、高血压、糖尿病等)者;(2)合并其他系统恶性肿瘤者;(3)合并感染性疾病者。切除的癌症和相应的癌旁正常组织被切割后立即储存在液氮中直到RNA提取。
1.2 实验材料 舌鳞状细胞癌细胞系(SCC4, SCC1, UM1 和 Cal27)和口腔角质形成细胞系(NHOK)购自中国上海科学院细胞银行, 在RMPI-1640培养基(美国Gibca公司)中培养,培养基含10%牛胎血清(鼎国公司,批号:TH20190412),条件为37℃,5%CO2。miR-337-3p mimics以及相应的对照组mimic阴性对照购自广州瑞博生物科技有限公司。使用上海吉凯生物科技有限公司设计并合成的sh-TTTY15敲低TTTY15的表达和相应的对照sh-NC。pcDNA3.1-TTTY15购自Genepharma。转染试剂Lipofectamine 2000(批号:JT20190408)购自Invitrogen公司。CCK-8试剂盒(批号:20190320)购自日本TaKaRa公司。聚合酶链式反应(polymerase chain reactio,PCR)试剂盒(批号:120114578ST)购自日本TaKaRa公司。
1.3 定量实时PCR分析 用Trizol试剂从组织或细胞中提取总RNA。用M-MLV RTase cDNA合成试剂盒(Takara),根据制造商的指示,将RNA反向转录成cDNA。在ABI PRISM 7700仪器(Thermo Fisher Science)上,用SYBR greener qPCRSuperMix(Thermo Fisher Science)进行定量实时PCR(qRT-PCR)检测。PCR扩增首先在95℃起始变性15 min,然后95℃下进行30 s, 58℃下进行30s,72℃下进行30 s, 以及最后一步在72℃下进行10 min的35次循环。然后,用直接测序法对单个PCR反应中产生的扩增产物进行分析。以GAPDH为检测TTTY15,miR-337-3p和JAK2表达水平的内参,采用2-ΔΔCt方法进行统计。每个实验重复3次,测量3次。见表1。
1.4 CCK-8法 采用CCK-8法测定细胞增殖。细胞接种于96孔板中,密度为5 000个/孔,培养1、2、3和4 d。在指定的时间点加入10 μl CCK-8试剂到每孔中。37℃孵育2 h后,在450 nm处测定吸光度。每个实验重复3次,每次测量3次。
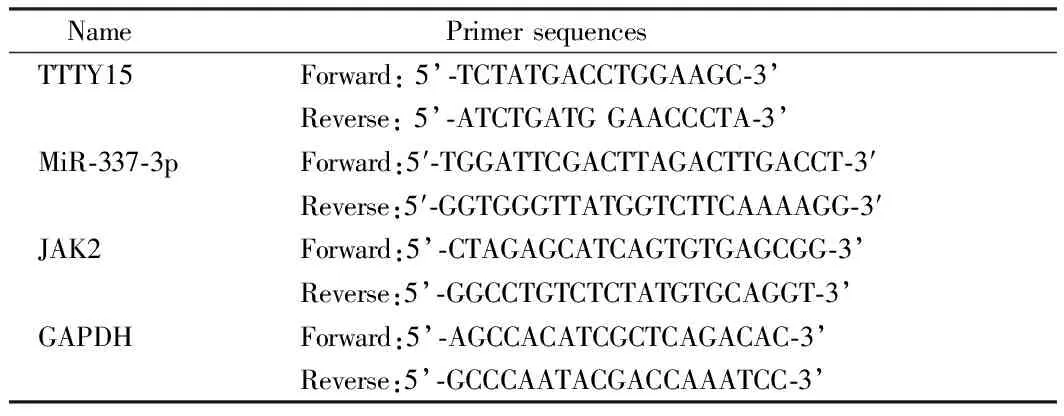
表1 qRT-PCR引物序列
1.5 Transwell 实验 细胞接种在装有小室的24孔板中,每组设置2个复孔。舌鳞状细胞癌细胞悬浮在无血清培养基的上室(约105个细胞/孔,8 μm孔径;BD Biosciences),下室内加入500 μl含10%的胎牛血清的RMPI-1640培养液。24 h后,用棉签轻轻地拭去上室表面的细胞(即未侵入下室的细胞),侵入下室的细胞采用甲醇固定,然后用结晶紫染色。在倒置显微镜下随机选取5个视野(包括膜的中央和周边),计数侵入下室的细胞数目。侵袭实验的Transwell小室底部覆有基质胶,其他步骤同迁移实验。
1.6 双荧光素酶报告基因检测实验 所有荧光素酶报告载体(TTTY15-WT、TTTY15-MUT)均由Ribo生物公司构建。将细胞(4.5×104)接种于48孔板中,培养至70%汇合。然后用脂质体2000将TTTY15-WT或TTTY15-MUT与miR-337-3p模拟物或阴性对照物共转染细胞。转染48 h后,按照制造商的说明测定荧光素酶活性。所有实验一式三份,重复3次。
1.7 Western blot 采用RIPA缓冲液(ThermoFisher Science)对细胞进行裂解,收集总蛋白。用BCA法测定蛋白质浓度。分别采用5%的SDS-PAGE浓缩胶和10%的SDS-PAGE分离胶分离蛋白,并将其转移到PVDF膜上。在5%的脱脂牛奶封闭后,首先用特异性抗体孵育膜:JAK2(稀释1∶1 000,Cell Signaling Technology)和GAPDH(稀释度1∶2 000,Santa Cruz)抗体检测膜。然后与山羊抗兔(1∶5 000,ab6721;Abcam)进行二次抗体孵育膜。使用ECL试剂盒(Amersham Pharmacia Biotech,Little Chalfont,UK)进行显影,采用ImageQuant LAS 4000微型生物分子成像仪(GE Healthcare)进行拍照。GAPDH被用作内部参考。用ImageJ软件进行western blot定量分析。

2 结果
2.1 TTTY 15在舌鳞状细胞癌组织和细胞系中表达上调 通过qRT-PCR分析发现,与正常对照组织相比,舌鳞状细胞癌样品中TTTY15表达显著增加(P<0.05)。与口腔角质形成细胞系(NHOK)相比的所有四个舌鳞状细胞癌细胞系(SCC4、SCC1、UM1和Cal27)中,TTTY15表达显著上调(P<0.05)。见表2、3。

表2 舌鳞状细胞癌组织和相应的癌旁正常组织中TTTY15的表达情况比较

表3 SCC4、SCC1、UM1和Cal27细胞系中TTTY15的表达情况比较
2.2 敲低TTTY 15可抑制舌鳞状细胞癌细胞的增殖、迁移和侵袭 成功建立TTTY15低表达细胞模型,采用CCK-8实验检测TTTY15低表达组和对照组的细胞增殖情况。与对照组相比,TTTY15低表达组可显著抑制细胞的增殖。使用Transwell实验评估了TTTY15低表达对细胞迁移和侵袭的影响,与对照组相比,TTTY15低表达的迁移和侵袭能力较弱。见图1,表4。

图1 Transwell迁移和侵袭实验检测sh-TTY15对舌鳞状细胞癌细胞的迁移和侵袭影响
表4 CCK-8实验检测sh-TTY15对舌鳞状细胞癌细胞的增殖影响
2.3 MiR-337-3p在舌鳞状细胞癌中下调并可与TTTY15结合 使用生物信息学数据库来寻找TTTY15的潜在目标基因。TTTY15包含miR-337-3p的保守目标位点。为确认TTTY15与miR-337-3p之间的直接相互作用,采用双荧光素酶报告法。双荧光素酶检测显示miR-337-3p对TTTY15-WT的报告活性有明显的抑制作用,但对TTTY15-MUT没有抑制作用。TTTY15与miR-337-3p的表达呈负相关。见表5,图2、3。
表5 荧光素酶报告基因法检测miR-337-3p对TTTY15-WT和TTTY15-MUT的影响

图2 TTTY15的野生型和突变型与miR-337-3p结合位点的示意图
2.4 转染miR-337-3p可促进舌鳞状细胞癌细胞的增殖、迁移和侵袭 将miR-337-3p mimics转染到细胞中,成功构建了miR-337-3p过表达模型。CCK-8实验显示,过表达miR-337-3p可明显抑制细胞的增殖。通过transwell迁移和侵袭实验,我们观察到miR-337-3p的过表达显著地减少了细胞的迁移和侵袭。见表6,图4。
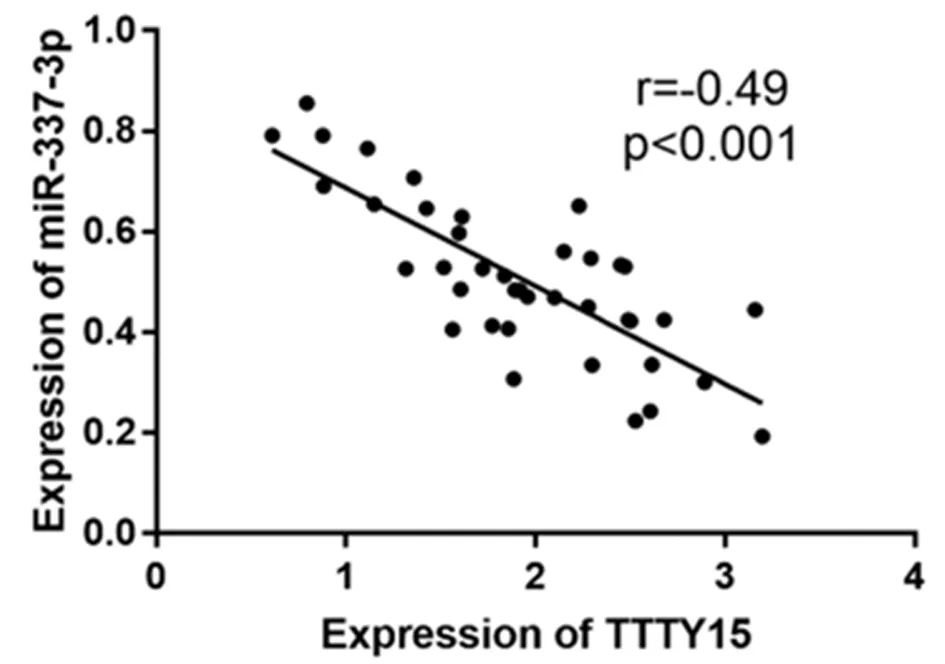
图3 TTTY15与miR-337-3p的皮尔逊相关系数分析
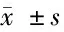
表6 CCK-8实验检测过表达miR-337-3p对 细胞的增殖的影响

图4 Transwell迁移和侵袭实验检测miR-337-3p对舌鳞状细胞癌细胞的迁移和侵袭影响
2.5 TTTY 15通过抑制miR-337-3p的功能,促进JAK 2的表达和舌鳞状细胞癌的生长 将miR-337-3p mimics和TTTY15 + miR-337-3p mimics共转染细胞。发现TTTY15在转染miR-337-3p mimics的细胞中下调,但这一现象在共转染过表达TTTY15和miR-337-3p mimics的细胞中逆转。转染miR-337-3p mimics的细胞中JAK2的mRNA和蛋白表达水平升高,而TTTY15 的过表达逆转了该效应, 这表明TTTY15可以通过抑制舌鳞状细胞癌细胞中的miR-337-3p诱导JAK2的表达。接下来,我们研究TTTY15是否能恢复miR-337-3p mimics转染对舌鳞状细胞癌细胞的影响。我们发现miR-337-3p mimics抑制了舌鳞状细胞癌细胞增殖和转移,而TTTY15的转染部分地消除了miR-337-3p mimics对舌鳞状细胞癌细胞增殖和转移的影响。见图5、6,表7、8。

图5 Transwell迁移和侵袭实验检测TTTY15+miR-337-3p共转染对舌鳞状细胞癌细胞的迁移和侵袭影响
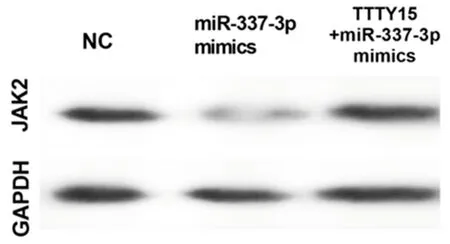
图6 Western blot 法检测蛋白表达水平
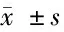
表7 CCK-8实验检测过表达TTTY15 + miR-337-3p对细胞增殖的影响
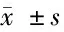
表8 Western blot 法检测3组细胞的JAK2蛋白表达水平
3 讨论
有证据表明,lncRNAs参与了许多重要的生物学过程,包括肿瘤发生和转移,从而为大多数肿瘤提供了潜在的治疗靶点[10]。因此,研究舌鳞状细胞癌中lncRNAs的生物学功能及其机制,可为临床治疗提供有价值的治疗靶点。
近年来,lncRNAs已在多种肿瘤细胞中被发现,这为肿瘤的治疗带来了战略性的改变,lncRNAs也是如今很多研究的重点。在舌鳞状细胞癌中曾报道过lncRNAs的调节障碍,与舌鳞状细胞癌相关的lncRNA的研究可提供预后和疾病监测标记并可能提供潜在的新的治疗靶点,例如,lncRNA GIHCG通过调节miR-429促进舌鳞状细胞癌的进展[11]。LncRNA TUC338过表达可在体外促进舌鳞状细胞癌细胞增殖并抑制舌鳞状细胞癌细胞凋亡[12]。LncRNA CASC15通过靶向miR-33a-5p促进舌鳞状细胞癌的进展[13]。受这些研究的启发,我们试图确定TTTY15在舌鳞状细胞癌中的作用。我们在40例舌鳞状细胞癌组织及癌旁正常组织对照组中检测到TTTY15,数据显示,TTTY15在舌鳞状细胞癌组织中的表达明显升高,而TTTY15高表达的患者预后比低表达者差。TTTY15在舌鳞状细胞癌中的高表达可以促进舌鳞状细胞癌细胞的增殖,侵袭和迁移。
miRNAs可作为促肿瘤基因或抑肿瘤基因调节肿瘤的进展。例如,双重功能的miRNA-186-5p可靶向FGF 2和RelA抑制多形性胶质母细胞瘤的发生[14]。miR-106a-363可促进尤文肉瘤的生长[15]。另外,越来越多的证据表明miRNAs的失调与舌鳞状细胞癌发病机制有关。例如,miR-183可促进舌鳞状细胞癌细胞株SCC25细胞凋亡[16]。miR-22通过抑制CD147表达抑制舌鳞状细胞癌细胞的侵袭、迁移和增殖[17]。miRNA-802通过靶向MAP2K4抑制舌鳞状细胞癌的进展[18]。与此同时,miR-337-3p的过表达在癌症发生和发展的许多细胞过程中起着抑癌的作用。例如,miR-337-3p通过调节CAPN4来抑制透明细胞肾癌细胞的增殖和转移[19]。miR-337-3p可靶向STAT3和RA1A调节非小细胞肺癌中的紫杉烷敏感性,miR-337-3p表达缺失可促进胃癌的淋巴结转移[20]。在本研究中,我们发现与癌旁正常组织相比,miR-337-3p在舌鳞状细胞癌组织中显著下调。miR-337-3p的过表达在体外抑制了舌鳞状细胞癌细胞的增殖、迁移和侵袭。
miRNA和lncRNA的相互作用在舌鳞状细胞癌发生中的确切作用尚不清楚。了解miRNA和lncRNA之间的相互作用,将极大地促进恶性肿瘤基于miRNA/lncRNA的诊断和治疗的发展。例如,上调的Lnc-SNHG1通过阻断miR-577和激活WNT2B/Wnt/β-catenin途径促进骨肉瘤的进展[21]。LncRNA SNHG20通过调节miR-495参与乳腺癌细胞的增殖、侵袭和迁移过程[22]。Lnc-SNHG1可作为miR-497的海绵促进非小细胞肺癌的进展[23]。本研究中,我们通过生物信息学分析预测了TTTY15与miR-337-3p之间的结合位点,并用双荧光素酶报告法证实miR-337-3p中含有TTTY15的结合位点。此外,我们还证实了TTTY15与miR-337-3p直接结合。我们还发现,在舌鳞状细胞癌细胞中,TTTY15通过抑制miR-337-3p的表达发挥了促癌作用。表明TTTY15直接靶向并下调miR-337-3p的表达从而影响舌鳞状细胞癌的进展。
据报道,JAK2在几乎所有组织中表达并与许多病理进展相关,而且JAK2在一些癌症中充当癌基因[23]。例如,JAK2过表达是鼻咽癌预后不良的预测因子[24]。JAK2基因敲除通过STATs和PI3K/AKT信号通路诱导肝癌细胞凋亡、自噬和抗增殖作用[25]。此外,JAK2是人类癌症中多个miRNAs的直接下游靶点,例如,胰腺癌中miR-216a的下调可能导致JAK 2过度表达和/或异常激活,从而加剧胰腺癌的发展[26]。MiR-375通过靶向JAK2抑制胃癌细胞的增殖和转移[27]。而在肝癌中,JAK2已经被证明是miR-337-3p的直接靶点。在本研究中,TTTY15的过表达抑制miR-337-3p的表达,而促进JAK2的表达。因此,我们认为TTTY15可以通过靶向miR-337-3p参与调节舌鳞状细胞癌组织和细胞中JAK2的表达。
综上所述,我们强调TTTY15作为“ceRNA”通过sponge miR-337-3p来促进JAK2的表达,从而在体外促进舌鳞状细胞癌的进展。我们的研究结果为舌鳞状细胞癌的发病机制提供了新的思路,也为舌鳞状细胞癌的治疗提供了潜在的靶点。
