rDNA和端粒重复序列鉴定马铃薯和茄子体细胞杂种染色体丢失和融合
2022-03-16王海波应静文叶文宣蔡兴奎宋波涛
王海波 应静文 何 礼,3 叶文宣 涂 卫 蔡兴奎 宋波涛,* 柳 俊
研究简报
rDNA和端粒重复序列鉴定马铃薯和茄子体细胞杂种染色体丢失和融合
王海波1,2应静文1何 礼1,3叶文宣1涂 卫1蔡兴奎1宋波涛1,*柳 俊1
农业农村部马铃薯生物学与生物技术重点实验室/ 园艺植物生物学教育部重点实验室/ 湖北省马铃薯工程技术研究中心/ 华中农业大学, 湖北武汉 430070;2湖北民族大学生物科学与技术学院, 湖北恩施 445000;3四川省农业科学院园艺研究所, 四川成都 610066
植物体细胞杂交是植物种质资源创制的重要方法。体细胞杂种在原生质体再生的过程中染色体会产生非常多的遗传变异。研究体细胞杂种的染色体行为为马铃薯体细胞杂种的创制和利用提供理论基础。本研究采用rDNA和端粒重复序列作为探针进行原位杂交(fluorescence in situ hybridization), 并结合基因组原位杂交(genomic in situ hybridization), 对马铃薯和茄子体细胞杂种染色体组成和变异进行了分析。原位杂交结果表明, 体细胞杂种中存在马铃薯和茄子融合的染色体和双着丝粒染色体, 并发现部分融合染色体是由马铃薯和茄子2号染色体末端对末端融合得到的。重排的双着丝粒染色体的着丝粒一个来源于马铃薯, 一个来源于茄子。此外, 体细胞杂种中来源于茄子的5S rDNA在体细胞杂种再生及稳定的过程中全部丢失。研究结果表明马铃薯与茄子在进行体细胞杂交的过程中, 染色体是不稳定的, 容易造成融合后代出现双着丝粒和染色体重排等现象。体细胞杂种的染色体会通过染色体重排、双着丝粒、rDNA均一化等多种形式使其染色体趋于稳定。
马铃薯; 茄子; 体细胞杂种; rDNA; 染色体重排
马铃薯(L.)是重要的非谷物类粮食作物, 在保障我国粮食安全和全面脱贫攻坚中具有重要的作用。由于栽培种和野生种之间存在倍性差异以及胚乳平衡数(Endosperm balance number, EBN)不匹配等原因导致远缘杂交不亲和, 使得野生种中抗性资源难以向栽培种转移。原生质体融合技术的发展和成熟为马铃薯野生种优良遗传资源利用和种质资源创制提供了非常好的方法。前人通过原生质体融合创制了非常多的优良材料, 为作物遗传育种提供了非常多的优良材料。例如, 小麦通过与高冰草等小麦近缘属禾草的非对称体细胞融合, 可以使小麦产生带有部分近缘属禾草染色体片段的渐渗系, 从而实现优良性状的转移[1-2]。前人通过马铃薯体细胞杂交创制了非常多的具有生物或者非生物胁迫抗性的马铃薯种质资源, 如抗晚疫病[3-4]、抗青枯病[5-6]、抗病毒[7-8]、抗寒[9]、耐盐[10]等, 并将这些优良的种质资源运用到马铃薯育种中。
体细胞融合后经过再生过程, 染色体会发生比较多的变异, 例如重排、缺失、双着丝粒等。基因组原位杂交(Genomic in situ hybridization, GISH)是区分体细胞杂种染色体来源的非常有效的工具[11-12]。有研究表明, 马铃薯和茄子的染色体是可以通过GISH进行有效区分的[13]。除了GISH以外, 还有一些染色体特异的细胞遗传学DNA标记也可以通过荧光原位杂交(Fluorescence in situ hybridization, FISH)用到马铃薯茄子体细胞杂种研究中。例如, 马铃薯和茄子的5S rDNA都定位在1号染色体上, 25S rDNA在马铃薯和茄子2号染色体上都产生非常明显的信号, 但是茄子25S rDNA在其他4条染色体也能观察到信号[13]。马铃薯和茄子的端粒重复序列在染色体末端都能产生明显的荧光信号[13]。这些特异的细胞遗传学DNA标记都可以用于研究体细胞杂种中染色体的行为, 通过对体细胞杂种染色体行为的研究, 可以使我们了解体细胞杂种的染色体遗传变异, 利于体细胞杂种的利用。
本研究通过GISH与rDNA等细胞遗传学DNA标记相结合, 对体细胞杂种中染色体来源进行分析, 并对其中的双着丝粒染色体的形成原因进行分析, 对远源体细胞杂种原生质体融合再生过程中的染色体特殊行为有一个初步的了解, 为利用马铃薯体原生质体融合创制种质资源提供理论基础。
1 材料与方法
1.1 植物材料
本研究所用到的植物材料包括栽培种马铃薯AC142 (二倍体), 栽培种茄子508.3 (二倍体), AC142和508.3的对称融合体细胞杂种PE60-10 (非整倍体)、PE60-13 (非整倍体)等[14]。
1.2 中期染色体制片
组培苗接种在含40 g L–1蔗糖的MS培养基中生长1周左右, 待根尖生长到1 cm左右时进行预处理。在上午9点左右, 植物根尖生长旺盛的时间将根尖取下, 用蒸馏水洗净培养基, 然后用2 mmol L–1的8-羟基喹啉(Sigma, USA)处理2~3 h[15], 预处理后的根尖用移液器吸净8-羟基喹啉, 然后用蒸馏水洗净, 并吸干水分, 然后用卡诺固定液(冰醋酸∶无水乙醇 = 1∶3)固定24 h以上, 然后将根尖保存在70%乙醇中备用。
固定好的根尖用手术刀片截取最前端偏白色的部分, 大约1~2 mm, 然后进行酶解。酶解的酶液为纤维素酶(Yakult, Japan)和果胶酶(Sigma, USA)的混合酶液, 37℃酶解90 min左右, 然后用移液器吸干净酶液, 并用蒸馏水漂洗10 min左右, 然后用移液器使用剪掉头的枪头将根尖吸出, 置于干净的载玻片上, 解剖针刮掉多余的水, 再加上卡诺固定液, 并用镊子将根尖敲碎匀浆, 并均匀散布到载玻片的一定范围内, 最后再加2滴卡诺固定液将细胞碎片等杂质冲洗干净, 室温阴干备用。
1.3 原位杂交
阴干的中期染色体制片在相差显微镜下进行镜检, 挑选出分裂相多且染色体形态较好的染色体制片用于下一步原位杂交试验。原位杂交试验的具体步骤参考何礼[13]。完成原位杂交试验的染色体制片置于黑暗条件下室温阴干, 然后用含有抗淬灭剂Vectarshield (Vector, USA)的DAPI (Roche, Switzerland)进行复染, 然后利用ZEISS AXIOSKOP40正置荧光显微镜进行镜检, Hamamatsu ORCA-R2 (Hamamatsu Photonics, Japan) CCD采集图片。使用Image Pro Plus 6.0进行伪彩添加、杂交信号和染色体图片的叠加。最后用Photoshop CS6 (Adobe, USA)进行图片调整和图版制作。
2 结果与分析
2.1 端粒重复序列和rDNA在融合亲本上的定位
前期研究表明, 端粒重复序列在马铃薯和茄子染色体末端都可以检测到非常明显的FISH信号[16]。本研究对5S rDNA、25S rDNA在AC142和508.3的定位进行分析发现, 5S rDNA在AC142和508.3上都得到2个明显的信号(图1-a, b)。根据前人研究结果, 这2条染色体为1号染色体。25S rDNA在AC142上可以得到2个明显的荧光信号, 这2个信号位于2号染色体末端核仁组织区(图1-a); 在508.3上, 25S rDNA得到了6个明显的信号(图1-b), 这6个信号中有2个是位于2号染色体末端核仁组织区的。说明rDNA可以用来识别马铃薯和茄子体细胞杂种中的特定染色体。
2.2 体细胞杂种中rDNA的丢失
利用5S rDNA和25S rDNA作为染色体特异的细胞遗传学标记, 结合基因组原位杂交(GISH), 对体细胞杂种PE60-13的rDNA的组成及来源进行分析。结果表明, PE60-13中5S rDNA信号全部来自于马铃薯染色体, 11个25S rDNA信号中, 4个来自于茄子, 7个来自于马铃薯(图2); 说明PE60-13中来源于茄子的5S rDNA信号在融合再生的过程中容易发生丢失, 并且来源于茄子的25S rDNA信号也比较容易丢失。
2.3 体细胞杂种中融合染色体的重排方式及来源
马铃薯和茄子体细胞杂种在融合的过程中, 染色体发生了比较多的变异, 包括染色体的丢失和重排等。利用不同的细胞遗传学标记对马铃薯和茄子体细胞杂种的一个重排染色体进行分析发现, 这个重排的染色体的内部存在很大的一个25S rDNA区域, 并且这个25S rDNA是来自于马铃薯和茄子染色体的(图3-a, b)。此外, 还发现该重排染色体的内部存在端粒重复序列的信号(图3-c, d)。因此, 根据体细胞杂种PE60-10中该染色体的组成、形态以及含有较多的端粒重复序列, 我们推测该染色体是马铃薯和茄子2号染色体末端对末端融合得到的(图4)。
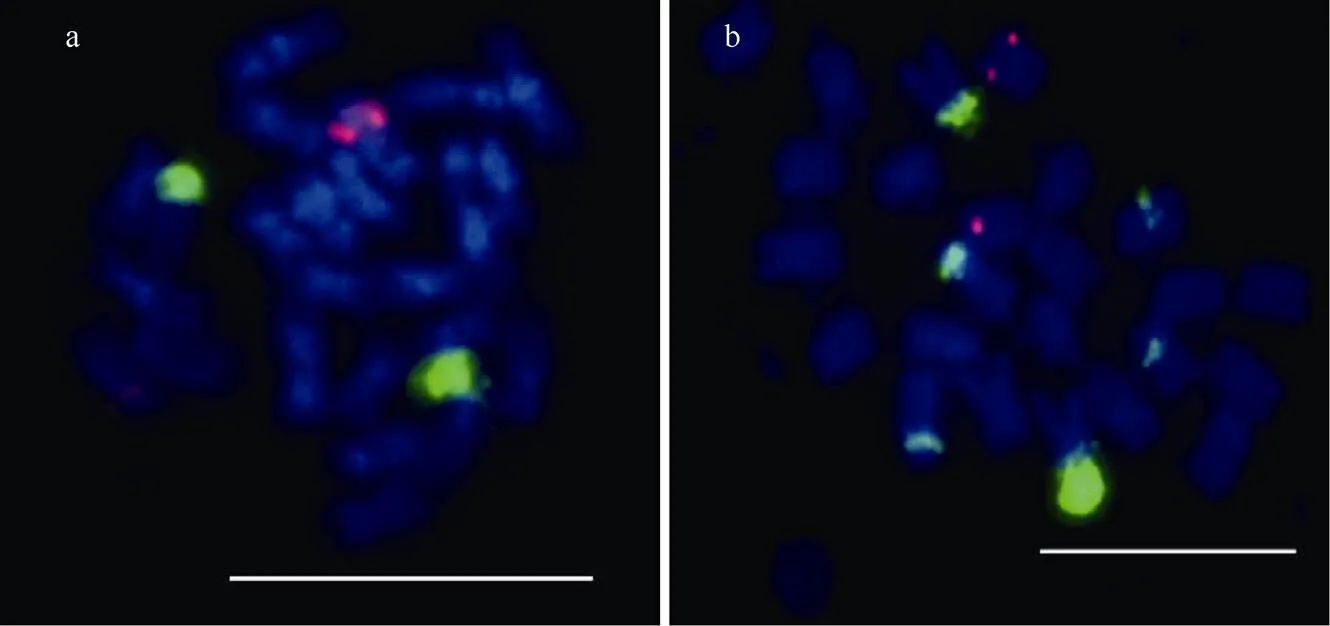
图1 rDNAs在AC142和508.3上的定位
a: rDNAs在AC142上的定位; b: rDNAs在508.3上的定位, 其中a、b中红色荧光信号为5S rDNA信号, 绿色荧光信号为25S rDNA信号。标尺为10 μm。
a: the distribution of rDNAs on AC142; b: the distribution of rDNAs location on 508.3.Red signals denote 5S rDNA signals, green signals denote 25S rDNA signals.Bar: 10 μm.

图2 rDNA探针结合GISH鉴定马铃薯和茄子体细胞杂种中染色体的组成
a: 体细胞杂种60-13染色体中含有rDNA位点染色体的识别(红色为5S位点, 绿色为25S位点); b: 来自a中的染色体经过洗涤后再开展GISH鉴定其亲本来源(红色为马铃薯染色体, 绿色为茄子染色体)。箭头指示25S位点, 箭指示5S位点。标尺为10 μm。
a: recognition of chromosomes containing rDNA sites in somatic hybrid 60-13 (red signals denote 5S sites, green signals denote 25S sites);b: recognition of parental chromosome origins by GISH performed after washing (Red signals denote chromosomes of.Green signals denote chromosomes of.).Arrowheads denote 25S sites, arrows denote 5S sites.Bar: 10 μm.

图3 rDNA、端粒重复序列结合GISH鉴定体细胞杂种中重排染色体的来源
a: 体细胞杂种PE60-10染色体中含有rDNA的染色体的识别(红色为5S位点, 绿色为25S位点); b: 来自a中的染色体经过洗涤后再开展GISH鉴定其亲本来源(红色为马铃薯染色体, 绿色为茄子染色体); c: 端粒探针信号在体细胞杂种PE60-10染色体中的分布(红色为端粒探针信号); d: 来自c中的染色体经过洗涤后再开展GISH鉴定其亲本来源(红色为马铃薯染色体, 绿色为茄子染色体)。图a和b中箭头指示25S位点, 箭指示5S位点, 图c和d中椭圆和圆形框指示含有rDNA位点的重排染色体。图a、b、c和d方框中放大的染色体为椭圆框中指示的染色体。标尺为10 μm。
a: the recognition of chromosomes containing rDNA sites in somatic hybrid PE60-10, red blocks denote 5S rDNA sites, green blocks denote 25S rDNA sites; b: the recognition of parental chromosome origins in (a) by GISH performed after washing, red denoted chromosomes from potato,green denoted chromosomes from eggplant.; c: the distribution of telomeric probe signals in PE60-10, red denoted the telomeric sites; d: the results of GISH performed after washing telomeric probe signals, red denoted chromosomes from potato, green denoted the chromosomes from eggplant.Arrowheads denoted 25S rDNA sites; arrows denoted 5S rDNA sites.White ellipse and rounded frames denote rearrangement chromo-somes containing 25S rDNA sites.The enlarged chromosomes in Fig.a, b, c, d denote chromosomes with white frames.Bar: 10 μm.

图4 体细胞杂种PE60-10中末端融合的染色体产生的示意图
染色体上明显染色很浅的区域为核仁组织区(NOR)。图中的染色体来自作为体细胞融合的马铃薯和茄子亲本, 以及它们的体细胞杂种PE60-10。
The apparent lightly stained areas on chromosomes denote nucleo-lar organizing regions (NOR).Chromosomes in the picture are from parents for somatic fusion between potato and eggplant, and their somatic hybrid PE60-10.
2.4 体细胞杂种中的双着丝粒及其形成方式
在马铃薯和茄子体细胞杂种PE60-10中发现了具有双着丝粒的重排染色体。通过基因组原位杂交试验发现, 重排染色体中的2个着丝粒中的一个位于茄子染色体片段上, 另外一个位于该重排染色体发生重排的区域(图5)。前期对茄子中期染色体形态观察, 并没有发现具有2个着丝粒的染色体, 这说明茄子染色体都只有1个着丝粒, 因此该双着丝粒染色体重排区域的着丝粒来源于马铃薯。
3 讨论
端粒重复序列、rDNA是植物基因组中比较常见的重复序列, 并且这些序列相对比较保守且在染色体上定位位置相对固定[16-19]。此外, 还有报道利用端粒重复序列和着丝粒重复序列对茄属物种进行分析, 发现在其着丝粒区域也存在端粒重复序列, 这对于端粒重复序列的进化和着丝粒的形成具有重要的意义。利用这些染色体特异的细胞学标记, 结合基因组原位杂交, 可以对体细胞杂种的染色体行为进行研究, 从而加深对体细胞杂种融合过程中染色体的行为的了解。
前人研究表明, 在新形成的异源多倍体中, rDNA位点的数量常常会发生变化[20], 其中一个亲本的rDNA位点会容易发生减少或者丢失[21]。异源多倍体其中一个物种的rDNA迅速丢失, 对杂种的rDNA基因均一化起到至关重要的作用[22]。本研究中, PE60-13中来源于茄子的5S rDNA位点全部发生了丢失, 这表明马铃薯和茄子体细胞杂种的5S rDNA在朝着马铃薯5S rDNA基因均一化的方向发展, 并以此来促进体细胞杂种染色体组的稳定性。

图5 体细胞杂种PE60-10中染色体重排形成的双着丝粒
a和b分别显示来自体细胞杂种PE60-10的2个染色体分裂相。箭指示具有双着丝粒的染色体。白色方框中显示该染色体的黑白图片以利于观察染色体上的缢痕。白色线条指示主缢痕, 黄色线条指示该染色体上另外一个明显的缢痕。标尺为10 μm。
a and b are two chromosome spreads of somatic hybrid 60-10.Arrows denote chromosomes with two centromeres.The white frames indicate chromosomes in black and white for better observation of constrictions.White lines denote primary constrictions, yellow lines denote another apparent constriction on chromosomes, respectively.Bar: 10 μm.
马铃薯和茄子对称融合体细胞杂种中发现了多条重排染色体, 对其中部分重排染色体来源进行分析, 发现PE60-10中的一条重排染色体是通过马铃薯和茄子2号染色体末端对末端融合得到的。这暗示着马铃薯和茄子在原生质体融合后再生的过程中, 2号染色体很有可能不稳定, 容易发生重排。此外, 本研究发现, 马铃薯+茄子对称融合体细胞杂种中存在比较多的染色体重排的现象。种间体细胞杂种着丝粒不稳定, 容易发生重组[23], 双着丝粒的染色体可以通过表观修饰, 使其中的一个着丝粒失活从而达到稳定状态, 并且会通过异染色质化阻止其重新活化[24]。本研究中, 在PE60-10中发现了具有双着丝粒的重排染色体, 并且这2个着丝粒分别来源于马铃薯和茄子的染色体(图5), PE60-10的双着丝粒染色体经过多次继代繁殖之后, 仍然能够稳定的存在。因此, PE60-10中具有双着丝粒的染色体可能是通过使其中一个着丝粒失去活性或者丧失大部分活性来进行正常的有丝分裂。
[1] Xiang F N, Xia G M, Chen H M.Effect of UV dosage on somatic hybridization between common wheat (L.) andL., 2003, 164: 697–707.
[2] 王晶, 向凤宁, 夏光敏, 陈惠民.利用不对称体细胞杂交向小麦转移高冰草染色体小片段.中国科学, 2004, 34: 113–120.
Wang J, Xiang F N, Xia G M, Chen H M.Using asymmetric somatic hybridization to transfer small chromosome fragments from tall wheatgrass to wheat., 2004, 34: 113–120 (in Chinese).
[3] Greplová M, Polzerová H, Vlastníková H.Electrofusion of protoplasts from,and., 2008, 30: 787–796.
[4] Tarwacka J, Polkowska-Kowalczyk L, Kolano B, Kolano B, Śliwka J, Wielgat B.Interspecific somatic hybrids(+), resistant to., 2013, 170: 1541–1548.
[5] Fock I, Collonnier C, Purwito A, Luisetti J, Souvannavong V, Vedel F, Servaes A, Ambroise A, Kodja H, Ducreux G, Sihachakr D.Resistance to bacterial wilt in somatic hybrids betweenand., 2000, 160: 165–176.
[6] Yu Y, Ye W X, He L, Cai X K, Liu T, Liu J.Introgression of bacterial wilt resistance from eggplant to potato via protoplast fusion and genome components of the hybrids., 2013, 32: 1687–1701.
[7] Austin S, Baer M A, Helgeson J P.Transfer of resistance to potato leaf roll virus fromintoby somatic fusion., 1985, 39: 75–81.
[8] Thieme R, Rakosy-Tican E, Gavrilenko T, Antonova O, Schubert J, Nachtigall M, Heimbach U, Thieme T.Novel somatic hybrids (L.+) and their fertile BC1progenies express extreme resistance to potato virus Y and late blight., 2008, 116: 691–700.
[9] Bastia T, Carotenuto N, Basile B, Zoina A, Cardi T.Induction of novel organelle DNA variation and transfer of resistance to frost and Verticillium wilt inthrough somatic hybridization with 1EBN., 2000, 116: 1–10.
[10] Bidani A, Nouri-Ellouz O, Lakhoua L, Sihachakr D, Cheniclet C, Mahjoub A, Drira N, Gargouri-Bouzid R.Interspecific potato somatic hybrids betweenandL.showed recombinant plastome and improved tolerance to salinity., 2007, 91: 179–189.
[11] Raina S, Rani V.GISH technology in plant genome research., 2001, 23: 83–104.
[12] Zluvova J, Lengerova M, Markova M, Hobza R, Nicolas M, Vyskot B, Charlesworth D, Negrutiu I, Janousek B.The inter-specific hybrid×reveals early events of sex chromosome evolution., 2005, 7: 327–336.
[13] 何礼.茄属种及其种间体细胞杂种的染色体特征分析.华中农业大学博士学位论文, 湖北武汉, 2013.
He L.Optimization of Potato Fluorescence in Situ Hybridization and Chromosome Characteristics ofGenomes and the Inter-specific Somatic Hybrids.PhD Dissertation of Huazhong Agricultural University, Wuhan, Hubei, China, 2013 (in Chinese with English abstract).
[14] Wang H B, Cheng Z N, Wang B S, Dong J K, Ye W X, Yu Y, Liu T, Cai X K, Song B T, Liu J.Combining genome composition and differential gene expression analyses reveals thatcontributes to bacterial wilt resistance in somatic hybrids., 2020, 39: 1235–1248.
[15] Dong F, Song J, Naess S K, Helgeson J P, Gebhardt C, Jiang J.Development and applications of a set of chromosome-specific cytogenetic DNA markers in potato., 2000, 101: 1001–1007.
[16] He L, Liu J, Torres G A, Zhang H Q, Jiang J M, Xie C H.Interstitial telomeric repeats are enriched in the centromeres of chromosomes inspecies., 2012, 21: 5–13.
[17] Lou Q, Iovene M, Spooner D M, Buell C R, Jiang J.Evolution of chromosome 6 ofspecies revealed by comparative fluorescence in situ hybridization mapping., 2010, 119: 435–442.
[18] Pendinen G, Gavrilenko T, Jiang J, Spooner D M.Allopolyploid speciation of the Mexican tetraploid potato speciesandrevealed by genomic in situ hybridization., 2008, 51: 714–720.
[19] Wu F, Tanksley S D.Chromosomal evolution in the plant family., 2010, 11: 182.
[20] Malinska H, Tate J, Matyasek R, Leitch A, Soltis D, Soltis P, Kovarik A.Similar patterns of rDNA evolution in synthetic and recently formed natural populations of(Asteraceae) allotetraploids., 2010, 10: 291.
[21] Mlinarec J, Satovic Z, Malenica N, Ivancic-Bace I, Besendorfer V.Evolution of the tetraploid(2= 32) and hexaploid(2= 48) (Ranunculaceae) was accompanied by rDNA loci loss and intergenomic translocation: evidence for their common genome origin., 2012, 110: 703–712.
[22] Pontes O, Neves N, Silva M, Lewis M S, Madlung A, Comai L, Viegas W, Pikaard C S.Chromosomal locus rearrangements are a rapid response to formation of the allotetraploidgenome., 2004, 101: 18240–18245.
[23] Metcalfe C J, Bulazel K V, Ferreri G C, Schroeder-Reiter E, Wanner G, Rens W, Obergfell C, Eldridge M D, O'Neill R J.Genomic instability within centromeres of interspecific marsupial hybrids., 2007, 177: 2507–2517.
[24] Sato H, Masuda F, Takayama Y, Takahashi K, Saitoh S.Epigenetic inactivation and subsequent heterochromatinization of a centromere stabilize dicentric chromosomes., 2012, 22: 658–667.
Identification of chromosome loss and rearrangement in potato and eggplant somatic hybrids by rDNA and telomere repeats
WANG Hai-Bo1,2, YING Jing-Wen1, HE Li1,3, YE Wen-Xuan1, TU Wei1, CAI Xing-Kui1, SONG Bo-Tao1,*, and LIU Jun1
1Key Laboratory of Potato Biology and Biotechnology, Ministry of Agriculture and Rural Affairs / Key Laboratory of Horticultural Plant Biology, Ministry of Education / Potato Engineering and Technology Research Center of Hubei Province / Huazhong Agricultural University, Wuhan 430070, Hubei, China;2College of Biological Science and Technology, Hubei Minzu University, Enshi 445000, Hubei, China;3Horticulture Institute, Sichuan Academy of Agricultural Sciences, Chengdu 610066, Sichuan, China
Somatic hybridization is an important way to create new germplasm.Somatic hybrids produced plenty of genetic variation during protoplast regeneration.In this study, to analyze the chromosome composition and variation of potato and eggplant somatic hybrids, rDNAs and telomeric repeats were used as probes for FISH (fluorescence in situ hybridization), combined with GISH (Genomic in situ hybridization).The results showed that rearranged chromosomes and dicentric chromosomes existed in somatic hybrids, and the parts of the rearranged chromosomes was derived from the end-to-end fusion of potato and eggplant chromosomes 2.One centromere of the rearranged dicentric chromosomes was derived from potato and the other was from eggplant.Eggplant 5S rDNA sites were lost in somatic hybrids to homogenize the rDNA of somatic hybrids.The results of this study indicated that the chromosomes were unstable during the somatic hybridization of potato and eggplant, which can easily cause dicentric and chromosomal rearrangements in somatic hybrids.The chromosomes of somatic hybrids tended to be stable through various ways such as chromosome rearrangement, dicentric and rDNA homogenization.
potato; eggplant; somatic hybrids; rDNA; chromosome rearrangement
本研究由国家现代农业产业技术体系建设专项(马铃薯, CARS09-P07)资助。
This study was supported by the China Agriculture Research System (Potato, CARS-09-P07).
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20211015.1509.006.html
通信作者(Corresponding author): 宋波涛, E-mail: songbotao@mail.hzau.edu.cn
E-mail: wanghaibo0519@126.com
2021-09-10;
2021-10-18.
10.3724/SP.J.1006.2022.14070
2021-04-20;
