基于种子萌发出苗过程中弯钩建成和下胚轴生长的棉花出苗壮苗机制与技术
2022-03-16周静远孔祥强张艳军李雪源张冬梅董合忠
周静远 孔祥强 张艳军 李雪源 张冬梅 董合忠,*
综述
基于种子萌发出苗过程中弯钩建成和下胚轴生长的棉花出苗壮苗机制与技术
周静远1,2孔祥强2张艳军2李雪源3张冬梅2董合忠1,2,*
1山东师范大学生命科学学院, 山东济南 250014;2山东省农业科学院经济作物研究所/ 山东省棉花栽培生理重点实验室, 山东济南 250100;3新疆农业科学院经济作物研究所, 新疆乌鲁木齐 830091
苗全苗壮是实现棉花丰产丰收的基础, 但棉花属于子叶全出土的双子叶植物, 播种出苗易受环境条件和播种技术的影响, 一播全苗、壮苗的难度很大。棉苗顶端弯钩及时建成和下胚轴稳健生长是棉花出苗壮苗的关键, 本文首次以单粒精播调控种子萌发出苗过程中的顶端弯钩建成和下胚轴生长的生理与分子机制为核心, 系统评述了棉花成苗壮苗的调控机制。棉花种子单粒精播、适当浅播, 促进下胚轴伸长、弯钩建成和展开的关键基因和适时、适量表达, 棉苗下胚轴伸长、弯钩及时建成, 保证出土并适时展开弯钩和脱掉种壳, 正常出苗。单粒精播种子出苗后通过调控下胚轴生长关键基因和表达, 下胚轴稳健生长, 形成壮苗。在此基础上, 总结提出了以单粒精播、适当浅播为核心, 配合精细整地、提高种子质量、地膜覆盖、膜下滴灌等措施的棉花成苗壮苗关键栽培技术, 为实现一播全苗、壮苗早发提供了重要参考和指导。
棉花; 出苗; 壮苗; 调控机制; 弯钩建成; 下胚轴生长
棉花是我国重要的经济作物, 是关系国计民生的大宗农产品和纺织工业原料。提高棉花产量和品质, 对于发展经济, 增加国家财富和农民收入, 扩大对外贸易, 具有十分重要的意义[1]。播种出苗是大田棉花生产的第一个环节, 是棉花丰产丰收的基础, 一直备受重视。但是, 不同于蚕豆、花生等子叶不出土或半出土的双子叶植物, 棉花属于子叶全出土作物, 两片子叶完全出土并展开才完成正常出苗过程[2]。在棉花幼苗出土过程中, 幼嫩的子叶和顶端分生组织易受土壤机械损伤, 因此, 出苗成苗是棉花整个生命周期中最脆弱的一个阶段[3]。为适应黑暗生长, 幼苗在出土前主要进行暗形态建成, 具有黄化且封闭的子叶、弯曲的顶端弯钩(出土前子叶与下胚轴连接处形成的弯钩状结构)及能够伸长和增粗的下胚轴, 这种特殊形态可以最大程度地减少幼苗出土时土壤对子叶和顶端分生组织的损害[4-5]。因此, 顶端弯钩建成和下胚轴生长是棉花能否正常出苗的关键, 一系列环境因素通过影响弯钩建成和下胚轴生长相关基因的表达显著影响棉花出苗壮苗过程; 提高棉花种子质量或活力, 更是弯钩建成和下胚轴生长相关基因的表达, 种子正常出苗、成苗和壮苗的基础保障。但迄今尚未见基于弯钩建成和下胚轴生长的棉花出苗壮苗机制与技术的总结或评述。本文拟在笔者研究成果的基础上, 结合国内外相关研究进展, 首次以弯钩建成和下胚轴生长为核心, 对棉花成苗壮苗的调控机制和关键技术进行了总结和评述。
1 棉花出苗成苗的调控机制
1.1 棉花种子出苗的过程
棉花种子在适宜的环境条件下, 先吸水膨胀, 当吸足大约与本身重量相等的水分时, 开始萌动发芽[6]。子叶中储藏的营养物质在适宜条件下分解并转运至胚根、胚芽等部位, 供胚生长, 当胚根通过珠孔露出种皮时完成萌动(也称露白); 胚根继续向深处生长, 长度达到种子长度一半时即完成发芽[7-8]。棉子发芽后, 胚根继续向下生长形成主根, 同时下胚轴伸长把子叶和胚芽推出地面, 子叶脱壳出土并完全展开完成出苗过程[9]。
1.1.1 顶端弯钩建成与出苗成苗 种子萌发出苗过程中茎尖分生组织会遭受到来自周围土壤的机械摩擦和损伤, 单子叶植物和双子叶植物幼苗在穿透土壤时对茎尖分生组织的保护策略是不同的[10]。对于棉花等大多数双子叶植物而言, 在出土时下胚轴顶端会形成一个类似“钩子”的结构, 即弯钩, 它在种子萌发出土时起着重要的保护作用, 有利于幼苗及时出土并脱掉种壳[4-5]。因此, 弯钩及时建成是幼苗能否正常出苗的关键, 直接关系到棉花基础群体的质量。此外, 弯钩及时展开对能否正常出苗成苗也有重要影响。如果弯钩在未完全出土前提早展开, 子叶和分生组织可能受损, 导致棉花不能正常出苗; 反之弯钩展开过晚, 则会使棉苗带壳出土, 影响子叶展开, 降低幼苗质量, 不利于形成壮苗[11]。
总之, 在棉花种子萌发出苗过程中, 顶端弯钩及时建成和展开对提高棉花的出苗率和成苗率具有重要意义。
1.1.2 下胚轴生长与出苗成苗 下胚轴作为连接根系和子叶的重要器官, 是种子萌发出苗过程中水、矿质元素、养分和信号分子运输的重要通道[12]。同时它对植物激素、光照、温度和重力等内部和外部信号也都有应答反应[13], 对植物幼苗生长发育具有重要生物学作用。在棉子萌发过程中, 下胚轴伸长生长是胚根突出种皮的动力, 能够促进胚对环境水分的吸收, 有利于种子萌发[14]。棉子萌发后, 下胚轴继续伸长, 一方面有利于子叶出土和光合作用, 为幼苗后续生长提供物质保障; 另一方面促使胚根下扎吸收土壤中的水和营养元素, 供幼苗生长发育[12]。因此, 下胚轴的稳健生长对棉子萌发出土及壮苗培育具有至关重要的作用。如果下胚轴失去生长能力, 子叶则不能顺利出土进行光合作用, 从而使种子营养被耗尽死于土壤中, 不能出苗; 相反, 如果种子萌发后, 下胚轴伸长过快, 易形成高脚苗, 不利于培育壮苗。
1.2 棉花出苗成苗的调控机制
顶端弯钩建成和下胚轴生长是棉花正常出苗成苗的关键, 植物激素及环境信号通过影响弯钩建成和下胚轴生长相关基因表达, 有效调控棉花出苗、成苗和壮苗过程[20]。
1.2.1 顶端弯钩建成的调控机制 研究证明, 生长素在下胚轴顶端内外侧细胞中的不均匀分布使得两侧细胞差异生长是弯钩建成的重要原因, 而这种不均匀分布很大程度上是由于生长素的极性运输所致[10]。AUX1/LAX3和pin-formed (PIN)作为植物体中主要的生长素内流和外排载体介导细胞对生长素的吸收[15-16]。二者共同决定了生长素在顶端弯钩发育过程中的时空积累: AUX1/LAX3将生长素均匀地转运到下胚轴顶端, 加上PIN转运蛋白的极性定位, 导致较高的生长素从弯钩外侧排出并在内侧积聚, 使弯钩内外两侧产生不同的生长素梯度, 引起弯钩两侧细胞差异生长, 形成弯钩[15-17]。因此, 下胚轴顶端两侧细胞中生长素的差异分布和响应对弯钩的建成至关重要, 但它并不是促进这一进程的唯一信号。既往研究证明, 乙烯和赤霉素(GAs)对弯钩建成也有积极作用[11,18-19]。
乙烯影响生长素生物合成和运输响应基因的表达, 是生长素梯度形成和维持的必要信号, 在弯钩建成过程中起着重要作用。一方面, 乙烯能够局部上调生长素生物合成基因色氨酸转氨酶相关2 ()表达, 增强弯钩内侧的生长素生物合成途径[20]。另一方面, 乙烯可以增强弯钩内侧AUX1的转运及PIN在皮层细胞的优先定位, 从而导致更高的不对称生长素积累, 促进弯钩建成[15-17]。此外, 遗传分析发现, 乙烯信号通路核心转录因子EIN3/EIL1可直接与()启动子结合激活其转录, 促进弯钩建成[21-22]。但调节生长素差异反应的机制目前还不完全了解。DELLA蛋白作为赤霉素信号转导途径中的负调控因子, 能够直接与转录因子EIN3/ EIL1的DNA结合域相互作用, 抑制其功能[25]。GAs能够抑制DELLA蛋白对EIN3/EIL1的降解, 促进的转录, 进而促进弯钩建成[21-22]。需要指出的是, 迄今对植物激素调控弯钩发育的信号网络尚不十分清晰, 特别是GAs或乙烯与生长素互作的详细分子机制尚不清楚, 参与生长素不对称反应和作用于下游的调控因子仍有待确定。
光照等环境信号对弯钩建成同样发挥重要作用。光信号对弯钩建成的抑制依赖于HLS1蛋白与光受体PhyB的互作, 破坏的寡聚化, 进而抑制其对弯钩建成的调控[26]。而在植物出土过程中, 土壤覆盖产生的机械力会诱导下胚轴及顶端弯钩产生乙烯, 促进顶端弯钩建成, 确保植物成功破土而出[26,56]。
1.2.2 下胚轴生长的调控机制 棉子在土壤中萌发后, 下胚轴会迅速伸长生长, 以促进幼苗出土。但在幼苗出土后, 光照等因素会抑制下胚轴的快速伸长, 使幼苗迅速进行光形态建成, 以免形成高脚苗[5,27]。近年来, 已在拟南芥中确定了可以介导植物激素调节下胚轴伸长的多种光信号元素, 主要包括光受体A/B (PhyA/B)、光敏色素互作因子(PIFs)和下胚轴5 (HY5)等[28-30]。
PIFs是一类含bHLH (basic helix-loop-helix)结构域的转录因子家族[31]。迄今为止, 在拟南芥PIF亚家族的15个同源成员中发现有7个成员(PIF1、PIF3~PIF8)可以和PhyA/B互作[12,30]。光信号能够促进PhyB进入细胞核内与PIFs相互作用, 使PIFs磷酸化降解, 导致生长素合成限速酶基因和的表达下降, IAA的合成量减少, 抑制下胚轴伸长, 相反黑暗中则促进PIFs积累及下胚轴伸长[13,32-33]。除此之外, PIFs对光调节下胚轴伸长的控制还涉及赤霉素信号通路转录因子DELLAs[34-38]。虽然PIFs网络信号调控框架已经建立, 但phy诱导的PIFs降解途径的中心成分以及导致PIFs磷酸化、泛素化和降解的详细机制仍有待研究。
下胚轴伸长关键基因是一种天然的下胚轴生长调节因子, 在蛋白水平上由E3泛素连接酶COP1 (constitutive photomorphogenic 1)控制[39]。研究发现, 光照能降低细胞核中COP1蛋白水平使其在下胚轴生长中发挥双重作用: 在土壤覆盖的黑暗环境下, COP1富集在细胞核内, 与HY5相互作用, 促进HY5蛋白降解, 进而促进下胚轴伸长; 而在光照下, COP1被移出细胞核, 使HY5蛋白积累, 抑制下胚轴伸长[40-41]。此外,作为激素和光信号的连接转换器, 能够介导多种激素对下胚轴伸长的调控[42], 遗传分析证明可以结合到()和()的启动子元件上进而负调控生长素的合成, 从而抑制下胚轴快速伸长[43-44]。进一步研究HY5蛋白感知刺激诱导信号的分子机制, 以及HY5蛋白控制靶基因表达的分子机制, 将更加深入地揭示基因在植物下胚轴生长和信号转导途径中的作用。
1.2.3 棉花壮苗的机制 全苗、壮苗是夺取棉花高产的基础。壮苗的表现是, 棉苗敦实, 下胚轴粗壮,根系发达, 叶片叶色油绿、大小适中[2]。由此可见, 下胚轴稳健生长是形成壮苗的关键。有研究表明, 单粒精播种子在顶土出苗后, 棉苗有独立的生长空间, 相互影响小, 光照充足, 诱导基因表达上调,基因表达下降, 抑制下胚轴快速伸长, 棉苗敦实, 发病率低, 易形成壮苗[27,45]。相反, 多粒穴播种子出苗后棉苗积聚在一起, 相互遮阴, 抑制基因表达, 使下胚轴快速伸长形成高脚苗, 降低了棉苗质量[45,56]。总之, 通过影响弯钩建成和下胚轴生长相关基因的差异表达, 可以有效调控棉花的出苗、壮苗(图1)。
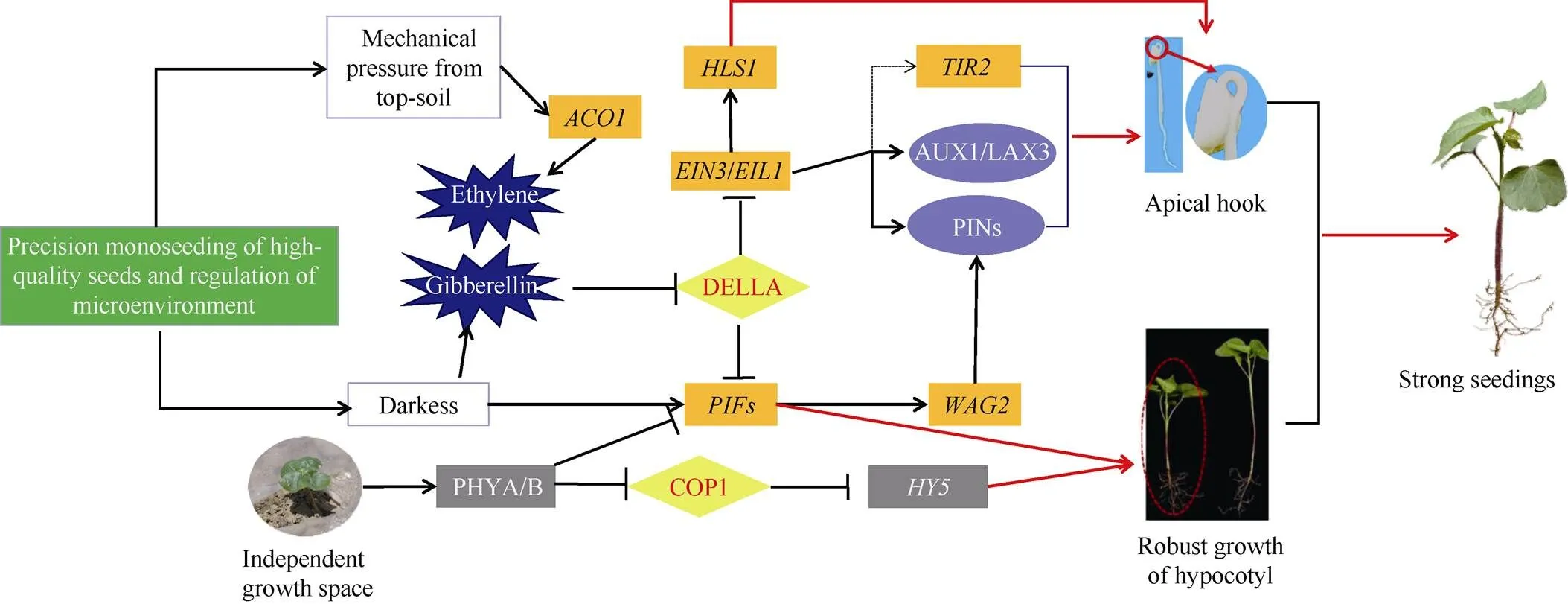
图1 棉花弯钩建成和下胚轴生长促进出苗壮苗的机制[3,10,27]
机械压力、光照等环境信号与乙烯、赤霉素等激素信号相互作用并最终影响生长素的合成及运输, 调控顶端弯钩生长素的不对称分布及下胚轴伸长。正常箭头表示正调控作用, T型箭头表示负调控作用, 虚线箭头表示具体作用机制未知。
Environmental signals such as mechanical pressure and light interact with hormone signals such as ethylene and gibberellin, which ultimately affects the synthesis and transport of auxin and regulates the asymmetric distribution of auxin during the apical hook formation and hypocotyl elongation.The normal arrow indicates positive regulation, the T-shaped arrow indicates negative regulation, and the dotted arrow indicates that the specific mechanism is unknown.
2 棉花出苗壮苗的关键调控技术
2.1 影响棉花出苗壮苗的主要因素
棉花种子从萌发到出苗成苗过程中受内在和外在因素的影响, 内在因素是种子本身, 要求种子结构要完整, 有稳定的遗传组成和良好的活力; 外在因素包括适宜温度、水分、土壤条件及其与土壤中其他生物和非生物因素之间的相互作用。
2.1.1 内在因素 种子活力指在广泛的田间条件下, 决定种子快速、整齐出苗并发育成正常幼苗的全部潜力的特性[6], 是影响种子出苗率与棉苗素质的根本因素。高活力的棉花种子具备完善的细胞结构和功能, 吸胀后保持旺盛的代谢强度, 在田间出苗和抗逆性方面也有很多优势[46]。例如高活力的种子具有更高的出苗率和更快的出苗速度, 保证种子萌发迅速而整齐; 在逆境土壤中高活力种子也具有更强的抗逆能力, 能迅速、整齐出苗[46]。反之, 低活力的种子发芽出苗率低、速度慢, 难以实现全苗壮苗。
2.1.2 外在因素 水分是制约种子萌发成苗的主要因素, 保持合适的土壤水分(墒情)是种子萌发成苗必不可少的[47]。土壤水分过多会影响土壤的透气性, 造成种子缺氧, 出苗困难; 土壤水分不足, 会造成带壳出苗、苗芽干枯, 降低成苗率[48]。此外, 土壤水分还通过影响土壤板结特性或引起某些土含病原体(如腐霉、疫霉等)限制棉苗生长发育[48]。温度也是种子萌发成苗的主要影响, 种子发芽率和发芽速度, 幼苗生长[49], 以及许多生理过程(如气孔导度、蒸腾、养分传输和二氧化碳的吸收)及根系的吸收生长都受温度的影响。氧气是棉子萌发以及幼苗生长发育进行呼吸作用的必要条件, 且棉子中含有大量脂肪, 萌发时需要大量氧气, 氧气不足会抑制棉子萌发进而影响棉苗的生长发育[6]。影响棉花成苗壮苗的外在因素很多, 但从根本上都是通过影响水分、温度、氧气这3个基本因素而间接发挥作用。
2.2 棉花出苗壮苗的关键调控技术
提高棉花种子活力和改善环境条件, 通过调控弯钩建成和下胚轴生长促进棉花种子出苗和壮苗。
2.2.1 提高种子质量 高质量种子是及时形成顶端弯钩和下胚轴稳健生长的保障, 是棉花一播全苗、培育壮苗的重要基础和前提。前人研究表明, 种子活力水平与种子成熟度呈正相关, 因此在生产中选取能代表品种特性的棉株中部且靠近主茎(内围1~2果节)、吐絮好、成熟度高、无病虫害的霜前花棉子做种是提高种子质量的根本措施。硫酸脱绒、药剂拌种及种衣剂包衣, 能显著提升种子发芽率和出苗速度, 同时有效防治棉花苗期病害和虫害, 也是有效提高种子质量、保障棉花一播全苗培育壮苗的重要措施[50]。
2.2.2 温墒调控措施 种子发芽出苗的土壤环境, 包括土壤硬实度、温度、水分等显著影响棉苗弯钩建成和下胚轴生长, 对棉花种子出苗成苗至关重要。
播前深耕整地能有效改善土壤结构, 提高地温, 增强土壤通透性, 扩大棉苗对水、肥的吸收范围, 有利于根系下扎和幼苗顶土出苗; 地膜覆盖则具有增温、保墒等作用, 能有效促进棉苗生长发育, 有利于培育壮苗[52]; 滴灌棉田采用“干播湿出”技术, 即在未进行冬春灌棉田的“干土”中直接覆膜播种(干播), 然后及时滴水增墒促进出苗(湿出), 棉田盐碱较重时宜在播种后连续滴水3~4次, 每次间隔6~7 d, 以降低棉种周围土壤的盐分, 创造有利于棉种发芽出苗和幼苗生长的土壤环境[45]。黄河流域棉区可在解冻后进行春耕, 并结合增施有机肥及时耙耕、保墒; 西北内陆(新疆)棉区春季风大, 土壤水分蒸发快, 应在入冬前翻耕完, 避免春耕[50]。无论哪个棉区, 播前造墒、适期播种、地膜覆盖、滴灌补墒等措施都是为了优化温、墒、气等环境因子, 确保种子萌发出苗过程中顶端弯钩及时建成和展开、下胚轴稳健伸长和生长, 促进棉花成苗、成苗和壮苗。播种过早, 地温低, 抑制弯钩建成和下胚轴生长, 容易造成烂种缺苗; 播种过晚, 下胚轴生长快, 易形成高脚苗, 而且因生育期推迟, 不能充分利用有效的生长季节, 影响产量和品质[51]。
2.2.3 播种粒数和深度 在适期播种的前提下, 播种质量是实现一播全苗的关键。传统条播及一穴多粒的播种方式, 不但浪费棉种, 而且会造成棉苗拥挤, 易形成高脚苗。Kong等[27]研究表明, 单粒精播、适当浅播(播深1.5~2.5 cm)的棉花种子在顶土出苗时, 受到机械压力大, 诱导乙烯合成基因表达, 产生足量乙烯。乙烯一方面促进表达, 促进弯钩建成; 另一方面诱导下胚轴增粗关键基因的表达, 从而促进下胚轴增粗, 更利于壮苗早发。相反, 多粒穴播棉苗顶土力强, 容易导致土壤提前裂开, 棉苗受光导致HLS1蛋白含量降低, 弯钩提前展开, 易造成带壳出苗[45]。因此, 在精细整地和提高种子质量的前提下, 适时播种、单粒精播并掌握好播种深度, 大田播种深度一般2.5 cm左右, 或者膜上打孔播种深度1.5 cm左右, 浅覆土1.0 cm左右, 侧封土, 适当增加播种穴数(约增加30%~50%), 缩小穴距, 不仅能够保障全苗壮苗, 也省去了间苗、定苗工序[45]。
3 总结和展望
苗全苗壮是棉花高产优质的基础和保障。现有研究已经明确棉苗顶端弯钩建成和下胚轴生长在棉花出苗、成苗和壮苗中的作用。但是, 其作用的分子机制还有很多问题没有搞清, 棉花出苗成苗的调控技术也需要进一步完善。具体而言, 应着重开展以下研究工作:
一是进一步揭示棉花弯钩建成和下胚轴生长的分子机制, 实现在更高水平上对出苗成苗的调控。对拟南芥等模式植物的研究表明, 弯钩建成和下胚轴生长受环境信号、激素信号等多方面的综合调控。然而, 关于植物激素对棉花弯钩建成和下胚轴伸长的调控主要集中于生长素、乙烯、赤霉素, 其他重要激素如脱落酸和油菜素甾醇(BR)对弯钩发育的作用还不清楚。例如, 这些激素是否调控弯钩建成及下胚轴的生长?是否与其他激素及环境信号通路互作?如何互作?此外, 大田棉花生长在复杂多变的环境中, 弯钩建成和下胚轴生长同时受多种环境因子影响, 单一环境信号的调控机制不足以揭示植物响应外界信号因子。因此, 应进一步探索激素信号与环境信号对棉花弯钩及下胚轴交叉调控的分子机制, 明确其调控网络, 为选育成苗力强的抗逆品种和制定成苗壮苗农艺技术提供理论支持。
二是进一步提高种子质量。棉花种子质量关系到弯钩建成和下胚轴生长, 影响种子出苗率和幼苗素质, 高质量种子是棉花一播全苗、壮苗的基本保障。因此, 要重视并下大力气提高种子质量。一方面要重视大田种子生产, 确保繁殖出高质量的种子; 另一方面, 研究创新种子加工技术, 包括脱绒、精选、包衣等, 生产和应用高质量的精加工种子, 为苗全苗壮打下基础。
三是加强农机农艺融合研究, 促进棉花苗壮苗。创造棉花出苗、成苗和壮苗的环境条件是实现棉花一播全苗壮苗的保障, 而要实现这一目标, 农机农艺融合是关键。要研究完善棉田整理、单粒播种、地膜覆盖、种肥同播、温墒调控技术及其装备, 在此基础上, 吸收并结合智能化、信息化技术, 有效调控棉花弯钩建成和下胚轴生长, 促进出苗成苗, 实现苗全苗壮。
综上, 棉苗顶端弯钩及时建成和下胚轴稳健生长是棉花出苗、成苗和壮苗的关键。棉花种子单粒精播、适当浅播, 既保持了出苗前的黑暗环境, 又保证了适宜的顶土压力, 诱导乙烯合成基因表达, 产生足量乙烯, 促进弯钩建成关键基因表达, 促进弯钩及时建成, 同时促进下胚轴生长关键基因的表达, 调控下胚轴生长, 正常出苗。单粒精播种子出苗后有独立的生长空间, 相互影响小, 控制基因表达, 调控下胚轴稳健生长, 形成壮苗(图1)。合理运用精细整地、地膜覆盖、膜下滴灌等农艺措施, 并选用高质量种子, 有利于促进和优化弯钩建成和下胚轴稳健生长, 促进出苗和壮苗。展望未来, 要进一步揭示弯钩建成和下胚轴生长的分子机制, 提高种子质量, 加强农机农艺融合研究, 实现在更高水平上对出苗成苗的调控, 彻底解决棉花一播全苗、壮苗难的问题。
[1] 王荣栋, 尹经章.作物栽培学.北京: 高等教育出版社, 2015.pp 258–297.
Wang R D, Yin J Z.Crop Cultivation and Management.Beijing: Higher Education Press, 2015.pp 258–297 (in Chinese).
[2] 董合忠.棉花重要生物学和栽培特性及其在丰产简化栽培中的应用.中国棉花, 2013, 40(9): 1–4.
Dong H Z.Major biological characteristics of cotton and their application in extensive high-yielding cultivation., 2013, 40(9): 1–4 (in Chinese with English abstract).
[3] 刘旦梅, 裴雁曦.双子叶植物幼苗顶端弯钩发育的分子机制.中国生物化学与分子生物学报, 2018, 34: 1138–1145.
Liu D M, Pei Y X.Molecular mechanism of the development of dicotyledonous seedling apical hook., 2018, 34: 1138–1145 (in Chinese with English abstract).
[4] McNellis T W, Deng X W.Light control of seedling morphogenetic pattern., 1995, 7: 1749–1761.
[5] Chen M, Chory J, Fankhauser C.Light signal transduction in higher plants., 2004, 38: 87–117.
[6] 董合忠, 李维江, 张晓洁.棉花种子学.北京: 科学出版社, 2004.pp 25–297.
Dong H Z, Li W J, Zhang X J.Science and Technology of Cotton seed.Beijing: Science Press, 2004.pp 25–297 (in Chinese).
[7] Rehman A, Farooq M.Cotton Production.Hoboken: Wiley Online Library, 2019.pp 23–46.
[8] Reddy K R, Reddy V R, Hodges H F.Temperature effects on early season cotton growth and development., 1992, 84: 229–237.
[9] Zhang Y J, Dong H Z.Yield and fiber quality of cotton., 2020, 2: 356–364.
[10] Abbas M, Alabadí D, Blazquez M A.Differential growth at the apical hook: all roads lead to auxin., 2013, 4: 441.
[11] Mazzella M A, Casal J J, Muschietti J P, Fox A R.Hormonal networks involved in apical hook development in darkness and their response to light., 2014, 5: 52.
[12] 姜楠, 王超, 潘建伟.拟南芥下胚轴伸长与向光性的分子调控机制.植物生理学报, 2014, 50: 1435–1444.
Jiang N, Wang C, Pan J W.Molecular regulatory mechanisms of hypocotyl elongation and phototropism in.,2014, 50: 1435–1444 (in Chinese with English abstract).
[13] 王红飞, 尚庆茂.被子植物下胚轴细胞伸长的分子机制.植物学报, 2018, 53: 276–287.
Wang H F, Shang Q M.Molecular mechanism of hypocotyl cell elongation in angiosperms.,2018, 53: 276–287 (in Chinese with English abstract).
[14] Sliwinska E, Bassel G W, Bewley J D.Germination ofseeds is not completed as a result of elongation of the radicle but of the adjacent transition zone and lower hypocotyl., 2009, 60: 3587–3594.
[15] Zadníkova P, Petrasek J, Marhavy P, Raz V, Vandenbussche F, Ding Z J, Schwarzerová K, Morita M T, Tasaka M, Hejátko J, van Der Straeten D, Friml J, Benková E.Role of PIN-mediated auxin efflux in apical hook development of., 2010, 137: 607–617.
[16] Villalobos L I A C, Lee S, De-Oliveira C, Ivetac A, Brandt W, Armitage L, Sheard L B, Tan X, Parry G, Mao H.A combinatorial TIR1/AFB–Aux/IAA co-receptor system for differential sensing of auxin., 2012, 8: 477–485.
[17] Tiwari S B, Hagen G, Guilfoyle T.The roles of auxin response factor domains in auxin-responsive transcription., 2003, 15: 533–543.
[18] Bleecker A B.Ethylene perception and signaling: an evolutionary perspective., 1999, 4: 269–274.
[19] Wang Y, Guo H.On hormonal regulation of the dynamic apical hook development., 2019, 222: 1230–1234.
[20] De Grauwe L, Vandenbussche F, Tietz O,Palme K, Van Der Straeten D.Auxin, ethylene and brassinosteroids: tripartite control of growth in thehypocotyl., 2005, 46: 827–836.
[21] Lehman A, Black R, Ecker J R.HOOKLESS1, an ethylene response gene, is required for differential cell elongation in thehypocotyl., 1996, 85: 183–194.
[22] Zhang X, Ji Y, Xue C, Ma H H, Xi Y L, Huang P X, Wang H, An F Y, Li B S, Wang Y C, Guo H W.Integrated regulation of apical hook development by transcriptional coupling of EIN3/EIL1 and PIFs in., 2018, 30: 1971–1988.
[23] Gallego-Bartolomé J, Arana M V, Vandenbussche F, Minguet P Ž, Minguet E G, Guardiola V, Straeten D V D, Benkova E, Alabadí D, Blázquez M A.Hierarchy of hormone action controlling apical hook development in.,2011, 67: 622–634.
[24] Willige B C, Eri O T, Zourelidou M, Schwechheimer C.WAG2 represses apical hook opening downstream from gibberellin and PHYTOCHROME INTERACTING FACTOR 5.(Cambridge, England), 2012, 139: 4020–4028.
[25] Achard P, Vriezen W H, Van Der Straeten D, Harberd N P.Ethylene regulatesdevelopmentthe modulation of DELLA protein growth repressor function., 2003, 15: 2816–2825.
[26] Lyu M, Shi H, Li Y L, Kuang K Y, Yang Z X, Li J, Chen D, Li Y, Kou X X, Zhong S G.Oligomerization and photo-deoligomerization of HOOKLESS1 controls plant differential cell growth., 2019, 51: 78–88.
[27] Kong X Q, Li X, Lu H Q, Li Z H, Xu S Z, Li W J, Zhang Y J, Zhang H, Dong H Z.Monoseeding improves stand establishment through regulation of apical hook formation and hypocotyl elongation in cotton., 2018, 222: 50–58.
[28] Yang H Q, Wu Y J, Tang R H, Liu D M, Liu Y, Cashmore A R.The C termini ofcrytochromes mediate a constitutive light response., 2000, 103: 815–827.
[29] Toledo-Ortiz G, Huq E, Quail P H.Thebasic/ helix-loop-helix transcription factor family., 2003, 15: 1749–1770.
[30] Leivar P, Monte E.PIFs: systems integrators in plant development., 2014, 26: 56–78.
[31] De Lucas M, Prat S.PIFs get BRright: PHYTOCHROME INTERACTING FACTORs as integrators of light and hormonal signals., 2014, 202: 1126–1141.
[32] Nozue K, Covington M F, Duek P D, Lorrain S, Fankhauser C, Harmer S L, Maloof J N.Rhythmic growth explained by coincidence between internal and external cues., 2007, 448: 358–361.
[33] Shen Y, Khanna R, Carle C M, Quail P H.Phytochrome induces rapid PIF5 phosphorylation and degradation in response to red light activation., 2007, 145: 1043–1105.
[34] Willige B C, Ghosh S, Nill C, Zourelidou M, Dohmann M N, Maier A, Schwechheimer C.The DELLA domain of GA INSENSITIVE mediates the interaction with the GA INSENSITIVE DWARF1A gibberellin receptor of., 2007, 19: 1209–1220.
[35] Feng S, Martinez C, Gusmaroli G.Coordinated regulation ofdevelopment by light and gibber ellins., 2008, 451: 475–479.
[36] Kunihiro A, Yamashino T, Mizuno T.PHYTOCHROMEINTERA CTING FACTORS PIF4 and PIF5 are implicated in the regulation of hypocotyl elongation in response to blue light in., 2010, 74: 2538–2541.
[37] Ariizumi T, Murase K, Steber S C M.Proteolysis-independent downregulation of DELLA repression inby the gibberellin receptor GIBBERELLIN INSENSITIVE DWARF1., 2008, 20: 2447–2459.
[38] Ueguchitanaka M, Nakajima M, Motoyuki A, Matsuoka M.Gibberellin receptor and its role in gibberellin signaling in plants., 2007, 58: 183–198.
[39] Osterlund M T, Hardtke C S, Wei N, Deng X W.Targeted destabilization of HY5 during light-regulated development of., 2000, 405: 462–466.
[40] Reed J W, Nagpal P, Poole D S, Furuya M, Chory J.Mutations in the gene for the red/far-red light receptor phytochrome B alter cell elongation and physiological responses throughoutdevelopment., 1993, 5: 147–157.
[41] Saijo Y.The COP1-SPA1 interaction defines a critical step in phytochrome A-mediated regulation of HY5 activity., 2003, 17: 2642–2647.
[42] Oyama T, Shimura Y, Okada K.TheHY5 gene encodes a bZIP protein that regulates stimulus-induced development of root and hypocotyl., 1997, 11: 2983–2995.
[43] Boron A K, Vissenberg K.Thehypocotyl, a model to identify and study control mechanisms of cellular expansion., 2014, 33: 697–706.
[44] 于延文.乙烯调控拟南芥HY5蛋白稳定性和幼苗下胚轴生长.中国农业科学院硕士学位论文, 北京, 2013.
Yu Y W.Ethylene Regulates the Stability of HY5 and Hypocotyl Growth in.MS Thesis of Chinese Academy of Agricultural Sciences, Beijing, China, 2013 (in Chinese with English abstract)
[45] 张冬梅, 张艳军, 李存东, 董合忠.论棉花轻简化栽培.棉花学报, 2019, 31: 163–168.
Zhang D M, Zhang Y J, Li C D, Dong H Z.On light and simplified cotton cultivation.,2019, 31: 163–168 (in Chinese with English abstract)
[46] 董建军, 代建龙, 李霞, 李维江, 董合忠.黄河流域棉花轻简化栽培技术评述.中国农业科学, 2017, 50: 4290–4298.
Dong J C, Dai J L, Li X, Li W J, Dong H Z.Review of light and simplified cotton cultivation technology in the Yellow River Valley., 2017, 50: 4290–4298 (in Chinese with English abstract).
[47] Ram L J, Philippe D, Christian S, You M P, Barbetti M J, Jean-Nol A.Abiotic and biotic factors affecting crop seed germination and seedling emergence: a conceptual framework., 2018: 432: 1–28.
[48] You M P, Barbetti M J.Severity of phytophthora root rot and pre-emergence damping-off in subterranean clover influenced by moisture, temperature, nutrition, soil type, cultivar and their interactions., 2017, 66: 1162–1181.
[49] Markus B.The role of temperature in the regulation of dormancy and germination of two related summer-annual mudflat species., 2003, 79: 15-32.
[50] Dai J L, Dong H Z.Intensive cotton farming technologies in China: achievements, challenges and countermeasures., 2014, 155: 99–110.
[51] 辛承松, 卢合全, 罗振, 孔祥强, 张祥宗.黄河三角洲盐碱地棉花“适密简”种植模式及技术规程.中国棉花, 2020, 47(8): 40–42.
Xin C S, Lu H Q, Luo Z, Kong X Q, Zhang X Z.“Proper Density and Simple” Cultivation model and technical regulations of cotton in saline-alkali land in the Yellow River Delta., 2020, 47(8): 40–42 (in Chinese with English abstract).
[52] 董合忠.滨海盐碱地棉花成苗的原理与技术.应用生态学报, 2012, 23: 566–572.
Dong H Z.Underlying mechanisms and related techniques of stand establishment of cotton on coastal saline-alkali soil., 2012, 23: 566–572 (in Chinese with English abstract).
[53] Dong H Z.Cotton Farming in Saline Soil.Beijing: Science Press, 2010.pp 179–190.
[54] Dong H Z, Li W Z, Li Z H, Zhang D M.Early plastic mulching increases stand establishment and lint yield of cotton in saline fields.2009, 111: 269–275.
[55] 罗振, 辛承松, 李维江, 张冬梅, 董合忠.部分根区灌溉与合理密植对旱区棉花产量和水分生产率的影响.应用生态学报, 2019, 30: 3137–3146.
Luo Z, Xin C S, Li W J, Zhang D M, Dong H Z.Effects of partial root-zone irrigation and rational close planting on yield and water Effects of partial root-zone irrigation and rational close planting on yield and water productivity of cotton in arid area., 2019, 30: 3137–3146 (in Chinese with English abstract).
[56] Li X, Kong X Q, Zhou J Y, Luo Z, Lu H Q, Li W J, T W, Zhang D M, Ma C L, Zhang H, Dong H Z.Seeding depth and seeding rate regulate apical hook formation by inducingexpression via ethylene during cotton emergence., 2021, 164: 92–100.
Mechanism and technology of stand establishment improvements through regulating the apical hook formation and hypocotyl growth during seed germination and emergence in cotton
ZHOU Jing-Yuan1,2, KONG Xiang-Qiang2, ZHANG Yan-Jun2, LI Xue-Yuan3, ZHANG Dong-Mei2, and DONG He-Zhong1,2,*
1College of Life Science, Shandong Normal University, Jinan 250014, Shandong, China;2Institute of Industrial Crops / Shandong Key Laboratory for Cotton Culture and Physiology, Shandong Academy of Agricultural Sciences, Jinan 250100, Shandong, China;3Institute of Cash Crops, Xinjiang Academy of Agricultural Sciences, Urumqi 830091, Xinjiang, China
Realizing full and strong stand establishment of seedlings is the basis for achieving high yields and bump harvests in cotton.However, cotton is a dicotyledonous plant whose cotyledons are successfully all unearthed for standing.Seedling emergence is susceptible to environmental conditions and seeding techniques.Therefore, it is generally more difficult for cotton to get full and strong stand establishment than other major crops.The apical hook formation and the hypocotyl growth at seed germination and emergence stages play key roles in seedling emergence and stand establishment.Here we systemically reviewed the regulation mechanism of cotton seedling growth for the first time and put forward the key agronomic cultivation techniques to promote cotton seedling growth, focusing on the physiological and molecular mechanism of hook formation and hypocotyl growth and their influencing factors.Precision monoseeding can improve timely and moderate expression of the key genesandrelated to hypocotyl elongation and hook formation, which assures better stand establishment by timely formation and expansion of the hooks and timely shedding of seed shells.The hypocotyl can grow steadily and form strong seedings by regulating the expression of key genesandrelated to hypocotyl growth under precision monoseeding.In this paper, the key cultivation techniques of cotton precision monoseedling, combined with fine soil preparation, improving seed quality, plastic mulching, and drip irrigation under mulching were summarized and reviewed.This review provides important reference and guidance for the improvement and development of cotton sowing and cultivation technology in cotton.
cotton; emergence; strong seedling; regulation mechanism; curved hook formation; hypocotyl growth
2021-06-07;
2021-10-09;
2021-10-20.
10.3724/SP.J.1006.2022.14116
通信作者(Corresponding author): 董合忠, E-mail: donghezhong@163.com
E-mail: zhoujingyuan0107@163.com
本研究由国家重点研究发展计划项目(2020YFD1001002), 国家自然科学基金项目(31771718, 31801307)和财政部和农业农村部: 国家现代农业产业技术体系建设专项(CARS-15-15)资助。
This study was supported by the National Key Research and Development Program of China (2020YFD1001002), the National Natural Science Foundation of China (31771718, 31801307), and the China Agriculture Research System (CARS-15-15).
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20211020.1240.002.html
