谷物源烷基间苯二酚的分析技术研究进展
2022-03-16樊凤娇黄沁沁李彭邹燕羽方勇
樊凤娇 黄沁沁 李彭 邹燕羽 方勇

摘要: 烷基间苯二酚(Alkylresorcinols, ARs)是谷物麸皮皮层中一类含量丰富的酚类类脂,同时也是全谷物判别中的生物标记物和重要的功能因子,适量摄入ARs可促进机体健康。建立准确、高效的谷物ARs分析方法有助于全谷物的质量评价及深入探究ARs的活性机制。本文综述了近年来国内外关于ARs提取、纯化及检测技术的研究进展,对比分析了各技术的优势和局限性,并对其发展方向进行了展望,以期为深入研究谷物中的ARs提供理论参考。
关键词: 谷物;烷基间苯二酚;同系物;提取技术;检测技术
中图分类号: S131+.3 文献标识码: A 文章编号: 1000-4440(2022)01-0250-08
Abstract: As a group of phenolic lipids, alkylresorcinols (ARs) are found abundantly in the bran fractions of wheat and rye. ARs have been considered as biomarkers in identifying the whole grains and important functional factors, and adequate intake of ARs can have a positive effect on health. Establishment of accurate and efficient methods for alkylresorcinols analysis is helpful to the quality evaluation of the whole grains and exploration of the active mechanism of ARs. The recent researches about the extraction, purification and detection technology of ARs in grains were reviewed, and the advantages and disadvantages of each technology were compared in the study. Moreover, in order to provide theoretical reference for the further study of ARs, the future development direction of ARs analysis techniques was proposed.
Key words: cereals;alkylresorcinols;homologues;extraction technology;detection technology
烷基间苯二酚 (Alkylresorcinols, ARs)是一类存在于植物、藻类以及某些微生物体内的酚类脂质。在人们日常饮食中,ARs主要存在于小麦和黑麦等谷物麸皮外层的角质层中[1]。ARs是可遗传的植物化学成分,其在农作物中的含量极易受到环境因素(如种植区域、施肥和农药处理等)的影响[2]。此外,加工因素也极易影响农产品的ARs含量,例如谷物在精制过程中,其皮层极易被碾去,因此精加工产品中几乎不含有ARs[3-4]。近年来,研究者分析了谷物对人体健康的积极影响,发现ARs在预防糖尿病的过程中发挥着重要作用[5-7],并且ARs能抑制低密度脂蛋白的氧化,具有预防心血管疾病及结肠癌的功效[8]。ARs是全谷物皮层中的重要活性成分,已被作为全谷物产品和人类摄入全谷物的生物标记物[9]。ARs含量对全谷物食品的品质具有较大影响,因此,选用合适、高效的ARs检测技术可实现全谷物食品品质的鉴定和分级,也有利于进一步阐明全谷物膳食的健康效益。
谷物富含的组分繁多、基质复杂,通常需要先进行特定成分的分离提取,再开展结构鉴定和含量测定研究。随着现代分析技术的发展,以常规溶剂为主的提取技术(萃取法、超临界萃取法、超声波辅助法等)与以固相萃取法、薄层色谱法、硅胶柱层析法为主的纯化技术和以分光光度法、色谱法和质谱联用法为主的检测方法在谷物ARs的研究过程中得到了广泛应用。本文对谷物ARs的提取、纯化及检测技术进行了综述,并对不同方法进行对比分析,以期为高效合理地选择谷物中ARs的检测方法提供参考。
1 烷基间苯二酚的结构及理化性质
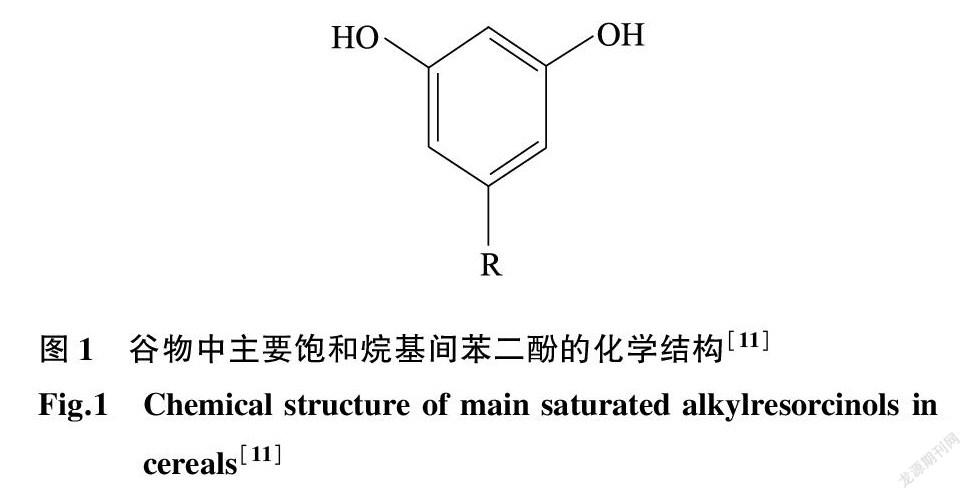
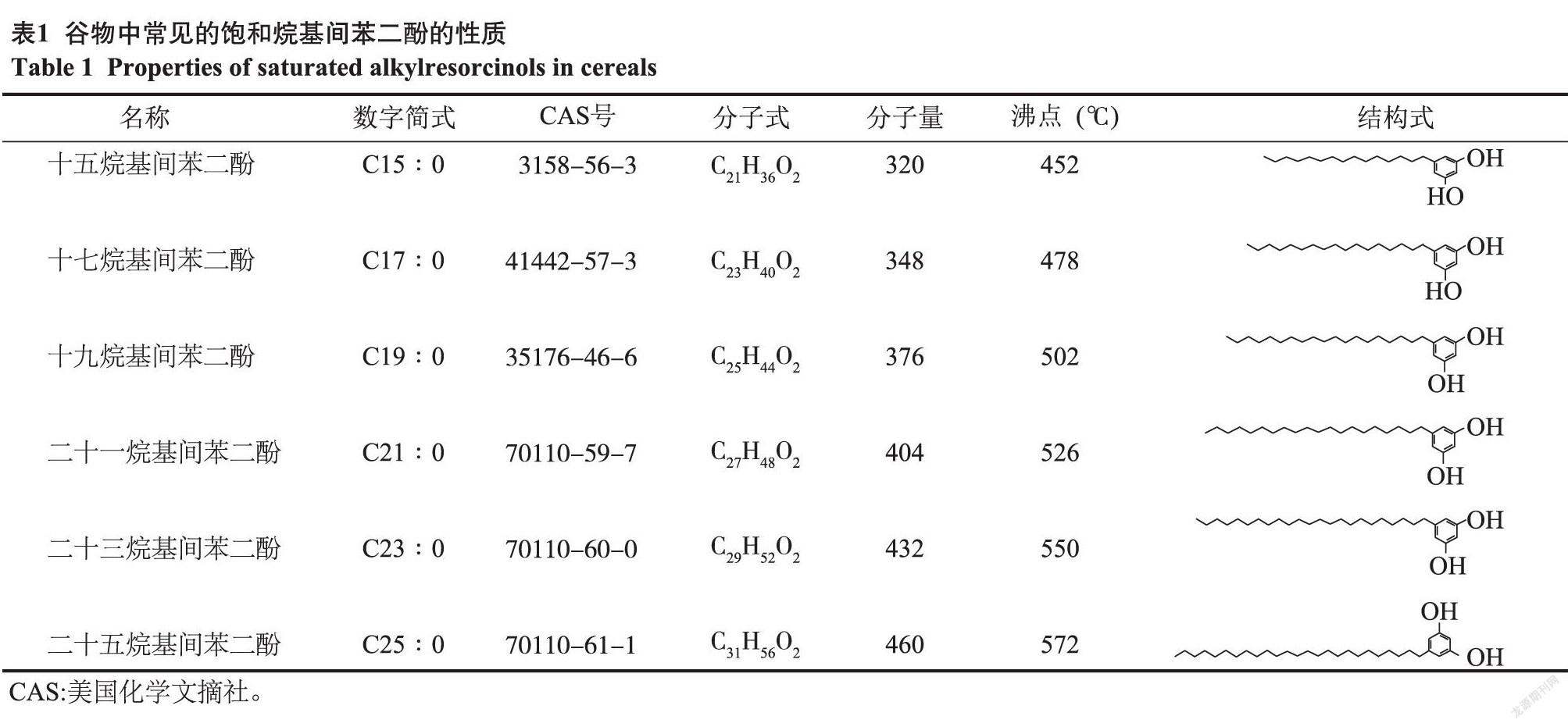
烷基间苯二酚又称5-烷基间苯二酚,是指苯环第5位碳上连接1个奇数碳的烷基或烯基侧链的1种1,3-二羟基苯衍生物,结构见图1。一般来说,取代R基团的链长以及双键数量和位置也并不完全相同,根据其饱和度和烷基侧链的碳原子数可以分为多种同系物[8],常见的饱和ARs如表1所示。对于不同谷物来源的ARs而言,通常是以多种不同链长或不同不饱和度的同系物混合形式存在的,与藜麦相关的报道中指出,不仅有奇数链的ARs,而且存在偶数链的ARs[10]。
ARs所具有的两亲性与极性二羟基苯环和疏水烷基链的存在有关[12]。一般情况下,ARs中的烷基长链含有10个以上的碳原子,使其易溶于非极性溶剂而难溶于水,其在水中的溶解度与R基链的长度有关。烷基链长度越长,分子的非极性程度也越高,主要可溶于甲醇、乙醇、乙酸乙酯等有机溶剂。此外,ARs的烷基侧链长度差异也会产生熔沸点方面的差异[13]。常见的饱和烷基间苯二酚(C15∶0~C25∶0)的沸点为452~572 ℃(表1)。
2 谷物中烷基间苯二酚的提取技术
麸皮外层含有的多酚等物质会对ARs的检测造成一定干扰,因此为准确地测定谷物中的ARs含量,需要將其从复杂组分中有效地提取出来。目前常见的提取方法包括常规溶剂萃取法、索氏抽提法、超临界流体萃取法和超声波提取法。
2.1 常规溶剂萃取法
在早期的报道中,主要采用常规溶剂萃取法进行ARs的提取。ARs易溶于有机试剂,在溶剂中可实现与不同溶解度杂质的分离。Ross等[11]对比用不同溶剂(乙酸乙酯、甲醇和丙酮)提取全麦粉中ARs的效果,发现用乙酸乙酯提取24 h时,提取液中ARs总量最高(698 μg/ml),显著高于其他提取试剂处理。Gunenc等[14]使用热丙醇对面包中的ARs进行提取,发现不同面包中的ARs总量为11.0~829.0 mg/kg,并且ARs在面包焙烤过程中具有较高的稳定性。张珺等[15]采用乙酸乙酯、丙酮、甲醇3种溶剂振荡48 h的方法提取糙米中的总ARs,并采用比色法对ARs含量进行测定,结果显示,用丙酮提取ARs的效果优于乙酸乙酯和甲醇。
2.2 索氏抽提法
索氏抽提法是在有机溶剂提取的基础上改进而来的,主要利用溶剂回流和虹吸原理,使谷物中的ARs被有机溶剂不断萃取,可以有效节约溶剂。Agil等[16]对索氏抽提法提取小黑麦麸皮ARs含量的工艺进行了优化,发现在温度为24 ℃、丙酮料液比为1 g∶40 ml、提取时间为16 h时,ARs总量可达到2 775.0~3 083.0 mg/kg,其中饱和ARs占比为86%~88%。
2.3 超临界流体萃取法
超临界萃取法是调节超临界流体的压力和温度来控制浓度和压力,利用其高渗透力和强溶解力来萃取分离混合物,从而达到高效提取谷物中ARs的目的。目前常用的是超临界CO2萃取技术。Dey等[17]采用超临界CO2萃取法对麸皮中的ARs进行2次提取。结果表明,当压力为25 MPa时,用0.06%乙醇、10%乙醇分别在70 ℃、45 ℃提取2 h、4 h,可得到高浓度的C17∶0、C19∶0和C21∶0,其含量占总提取物的68%以上。Athukorala等[18]使用超临界CO2技术对ARs进行连续2次提取,结果显示,第1次提取物中主要是C18脂肪酸,第2次提取过程中利用乙醇可提取得到95%以上的ARs,此时测得黑小麦中ARs的总量为700.0 mg/kg。
2.4 超声波辅助法
超声波技术属于非热加工技术的一种,主要利用超声波产生的机械振动、空化、击碎等效应来加速有机溶剂进入谷物中的运动速度和穿透力,从而实现ARs的高效提取。超声波不会破坏ARs的结构和生物活性,是目前研究得较多的提取方法。彭田园等[19]对超声波法提取小麦麸皮ARs的工艺进行了优化,发现当超声波功率为285 W、提取时间为2 min、乙酸乙酯料液比为1 g∶50 ml时,全麦粉中的总ARs含量最高,为382.7 μg/g。Patzke等[20]利用超声波辅助法对黑麦麦麸ARs进行2次提取,再利用低温结晶法和半制备型液相色谱法进行纯化,最终制备出纯度为90%的ARs同系物单体。
2.5 提取技术的比较
目前,绝大数的提取工艺是以传统的溶剂提取法为基础,辅以其他手段以提高ARs的提取率。采用超声波辅助溶剂提取法可以明显减少溶剂的耗量,缩短萃取时间。不同的提取方法具有不同的特点,详见表2。对于具体的ARs提取工艺的选择,应根据实际情况而定,例如,对于工厂中ARs的大批量提取,超临界和超声波提取法可能更适合。
3 谷物中烷基间苯二酚的纯化技术
全谷物的组分较多且复杂,仅使用单一的色谱技术很难实现对ARs粗提物的准确定性和定量,因此亟需借助纯化技术来提高ARs粗提物定性、定量分析的准确性。将ARs分离出来后再经过适当的纯化处理,可以提高分析方法的灵敏度。下面对常见的ARs纯化技术进行简单的介绍。
3.1 固相萃取法
固相萃取是利用选择性吸附与洗脱的液相色谱分离原理对样品进行富集、分离和净化的方法,具有速度快、重现性好和回收率高等优点,因而被广泛使用。近年来,根据不同待测物的性质,逐渐衍生出不同介质的固相萃取小柱。常用的小柱有硅胶柱、C18柱、阴离子交换柱、氨基柱和聚酰胺柱等。Geerkens等[27]采用超声辅助乙酸乙酯法获得黑麦ARs粗提物,并利用聚酰胺CC6 SPE小柱对ARs粗提物进行净化处理,发现该方法的回收率可达83.80%~103.95%。Marklund等[28]使用OasisMAX SPE小柱对用乙酸乙酯提取出的ARs粗提物进行净化,通过方法学试验发现其净化效果良好。然而固相萃取小柱也有一些弊端,如价格昂贵、操作繁琐等。
3.2 柱层析法
柱层析法主要是基于组分间的物化性质差异(如分子形状、大小及分子亲和力等),使其在两相(固定相和流动相)中移动的速度不同,通过收集不同的流出液,可以达到纯化的目的[29]。目前,ARs的大规模纯化主要采用硅胶柱色谱法。Liu等[30]选用三氯甲烷-乙醚(体积比为9∶1)为洗脱液,对装有麸皮提取物的层析柱进行洗脱,发现在来自21个中国小麦品种的麸皮中,ARs总含量为697~1 732 μg/g,其中C19∶0、C21∶0是含量最多的同系物。Kozubek[31]同样利用硅胶柱层析法,先用纯三氯甲烷洗脱,再用三氯甲烷-乙酸乙酯洗脱ARs粗提物,结果表明,该方法可以将ARs同系物进行有效分离,其产率约为27%。尽管用硅胶柱层析法对样品进行纯化的过程耗时长,但操作简单、适用性强、成本低廉,因此可用于实验室中对样品进行大量纯化。
3.3 薄层色谱法
薄层色谱法(Thin layer chromatography, TLC)的原理与柱层析法类似,先将固定相(吸附剂)制成薄层,利用吸附剂对不同ARs成分吸附力的大小及展开剂解吸附作用的差异进行分离。此法用于ARs的纯化主要是基于组分间吸附力、分配系数、比移值(Rf)的差异。Ross等[9]使用TLC对不同链长的ARs同系物进行分离,并加入显色剂香兰素-氯化氢试剂与ARs反应形成红色,再通过一系列反应使ARs可视化。此外,郭亚洲等[8]选用石油醚-乙酸乙酯混合溶液作为展开剂对ARs进行TLC分离,根据标準品对应的Rf值确定提取物中ARs的位置,成功实现了粗提物的分离纯化。然而,该技术存在试剂消耗量大、前处理过程繁琐、重现性和灵敏度不高等问题。
4 谷物中烷基间苯二酚的检测方法
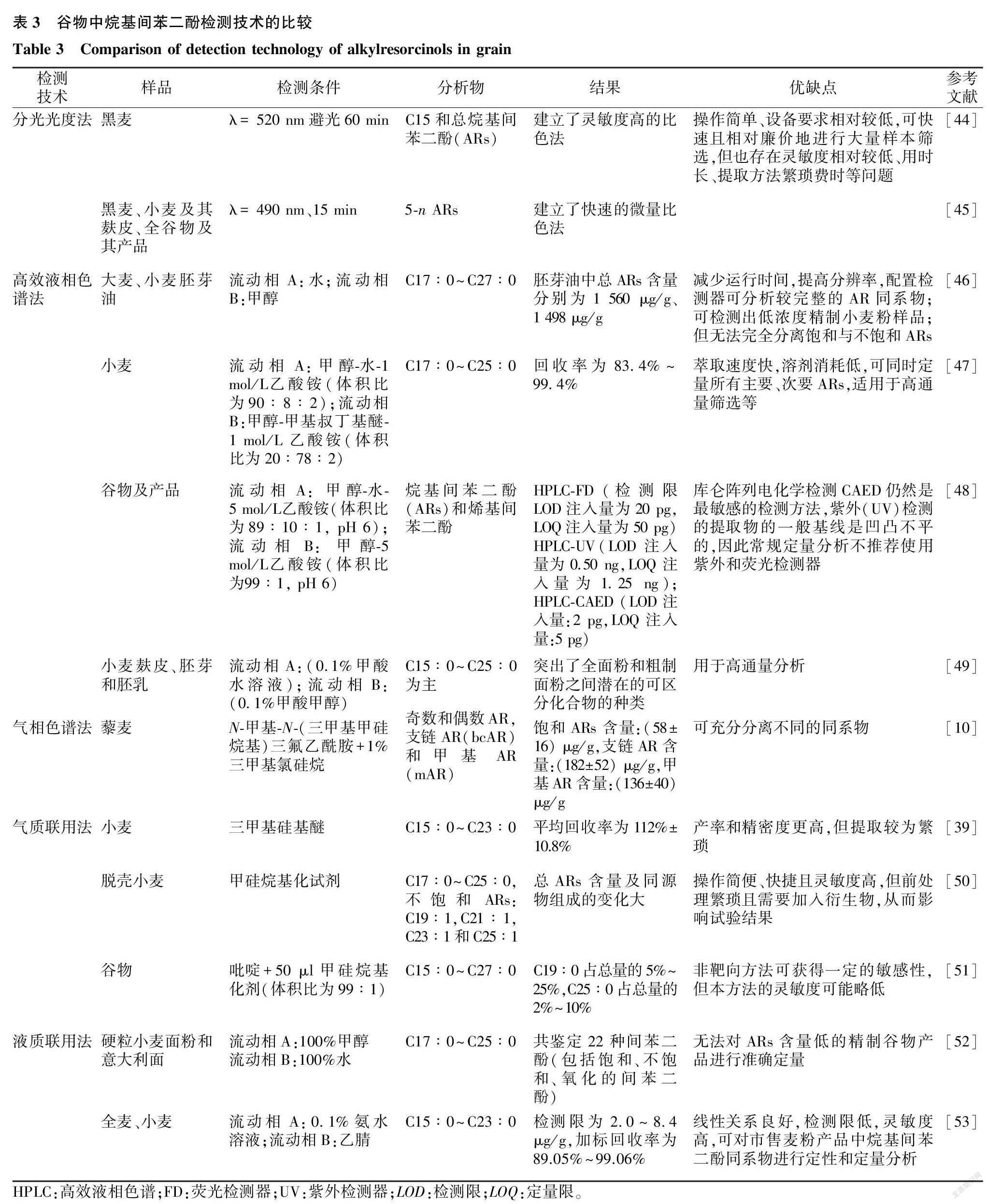
由于ARs同系物结构相近,性质相似,使得谷物中ARs同系物不易被区分和鉴定。目前谷物中ARs的检测方法主要有分光光度法、色谱法和色谱-质谱联用法等,下面对相关检测方法进行介绍。
4.1 分光光度法
分光光度法通过测定ARs在特定波长范围内的吸光度,再对其进行定量分析。该方法是测定ARs总量的最基本方法。Tluscik等[32]发现,ARs可以与重氮化的Fast Blue B反应形成可显色衍生物,并首次提出了ARs的比色分析法。Zarnowski等[33]选取ARs同系物标准品进行比色法校准曲线的绘制,结果显示,冬小麦ARs总含量为57.3 μg/g,其中C25∶0含量最多,占比为35.5%。中国国家粮食和物资储备局发布的全麦粉行业标准推荐的方法为在室温振荡48 h后,基于重氮盐Fast Blue B反应的分光光度法进行ARs总量的测定[34]。分光光度法操作简单,对设备的要求相对较低,可快速且相对廉价地进行大量样本筛选,但同时也存在灵敏度相对较低、用时长、提取方法繁琐费时、仅能测定总量、无法对单一ARs同系物含量进行分析等多种问题。
4.2 色谱法
4.2.1 气相色谱法 气相色谱(Gas chromatography, GC)法根据组分的沸点、极性及吸附性质的差异来实现谷物中ARs的分离,并通过检测器进行定性、定量分析。ARs含有较多碳原子,其沸点较高,因此需要对其进行衍生化预处理。硅基衍生化是鉴定ARs的一个相对较优的选择,常用的衍生剂有甲硅烷基化试剂(BSTFA)、1%三甲基氯硅烷(MSTFA)等。对ARs同系物进行衍生化处理后,气相色谱检测温度显著降低,并且保留时间缩短。Andersson等[35]对ARs粗提物进行衍生化处理,再经过GC检测分析发现,挪威面包中ARs的总含量为21~2 766 mg/g,其中ARs含量较多的均为全麦面包,同时也证实ARs可作为全麦食品的生物标记物。
4.2.2 高效液相色谱法 高效液相色谱(High performance liquid chromatography, HPLC)法的原理主要是根据物质在两相中的分配系数不同,通过洗脱使混合物中的各组分分离出来。目前,已有研究者利用紫外检测器和荧光检测器检测ARs。王宇飞等[36]开发了HPLC-荧光法快速检测全麦中ARs的技术,利用体积比为3∶7的乙醇-乙腈溶液等梯度洗脱,然后通过荧光检测器分析,发现C17∶0~C25∶0共5种同系物的R2>0.999,线性范围为0.05~10.00 μg/g,加标回收率为94.5%~104.0%。由于ARs含有苯环,使其在紫外波长280 nm左右有特征吸收峰,因此可以通过检测器对ARs进行分析。邹燕羽等[37]建立了HPLC-紫外检测器分析方法,经过方法学验证得出ARs同系物的加标回收率为81.16%~112.92%,线性相关系数均大于0.999。
4.3 色谱-质谱联用法
4.3.1 气质联用技术 气相色谱-质谱联用技术(Gas chromatography-mass spectrometry, GC-MS)是在GC基础上发展起来的,经GC分离后的物质最终进入MS系统,通过对待测物的质荷比、相对分子质量和强度分布进行分析,可以明确化合物的结构信息。GC-MS具有GC的高分离度和MS的高准确度、高灵敏度的特点[38],在食品领域的研究中得到了广泛应用。ARs酚羟基经过衍生化处理后,会形成特定的离子[质荷比(m/z)为268],通过单离子检测的方式,可以提高检测方法的灵敏度。Giambanelli等[39]对4种小麦的ARs进行提取处理,再经衍生化和GC-MS-SIM分析,发现小麦中ARs的总含量为478.3~1 153.9 mg/kg,饱和同系物以C17∶0~C25∶0为主,3种不饱和同系物为C19∶1、C19∶2和C21∶1,不饱和同系物仅占总ARs的3%~8%。GC-MS方法也可用于麸皮品种、种植区域等对ARs含量及其同系物影响的研究中[40]。此外,近年来质谱技术逐渐由单级质谱向串联质谱发展,质谱串联后的选择性增强,由此发展起来的GC-MS/MS和GC-飞行时间(TOF)-MS也可用于ARs的检测。
4.3.2 液质联用技术 液相色谱-质谱联用技术(Liquid chromatography-mass spectrometry, LC-MS)是以液相为分离系统,再利用质谱进行鉴定的技术,近年来也常被用于测定ARs。该技术适用于对热不稳定和难挥发性分子的测定,具有抗干扰能力强、稳定性好和灵敏度高等优点。Reboolleda等[41]使用LC-MS方法对麦麸中的ARs进行分析,发现在麦麸中存在C15∶0~C25∶0的ARs同系物。Liu等[42]建立了对ARs定量分析的LC-MS法,并使用单离子检测方法提高了不饱和ARs的灵敏度和选择性,减少了在分析之前通过固相萃取进行的净化步骤,结果發现,R2可达0.998 6~0.999 8,检测限(LOD)为5 ng/g,定量限(LOQ)为15 ng/g,满足其检测的要求。Gunenc等[43]探究了高直链玉米淀粉与黑麦麸中ARs之间的包合物形成过程,通过LC-MS方法在麦麸粗提物中鉴定出13种不同的ARs同系物(6种饱和ARs,7种不饱和ARs),结果发现甘油三酸酯、固醇和游离脂肪酸等可能会干扰ARs含量的测定过程。
4.4 检测方法的比较
分光光度法、色谱法和色谱-质谱联用法等技术对ARs的分析均是基于不同检测机制,各方法在灵敏度、准确度方面都存在差异。Landberg等[24]评估和比较了用GC和分光光度法测定谷物及其产品中ARs的区别,发现GC法和分光光度法在测定ARs总含量上表现出了良好的一致性。为更好地选择ARs检测方法,表3整理了目前常用于测定谷物ARs方法的优缺点。对于ARs总含量的检测,比色法是最佳选择,而如果需要得到饱和、不饱和ARs等详细信息,则需采用LC-MS、GC-MS等联用技术。因此,在实际分析过程中,需要综合考虑检测目的、检测方法的精密度及可操作性等,选择最合适的检测方法。
5 结论与展望
本文对谷物中ARs的提取、纯化和检测技术方面的国内外相关研究情况进行了分析和总结。如何有效地去除杂质、提高提取效率、确保检测结果的稳定性和重复性仍是制约其在食品工业广泛应用的技术难点。质谱类仪器因其精密性和高通量,可实现对ARs同系物进行定量和定性的分析。除此之外,配合化学计量学等统计手段,科研人员可以对ARs进行指纹图谱的绘制,这项技术在食品真实性鉴定方面拥有巨大潜力。随着现代分析仪器、技术的迅速发展,应探寻适宜的检测技术或将多种分析方法相结合,使之能够全面、高效地分析谷物中ARs同系物的组成情况,从而为全谷物健康效益的深入研究和高价值产品的开发提供理论基础。
参考文献:
[1] Z·MOWSKI R, SUZUKI Y, YAMAGUCHI I, et al. Alkylresorcinols in barley (Hordeum vulgare L. distichon) grains[J]. Zeitschrift für Naturforschung C, 2002, 57(1/2): 57-62.
[2] JAS'KIEWICZ B, SZCZEPANEK M. Crop management and variety have influence on alkylresolcinol content in triticale grain[J]. Acta Agriculturae Scandinavica, Section B-Soil & Plant Science, 2016, 66(7): 570-574.
[3] ANDERESSON U, DEY E S, HOLM C, et al. Rye bran alkylresorcinols suppress adipocyte lipolysis and hormone‐sensitive lipase activity[J]. Molecular Nutrition & Food Research, 2011, 55(S2): S290-S293.
[4] 冯 煦,姜 东,单 宇,等. 小麦麸皮的化学成分[J]. 中草药,2009,40(1):27-29.
[5] CECILIE K, ANNE T, KIM O, et al. Higher whole-grain intake is associated with lower risk of Type 2 diabetes among middle-aged men and women: the danish diet, cancer, and health cohort[J]. The Journal of Nutrition, 2018, 148(9):1434-1444.
[6] DELLA P G, VETRANI C, VITALE M, et al. Wholegrain intake and risk of type 2 diabetes: evidence from epidemiological and intervention studies[J]. Nutrients, 2018, 10(9): 1288.
[7] BISKUP I, KYRO C, MARKLUND M, et al. Plasma alkylresorcinols, biomarkers of whole-grain wheat and rye intake, and risk of type 2 diabetes in Scandinavian men and women[J]. The American Journal of Clinical Nutrition, 2016, 104(1): 88-96.
[8] 郭亚洲. 麸皮中烷基间苯二酚对HepG2细胞抗肿瘤机理研究[D].镇江:江苏大学,2019.
[9] ROSS A B, MAN P, ANDERSSON R, et al. Chromatographic analysis of alkylresorcinols and their metabolites[J]. Journal of Chromatography A, 2004, 1054(1/2): 157-164.
[10]ROSS A B, SVELANDER C, KARLSSON G, et al. Identification and quantification of even and odd chained 5-n alkylresorcinols, branched chain-alkylresorcinols and methylalkylresorcinols in Quinoa (Chenopodium quinoa)[J]. Food Chemistry, 2017, 220: 344-351.
[11]ROSS A B, KAMAL-ELDIN A, JUNG C, et al. Gas chromatographic analysis of alkylresorcinols in rye (Secale cereale L.) grains[J]. Journal of the Science of Food and Agriculture, 2001, 81(14): 1405-1411.
[12]周厚德,劉玉环,李瑞贞,等. 全麦中烷基间苯二酚的研究概述[J]. 食品科学,2008(8):680-684.
[13]BART LOMIEJ S, JUSTYNA R K, EWA N. Bioactive compounds in cereal grains-occurrence, structure, technological significance and nutritional benefits-a review[J]. Food Science and Technology International, 2012, 18(6): 559-568.
[14]GUNENC A, TAVAKOLI H, SEETHARAMAN K, et al. Stability and antioxidant activity of alkyresorcinols in breads enriched with hard and soft wheat brans[J]. Food Research International, 2013, 51(2): 571-578.
[15]张 珺,何义雁,朱香燕,等. 分光光度法快速测定糙米中烷基间苯二酚的研究[J]. 粮食与饲料工业, 2015(3):63-65.
[16]AGIL R, OOMAH D B, MAZZA G, et al. Optimization of alkylresorcinols extraction from triticale bran using response surface methodology[J]. Food and Bioprocess Technology, 2012, 5(7): 2655-2664.
[17]DEY E S, MIKHAILOPULO K. A food grade approach for the isolation of major alkylresorcinols (ARs) from rye bran applying tailored supercritical carbon dioxide (scCO2) extraction combined with HPLC[J]. The Journal of Supercritical Fluids, 2009, 51(2): 167-173.
[18]ATHUKORALA Y, HOSSEINIAN F S, MAZZA G. Extraction and fractionation of alkylresorcinols from triticale bran by two-step supercritical carbon dioxide[J]. LWT-Food Science and Technology, 2010, 43(4): 660-665.
[19]彭田園,赵仁勇,王香玉,等. 超声波辅助提取全麦粉中烷基间苯二酚的工艺优化[J]. 河南工业大学学报(自然科学版), 2017, 38(4): 14-19.
[20]PATZKE H, SCHULZE-KAYSERS N, SCHIEBER A. Separation and isolation of saturated and unsaturated 5-n-alk (en) ylresorcinols from rye bran[J]. Journal of Chromatography A, 2016, 1438: 39-45.
[21]KULAWINEK M, JAROMIN A, KOZUBEK A, et al. Alkylresorcinols in selected Polish rye and wheat cereals and whole-grain cereal products[J]. Journal of Agricultural and Food Chemistry, 2008, 56(16): 7236-7242.
[22]BORDIGA M, LOCATELLI M, TRAVAGLIA F, et al. Alkylresorcinol content in whole grains and pearled fractions of wheat and barley[J]. Journal of Cereal Science, 2016, 70: 38-46.
[23]ROSS A B, SHEPHERD M J, SCHVPPHAUS M, et al. Alkylresorcinols in cereals and cereal products[J]. Journal of Agricultural and Food Chemistry, 2003, 51(14): 4111-4118.
[24]LANDBERG R, DEY E S, FRANCISCO J D C, et al. Comparison of supercritical carbon dioxide and ethyl acetate extraction of alkylresorcinols from wheat and rye[J]. Journal of Food Composition and Analysis, 2007, 20(6): 534-538.
[25]SKRAJDA M, DABROWSKI G, KONOPKA I, et al. Effect of different cultivation technologies on correlations between the selected wheat grain quality features and the content of phenolic compounds[J]. Polish Journal of Natural Sciences, 2017, 32(3): 537-548.
[26]ZIEGLER J U, STEINGASS C B, LONGIN C F H, et al. Alkylresorcinol composition allows the differentiation of Triticum spp. having different degrees of ploidy[J]. Journal of Cereal Science, 2015, 65: 244-251.
[27]GEERKENS C H, MATEJKA A E, CARLE R, et al. Development and validation of an HPLC method for the determination of alk (en) ylresorcinols using rapid ultrasound-assisted extraction of mango peels and rye grains[J]. Food Chemistry, 2015, 169: 261-269.
[28]MARKLUND M, LANDBERG R, MAN P, et al. Determination of alkylresorcinol metabolites in human urine by gas chromatography-mass spectrometry[J]. Journal of Chromatography B, 2010, 878(11/12): 888-894.
[29]LIANG J, HE J, ZHU S, et al. Preparation of main iridoid glycosides in Fructus corni by macroporous resin column chromatography and countercurrent chromatography[J]. Journal of Liquid Chromatography & Related Technologies, 2013, 36(8): 983-999.
[30] LIU J, HAO Y, WANG Z, et al. Identification, quantification, and anti-inflammatory activity of 5-n-alkylresorcinols from 21 different wheat varieties[J]. Journal of Agricultural and Food Chemistry, 2018, 66(35): 9241-9247.
[31]KOZUBEK A. Isolation of 5-n-alkyl, 5-n-alkenyl-and 5-n-alkdienyl-resorcinol homologs from rye grains[J]. Acta Alimentaria Polonica, 1985, 11(2):185-198.
[32]TLUSCIK F, KOZUBEK A, MEJBAUM-KATZENELLEBOGEN W. Alkylresorcinols in rye (Secale cereale L.) grains. Ⅵ. Colorimetric micromethod for the determination of alkylresorcinols with the use of diazonium salt, Fast Blue B[J]. Acta Societatis Botanicorum Poloniae, 1981, 50(4): 645-651.
[33]ZARNOWSKI R, SUZUKI Y. 5-n-alkylresorcinols from grains of winter barley (Hordeum vulgare L.)[J]. Zeitschrift für Naturforschung C, 2004, 59(5/6): 315-317.
[34]國家粮食局.全麦粉:LS/T 3244—2015[S]. 北京:中国标准出版社,2015
[35]ANDERSSON A A M, MAN P, WANDEL M, et al. Alkylresorcinols in wheat and rye flour and bread[J]. Journal of Food Composition and Analysis, 2010, 23(8): 794-801.
[36]王宇飞,雪 松,向雪松,等. 全麦中烷基间苯二酚液相荧光测定方法的建立[J].营养学报,2018,40(4):392-397.
[37]邹燕羽,方 勇,李 彭,等. 全麦粉和小麦粉中烷基间苯二酚同系物组成的对比分析[J].中国农业科学,2020,53(10):2055-2065.
[38]郑亚辉.串联质谱技术在食品安全分析中的应用[J].现代科学仪器,2006(1):32-35.
[39]GIAMBANELLI E, FERIOLI F, D’ANTUONO F L. Alkylresorcinols and fatty acids in primitive wheat populations of Italian and Black sea region countries origin[J]. Journal of Food Composition and Analysis, 2018, 69: 62-70.
[40]GUNENC A, HADINEZHAD M, TAMBURIC-ILINCIC L, et al. Effects of region and cultivar on alkylresorcinols content and composition in wheat bran and their antioxidant activity[J]. Journal of Cereal Science, 2013, 57(3): 405-410.
[41]REBOOLLEDA S, BELTRAN S, SANZ M T, et al. Extraction of alkylresorcinols from wheat bran with supercritical CO2[J]. Journal of Food Engineering, 2013, 119(4): 814-821.
[42]LIU L, WINTER K M, STEVEVSON L, et al. Wheat bran lipophilic compounds with in vitro anticancer effects[J]. Food Chemistry, 2012, 130(1): 156-164.
[43]GUNENC A, KONG L, ELIAS R J, et al. Inclusion complex formation between high amylose corn starch and alkylresorcinols from rye bran[J]. Food Chemistry, 2018, 259: 1-6.
[44]GAJDA A, KULAWINEK M, KOZUBEK A. An improved colorimetric method for the determination of alkylresorcinols in cereals and whole-grain cereal products[J]. Journal of Food Composition and Analysis, 2008, 21(5): 428-434.
[45]SAMPIETRO D A, JIMENEZ C M, BELIZAN M M, et al. Development and validation of a micromethod for fast quantification of 5-n-alkylresorcinols in grains and whole grain products[J]. Food Chemistry, 2013, 141(4): 3546-3551.
[46]MOREAU R A, FANG X. Analysis of alkylresorcinols in wheat germ oil and barley germ oil via HPLC and fluorescence detection: cochromatography with tocols[J]. Cereal Chemistry, 2016, 93(3): 293-298.
[47]ZIEGER J U, SCHWEIGGERT R M, CARLE R. A method for the simultaneous extraction and quantitation of lipophilic antioxidants in Triticum sp. by HPLC-DAD/FLD-MSn[J]. Journal of Food Composition and Analysis, 2015, 39: 94-102.
[48]ROSS A B. Analysis of alkylresorcinols in cereal grains and products using ultrahigh-pressure liquid chromatography with fluorescence, ultraviolet, and CoulArray electrochemical detection[J]. Journal of Agricultural and Food Chemistry, 2012, 60(36): 8954-8962.
[49]GENG P, HARNLY J M, CHEN P. Differentiation of whole grain from refined wheat (T. aestivum) flour using lipid profile of wheat bran, germ, and endosperm with UHPLC-HRAM mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2015, 63(27): 6189-6211.
[50]GIAMBANELLI E, FERIOLI F, D’ANTUONO L F. Retention of alkylresorcinols, antioxidant activity and fatty acids following traditional hulled wheat processing[J]. Journal of Cereal Science, 2018, 79: 98-105.
[51]HAMMANN S, KORF A, BULL I D, et al. Lipid profiling and analytical discrimination of seven cereals using high temperature gas chromatography coupled to high resolution quadrupole time-of-flight mass spectrometry[J]. Food Chemistry, 2019, 282: 27-35.
[52]KNNODLER M, MOST M, SCHIEBER A, et al. A novel approach to authenticity control of whole grain durum wheat (Triticum durum Desf.) flour and pasta, based on analysis of alkylresorcinol composition[J]. Food Chemistry, 2010, 118(1): 177-181.
[53]黃沁沁,樊凤娇,李 彭,等. GC-MS和LC-MS/MS分析麦粉中烷基间苯二酚同系物组成[J].食品科学,2021,42(14):187-194.
(责任编辑:徐 艳)
2531501186354
