超高效液相色谱串联质谱同时检测人血清5种甾体激素方法学及生物参考区间的建立
2022-03-14陆优丽杨双双张美微欧美贤董春霞沈薇薇姜凤丽李水军
陆优丽,杨双双,张美微,欧美贤,董春霞,沈薇薇,姜凤丽,李水军
(上海药物Ⅰ期临床暨药物一致性评价工程技术研究中心 上海市临床质谱研究所上海市徐汇区中心医院 复旦大学附属中山医院徐汇医院,上海 200031)
甾体激素又称类固醇激素,是一类亲脂性、低相对分子质量的化合物,其结构以环戊烷多氢菲母核为基础。甾体激素在人体内可通过酶的作用相互转化,在调节免疫、维持机体发展及生长发育等人体正常的生理生化活动中起着重要作用[1-2]。甾体激素根据功能的不同主要分为肾上腺皮质激素和性激素两大类,其中性激素又分为雄激素、雌激素和孕激素。睾酮(testosterone,T)、双氢睾酮(dihydrotestosterone,DHT)、雄烯二酮(androstenedione,AD)、脱氢表雄酮(dehydroepiandrosterone,DHEA)是人体内主要的雄激素,雄激素浓度的异常变化与疾病的发生密切相关:前列腺癌的形成最初依赖于T、DHT、AD、DHEA,并由雄激素受体信号轴介导,因此雄激素剥夺疗法是局限性晚期或转移性前列腺癌的主要临床治疗方法,雄激素水平的准确测定也是判断雄激素是否缺乏的重要依据;性激素与肥胖有关,雄激素缺乏会导致肌肉质量、体积和力量的下降,是身体脂肪增加的主要原因,可导致性功能的下降[3-5]。《肾上腺皮质癌诊治专家共识》[6]指出,雄激素的水平(如高浓度的DHEA)或分泌方式(如同时分泌雄激素和皮质醇)可能提示恶性病变,可用于临床相关疾病的辅助诊断。有研究结果表明,多囊卵巢综合征的发病与雄激素过多有关[7],同时检测多种雄激素水平较检测单项激素水平具有更高的诊断特异性[8]。17α羟孕酮(17alphahydroxyprogesterone,17OHP)可用于排除非典型肾上腺增生引起的雄激素升高,亦是鉴别诊断多囊卵巢综合征的必要检测指标之一[5],同时检测T、DHT、AD、DHEA和17OHP是辅助和鉴别诊断多囊卵巢综合征快速而有效的方法。
目前,仍有较多实验室采用免疫学方法进行甾体激素的检测[9-10],而免疫学方法因特异性差,容易受到人体内多种激素的交叉干扰,易出现假阳性或假阴性结果[11]。液相色谱串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)因检测灵敏度高、特异性好,在小分子生物标志物的检测中具有突出优势,更被认为是甾体激素检测的“金标准”[12-13]。《多囊卵巢综合征中国诊疗指南》[14]建议联合检测多种甾体激素,以达到较好的特异性和准确性。然而,我国同时检测T、DHT、AD、DHEA、17OHP这5种甾体激素的研究报道较少。刘琪等[15]运用液液萃取法建立了一种可同时检测18种类固醇激素的LC-MS/MS方法,但未对干扰物进行验证;曹正等[7]建立了同时检测T、DHT、AD、DHEA和17OHP的方法,但未进行干扰物和基质效应的性能验证;且这2项研究均未进行基于中国人群的生物参考区间的研究[7,15]。本研究旨在建立可同时检测人血清中T、DHT、AD、DHEA和17OHP的超高效液相色谱串联质谱(ultra high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)方法,并进行全面的性能验证;同时,通过检测上海地区表观健康成年人血清中5种甾体激素的水平,建立适用于上海地区的血清T、DHT、AD、DHEA和17OHP的参考区间。
1 材料和方法
1.1 研究对象
根据美国临床实验室标准化学会(the Clinical and Laboratory Standards Institute,CLSI)C28-A3C文件[16]要求,从体检人群中筛选符合要求的研究对象,共纳入368名表观健康者,其中男120名、女248名,年龄16~100岁。本研究获得上海市徐汇区中心医院伦理委员会批准。纳入标准:无5种甾体激素异常相关疾病,无糖尿病、高血压、肿瘤、冠心病、多囊卵巢综合症、月经不调、骨质疏松症等相关病史及症状;体检结果正常,血常规、尿常规、血清学检查和肝功能、肾功能、血糖、血脂、肿瘤标志物等检测结果均正常。排除标准:近期妊娠、哺乳期、大量饮酒、近期或长期献血、输血、接受手术者以及溶血、脂血等质量不合格样本。
1.2 血清样本采集与保存
采集所有研究对象晨起空腹前臂静脉全血,1 200×g离心10 min,分离血清,保存于2 mL离心管中,-70 ℃冷冻保存待测。
1.3 试剂与标准品
分析物T(纯度为99.54%)、DHT(纯度为99.80%)、AD(纯度为99.44%)、DHEA(纯度为99.87%)、17OHP(纯度为96.40%)、T-d3、DHT-d3、AD-13C3、DHEA-d5、17OHP-d8(纯度均>97.00%)及内标的标准品均购自美国Cerilliant公司。甲酸、甲醇、乙腈(色谱级,美国TEDIA公司) ;氨水(色谱纯试剂,中国国药集团化学试剂有限公司);30%脂肪乳注射液(C14~C24,无锡费森尤斯卡比华瑞制药有限公司);实验用水为本实验室采用Millipore纯水系统(美国Millipore 公司) 自制。
1.4 主要仪器与耗材
API 4000串联质谱仪(美国AB Sciex公司);LC-30AD高效液相色谱系统(日本岛津公司);色谱柱为Poroshell 120 EC-C18(2.1×100 mm,2.7 μm,美国Agilent公司);Vortex Genie2 涡旋混合器( 美国Scientific Industries公司) ;Mikro22R冷冻高速离心机(德国Hettich公司) ;移液器( 德国Eppendorf公司);固相微萃取小柱为SOLAμ HRP(2 mg/mL 96 well plate,美国Thermo Fisher Scientific公司)。
1.5 溶液配制
因无法得到人空白血清基质,故用活性炭吸附过的小牛血清替代人血清作为空白基质,用于标准曲线的配制和稀释实验中的稀释液,质控样本和回收率、基质效应等的考察使用含本底的混合人血清样本。
1.5.1 标准曲线及质控添加液的配制 用50%甲醇将(T、AD、17OHP)/DHT/DHEA储备液配制成混合工作液,并按比例稀释,制成标准曲线添加液和低、中、高浓度的质控添加液。详细分析物浓度见表1。
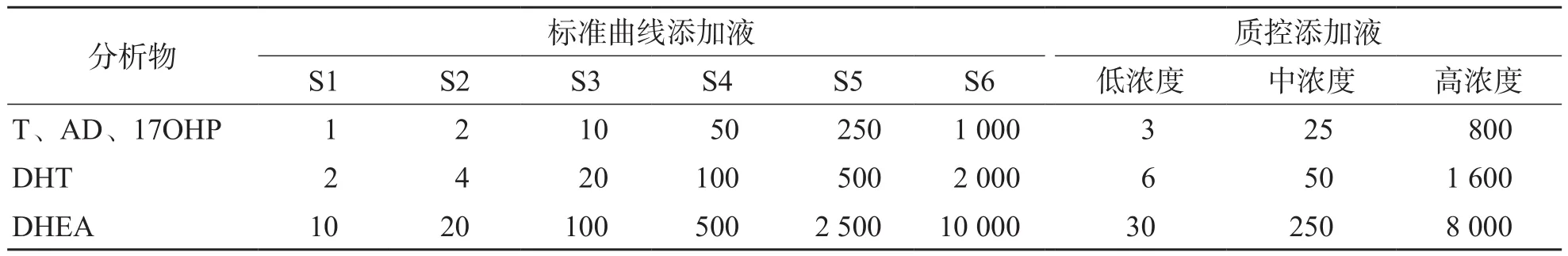
表1 标准曲线添加液和质控添加液配制浓度 ng/mL
1.5.2 标准曲线样品和质控品的配制 准确吸取500 μL活性炭吸附过的小牛血清,加入5 μL标准曲线添加液中,得到标准曲线样品;准确吸取500 μL混合人血清,加入5 μL质控品添加液中,得到质控品。
1.5.3 内标工作液的配制 将T-d3、AD-13C3、17OHP-d8、DHT-d3和DHEA-d5储备液用50%甲醇稀释,配制成浓度为10、20、20、40、100 ng/mL的内标工作液,待用。
1.6 样本前处理
将待测人血清样品和配制的标准曲线样品、质控品和内标工作液取出,室温平衡,检测前混匀。取500 μL人血清样品(另补充5 μL 50%甲醇)、505 μL标准曲线样品和质控品,分别加入10 μL内标工作液,涡旋震荡5 min混匀,再加入500 μL甲醇沉淀,震荡5 min,22 136×g离心10 min,弃上清,分别加入500 μL 2%氨水和3.5 mL 2%氨水-10%甲醇,混匀,上样至固相萃取小柱。固相萃取小柱操作步骤:(1)700 μL甲醇活化;(2)700 μL 10%甲醇-2%氨水平衡;(3)上样;(4)700 μL 40%甲醇清洗2次;(5)50 μL甲醇洗脱2次(每步操作压力均控制在30 psi以内)。将洗脱下来的溶液转移至进样管中,加入20 μL水混匀后进行分析,进样体积为30 μL。
1.7 液相色谱条件
采用Poroshell 120 EC-C18色谱柱(2.1 mm×100 mm,2.7 μm)。流动相A为0.05%甲酸-30%乙腈水溶液,流动相B为0.05%甲酸-90%乙腈溶液。梯度洗脱程序:0.00 min(0%B),0.1~7.00 min(35%B),7.01~9.00 min(100%B),9.01~12.00 min(0%B)。流速为0.3 mL /min,持续12 min,进样体积为30 μL。自动进样器温度为4 ℃。
1.8 质谱条件
用电喷雾离子源在正离子扫描模式下进行多反应监测模式分析,扫描间隔为5 ms。雾化气(Gas1)60 psi,辅助气(Gas2)70 psi,气帘气(CUR)30 psi,碰撞气(CAD)12 psi,离子源温度为550 ℃。分析物的具体质谱参数见表2。
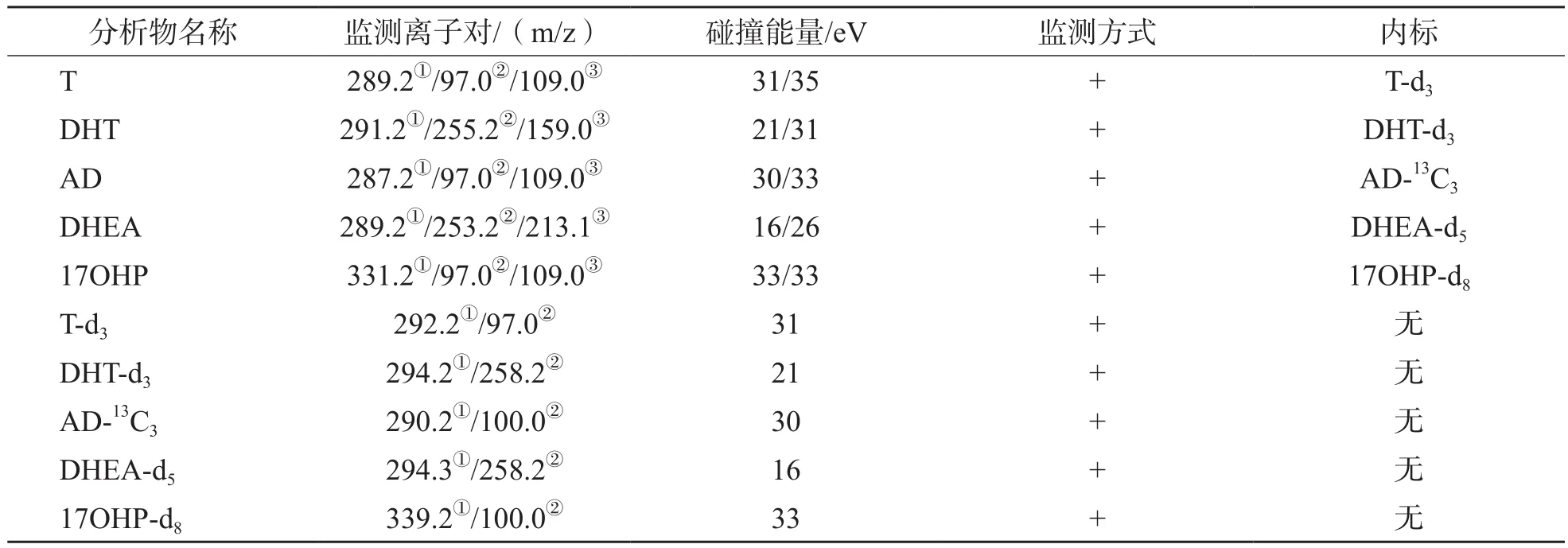
表2 分析物质谱参数
1.9 方法学验证
1.9.1 残留评价 在标准曲线最高浓度点样品进样完成后,进1针空白样品,考察是否存在残留。以分析物保留时间处的峰面积不超过最低定量检测限(lower limit of quantification,LLOQ)的20.0%,内标保留时间处的峰面积不超过内标峰面积的5.0%为进样无残留。
1.9.2 准确度与精密度 准确吸取505 μL低、中、高浓度质控品和用于配制该质控品的混合人血清,按预处理方法各进行6次平行实验,测定质控品各个分析物的浓度,计算批内准确度和精密度。连续制备3批质控品,考察批间准确度和精密度。计算公式:准确度=(实际测定值-本底值)/理论添加值×100%,精密度[以(变异系数(coefficient of variation,CV)表示]=标准偏差/测定浓度平均值×100%。
1.9.3 稀释实验 在混合的人血清基质中加入工作液配成最高定量检测限(upper limit of quantification,ULOQ)和5倍的ULOQ样本,用活性炭吸附过的小牛血清作为稀释液分别稀释2倍和10倍,至ULOQ浓度的1/2,按预处理方法处理后进样分析,考察6份稀释样本的准确度和精密度。
1.9.4 基质效应和提取回收率 取5份不同来源的人血清各500 μL,加入10 μL内标工作液,按预处理方法处理,100 μL甲醇洗脱后加15 μL 50%甲醇水溶液和5 μL蒸馏水,混匀,进样(A1/IS1)。取同样来源的人血清500 μL,分别加入5 μL低、中、高3种浓度的质控添加液,再加入10 μL内标工作液,按预处理方法处理,100 μL甲醇洗脱后加15 μL 50%甲醇水溶液和5 μL蒸馏水,混匀,进样(A2/IS2)。取同样来源的人血清500 μL,不加内标,按预处理方法处理,100 μL甲醇洗脱后分别添加5 μL低、中、高3种浓度的质控添加液、10 μL内标工作液和5 μL蒸馏水,混匀,进样(A3/IS3)。另取100 μL甲醇,分别加入5 μL低、中、高3种浓度的质控添加液、10 μL内标工作液和5 μL蒸馏水,混匀,进样(A4/IS4)。以上样品重复测定3次,分别得出分析物和内标的峰面积。计算公式:分析物基质效应=(A3峰面积-A1峰面积)/A4峰面积,内标校正的基质效应=分析物基质效应×IS4峰面积/IS3峰面积,分析物提取回收率(%)=(A2峰面积-A1峰面积)/(A3峰面积-A1峰面积)×100%,内标提取回收率(%)=IS2峰面积 / IS3峰面积×100%。
1.9.5 选择性 尽管LC-MS/MS技术在特异性和选择性方面优于其他检测技术,但甾体激素种类丰富,血清中其他内源性结构类似物可能会对分析产生潜在干扰;此外,溶血和脂血也可能影响检测结果。因此,本研究评估了UPLCMS/MS对结构类似的甾体激素、溶血、脂血等的抗干扰能力。
(1)干扰物。将可能干扰甾体激素检测结果的分析物加入混合人血清中,并配置低值和高值质控品,测定待测物浓度,与未添加干扰物的质控品比较,计算结果的偏差。干扰物(血清浓度,根据参考区间上限或上限的10倍浓度确定加入量)包括孕酮(100 ng/mL)、雌二醇(4 ng/mL)、雌酮(2 ng/mL)、孕烯醇酮(30 ng/mL)、17羟基孕烯醇酮(100 ng/mL)、皮质醇(100 ng/mL)、可的松(100 ng/mL)。
(2)溶血。收集3份不同来源的全血样本,各取2 mL血清,分别加入40 μL(2%)对应的血细胞,通过超声处理使血细胞完全破碎后,各取510 μL,按前处理方法处理后测定其浓度,将结果与对应的无溶血的血清样本浓度进行比较,计算偏差。
(3)脂血。收集3份不同来源的全血样本,各取2 mL血清,分别加入10、20、40 μL(0.5%、1.0%、2.0%)的脂肪乳,振荡混匀,得到高三酰甘油血清样本,测定其三酰甘油浓度依次为4.58、6.65、10.79 mmol/L,各取510 μL,按前处理方法处理后,测定其中的甾体激素浓度,考察高三酰甘油对激素测定是否有干扰。
1.9.6 稳定性 收集6名体检人员(男、女各3名)的血清样本,每份样本分装成3份,分别考察其室温(25 ℃)放置4、24 h;-25~-15 ℃放置30、100 d,以及-90~-70 ℃放置30、100 d的稳定性。
1.10 参考区间的建立
采用UPLC-MS/MS检测368名表观健康者的血清T、DHT、AD、DHEA和17OHP水平,并建立参考区间。采用UPLC-MS/MS检测368名表观健康者血清T、DHT、AD、DHEA和17OHP水平,并建立参考区间。按性别和年龄(16~20岁、21~30岁、31~40岁、51~60岁、>61岁)分别分组。
1.11 统计学方法
采用SPSS 24.0软件进行统计分析。采用Dixon法剔除离群值。正态性检验采用Q-Q图结合Kolmogorov-Smirnov检验。呈正态分布的计量资料用±s表示,组间比较采用方差分析,采用±1.96s方式建立参考区间。呈非正态分布的计量资料以中位数(M)[四分位数(P25~P75)]表示,组间比较采用Kruskal-Walli检验,采用百分位数法(P2.5~P97.5)建立参考区间。以P<0.05为差异有统计学意义。
2 结果
2.1 分离条件的摸索与优化
甾体激素在人体内含量低,人血清经蛋白沉淀后再用固相萃取柱纯化浓缩,可以有效减小基质对分析测定的干扰,提高激素的检测灵敏度。使用Poroshell 120 EC-C18色谱柱,用含甲酸的流动相进行梯度洗脱,可以较好地分离T、DHT、AD、DHEA和17OHP,峰形好,且灵敏度高。优化后的分析物及对应内标的色谱图见图1。
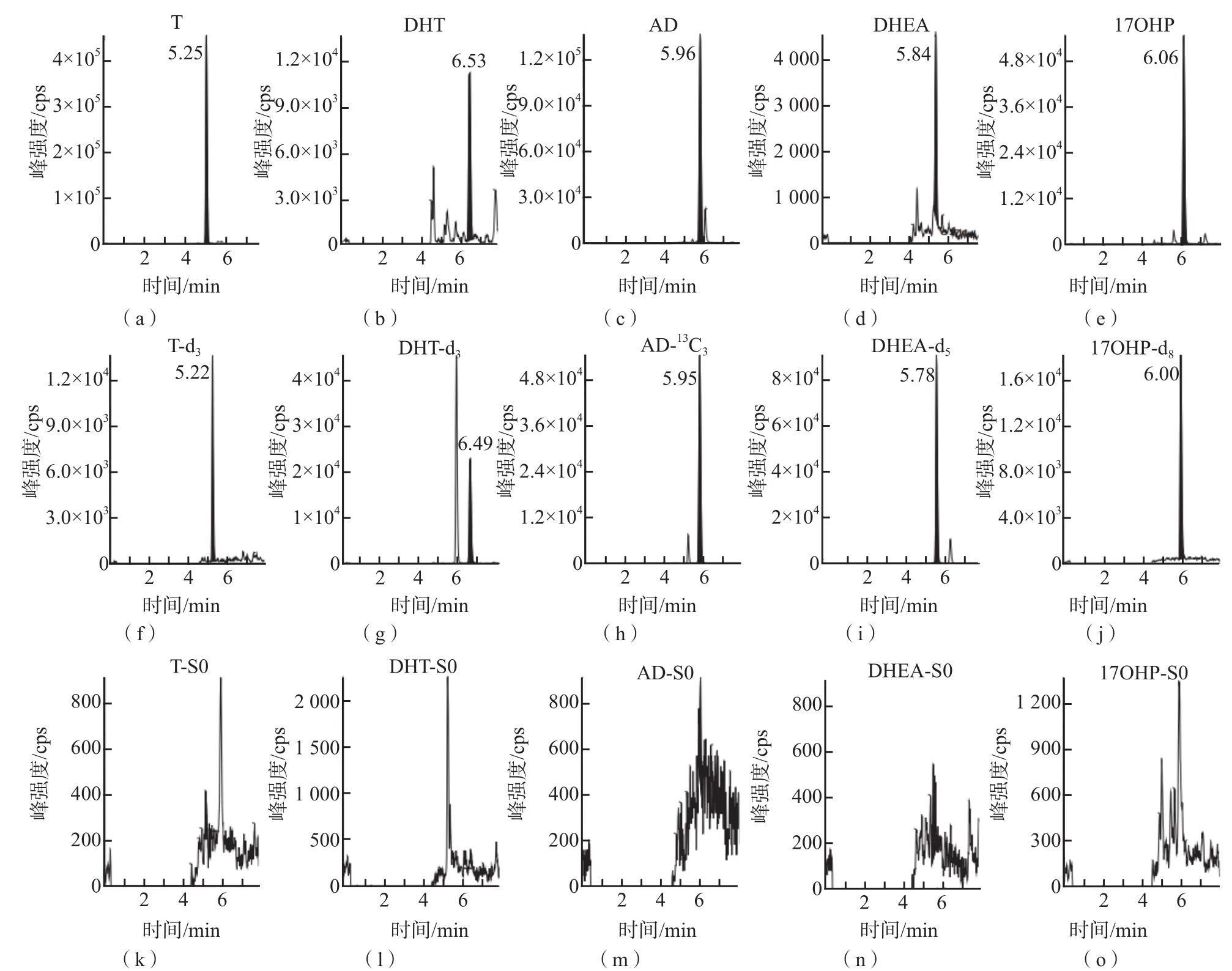
图1 人血清样本中T、DHT、AD、DHEA及17OHP及其对应内标、空白替代基质典型色谱图
2.2 标准曲线和最低定量限
以标准曲线样品分析物的浓度为X轴,分析物峰面积与对应内标峰面积的比值为Y轴,用最小二乘法1/x权重进行线性回归,得到T、DHT、AD、DHEA、17OHP的回归方程分别为:Y=0.004 89X+0.029(r2=0.999 6)、Y=1.67X+0.007(r2=0.999 5)、Y=2.05X+0.005(r2=0.999 8)、Y=0.28X+0.011(r2=0.999 8)、Y=2.51X+0.015(r2=0.999 9),线性关系良好。T、DHT、AD、DHEA和17OHP的最低定量限分别为0.01、0.02、0.01、0.10和0.01 ng/mL。
2.3 残留评价
计算结果显示,5种甾体激素各分析物保留时间处峰面积均不超过最低定量限LLOQ的20%,且内标保留时间处的峰面积不超过内标峰面积的5%,表明进样无明显残留。
2.4 准确度、精密度和稀释实验
5种甾体激素3个批次的准确度和精密度测定低、中、高浓度质控样品的批内平均准确度均为96.6%~105.6%,CV均<8%;批间准确度为95.0%~105.2%,批间CV均<6%。稀释实验结果表明,5倍ULOQ以内的样本稀释10倍后,采用本方法检测,准确度为86.16%~103.60%,CV<5%,本方法的可报告范围可覆盖5 000倍。见表3。
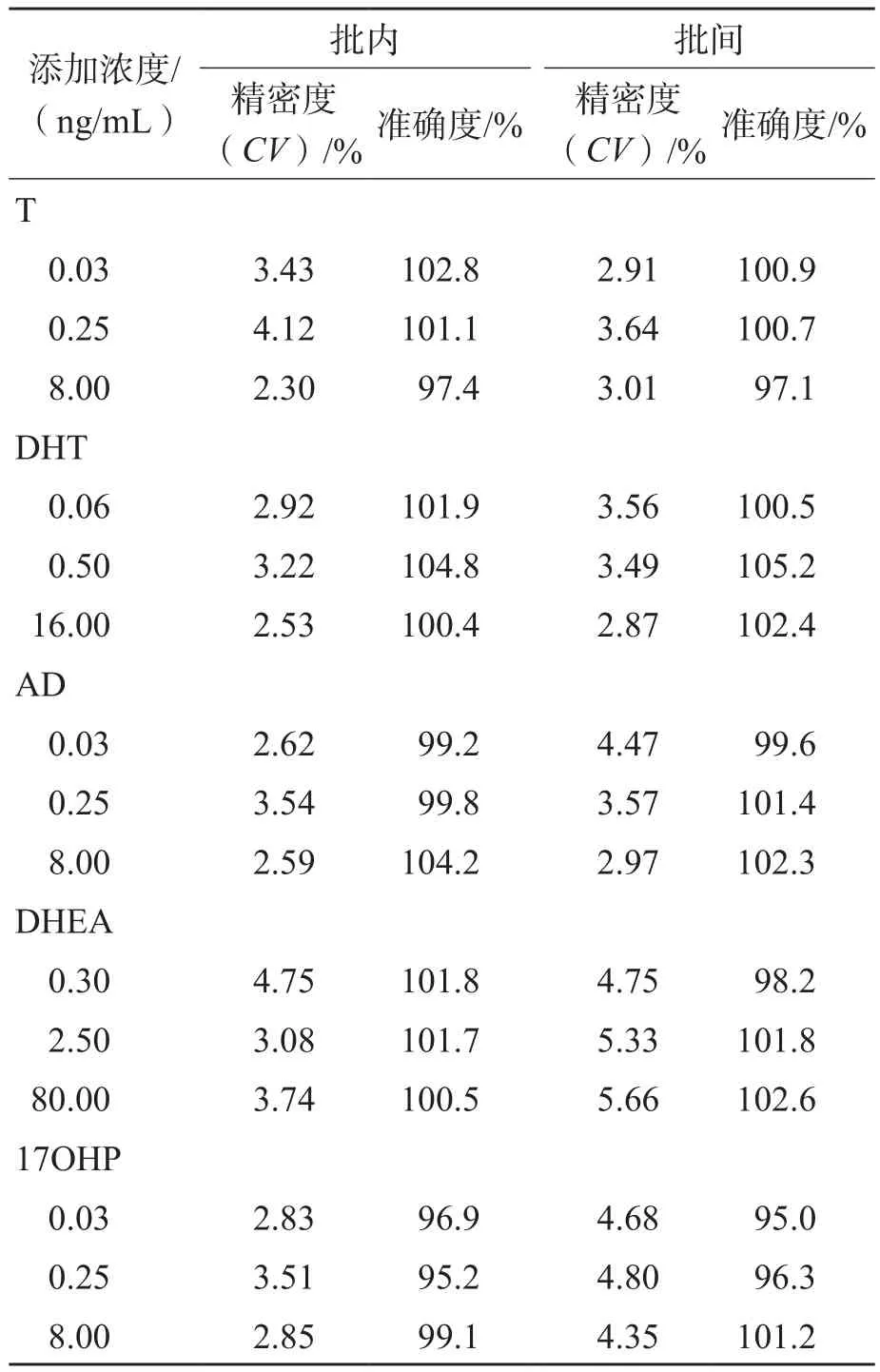
表3 批内和批间准确度与精密度
2.5 基质效应和提取回收率
5种甾体激素均存在一定程度的基质抑制,经内标校正后,T、DHT、AD、DHEA和17OHP的相对基质效应分别为0.945 3、1.005 0、1.003 0、0.966 9和1.009 0,表明同位素内标可校正基质效应。此外,各分析物及内标在血清中的提取回收率均>60%。见表4。
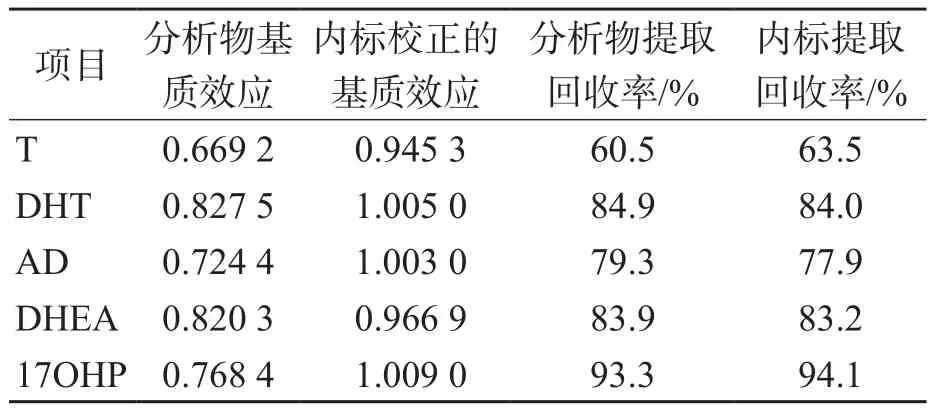
表4 5种甾体激素基质效应和提取回收率
2.6 选择性
干扰实验结果表明,8种潜在干扰物对甾体激素检测结果的偏差为-9.90%~2.72%,均在可接受范围内。溶血实验结果表明,含有2%溶血细胞的血清样本T、DHT、AD和17OHP测定结果的偏差为1.93%~9.49%,无明显影响,但会导致DHEA测定结果偏低18.65%。高三酰甘油对5种甾体激素的测定结果偏差为0.15%~12.54%,对测定结果无干扰。
2.7 稳定性
稳定性实验结果表明,血清样本室温放置24 h,除DHEA浓度下降-37.33%外,其他4种甾体激素均较稳定;此外,血清样本分别在-25~-15 ℃和-90~-70 ℃下冻存100 d,检测结果偏差均<±15%。见表5。
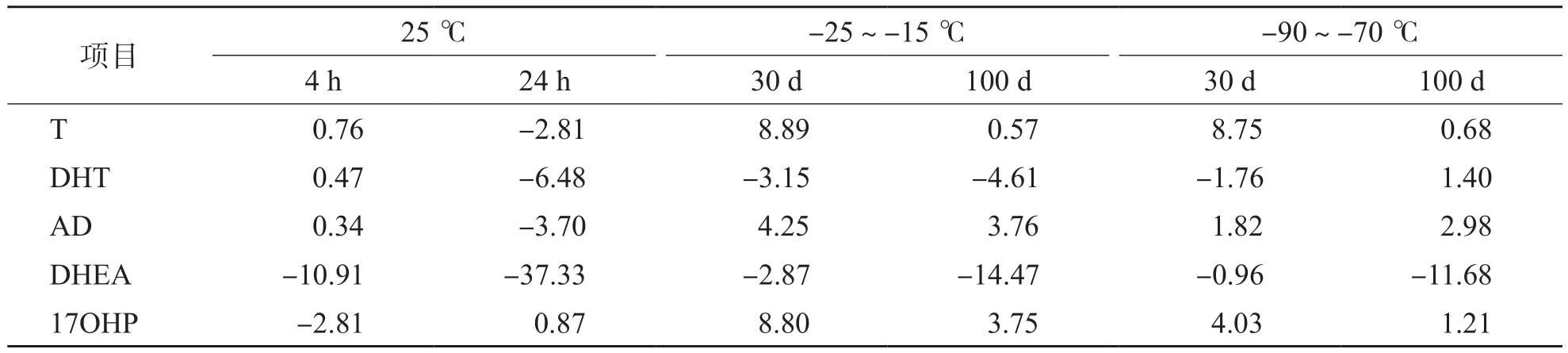
表5 5种甾体激素不同温度放置不同时间对血清样本稳定性(相对偏差)的影响 %
2.8 室间质量评价结果
采用本研究建立的UPLC-MS/MS方法参加2019年国家卫生健康委临床检验中心全国内分泌正确度验证质谱法调查,结果显示,T、17OHP 2个项目测定结果与靶值的偏差为-5.00%~0.38%,均在可接受的范围内,合格率为100%。相关室间质量评价结果见表6。
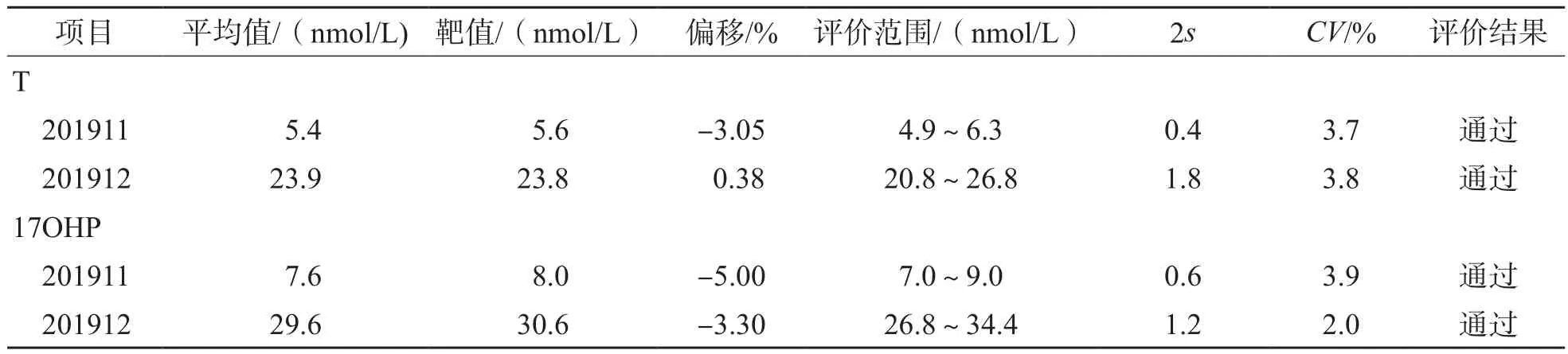
表6 2019年国家卫生健康委临床检验中心T、17OHP相关室间质量评价结果
2.9 参考区间
2.9.1 离群值 采用Dixon法在女性研究对象T测定值中发现1个离群值(8.8 ng/mL),与相邻值的D为8.1 ng/mL,R为8.73,D/R=0.93>1/3。故最终有367名研究对象纳入本研究。
2.9.2 不同性别、年龄表观健康者5种甾体激素水平比较 男、女性血清T、DHT、AD、DHEA和17OHP水平差异均有统计学意义(P<0.05),因此需按性别建立不同的参考区间。男性5个年龄段之间血清T、DHT、AD、DHEA和17OHP水平差异均无统计学意义(P>0.05),因此将男性不同年龄段合并后建立统一的参考区间。16~20岁、21~30岁和31~40岁女性血清T、DHT、AD、DHEA和17OHP水平与51~60岁、>61岁女性比较,差异均有统计学意义(P<0.05),而16~20岁、21~30岁、31~40岁女性之间和51~60岁、>61岁女性之间差异均无统计学意义(P<0.05)。因此女性按16~50岁和>50岁分别建立参考区间。见表7。
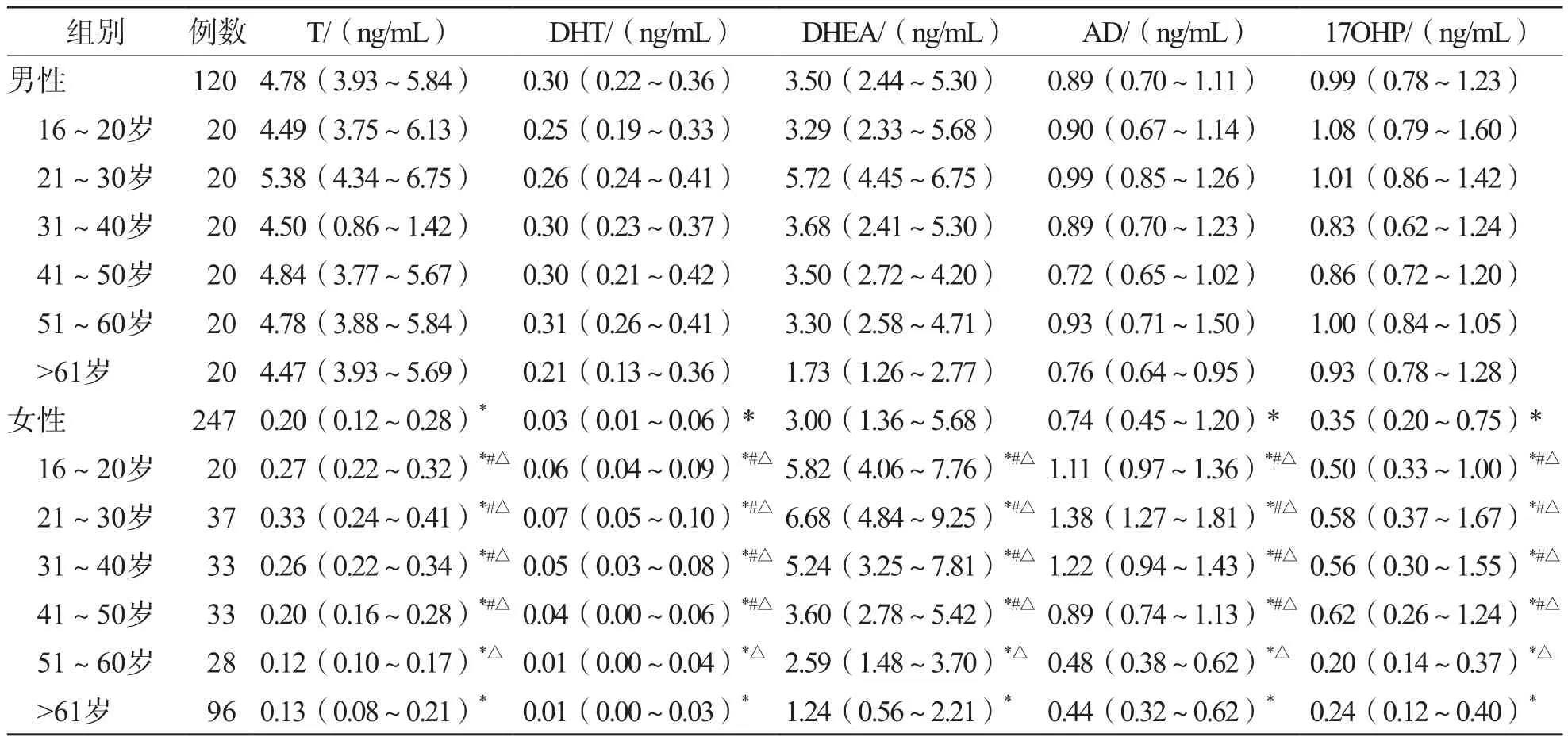
表7 不同性别及年龄的表观健康者5种甾体激素比较
2.9.3 参考区间建立 正态性检验结果显示,1 6~5 0岁女性血清D H T水平呈正态分布(P=0.200),男性和>50岁女性血清T、AD、DHT、DHEA和17OHP水平均呈非正态分布(P<0.05)。采用不同方式建立的参考区间见表8。
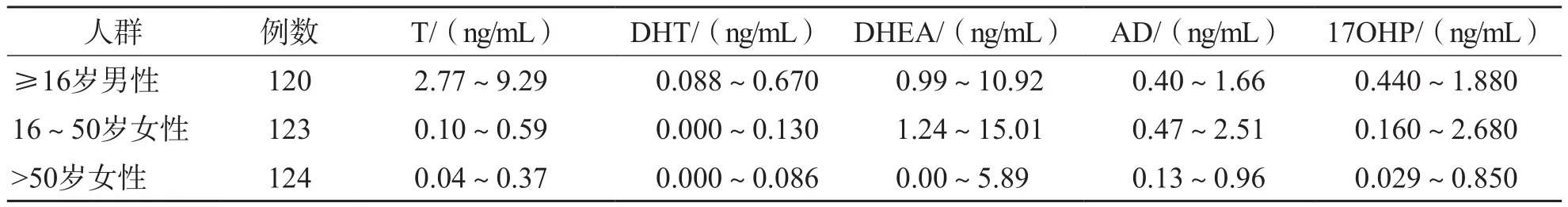
表8 5种甾体激素的参考区间
3 讨论
本研究建立了一种选择性高、准确好的检测血清5种甾体激素(T、AD、DHT、DHEA和17OHP)的UPLC-MS/MS方法。血清样品经甲醇沉淀等前处理后,用SOLAμ HRP固相萃取小柱纯化,可以有效除去杂质干扰。各激素用其对应的稳定同位素作为内标,可减小基质干扰和前处理损失的影响,提高定量的准确度。本研究建立的LC-MS/MS检测方法可排除其他结构类似的内源性激素的干扰,各激素检测的线性范围达到1 000倍,r2值均>0.999 5,可报告范围达到5 000倍,在生理和病理浓度下均可被准确检出。LLOQ低于以往的文献报道[6],分别为0.01(T/17OHP /AD)、0.02(DHT)、0.10 ng/mL(DHEA),可灵敏且准确定量样本中的低浓度甾体激素水平,在短时间内高效完成人体内痕量类固醇激素多组分的定量分析。此外,本研究还考察了溶血、脂血对于测定结果的影响,证实了溶血样本会干扰DHEA的测定结果,建议在实际应用中,严格控制样本溶血,保证检验质量。
本研究建立的方法参加2019年国家卫生健康委临床检验中心开展的16种17OHP制备物和新鲜冰冻人血清基于2种评价方案的互通性研究结果显示,所有正确度验证材料和甾体激素标准物质在本实验室和金域医学实验室2个LCMS/MS分析系统中表现出良好的互通性[17]。T和17OHP项目参加了2019年上半年国家卫生健康委临床检验中心全国内分泌正确度验证质谱法调查,合格率为100%。本研究建立的方法可实现对甾体激素多组分的分快速准确测定,可为临床雄激素异常相关疾病的检测和诊断提供准确、有效的依据。
T、AD、DHT、DHEA和17OHP是辅助临床鉴别诊断多囊卵巢综合征的重要指标,建立适合本地区临床实验室的参考区间可以更好地为相应疾病的诊断提供参考。本研究对367名体检者血清样本的激素水平进行了统计分析,并根据性别和年龄差异进行分组,建立了基于UPLCMS/MS方法的参考区间。虽然与文献报道[18]存在微小的差异,但考虑到研究对象的地域、种族、生活习惯等因素,本研究结果更适用于为上海地区人群甾体激素相关疾病的诊断提供参考。后续将扩大样本量对此参考区间进行进一步验证。
