纤维素酶法提取金银花中绿原酸工艺优化及其抗氧化活性
2022-03-10杨红文彭福润
杨红文,彭福润
(闽南师范大学生物科学与技术学院,福建 漳州 363000)
金银花,又名金藤花,是忍冬科忍冬属植物的干燥花蕾,有宣散风热、抗菌消炎、免疫调节等作用,是传统的中药材,是连花清瘟胶囊、金花清感颗粒、双黄连等多种清火中药处方的组分。绿原酸为金银花主要活性成分[1],绿原酸含量多少是判断金银花质量好坏的重要指标[2],绿原酸具有降血压、降血脂、抗菌、抗病毒、抗肿瘤和清除自由基等作用[3-8],在医药、保健、食品等行业具有很大的应用价值。
水提法和有机溶剂浸提法是金银花中绿原酸提取的两种传统方法,前者耗时长、效率低、杂质多[9],后者虽然耗时短、提取率高、杂质少,但存在有机溶剂残留问题[10]。纤维素是植物细胞壁的主要成分,纤维素酶可以降解植物细胞壁纤维素,促使活性成分溶出,提高其得率,还能避免水提法的高温对活性成分的破坏[11]。本试验首次采用纤维素酶提取金银花中的绿原酸,在探讨纤维素酶添加量、pH值、提取温度、提取时间和料液比对提取率影响的基础上,采用正交优化得出最佳提取工艺,并以维生素C为阳性对照,采用铁离子还原法和羟自由基清除试验确定所得金银花绿原酸提取液的体外抗氧化活性,为金银花中绿原酸的活性研究及其在医药、食品中的应用奠定基础。
1 材料与方法
1.1 材料与仪器
金银花(产地安徽省芜湖):芜湖市徽福茶叶有限公司;绿原酸标准品(HPLC≥98%):合肥博美生物科技有限公司;纤维素酶(粉末制剂,酶活≥15 000 U/g)、无水乙醇、氢氧化钠、盐酸、铁氰化钾、三氯化铁、三氯乙酸、水杨酸、双氧水、硫酸亚铁、抗坏血酸(分析纯):国药集团化学试剂有限公司。
FW100型万能粉碎机:天津泰斯特仪器有限公司;TP-114型电子分析天平:上海精天电子仪器公司;HH-8数显恒温水浴锅:常州国华电器有限公司;UV-1100PC型紫外/可见分光光度计:厦门精艺兴业科技有限公司;SHB-Ⅲ型循环水真空泵:河南省予华仪器有限公司;DHG-101-4A型电热恒温鼓风干燥箱:上海精宏仪器设备有限公司。
1.2 试验方法
1.2.1 绿原酸标准曲线的制备
精确称取5.0 mg绿原酸标准品,置于50 mL容量瓶中,用无水乙醇溶解并定容至刻度线,再吸取0、0.2、0.4、0.6、0.8、1.0 mL,分别用无水乙醇稀释并定容至10 mL,得到 0、2、4、6、8、10mg/L 系列浓度的绿原酸标准液。以无水乙醇为空白对照,在波长328nm下测定吸光度[12]。以绿原酸标准液浓度(mg/L)为横坐标,吸光度为纵坐标,绘制标准曲线,得线性回归方程y=0.043 2x+0.001 3,R2=0.999 2。
1.2.2 金银花绿原酸的提取及含量测定
将金银花样品经60℃烘干至恒重后粉碎过80目筛备用,用电子分析天平准确称取1.0 g金银花粉末,放入50 mL锥形瓶中,加入适量蒸馏水并轻轻搅拌,静置30 min后加入一定量50℃活化15 min的纤维素酶,调节pH值,置于特定温度的恒温水浴锅中提取一定时间。提取液经真空抽滤两次合并滤液,用蒸馏水定容至100 mL,准确量取1 mL,用蒸馏水稀释并定容至50 mL,得到待测液,于328 nm波长处测定吸光度,根据标准曲线计算绿原酸浓度,并按下式计算绿原酸提取率。

式中:C为根据标准曲线计算出的绿原酸浓度,mg/L;N 为稀释倍数,50;V 为提取液总体积,0.1 L;M为金银花粉末质量,1 g。
1.2.3 单因素试验及正交试验
分别对提取温度(30、40、50、60、70 ℃)、提取时间(30、40、50、60、70 min)、料液比[1∶15、1∶20、1∶25、1∶30、1∶35(g/mL)]、纤维素酶添加量(0.1%、0.2%、0.3%、0.4%、0.5%)、pH 值(3.5、4.0、4.5、5.0、5.5)进行单因素试验,研究各因素对金银花绿原酸提取率的影响,并选择提取温度、提取时间、纤维素酶添加量、pH值进行四因素三水平L9(34)正交试验,确定金银花绿原酸提取的最佳工艺参数。
1.2.4 铁离子还原能力测定
参考浦跃武等[13]的方法略作修改,将绿原酸提取液减压蒸发浓缩后用蒸馏水稀释制备成0、0.1、0.2、0.3、0.4、0.5 mg/mL浓度梯度,并分别吸取2 mL加入6支试管;再向每支试管分别加入磷酸盐缓冲液(0.2 mol/L,pH6.6)及1%铁氰化钾溶液各2 mL,振荡混匀并于50℃水浴20 min,置于冰盆中快速冷却终止反应,各加入2 mL 10%三氯乙酸溶液,轻轻振荡混合均匀,各取2 mL置于6支新试管,再向新试管中分别加入2 mL蒸馏水和0.5 mL 0.1%三氯化铁溶液,26℃静置10 min。以不添加绿原酸提取液的反应液为空白对照调零,700 nm处测定吸光值,以维生素C作为对照。
1.2.5 羟自由基清除率测定
参考罗敏等[14]的方法略作修改,将制备的0、0.1、0.2、0.3、0.4、0.5 mg/mL 绿原酸提取液 2 mL 分别加入6支试管,向每支试管加入硫酸亚铁溶液(8 mmol/L)和水杨酸-乙醇溶液(8 mmol/L)各2 mL,再各加入2 mL双氧水(8.8 mmol/L),同时设置以蒸馏水替代双氧水的本底对照,轻轻振荡混匀,26℃静置45 min进行羟自由基清除试验,510 nm处测吸光值,按下式计算羟自由基清除率。以维生素C作为对照。

式中:A空白为不添加绿原酸提取液的空白对照吸光值;A样品为加不同浓度绿原酸提取液后的吸光值;A本底为蒸馏水替代显色剂双氧水的本底对照吸光值。
2 结果与分析
2.1 提取温度对绿原酸提取率的影响
在料液比1∶25(g/mL)、纤维素酶添加量0.3%、pH5.0、提取时间50 min时,提取温度对绿原酸提取率的影响见图1。

图1 提取温度对绿原酸提取率的影响Fig.1 Effect of extraction temperature on the yield of chlorogenic acid
从图1中可以看出,在30℃~70℃温度范围内,金银花绿原酸提取率呈先升后降的趋势,在50℃时提取率最大。提取温度低于50℃时,纤维素酶活性随温度升高而增加,加速了金银花细胞壁纤维素的降解,同时分子热运动加剧及绿原酸溶解度升高,绿原酸溶出加速,提取率升高。当提取温度超过50℃后,纤维素酶活性下降,金银花细胞壁纤维素降解程度减弱,绿原酸溶出减少,且随着提取温度进一步升高,绿原酸更易被氧化[15],提取率下降。因此选择提取温度40、50、60℃进行正交试验。
2.2 提取时间对绿原酸提取率的影响
在料液比1∶25(g/mL)、纤维素酶添加量0.3%、pH5.0、提取温度50℃时,提取时间对绿原酸提取率的影响见图2。

图2 提取时间对绿原酸提取率的影响Fig.2 Effect of extraction time on the yield of chlorogenic acid
从图2中可以看出,随着提取时间延长,纤维素酶对金银花细胞壁纤维素分解更加充分,且随着时间延长,绿原酸溶出增多,提取率升高,50 min时,提取率达到最高。继续延长提取时间,提取率不升反降,可能是因为长时间提取,金银花绿原酸溶出基本达到平台期,且长时间较高温提取,绿原酸氧化破坏加剧,使绿原酸提取率下降[16],也可能是绿原酸在有光条件下更容易分解,导致绿原酸提取率下降[17]。因此选择提取时间40、50、60 min进行正交试验。
2.3 料液比对绿原酸提取率的影响
在纤维素酶添加量0.3%、pH5.0、提取温度50℃、提取时间50 min时,料液比对绿原酸提取率的影响见图3。

图3 料液比对绿原酸提取率的影响Fig.3 Effect of solid liquid ratio on the yield of chlorogenic acid
从图3中可以看出,金银花绿原酸提取率随溶剂体积增加逐渐增大,料液比1∶30(g/mL)时提取率达到最大,之后略有下降。在一定范围内,随着溶剂体积增加,金银花中绿原酸溶出增加,提取率上升,液料比达到1∶30(g/mL)时,金银花中绿原酸溶出基本完全,不再随着溶剂体积增加而更多溶出,反而会随着溶剂体积增加,pH值有所上升,导致绿原酸部分水解,提取率略有下降[17]。但整体看,料液比对绿原酸提取率影响并不明显,因此选取料液比为1∶30(g/mL),不再进行后续正交试验。
2.4 纤维素酶添加量对绿原酸提取率的影响
在料液比 1∶25(g/mL)、提取温度 50 ℃时、pH5.0、提取时间50 min,纤维素酶添加量分别为金银花质量的0.1%、0.2%、0.3%、0.4%、0.5%时,探究纤维素酶添加量对绿原酸提取率的影响,结果见图4。
从图4中可以看出,随着纤维素酶添加量增加,金银花绿原酸提取率逐渐升高,当纤维素酶添加量为0.4%时提取率达到38.62 mg/g,之后随着纤维素酶添加量增加,提取率不再升高。0.4%的纤维素酶添加量对金银花细胞壁纤维素的酶解已基本饱和[18]。因此选择纤维素酶添加量0.3%、0.4%、0.5%进行正交试验。
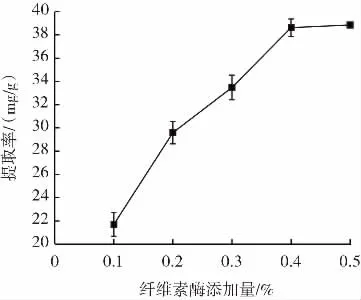
图4 纤维素酶添加量对绿原酸提取率的影响Fig.4 Effect of cellulase dosage on the yield of chlorogenic acid
2.5 pH值对绿原酸提取率的影响
在料液比 1∶25(g/mL)、纤维素酶添加量 0.3%、提取温度50℃、提取时间50 min时,提取液的pH值对绿原酸提取率的影响见图5。

图5 pH值对绿原酸提取率的影响Fig.5 Effect of pH value on the yield of chlorogenic acid
从图5中可以看出,提取最佳pH值为4.5,此时提取率最高,达40.02 mg/g,pH值升高或下降,提取率均降低。纤维素酶的最适pH值在5.0左右,而绿原酸在pH3.0时最稳定,分解最少[19],综合看来,pH4.5左右能够兼顾酶的最大催化活性和绿原酸的稳定性。因此选择pH值为4.0、4.5、5.0进行正交试验。
2.6 正交试验结果分析
正交试验设计及结果见表1。
从表 1 中可以看出,极差 RC>RA>RB>RD,故影响纤维素酶法提取金银花中绿原酸的因素次序:纤维素酶添加量>提取温度>提取时间>pH值,最优提取条件组合为A2B2C2D2,而最优组合未出现在正交试验组中,按照最佳组合的提取条件进行验证试验,6次平行验证试验得到绿原酸提取率均值为(40.10±0.34)mg/g,高于正交试验实际最优组合(39.65 mg/g),且重复性良好,故纤维素酶提取金银花中绿原酸的最佳组合条件为提取温度50℃、提取时间50 min、纤维素酶添加量0.4%、pH4.5。
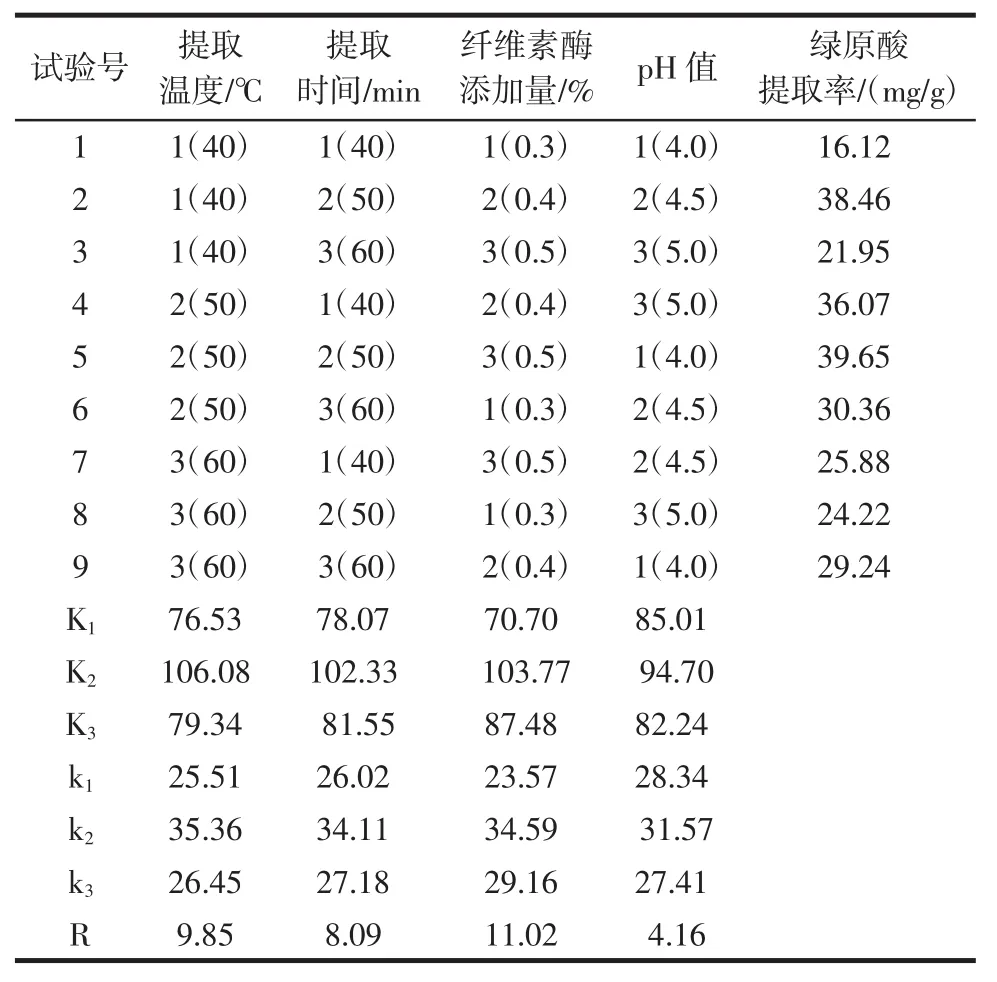
表1 正交试验结果Table 1 The results of orthogonal test
2.7 金银花绿原酸提取液的铁离子还原能力
金银花绿原酸提取液铁离子还原能力见图6。

图6 绿原酸提取液铁离子还原能力Fig.6 Ferric ion reducing capacity of chlorogenic acid extract
从图6中可以看出,在质量浓度0~0.5 mg/mL范围内,金银花绿原酸提取液和维生素C均可还原铁离子形成普鲁士蓝,且都呈现剂量效应,在相同质量浓度下,金银花绿原酸提取液还原铁离子的能力比维生素C强。金银花绿原酸提取液对铁离子的强还原性可能和其分子内的邻苯二酚结构更容易提供氢质子或电子有关[20]。
2.8 金银花绿原酸提取液的羟自由基清除能力
金银花中绿原酸提取液的羟自由基清除能力见图7。
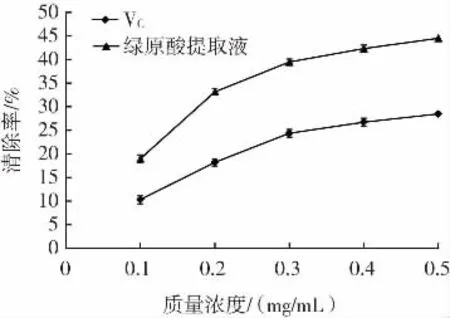
图7 绿原酸提取液对羟自由基的清除率Fig.7 Hydroxyl radical scavenging rate of chlorogenic acid
从图7中可以看出,金银花中绿原酸提取液和维生素C都有较强的羟自由基清除能力,且呈现明显的剂量效应,但在各质量浓度下,金银花绿原酸提取液的羟自由基清除率均高于维生素C,0.5 mg/mL的绿原酸提取液羟自由基清除率达44.51%,明显高于相同浓度维生素C的清除率(28.48%),金银花提取液的较高的羟自由基清除率也和其邻苯二酚结构有关[20]。
3 结论
纤维素酶法提取金银花中绿原酸最佳工艺为提取温度50℃、提取时间50 min、纤维素酶添加量0.4%、pH4.5,此条件下绿原酸提取率为40.10 mg/g;所得绿原酸提取液对铁离子还原能力和羟自由基清除率均高于相同浓度维生素C。
