推拿退热六法对大肠杆菌内毒素致热幼兔外周环氧合酶2、前列腺素E2表达的影响
2022-03-07张英琦刘志凤于天源焦谊王厚融徐亚静官乾刘迪
张英琦 刘志凤 于天源 焦谊 王厚融 徐亚静 官乾 刘迪
发热是儿童疾病最常见的症状之一,也是儿童入院的第二大常见原因[1]。小儿推拿治疗发热历史悠久,可追溯至隋唐时期,如《厘正按摩要术》:“小儿发热,有表里虚实之异……分阴阳,二百遍。推三关,一百遍……”,相关推拿手法一直沿用至今。小儿推拿通过体表干预激发体内的调节系统,患儿多不抗拒,舒适度高,临床效果良好。本课题组综合分析明清至现代小儿推拿专著及临床资料,最终选用穴位清晰、作用明确、应用广泛、便于操作的退热六法(开天门、推坎宫、揉太阳、揉耳后高骨、清天河水、推脊)作为干预方法进行研究。本研究采用大肠杆菌内毒素(lipopolysaccharides,LPS)注射方法制备幼兔细菌发热模型,旨在观察推拿退热六法对内毒素诱导发热幼兔的退热作用,探讨其作用机制,为进一步揭示临床小儿推拿退热的作用机制提供依据。
1 材料与方法
1.1 实验动物
2月龄清洁级新西兰雄性幼兔,体质量(2±0.5) kg,体温(39±0.5)℃,购于北京隆安实验动物养殖中心,动物生产许可证编号:SCXK(京)2019-0006。单笼饲养,饲料由北京中医药大学实验动物中心提供。购入后置于室温20~25℃、相对湿度为40%~60%的饲育室内,适应性饲养3日后,筛选基础体温均一的幼兔共24 只。本实验所有操作经过北京中医药大学IACUC的批准(BUCM-4-2020083102-3013),并按实验动物使用的3R原则给予人道的关怀。
1.2 药品及试剂
脂多糖(美国Sigma公司,生产批号:0000081276)、生理盐水(石家庄四药有限公司,生产批号:2012141904)、BSA标准品(北京索莱宝科技有限公司,生产批号:20200817)、彩虹 245 广谱蛋白Marker(北京索莱宝科技有限公司,生产批号:1223C021)、三氯乙醛(上海麦克林生化科技有限公司,生产批号:C10323759)、BCA蛋白定量试剂盒(北京索莱宝科技有限公司,生产批号:20200903)、10×TBST (北京索莱宝科技有限公司,生产批号:20210311)、兔源COX-2抗体(北京博奥森生物技术有限公司,生产批号:AI06116399)、PGE2 ELISA试剂盒(上海酶联生物科技有限公司,生产批号:20210101-72205A)。
1.3 主要实验仪器
信息化生物信号采集与处理系统(成都泰盟科技有限公司)、温度探头(成都泰盟科技有限公司)、电子天平[美国双杰兄弟(集团)有限公司]、电泳仪(美国 BIO-RAD 公司)、Mini-P-2 电泳槽( 美国BIO-RAD公司)、 MultiSkan3酶标仪(美国 Thermo公司)、水平脱色摇床(北京六一公司)、Fresco 低温冷冻离心机(美国Thermo公司)。
1.4 动物分组与造模
采用随机数字表法将24只幼兔随机分为3 组,即盐水对照组、模型组和退热六法组,每组8只。盐水对照组经耳缘静脉予以1 mL/kg无热源生理盐水注射。模型组、退热六法组均采用LPS注射方法制备发热幼兔模型,药物用量、给药方式参考文献[2]及课题前期研究[3]制定:用生理盐水将LPS稀释至0.5 μg/mL,并按1 mL/kg剂量经幼兔耳缘静脉注射给药。以注射造模后1小时内开始发热,肛温升高0.6℃以上为造模成功。
1.5 干预方法
盐水对照组、模型组、退热六法组所有动物推拿手法操作部位于实验前一天剃毛。造模成功后,退热六法组以室温清水为介质,按照如下步骤进行手法操作:①退热六法第一法:开天门(兔两眉骨内侧中点至神庭穴[4])直推200次,操作2分钟[5];②退热六法第二法:推坎宫(兔内眼角,上下眼睑交界处直上至眶上突外端[2])直推200次,操作2分钟[4];③退热六法第三法:揉太阳(兔外眼角后上方颞窝中[2])揉200次,操作2分钟[4];④退热六法第四法:揉耳后高骨(兔寰椎翼前缘直上方凹陷处[2])揉24次掐3下,操作2分钟[4];⑤退热六法第五法:清天河水(兔腕横纹至肘横纹[2])500次,操作5分钟[6];⑥退热六法第六法:推脊(兔背中线上,第7颈椎与第1胸椎棘突间至尾根[2])300次,操作5分钟[4]。在相同时段内模型组、盐水对照组幼兔在已剃毛部位涂抹与退热六法组等量的室温清水,并抓握,但不进行推拿手法干预。
操作者均取得执业医师资格证并接受统一培训,以保证操作手法、刺激量等相同。直推时,操作者食、中二指并拢,余三指握拳,用力要均匀、持久、轻柔,在表皮操作,不能带动皮下组织,以皮肤不发红为度。操作者肩、肘、腕关节放松,靠肘关节的屈伸活动来实现。揉法操作时操作者手指不可离开皮肤表面,以前臂带动手腕做环形而有节律的运动。操作时,操作者手指蘸水要干湿得易,不可过干或过湿。
1.6 观察指标及检测方法
1.6.1 体温变化值 使用BL-420N生物信号采集系统于造模后每20分钟连续监测肛温至造模后180分钟,即干预后120分钟。
1.6.2 血常规检测 分别于干预前、干预后120分钟于兔耳缘静脉采血0.5 mL,置于含 EDTA抗凝管中,以五分类血液分析仪检测白细胞、中性粒细胞百分比。
1.6.3 血、肝、肺组织取材 干预后120分钟,幼兔腹腔注射水合氯醛后处死。开腹,下腔静脉取血5 mL,使用低温离心机4℃,3 000 r/min离心15分钟,取上清液。取肝、肺组织置于液氮罐中冷冻,后转移至-80℃冰箱中保存备用。
1.6.4 血、肝、肺组织前列腺素E2(prostaglandin E2,PGE2)表达 使用酶联免疫吸附试验(ELISA法)对外周血、肝、肺PGE2浓度进行检测,具体过程如下:标准品孔加不同浓度标准品50 μL;样本孔加样本稀释液40 μL,待测样品10 μL,后每孔加入酶标试剂100 μL,37℃孵育60分钟,再用洗涤液洗涤5次,拍干。随后在各反应孔中加入显色剂A50 μL,显色剂B50 μL,振荡混匀,37℃避光显色15分钟,最后加入终止液50 μL终止反应。随后将反应孔板置于酶标仪中读取数据,波长设置450 nm。检测操作过程全部按照试剂盒说明书进行。
1.6.5 肝、肺组织环氧合酶2(cyclooxygenase,COX-2)表达 每份样本组织加入预冷的RIPA裂解液1 mL充分研磨,12 000 r/min 低温离心15分钟后取上清液。用BCA蛋白定量试剂盒测定各样本蛋白浓度后,确定蛋白上样量,加入5倍SDS-PAGE蛋白上样缓冲液。目标蛋白上样后电泳,先恒定电压60 V电泳20分钟,后恒定电压80 V电泳90分钟。转膜时操作条件为恒定电压100 V转移70分钟。加入10%脱脂牛奶封闭2小时后,将PVDF膜按蛋白分子量剪开。1×TBST每10分钟洗1次,共洗3次。分别加入一抗COX-2抗体(1∶1 000)及一抗GADPH 抗体(1∶1 000),摇床上室温孵育1小时后4℃冰箱过夜。洗膜:1×TBST每10分钟洗1次,共洗3次。经二抗HRP-羊抗兔、HRP-羊抗鼠IgG(1∶10 000)室温摇床孵育1小时。1×TBST每10分钟洗1次,共洗5次。然后使用ECL试剂盒曝光显影,条带曝光完毕后,PVDF膜自然晾干后封存。应用Image J分析软件计算目标条带积分光密度值。
1.7 数据处理

2 结果
2.1 各组幼兔各时段体温的变化值
造模后幼兔体温明显升高,与盐水对照组相比差异有统计学意义(P<0.05)。研究过程中大部分动物出现明显的精神萎靡,头面、耳廓明显发烫,甚至出现粗大喘息、腹泻等症状,提示造模成功。模型组与退热六法组在干预前体温差异无统计学意义(P>0.05)。盐水对照组体温无明显波动,模型组体温维持较高水平。推拿退热六法干预可降低幼兔的体温。与模型组比较,在退热六法干预后各监测时间点,体温增长幅度均低于模型组,在干预后20分钟、80分钟、100分钟、120分钟差异有统计学意义(P<0.05)。见表1。
2.2 各组幼兔白细胞、中性粒细胞变化
干预前,即造模后60分钟,模型组、退热六法组白细胞计数、中细粒细胞百分比显著低于盐水对照组,差异有统计学意义(P<0.05),提示细菌感染模型造模成功。模型组与退热六法组比较,差异无统计学意义(P>0.05),说明两组在干预前无差别,具有可比性。干预后120分钟,模型组、退热六法组白细胞仍显著低于盐水对照组(P<0.05),模型组与退热六法组比较,差异无统计学意义(P>0.05)。模型组、退热六法组中性粒细胞百分比与盐水对照组差异有统计学意义(P<0.05),与模型组相比,退热六法组中性粒细胞明显降低(P<0.05)。见表2。

表2 各组幼兔干预前、干预后120分钟白细胞、中性粒细胞计数变化
2.3 各组幼兔血、肝、肺组织PGE2表达量比较
干预后120分钟,与盐水对照组相比,模型组血、肝、肺组织PGE2表达量显著升高,差异具有统计学意义(P<0.05)。退热六法组血PGE2较盐水对照组比较,差异无统计学意义(P>0.05),肝、肺组织PGE2较盐水对照组差异显著(P<0.05)。退热六法组较模型组,血、肝、肺组织PGE2表达量均降低(P<0.05)。见表3。

表3 各组幼兔血、肝、肺PGE2表达量比较
2.4 各组幼兔肝、肺组织中COX-2蛋白表达水平比较
模型建立后,模型组幼兔肝、肺组织COX-2蛋白表达增加,与盐水对照组相比具有统计学差异(P<0.05)。推拿干预后120分钟,与模型组比较,退热六法组肝、肺组织COX-2表达水平显著下降(P<0.05)。见表4、图1、图2。
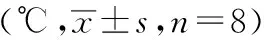
表1 各组幼兔干预前、干预后120分钟各时间点体温变化值

表4 各组幼兔肝、肺COX-2表达量比较

注:Y 盐水对照组;M 模型组;T 退热六法组。

注:Y 盐水对照组;M 模型组;T 退热六法组。
3 讨论
发热由外源性致热原进入机体刺激单核细胞、巨噬细胞等产生内生致热原,继而作用于体温调节中枢影响体温调定点所致。神经细胞进一步引发交感神经系统兴奋,促进机体局部或者全身的发热反应[7]。
本课题组通过对古今文献进行研究,总结出“退热六法”(开天门、推坎宫、揉太阳、揉耳后高骨、清天河水、推脊)作为实验干预手段[8]。这些穴位位置明确,疗效显著,刺激量相对固定。其中头面部四大手法(开天门、推坎宫、揉太阳、揉耳后高骨)是具有代表性的退热手法。孙重三先生的《儿科推拿疗法简编》将头面部四大手法列为所有手法之首,用于治疗感冒、头痛、急慢惊风等儿科常见病。“天河水”是小儿推拿特定穴之一,清天河水,性微凉,清热而不伤阴,虚热、实热皆可用,是使用频率最高的退热手法[9]。督脉为阳脉之海,脊柱穴位于督脉之上,推脊能够调节阳气,泻一身之火。在小儿退热手法基础上加上推脊能更有效地控制小儿发热,并且操作方便,简便易行[10]。
血常规中的白细胞和中细粒细胞值是判断血液细菌感染的主要指标[11]。刘晓红等[12]通过实验发现,兔在感染发热期会出现精神怠倦、颤抖、身体蜷缩、白细胞数降低,之后随着体温的升高进入高峰期,白细胞数渐渐上升,中性粒细胞数增多。本实验观察到模型组、退热六法组耳缘静脉注射LPS后血白细胞、中性粒细胞显著降低。退热六法组在干预后,中性粒细胞受到明显下调,提示退热六法的解热作用与调节外周中性粒细胞有关。白细胞计数与文献有差异,可能与检测的时间点有关,仍需进一步研究。
前列腺素(prostaglandin,PG)是体温调节的重要介质,在体温调节研究中占有重要地位[13]。PGE2是内源性热原介导的外周免疫反应与中枢神经系统体温调节之间的连接纽带,是多种致热原诱导体温升高的中枢共同通路。环氧合酶(cyclooxygenase,COX)是合成前列腺素的关键限速酶[14],COX-2在整个炎症的发生、消退修复过程中可见大量持续的表达[15],选择性阻断COX-2可完全消除发热反应[16]。Kupffer细胞是机体内最大的巨噬细胞群,在发热的启动过程和终止过程中起到重要的作用。肝巨噬细胞也被认为是外周致热原性细胞因子的主要细胞来源[17]。在LPS诱导的发热过程中,COX-2在肝和肺部的巨噬细胞中大量表达[18]。本实验观察到经LPS静脉注射刺激,可明显诱导幼兔血、肝、肺组织中PGE2含量增加,肝、肺组织COX-2表达水平的明显增高。经退热六法干预后,这些组织的PGE2、COX-2表达量均下降,提示退热六法的解热作用与降低外周PGE2的含量以及COX-2的表达有关。
本研究实验结果显示,推拿退热六法能明显抑制发热幼兔的体温上升,下调血中性粒细胞百分比,降低外周血、肝、肺PGE2水平,抑制肝、肺组织中COX-2的表达,其机制值得进一步深入研究,以阐明推拿手法治疗小儿发热的起效途径,为研究推拿退热机制提供科学依据,为临床治疗发热类疾病提供参考。
