亚高山湖泊天才湖周边土壤腐殖酸的光降解研究*
2022-03-05安世林罗春燕杜瑛珣
安世林,罗春燕,陈 煜,杜瑛珣
(1:中国科学院南京地理与湖泊研究所,南京 210008) (2:中国科学院大学,北京 101408) (3:江苏省如东经济开发区管理委员会,南通 226400)
溶解性有机质(DOM)是水生态系统中普遍存在的一种非均相天然有机质混合物,根据其来源的不同可分为外源和内源性有机质. 外源DOM主要指流域陆地生态系统产生,经地表径流进入湖泊;而内源DOM则是湖泊中浮游植物、沉水植物和细菌等在生长过程分泌或死亡过程分解产生[1]. DOM在湖泊生态系统中具有重要作用和意义,主要表现在: (1)DOM富含的大量碳、氮、磷生源要素,可以通过被微生物利用进入到食物网中,在水生生态系统物质循环和能量流动中扮演重要的角色[2]. (2)DOM中的吸光物质即有色溶解有机质(CDOM)是水体中一类重要的光吸收物质,其能显著改变水下光场,减弱B波段紫外光(UV-B,280~320 nm)进入深层水体,从而保护水生生物的正常生长发育[3];(3)DOM是全球重要的碳库之一(700 Pg C),其从陆地、内陆水体到海洋的迁移转化是全球碳循环的重要组成部分. 内陆水体接纳陆地碳输入量达5.1 Pg/a,占陆地固碳通量的70%;每年内陆水体排放入大气、输入海洋和埋藏的碳通量分别为3.9、0.9和0.6 Pg/a[4]. 因此,了解内陆水体DOM如何转化为CO2的过程对于计算本地的碳通量和预测未来气候条件下内陆水域的CO2的排放是十分必要的.
亚高山湖泊是指位于树线以下的高海拔湖泊,由于对全球气候变化具有较强的敏感性,此类湖泊正受到广泛关注[5-6]. 亚高山湖泊受人类活动干扰少,营养盐浓度普遍较低,因此内源溶解性有机质产生量较少;而由于其位于树线下,流域森林覆盖率高,土壤中含有丰富的腐殖质[7], 这些腐殖质随地表径流进入湖泊,是该类湖泊DOM的主要来源. 腐殖酸在可见光波段有较强的吸收,导致该类湖泊的水色通常呈棕色[7],容易发生光化学转化. 前期的研究发现[8],光化学过程使亚高山湖泊——天才湖湖水的DOM迅速分解,在4 d的原位光照实验中,40%的溶解性有机碳(DOC)发生了矿化. 其中光降解过程能使腐殖质类物质转化为低分子量的酸和醛,增加了生物可利用性[9-10].
溶解性有机质的光化学转化途径有2种,一是直接光解,指其中CDOM吸收光子后,形成激发态CDOM(*CDOM),其发生苯环破裂、双键断裂而使结构产生变化[11-12];二是间接降解,是指*CDOM和溶解氧(DO)发生一系列的电子转移反应,形成活性氧物质(ROS),如羟基自由基、活性氧自由基和双氧水等,这些ROS和DOM发生氧化反应,使大分子结构DOM转化成小分子物质,生成小分子有机酸[13];或使其转化为多羟基芳香类物质,增加了其生物可利用性. 因此,对这2种反应途径产生影响的环境条件,都一定程度控制着DOM的光降解过程. 以往的研究表明,光照条件(包括强度、频率)[14-15]、pH[16]和溶解氧的存在[12, 17]与否对DOM的光化学过程有显著影响:相较于可见光区,紫外光区波长短,能量高[18],在相同条件下更易于激发光敏化反应,从而DOM光解效果明显[18-20]. pH和溶解氧均对ROS的产生过程有影响:溶解氧的存在能促进ROS的产生和DOM的光降解[12];而pH除影响ROS的产生外,还影响着DOM的存在形式[16];因此pH对有机质光解的影响并不统一.
近年来,全球气候变化(降水增多和气温升高)引起的陆地植被盖度的增加,将使亚高山湖泊DOM浓度大幅增加[21-23];这些外源DOM(腐殖酸)输入对湖泊生态系统的可能影响与其在湖泊中的迁移转化过程密切相关. 外源DOM通常被认为是难以被微生物降解[24],光化学转化是其在自然界中的主要转化途径. 迄今为止,亚高山湖泊DOM光解研究多集中在不同波段条件对DOM降解的影响及其光解对DOM性质的影响[25];而不同波段的光化学转化效率缺乏定量研究,一些重要影响因素如pH、DO对光解过程的影响研究依然有限. 而大量外源DOM中腐殖酸的输入可能导致该类湖泊的酸化[23],全球气候变暖导致湖泊温度升高,湖水中DO浓度相对降低[25],在湖水低氧或缺氧状态下DOM的光降解过程可能将会受到较大限制[12,17];ROS生成速率降低导致光敏化反应减弱从而使得DOM分解速率降低. 同时气候变暖导致的浮游藻类生长的变化也会相应引起湖水中DO的变化[26-27],进而影响湖泊DOM的光解过程. 因此,本研究以亚高山湖泊周边土壤腐殖酸为研究对象,进行室内受控实验,通过设置不同的pH值、不同的光照波段(可见光(Vis)、紫外光A(UVA)和紫外光B(UVB))以及不同的载气条件(空气、氮气、不通气),深入研究腐殖酸(THA)在不同环境条件下可能存在的降解情况和产物的变化,并提出以表观光子转化效率(每摩尔光子能使THA发生转化的程度)定量比较不同波段太阳光的光子转化率,为天才湖DOM的光解过程提供可靠的基础数据,同时为天才湖及其他亚高山湖泊DOM转化和碳元素的迁移研究提供数据支撑;有助于揭示气候变化框架下,外源有机质输入对湖泊生态系统的影响.
1 材料与方法
1.1 THA的采集与提取
位于云贵高原老君山的天才湖(26°38′4.57″N,99°42′59.21″E),属典型亚高山湖泊,其海拔约3880 m,位于树线以下约200 m[8],流域年均气温14.0℃,年降水量约800 mm,年光照时长达2166 h(数据来源http://data.cma.cn/). 湖水的补充来源主要包括大气降水、地表溪流和泉水等, 周边植被以铁杉林和高山杜鹃灌丛为主,土壤中富含的大量有机质常随地表径流进入水体,属腐殖质湖泊[28]. 天才湖营养水平低,经测定[8],2013年6月湖泊总氮、总磷和叶绿素a浓度分别为0.54 mg/L、14.4 μg/L和1.5 μg/L.
于2013年6月采集天才湖岸边50 m范围内的表层(5 cm以上)土壤,冷冻干燥储存. 依照国际腐殖物质学会方法提取THA(http://humic-substances.org/). 提取过程如下:将土样去根,风干碾磨后,经2.0 mm的筛子,在室温下用1.0 mol/L盐酸将样品pH值调至1~2;用0.1 mol/L盐酸稀释,得比例为1.0 g干样品∶10 mL液体的悬浮液. 将该悬浮液放入摇床震荡1 h,低速离心分离上清液和沉淀. 将沉淀用1.0 mol/L的氢氧化钠溶液中和至pH=7.0,在氮气氛围下加入0.1 mol/L氢氧化钠溶液,得比例为1.0 g干样品∶10.0 mL液体得悬浮液,将其震荡4 h后,收集上清液. 用6.0 mol/L盐酸酸化上清液至pH=1.0,静置12~16 h,离心得粗制腐殖酸固体. 加入0.1 mol/L氢氧化钾溶液溶解粗制腐殖酸,高速离心以除去悬浮固体. 而后加入6.0 mol/L盐酸至pH=1.0,静置12~16 h,离心并弃去上清液. 在塑料容器中,加入0.1 mol/L盐酸/0.3 mol/L氢氟酸溶液,室温下震荡12 h. 离心并重复盐酸/氢氟酸处理,直至灰分含量为1.00%以下. 最后利用透析方法去除Cl-后冷冻干燥,得纯化THA.
1.2 THA的光化学反应
本降解反应装置为南京胥江机电厂制备的 XPA-7 多试管搅拌型光反应仪. 可调型光源(汞灯)置于有流动自来水冷却的石英冷阱中,冷阱外不放置滤光片,反应在汞灯光激发下进行. 反应容器为 50.0 mL石英管,与光源距离约为 5.0 cm,整个反应装置处于暗箱中.
将50.0 mL 22.5 mg/L的THA溶液分别置于10支石英管中,滴加盐酸/氢氧化钠溶液调节pH直至6.0或8.0. 检查光源、循环冷却水后,将10支石英管放入光化学反应仪中,功率调至500 W,打开循环冷却水,开启光源,反应过程中温度保持在(28±0.5)℃. 光照反应过程中反应管绕光源匀速旋转,使各反应管接受光强尽量保持一致. 在不同的反应时间停止光照,取出1个石英管. 样品经0.22 μm的滤膜过滤后,冷藏,在两周内进行DOC浓度、紫外-可见光全波扫描(UV-Vis)及三维荧光光谱(EEM)分析. 利用滤光膜进行不同光波段下THA的光降解反应实验:将石英冷肼分别以不同滤光膜包裹:Vis+UVA(透过可见光和UVA(320~400 nm))、Vis(仅透过可见光),pH调至8.0,其余实验步骤保持不变. 不同载气条件下THA的光降解反应:反应过程中,持续向反应管内通入高纯氮气、空气或不通气. 持续通氮气条件下可认为DO为0,持续通空气条件下DO浓度约10~11 mg/L;不通气时反应溶液与大气相通,DO浓度约为8 mg/L;pH调至8.0,其余实验步骤保持不变.
因前期实验表明[8],溶解性有机质的室内模拟光化学转化实验的有机质转化率的平均误差仅为2.3%;加上提取的THA量较少,故本研究未进行平行实验.
1.3 THA的分析方法
1.3.1 紫外-可见吸收光谱分析(UV-Vis) 采用Lambda 35(PerkinElmer)紫外-可见吸收光谱仪,波长扫描范围200~800 nm, 空白参比选用Milli-Q水. 通过一定波长下的吸光度计算该波长下的吸收系数:
aλ′=2.303Aλ/L
(1)
式中,aλ′为校正波长λ下的吸收系数(m-1),Aλ为波长λ下的吸光度,L为光程路径(0.01 m).
aλ=aλ′-a750λ/750
(2)
由于过滤后可能留有颗粒物质会引起光散射,故通过校正散射效应得订正后式(2),即aλ为校正后波长λ下的吸收系数(m-1).
1.3.2 三维荧光光谱分析(EEMs) 本实验中使用日立F-7000荧光光谱仪(Hitachi-High-Technologies)对THA进行光谱分析测定,仪器参数选用发射波长(Em)为250~550 nm,步长1 nm;激发波长(Ex)200~450 nm,步长5 nm. 空白参比选用Milli-Q水. 利用光降解实验获得的(48个)样品的EEM数据建立EEM-PARAFAC模型. 模型建立前,对三维荧光光谱进行校正:①根据紫外-可见吸收光谱的数据进行内滤效应校正[29];②以Milli-Q水作为空白扣除;③利用Milli-Q水的拉曼单位进行归一化处理(R.U.)校准荧光强度的变化. 利用DOMFluor工具箱在MATLAB R2008a软件中获得四组分模型(C1~C4,图1),验证模拟结果的可靠性通常使用随机初始化(random initialization)和折半分析法(split-half analysis).
组分如下:C1组分激发波长<275 nm,发射波长最大值出现在426 nm处,被认为是一种广泛存在的陆源产生的类腐殖质[30-32]. C2组分最大的激发波长在255 nm处,最大发射波长为502 nm,属土壤淋溶液,为类腐殖质[33-35]. C3组分在335和464 nm处分别存在激发最大值、发射波长最大值,属类腐殖质[35]. C4组分的最大激发和发射波长分别为275和304 nm,被认为属类蛋白质物质[36-38]. 初始THA中,C1~C4组分的相对丰度分别为35.91%、46.00%、1.73%和16.36%,其中C1、C2是THA荧光组分的主要组成.
1.3.3 光谱指标 研究中采用280 nm处的吸收系数a280表示THA芳香性组分的浓度,其值减小则溶液芳香性组分的浓度逐渐变小,物质芳香基团逐渐消失[2, 8]. E2/E3为250 nm和365 nm处吸收系数的比值、其值与相对分子质量大小呈反比[39]. 光谱斜率S275-295表示275~295 nm处的斜率,该值常用来表示水中CDOM的光漂白过程对应的分子量变化,其值越大,溶液中所含分子量越小[40]. SUVA254为254 nm处的吸光度与DOC比值(单位:L/(m·mg)),数值越大则表明其芳香化程度高[41]. 经测定,THA的SUVA254为5.09 L/(m·mg),S275-295为0.01,说明天才湖周边土壤腐殖酸腐殖化程度较大,分子量较大.
1.3.4 光子通量 汞灯光源传递能量的本质为光子的传递,单位时间内进入溶液中的光子数表示为光子通量. 已知500 W汞灯在不同透光膜下的透光强度L及膜透光率T,则汞灯在覆膜条件下发光强度为:
L1=L·T
(3)
该波长下1个光子的能量Q(J)为:
Q=h·c/λ
(4)

图1 C1~C4组分三维荧光图及相应的激发、发射特征谱图Fig.1 Three-dimensional fluorescence images of C1-C4 components and corresponding excitation and emission characteristic spectra
由式(3)和(4)可得出单位面积光子通量F0(mol photons/(m2·s·nm)):
(5)
考虑到光程内(D,石英管直径)溶液吸收光子的衰减[42],溶液光子通量F(mol photons/(s·nm)):
F=F0·S[1-exp(-aλ·D)]
(6)
式中,L、L1分别指汞灯自然、覆膜条件下的发光强度,mW/(m2·nm);T:膜透光率;h:普朗克常量,6.626×10-34(J·s);c:光速,2.998×108m/s;Na:阿伏伽德罗常数,6.02×1023;S为石英管水平方向上截面积,0.0045 m2;D:石英管直径,0.03 m.
1.3.5 表观光子转化率 采用表观光子转化率来定量不同光照波段(Vis、UVA和UVB)对THA光解的效率[12]. 采用吸收系数a280(m-1)表征THA的光解效率,在本研究中,表观光子转化率表征每摩尔光子能使吸收系数a280减少的程度. 不同波长下表观光子转化率不同,设可见光表观光子降解率为ηVis,UVA波段的表观光子降解率为ηUVA,UVB膜波段的表观光子降解率为ηUVB,以Δa280表示THA光解反应前后浓度变化,光照时间t=10 h,可得如下等式:
FVis·t·ηVis+FUVA·t·ηUVA+FUVB·t·ηUVB=Δa280
(7)
1.4 统计分析
不同pH、不同光波段、不同载气对THA降解的影响采用均值检验分析,P<0.05表示显著差异,P>0.05表示无显著差异.
2 结果与分析
2.1 THA的光化学降解行为研究

图2 光降解过程中THA的UV-Vis光谱(a)、DOC浓度和a280(b)、E2/E3和 S275-295(c)、荧光组分强度变化(d)(THA初始浓度=22.5 mg/L,T=25℃,500 W汞灯,pH=8.0)Fig.2 Changes in UV-Vis absorption spectrum (a),DOC concentration and a280(b), E2/E3 and S275-295(c),EEM-PARAFAC(d) during the photodegradation of THA (Initial concentration of THA=22.5 mg/L,T=25℃,500 W mercury lamp,pH=8.0)
图2c显示了THA中的4种荧光组分的变化,C1、C2和C3均属类腐殖质,其变化具有一定的相似性,随着光反应的进行3种组分含量呈现先上升后下降的变化趋势,出现最大值的时间点略有差异,C1最大值产生时间点为光照后0.5 h,C2为1 h,C3为2 h出现峰值. 光反应进行10 h后,C1降解17.31%,C2降解74.63%,C3增加333.33%. C4组分属类蛋白物质,随光反应的进行先迅速降低,而后略微升高,最小值出现于光照6 h后,光照10 h后C4降解45.83%.

图3 不同pH体系中THA的a280/(a280)0(a)、 E2/E3(b)和S275-295(c)的变化(THA初始 浓度=22.5 mg/L,T=25℃,500 W汞灯)Fig.3 Changes in a280/(a280)0(a),E2/E3(b) and S275-295 (c) during the photodegradation of THA under different pH conditions (Initial concentration of THA=22.5 mg/L, T=25℃,500 W mercury lamp)
2.2 pH对THA的光化学降解影响
THA在pH=6.0和pH=8.0溶液中的降解显示(图3),在280 nm下吸收率的变化情况,随着反应时间的增加,THA浓度逐渐降低. 相较于pH=8.0的体系,THA在pH=6.0溶液中的降解更快(P<0.05),在反应2 h后表现明显,在t=4 h时,pH=6.0的THAa280减少77.29%,较pH=8.0情况多降解10.05%. 而在反应达到10 h后,pH=6.0的THAa280减少95.80%,较pH=8.0情况多降解8.17%. 其a280降解速率满足拟一级动力学方程,pH=8.0、6.0的反应动力学常数分别为0.220、0.319(R2=0.98、0.99). pH=6.0的E2/E3的增加(即分子量减小)比pH=8.0的快,两者存在差异显著(P<0.05),反应达到10 h时,分子量进一步减小,E2/E3达到5.58.S275-295的变化程度同样印证了THA分子量的大小变化.
图4中显示了2种pH条件下THA 4种EEM-PARAFAC组分变化,可以看出在不同pH条件下,C1~C4组分呈现相似的变化趋势:两种pH条件下,除C3外,各组分随时间的变化不存在显著差异;但光照反应10 h后EEM-PARAFAC的含量存在较大差异(表1). 由于溶液pH对物质的荧光强度有影响,两种pH条件下4种组分的初始荧光强度有所差异(表1);因此,以降解率来判别pH对降解的影响.
pH=8.0的体系C1、C2、C4组分在光照结束后含量分别降低17.31%、74.63%、45.83%,而C3组分有所升高(0.03 R.U.升至0.13 R.U.). 光化学反应开始前组分C1、C2占据最主要部分,反应结束后,C1组分占比50.00%为主导,其他3种组分差异不大. 与pH=8.0的体系不同的是,pH=6.0的溶液中THA的4种组分C1~C4降解率分别为83.15%、93.48%、50.00%、64.00%,其C3组分含量并未升高,C1、C2、C4组分降解程度更大,在反应开始THA以组分C1和C2占比最大,但反应结束后,以C1组分占比34.89%,C4组分占比41.86%为主导. 由此可以看出,溶液pH对荧光组分的降解效果有较大影响,并且在特定pH条件下可以促进组分间的相互转化从而使之含量升高.
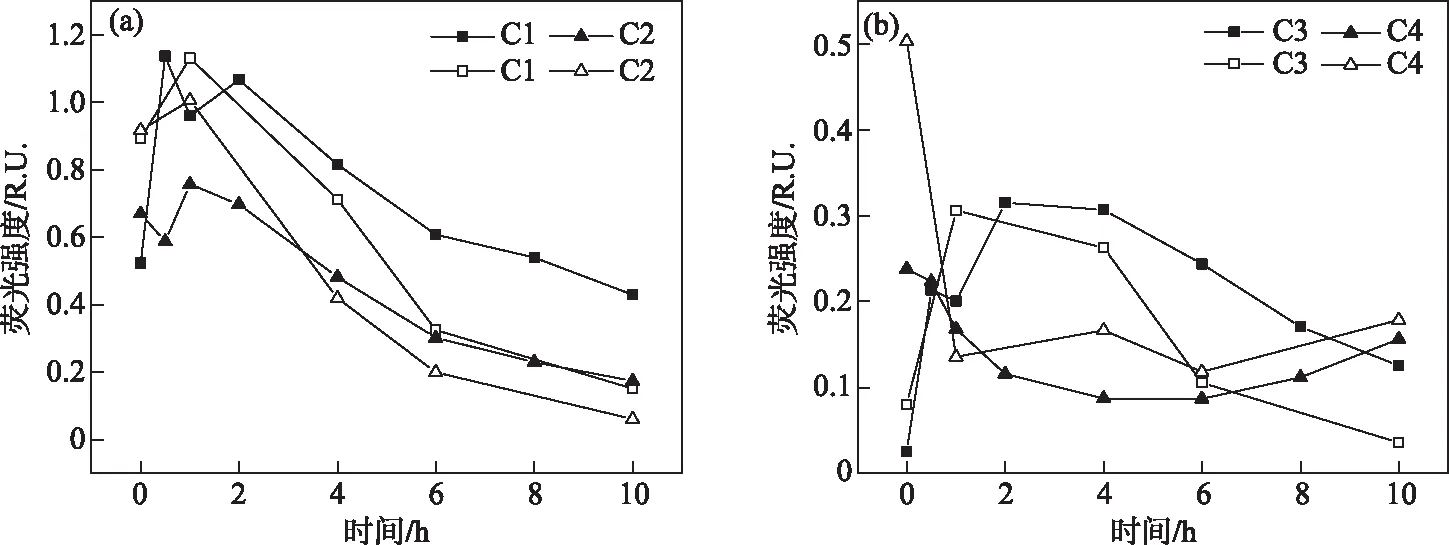
图4 pH=8.0(实心)和pH=6.0(空心)条件下C1~C4的光降解变化 (THA初始浓度=22.5 mg/L,T=25℃,500 W汞灯)Fig.4 Changes of photodegradation of C1-C4 under pH=8.0 (solid) and pH=6.0 (hollow) (Initial concentration of THA=22.5 mg/L,T=25℃,500 W mercury lamp)

表1 不同pH条件下C1~C4组分变化Tab.1 Changes in the fluorescent intensity and the relative abundance of C1-C4 components
2.3 氧气影响
DO是光化学反应过程中的重要影响因素. 反应过程持续通氮气可认为DO为0,不通气时反应溶液与大气相通,反应过程持续通空气可认为DO过饱和;在载气实验中THA的降解效果与无载气实验产生较大差异,如图5所示. 在通入氮气的情况下,THA降解较慢,光照4 h THAa280仅降低30.1%,光照结束后a280降低67.5%,低于无载气条件20.1%,其降解程度最小(P<0.05). 而在通入空气的情况下,THA降解速率显著大于无载气和氮气的条件(P<0.05),反应4 ha280降低76.3%,光照结束后a280降低97.2%,相较于无载气条件下THA多降解9.6%. 同时a280降解速率满足拟一级动力学方程,其动力学常数分别为0.220(无载气)、0.345(空气)、0.106(氮气)(R2=0.98、0.91、0.93). 同样地,在通入氮气时,E2/E3增长缓慢,光照10 h仅达到3.81,在通入空气时E2/E3增长迅速,在10 h达到6.81.S275-295反映了同样的规律.
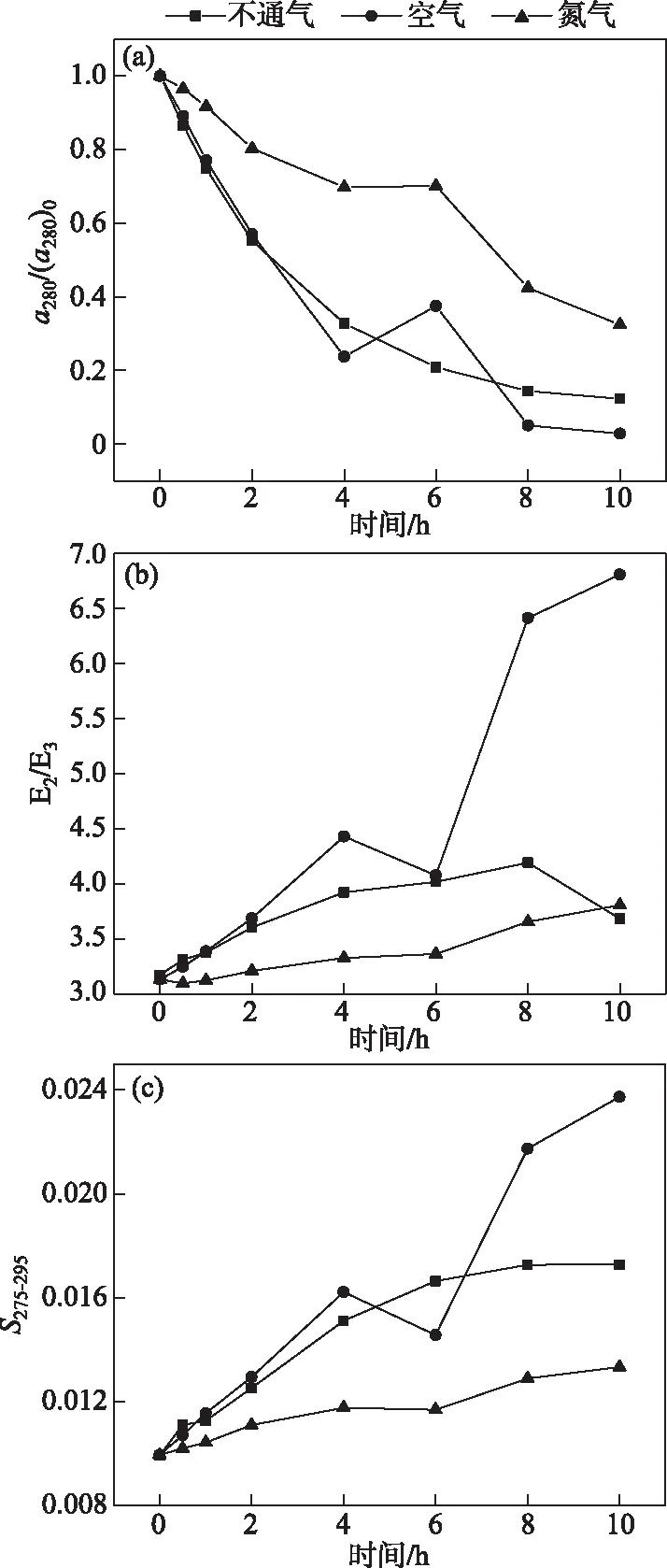
图5 不同载气实验THA的a280/(a280)0(a)、E2/ E3(b)和S275-295(c)的变化(THA初始浓度= 22.5 mg/L,T=25℃,500 W汞灯,pH=8.0)Fig.5 Changes in a280(a)/(a280)0,E2/E3(b) and S275-295(c) during the photodegradation of THA with different carrier gas(Initial concentration of THA=22.5 mg/L, T=25℃,500 W mercury lamp,pH=8.0)
在通入载气的条件下,可以明显看出在有无氧气的条件下,THA的组分变化情况差异较大,如图6所示. 与不通气实验组相比,通入氮气条件下C1含量增加31.41%,空气条件下C1降解79.11%. 而C2组分在有无载气的条件下呈现相同的变化趋势,空气条件下降解96.92%,而氮气条件下仅降低51.97%,少于无载气条件22.09%. 对于C3组分,无载气条件下在光照2 h时达到最大值0.32 R.U.,而后迅速分解,光照结束后其含量增加4倍左右;而在通入氮气时,达到最大含量0.24 R.U.的时间为4 h,随后缓慢下降至0.20 R.U.;反观空气条件下C3含量达最大值0.27 R.U.的时间为6 h,而后迅速分解,光照10 h后含量较初始仅增加18.08%. C4含量的变化趋势存在一定的差异,在不通气的条件下,反应过程较为缓慢,总体趋势表现为先降低后升高;而通入空气的条件下,C4含量在光照初始阶段表现为含量上升,随后含量降低;氮气条件下C4的总体趋势表现为下降过程.

图6 不同载气实验C1~C4荧光强度变化 (THA初始浓度=22.5 mg/L,T=25℃,500 W汞灯,pH=8.0)Fig.6 Changes in C1-C4 fluorescent intensity in experiments with different carrier gas (Initial concentration of THA=22.5 mg/L,T=25℃,500 W mercury lamp,pH=8.0)

表2 不同光照波段实验的a280变化和光子通量Tab.2 a280 variation and photon flux in different light band experiments
2.4 光波段的影响
光波段对THA的降解有很大的影响;在不加膜实验中汞灯的光源光谱见图7a,在可见光(Vis(400~800 nm))、紫外光(UVA(320~400 nm)、UVB(280~320 nm))波段均具有发射;Vis实验中,滤光膜仅可透过可见光,而Vis +UVA实验组则透过可见光和UVA. 在这3组实验中,随着反应时间的增加,THA浓度均逐渐降低;在反应达到10 h后,不加膜的THAa280减少87.63%,Vis+UVA的THAa280减少12.31%,Vis的THAa280减少6.41%.a280的降解速率为不加膜>>Vis+UVA>Vis,存在显著差异(P<0.05). THA降解速率满足拟一级动力学方程,其动力学常数分别为0.220、0.012、0.006(R2=0.98、0.94、0.97).
图7c表示THA的E2/E3的变化,在不加膜体系中反应进行较快,在8 h时达到峰值,而在加膜条件下,仅透过可见光的体系反应程度最小,E2/E3值仅3.47,Vis+UVA体系E2/E3值分别为3.92,在不加膜与有膜的体系中E2/E3的变化存在显著差异(P<0.05). 图7d中S275-295值的变化可显示出相同的分子变化趋势.
四足机器人(quadruped robot,QR)属于足式机器人,相对于履带式和轮式机器人,具有机动性好、环境破坏程度小、主动隔振等优点,应用前景良好。该型机器人涉及力学、机械学、生物学、计算机、人工智能等多学科,相关技术一直是国内外机器人领域研究的热点之一。以美国卡耐基梅隆大学的波士顿动力实验室为代表,2005年发布了Big Dog大狗机器人,又先后推出了如Alpha Dog、Little Dog、Cheetah等产品,引起行业内的广泛关注。
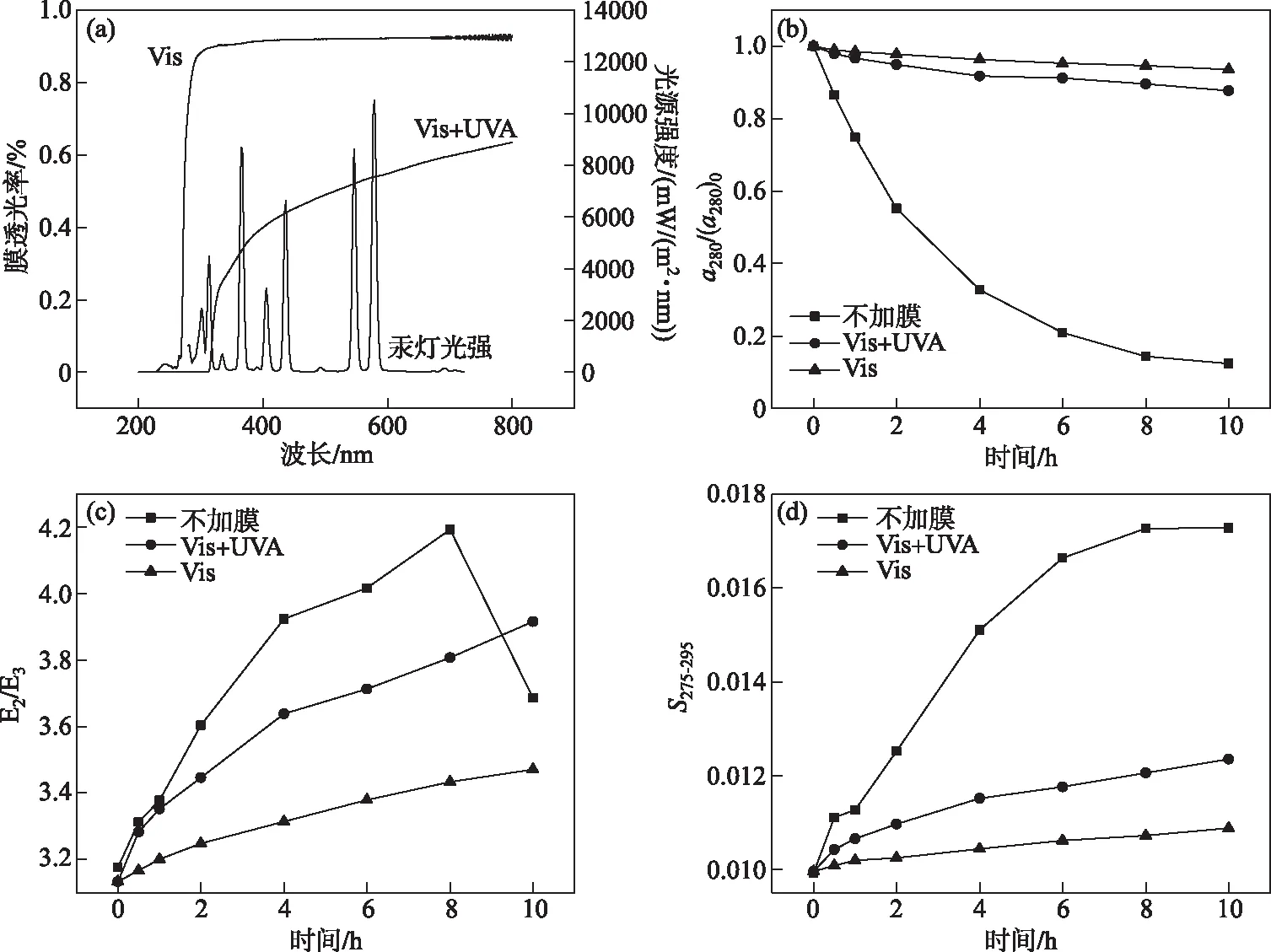
图7 汞灯光谱和滤光膜透光率(a),不同光照波段实验中a280/(a280)0(b),E2/E3(c)和 S275-295(d)的变化(THA初始浓度=22.5 mg/L,T=25℃,500 W汞灯,pH=8.0)Fig.7 Spectroscopy of mercury lamps and transmittance of filter membranes(a),changes in a280/(a280)0 (b), E2/E3(c) and S275-295 (d) during the photodegradation of THA in the experiments with different irradiation wavelengths(Initial concentration of THA=22.5 mg/L,T=25℃,500 W mercury lamp,pH=8.0)
图8中显示了不同光波段下THA组分C1~C4的光降解变化,在不加膜与加膜体系下存在显著差异(P<0.05). 不加膜时,C1组分含量呈现先增长后降低的趋势,达到峰值所需时间为0.5 h,光照10 h后其含量较初始降低. 与之对比在2种覆膜条件下,C1荧光强度在较长时间内呈增加趋势:Vis+UVA中C1含量达到峰值时为光照6 h,Vis为8 h,反应10 h后其含量较初始分别升高75.25%、82.88%,随着光照时间的进一步增加其C1组分荧光强度略微减弱. C2组分含量在不加膜时降解程度较大,达到10 h时C2降解74.24%,而2种覆膜的溶液体系C2变化程度较小,反应10 h后,Vis+UVA中C2含量降低10.80%,Vis中C2降低6.21%. C3组分含量无膜时呈现先大幅增长后降低的变化,反应10 h后增长160.00%,而覆膜体系中随光照增加C3荧光强度有所增加,Vis+UVA体系C3含量增长最少,增长 63.83%. C4组分含量在无膜体系呈现先减少后增加的趋势,在光照6 h达到最小值,仅为初始含量的22.17%;在覆膜体系中呈现波动,无明显的增加或减少的趋势.

图8 不同光照波段实验C1~C4荧光强度变化 (THA初始浓度=22.5 mg/L,T=25℃,500 W汞灯,pH=8.0)Fig.8 Changes in C1-C4 fluorescent intensity in experiments with different irradiation wavelengths (Initial concentration of THA=22.5 mg/L,T=25℃,500 W mercury lamp,pH=8.0)
利用实验所得汞灯光谱以及不同滤光膜透光率,对波长λ进行积分可得3组光照实验中各波段(Vis,UVA 和UVB的光子通量)(表2). 于此同时,将光子通量数值和3组光照实验Δa280代入公式(7),解方程可得ηUVB=2143.90 m-1/(mol photons),ηUVA=967.36 m-1/(mol photons),ηVis=186.05 m-1/(mol photons). 数据详见表2.
3 讨论
3.1 光化学转化过程中DOC浓度、CDOM和FDOM的降解差异分析
THA的初始溶液测定显示,THA是一类腐殖化程度较高,分子量较大,主要成分以类腐殖质为主的有机质;以CDOM和FDOM表征THA在光照条件下结构和性质的转变是现阶段常用的方法[43-45],但DOM、CDOM和FDOM之间既有相互联系又有较大差异,CDOM是DOM的中能吸光(有色)的部分,而FDOM又属于CDOM中一部分物质,是指代一类吸收了光能之后能发出荧光的物质[45]. 通常地,采用DOC浓度来表征DOM的量,在降解过程中,DOC浓度的降解速率远低于CDOM的降解速率(图2b),说明光降解过程中DOM的矿化速率低于吸光物质(以a280表征)的降解速率,部分CDOM转化为不吸光物质而非矿化(转化为CO2).
CDOM与FDOM的变化存在明显差异(图2):随着实验光照时长的增加,a280逐渐降低,较初始发生大幅度变化且并无升高现象(图2b);研究认为,CDOM含量下降的直接原因是吸光物质被分解[14],比如芳香碳的分解、羧基碳的分解[46]等或者THA与活性氧物质结合[11,13,47],破坏了发色基团, 使得溶液吸光能力下降. 而荧光组分的光反应性差异很大,比如在短暂的光照时间内,C1、C2、C3均有升高趋势,而后随光照时间的增加而发生降解,而C4组分则迅速降低,随后有所增加(图2d);研究表明FDOM不同组分在光解过程中是可以相互转化的[48]. 光降解过程中CDOM的减弱较为常见[2,8,14,28,49],但FDOM的增加趋势较少被捕获到. 这也说明了DOM组成的复杂性,在不同来源DOM降解过程中CDOM与FDOM的变化并不均呈现统一的趋势.
3.2 酸性介质有利于THA的光化学过程
本研究结果显示,相对于弱碱性介质(pH=8.0),弱酸性介质(pH=6.0)更有利于THA的光化学降解(图3). 与此同时,THA的荧光组分亦受到溶液介质酸碱度的影响. 在光照结束后,除pH=8.0的C3组分含量升高,其余组分均降解减少,并且在pH=6.0的反应溶液中,4种组分降解率均大于pH=8.0的溶液. 从以上结果得出初步结论,天才湖有机质可能更易在偏酸性反应体系中发生光解反应.
在已有关于介质的酸碱性对有机物质光化学降解的影响的研究结论并不一致. DOM中含有大量以酸性为主的官能团(如羧基、酚羟基),这些有机酸的化学行为十分复杂[47]. 首先pH会影响光化学过程中活性氧物质自由基(ROS)的产生,从而影响DOM的光解速率[48];其次pH会影响物质的离子/质子化,从而影响其光活性[50-51];而在课题组前期有关pH对五倍子酸的光降解速率影响的研究表明[16],pH的降低(pH=7减低到pH=5)对五倍子酸(质子化)的直接光解起抑制作用,而对ROS的产生和间接光解起促进作用. 介质的酸碱性对直接光解和间接光解的影响可能存在相反的作用. 在本研究的光化学降解中,直接光解和间接光解并存(体系中存在溶解氧可能产生ROS),在本实验pH范围内(6~8),pH的减低使总的光解效率增加,这可能说明在该范围内,因pH减低对间接光解的促进作用大于对直接光解的抑制作用. 也说明了间接光解(ROS的氧化)在THA光降解过程中的重要贡献.
近半个世纪来,气温变化导致的多年冻土退化、流域植被变化等使得很多湖泊中接受了更多的外源DOM[52],有模型预测由于气温变化,挪威的1000个原始湖泊的DOC浓度在100年后将比现值(2.0~3.3 mg/L)提高近65%[23];一些腐殖质浓度高的湖泊pH在5~6之间[53]. 因此,降水增多可能使亚高山湖泊接受更多的陆源腐殖酸[54],从而减低湖泊的酸碱度. 本研究结果表明酸碱度的降低有利于DOM的光化学转化,促进光矿化,这可能会加速湖泊的碳、氮、磷物质的循环,进而影响湖泊生态的系统稳定.
3.3 氧气促进THA降解
从载气实验中可以分析出,有无氧气的参与对THA的分解程度有十分重要的作用. 在通入空气的实验组相较于无载气的实验组其降解程度更高,而无载气的分子降解程度又高于氮气条件下降解程度.

在自然水体中,由于浮游植物的光合作用产生氧气,会促进光降解过程中ROS的产生,根据拟一级动力学常数,空气条件下a280的降解速率是氮气条件下的3.25倍,反应结束时,各EEM-PARAFAC组分的荧光强度在空气条件下也较氮气条件下有较大幅度降低. 因此,间接氧化反应很可能是DOM在自然水体中光化学转化的主要途径. 而在天然湖泊,由于全球气温的普遍升高促使水体温度上升,水体内溶解氧浓度降低[25];腐殖质湖泊内(如天才湖)大部分浮游藻类的光合作用受到营养盐(如氮、磷)的限制[27],温度升高并未使其自然生产力增高[26-27],而呼吸作用因温度的升高提高了呼吸酶的活性而增强[25],导致湖内DO被进一步消耗;同时降水的增加将更多土壤有机质汇入湖泊内,微生物群落呼吸作用提高[25],造成群落生产与呼吸比例低于1,导致表层DO不饱和及湖下层呈现低氧或厌氧状态,水体内没有足够的氧气,这可能将会更加限制有机质ROS反应的进行[12,17],从而大大限制DOM的光降解速率. 有氧气参与的过程所生成的光化学产物是否不同[11],由于本研究所采用的表征手段(吸收光谱和荧光光谱)较为粗糙,并不能看出产物结构的差异;在以后的研究中有必要采用高分辨率质谱(fourier transform ion cyclotron resonance mass spectrometry)进行深入的研究和比较.
3.4 可见光和紫外光对THA降解的贡献
本实验的光化学模型计算显示,紫外光波段的表观光子降解率(η)约为可见光的5~11倍:ηUVA为ηVis的5.20倍,ηUVB为ηVis的11.53倍,说明在同样辐照强度下,紫外光拥有对DOM更高效的降解能力. 但是在自然环境中,紫外辐射仅占太阳辐射的8%[56]. 根据对天才湖表层水光谱的测定[8],其UVB、UVA和Vis波段的能量分别为1195.29、25582.98、328419.60 mW/m2,结合本研究计算的表观光子降解率,推测对于表层水,UVB、UVA和Vis的能量对THA的降解贡献分别为2.90%、27.99%、69.11%. 而在表层以下的水,紫外光会发生更为强烈衰减,可见光的降解作用可能将进一步增强[57]. 在水的作用下,紫外光在水体中的穿透性较弱,一般仅为几厘米到几十厘米[57]. 在自然环境中,可见光对DOM溶解性有机质的降解不可忽略.
天然有机质从陆地转移到水中吸收太阳紫外线和可见光辐射而退化[58]. 在水体环境中DOM的光解速率取决于量子转化率(光反应的效率)和光强[18]. 从根本上说,太阳辐射的任何变化(即云量或空气污染事件的变化)都可能导致水中DOM光降解的变化[18]. 例如,太阳辐射影响植被掉落物的降解率并增加微量气体的排放. 这些自然源排放的微量气体,例如氮氧化物(NOx)和卤代烃,会对流层和平流层中臭氧的浓度产生一定的影响,而臭氧浓度的改变则会进一步增强太阳辐射[20]. 由于亚高山湖泊冷水中微生物分解速度较慢,光降解对亚高山湖泊中碳循环显得尤为重要;紫外线和可见光辐射增强以及气候变化对碳循环的作用最终结果可能增加了向大气中释放的二氧化碳,从而加强了气候变化(正反馈)[18].
4 结论
亚高山湖泊天才湖周边土壤中THA腐殖化程度高,分子量较大,含4种荧光组分,其中78.45%为类腐殖质,类蛋白质物质仅占比21.55%. CDOM在光化学转化过程呈减少趋势,而光化学过程中会产生荧光组分C1、C2和C3,使其在反应初始荧光强度增加. 紫外光存在、DO存在与否对THA光化学转化过程的影响很大,对于THA,酸性环境有利于其光解;不同光照波段实验显示,紫外光对THA的降解贡献虽仅占30.89%,但紫外光波段的分解能力为可见光的5~11倍;在氧气的参与下,DOM矿化程度将会更加完全.
由于亚高山湖泊中DOM以外源性腐殖质为主,光化学降解是在湖泊中主要的转化过程,研究结果预示着,在气候和人类活动的作用下,亚高山湖泊的光化学转化过程将会加剧,增强亚高山湖泊在碳循环中的作用:全球变暖导致的降水增多使亚高山湖泊将接纳大量的腐殖类物质,并且引起湖泊酸化;另一方面,人类活动引起的臭氧空洞使更多的紫外线进入湖泊;更多的腐殖类物质叠加更快的光化学转化速度将释放大量的CO2;而这可能对气候变暖起到正反馈作用,加剧区域气候的变暖. 值得一提的是,因气候变暖导致的湖泊缺氧会减缓光降解的速度,缓冲以上光降解作用增强的过程. 因此,后续研究有必要建立亚高山湖泊DOM光化学转化模型,模拟和预测气候变化背景下光化学转化过程中CO2的产生.
