亚铁胁迫对甜菜幼苗矿质元素积累的影响
2022-03-05董寅壮於丽华
董寅壮,王 堽,於丽华,耿 贵,
(1黑龙江大学生命科学学院,哈尔滨 150080;2黑龙江大学现代农业与生态环境,哈尔滨 150080)
0 引言
干旱、盐碱、高温、重金属等非生物胁迫会显著抑制农作物的生长发育[1-2]。铁元素(Fe)是植物生长发育过程中不可或缺的微量元素,植物能够直接吸收土壤中的二价铁(Fe2+),适宜浓度Fe2+会促进植物的生长发育。在通气良好的中性钙质土壤中,铁的有效性较低,往往以植物难以吸收利用的三价铁形式存在[3]。但是在一些低洼淹水的土壤中,由于较低的氧化还原电位,Fe3+会被还原为植物能够利用的Fe2+并不断积累,最终对植物的生长产生负面作用[4]。
甜菜是黎科,甜菜属,二年生草本植物,也是世界第二大糖料作物,在中国东北、西北和华北地区有着广泛的种植区域[5]。铁元素是甜菜生长过程中必须的微量元素,参与甜菜的叶绿素合成与细胞内的氧化还原反应和电子传递[6],另外铁元素还是植物中许多参与呼吸作用的酶的成分。适宜浓度的铁能够促进甜菜的生长,但是缺铁会导致其叶片黄化、植株矮小等。同时,高浓度的Fe2+也会对其生长发育产生显著的抑制作用。
研究发现,高铁胁迫会影响豌豆叶绿体膜的脂肪酸组成,并且影响其光系统Ⅱ,增加了类囊体细胞色素b6/f的含量,导致光合速率下降[7];另外,高浓度的Fe2+还会通过Fenton反应在植物组织中沉淀,导致活性氧(ROS)的积累,特别是羟自由基(·OH)[8],从而不可逆地破坏植物的细胞结构、膜、DNA 和蛋白质[9]。同时,高浓度的Fe2+也会影响植物对其他矿质元素的吸收和利用[10-11],而高铁胁迫对甜菜矿质元素吸收的影响则鲜有报道。本研究采用水培方法,探究了高铁胁迫下甜菜幼苗对铁素及其他矿质元素的吸收规律,为后续研究高铁胁迫下甜菜生理变化机制和高Fe2+土壤下甜菜的种植提供理论依据。
1 材料与方法
1.1 试验材料与处理
甜菜种子购自德国KWS公司,品种为‘KWS1176’。种子在烘干蛭石中加适量水于光照培养室内使种子萌发,至子叶完全展开(7 天)后将萌发一致的幼苗转移栽至1/2 倍Hoagland 营养液水培槽中,其中Fe2+以Fe(Ⅱ)-EDTA 形态供应。光培室气候条件为:温度:昼夜28±2℃、20±2℃;光强:450 mmol/(m2·s),14h/10h(光照/黑暗);相对湿度:60%~70%。6 天后将幼苗移至Fe2+浓度分别为0.12、0.24、0.48、0.96、1.92和3.84 mmol/L 的营养液中培养,对照组为1/2 Hoagland 营养液(Fe2+浓度0.06 mmol/L)培养的幼苗,(下文对照组和6 个处理组分别用CK、T1、T2、T3、T4、T5、T6表示)。每个处理组设置6 个重复,培养期间水培槽内24 h通气,每7天更换一次培养液,幼苗处理14天后收获,测定甜菜幼苗生物量、地上部和地下部全氮(TN)、全磷(TP)、全钾(TK)、铁(Fe)、锰(Mn)、铜(Cu)和锌(Zn)含量。
1.2 甜菜植株矿质元素的测定
采用凯氏定氮法测定植株TN[12],钼锑抗比色法测定植株TP[13],火焰光度计法测定植株TK[14];采用原子吸收光谱法测定植株Fe、Mn、Cu和Zn元素含量[15]。
1.3 数据分析方法
数据采用Microsoft Office Excel 2019进行收集整理;用IBM SPSS Statistics 20.0专业软件对数据进行方差和Duncan法显著性检验(P<0.05);用Sigma Plot 14.0进行绘图。
2 结果与分析
2.1 不同浓度Fe2+对甜菜幼苗地上部和地下部铁元素含量的影响
不同浓度的Fe2+对甜菜不同部位铁元素积累的影响如图1所示。由图1可知,所有处理组中,地下部铁元素含量均高于其地在上部的含量。根据单因素方差分析,除T1处理组之外,T2-T6的所有处理组幼苗的地上部与地下部Fe 含量较CK 组均显著上升;幼苗地上部中,T1处理组Fe 含量与对照组、T2与T3处理组之间没有显著差异;地下部中,T1处理组幼苗Fe含量较CK组略有升高,但未达到显著水平。T2、T3和T4处理组的Fe含量在统计学方面差异不显著,并且T4处理组较T3处理组略有降低。整体上,随着铁浓度的不断提高,甜菜幼苗各部位的铁元素含量呈现逐渐升高的趋势,在T6处理组时达到最大,幼苗的地上部与地下部的Fe含量分别达到了4072 mg/kg DW 和11024 mg/kg DW。与CK 处理组相比,T6组幼苗地上部与地下部的Fe 含量分别上升了484%和198%。

图1 不同浓度Fe2+对甜菜幼苗铁元素积累的影响
2.2 不同浓度Fe2+对甜菜幼苗地上部和地下部大量元素含量的影响
不同浓度的铁对甜菜幼苗氮素积累的影响如图2(a)所示。由图2(a)可知,高浓度的铁对甜菜幼苗的氮素吸收具有抑制作用,随着Fe2+浓度的升高,幼苗植株中氮素的含量逐渐下降。在幼苗的地上部中,T1处理组的氮素含量与CK 组相比没有显著差异,之后所有处理组均依次下降并达到显著水平,T6处理组幼苗地上部全氮含量较CK组下降了44%;在幼苗地下部中,T1处理组幼苗全氮含量较CK 组略有上升,T2、T3处理组略有下降,但是均未达到显著水平。之后,随着Fe2+浓度的不断升高,植株地下部氮素含量呈显著下降趋势,T6处理组幼苗地下部氮素含量较CK 组下降了约55%。
不同浓度的铁对甜菜幼苗磷素积累的影响如图2(b)所示。由图2(b)可知,随着Fe2+浓度的升高,甜菜幼苗地上部和地下部植株全磷的含量均在T1处理组有所升高,但未达到显著水平,T6处理组幼苗全磷含量最低。幼苗地上部磷素含量自T1处理组之后呈下降趋势,但是根据单因素方差分析,T1-T5处理组地上部分的氮素含量与CK 组相比,均没有显著差异。T6处理组幼苗地上部分磷素含量下降与CK 组相比下降了26%。在幼苗地下部中,所有处理组的磷素含量均低于地上部。与地上部类似,T2处理组磷素含量较CK组略高,其他处理组都低于CK组。T4、T5、T6处理组磷素含量较CK 组显著降低,T6组幼苗地下部磷素含量较CK组下降了约23%。
不同浓度的铁对甜菜幼苗钾素吸收的影响如图2(c)所示。由图2(c)可知,随着Fe2+浓度的升高,幼苗地上部和地下部K元素含量均在T2处理组达到最高,分别为18.69 mg/g DW 和16.98 mg/g DW,较CK 组升高了57%和28%,随后,K 元素含量逐渐降低,至T6组达到最小值。地上部中T1、T2、T3、T4、T5处理组的幼苗K元素含量均高于CK 组,并且T1-T4处理组均显著高于CK组。T6组的幼苗地上部的钾元素含量显著低于CK组。地下部幼苗K 元素含量变化趋势与地上部分相似,T2处理组幼苗K元素含量显著高于CK组。但T1、T3-T6处理组的K元素含量较CK组相比均没有显著差异。
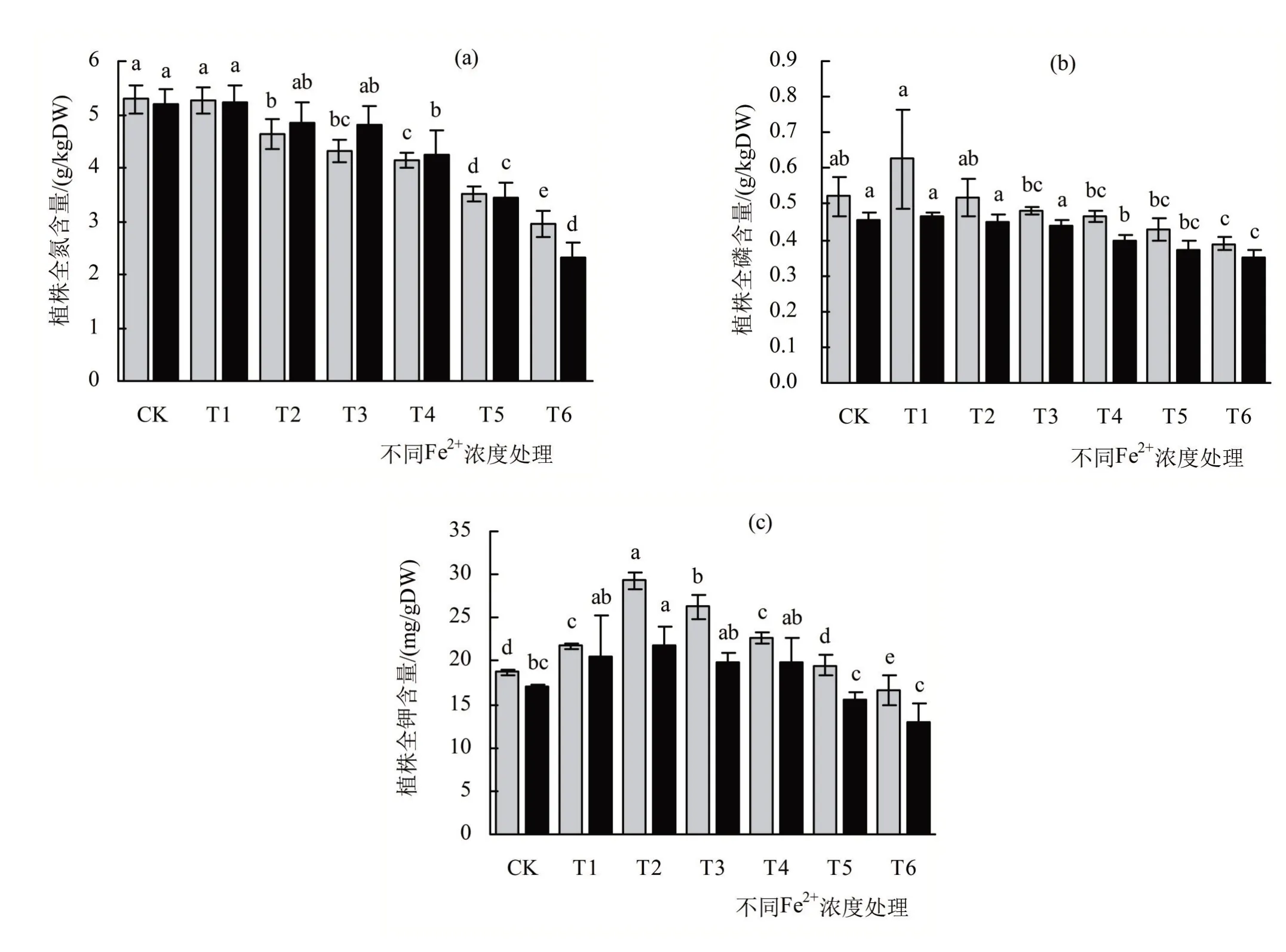
图2 不同浓度Fe2+对甜菜幼苗氮(a)、磷(b)和钾(c)元素吸收的影响
2.3 不同浓度Fe2+对甜菜幼苗地上部和地下部微量元素含量的影响
不同浓度的铁对甜菜幼苗植株锰元素(Mn)积累的影响如图3(a)所示。由图3(a)可知,随着Fe2+浓度的上升,幼苗地上部与地下部Mn 含量在T1-T3处理组呈下降趋势。T4处理组的植株Mn含量较前两个处理组急剧升高随后又继续下降并在T6处理组降至最低。在植株地上部中,T2和T5处理组之间的Mn 含量没有差异。在地下部中T3处理组与T5处理组之间没有显著差异。

图3 不同浓度Fe2+对甜菜幼苗锰(a)、铜(b)和锌(c)元素吸收的影响
不同浓度的铁对甜菜幼苗植株铜(Cu)元素积累的影响如图3(b)所示。从图3(b)可知,不同铁水平处理下,幼苗地下部的Cu 含量普遍高于其在地上部的含量。随着Fe2+浓度的提高,植株Cu浓度呈现出逐渐上升的趋势。在幼苗地上部中,T1、T2处理组的Cu 含量较CK 组无显著差异,T3、T4之间无差异但相对与CK组有了显著的升高,至T6处理组达到最大值89.8 mg/kg DW 较CK 组上升了约101%;在幼苗地下部中,幼苗Cu含量从CK组至T4组缓慢上升,但未达到显著水平。
不同浓度的铁对甜菜幼苗植株锌元素(Zn)积累的影响如图3(c)所示。高铁胁迫对植株地上部与地下部Zn 吸收的影响不同。由图可知,在植株地上部中,T1和T2处理组植株地上部Zn的含量较CK组略有降低,之后随着Fe2+不断提高,植株地上部锌元素含量逐渐上升。T1、T2和T3处理组的锌元素含量与CK组没有差异;在植株地下部中,T1和T4处理组的Zn含量与CK组相近,但是T2和T3处理组的Zn 含量显著高于CK 组。之后,T4、T5、T6处理组又呈现出逐渐上升的趋势。植株地上部和地下部中锌元素的含量较CK组分别增加了约117%和84%。T5 和T6 组的Zn 含量急剧升高分别达到了131.0 mg/kg DW和226.7 mg/kg DW。
3 讨论
铁元素是植物需求量最大的一种微量元素之一,参与植物细胞的各种重要生理生化过程。但是当植物体内的铁元素浓度过高时,会对植物的生长发育产生负面作用。研究表明,高浓度的二价铁会对水稻的生长产生较强的抑制作用[16]。同样的现象在对小麦的研究中被发现,高浓度的铁降低了其株高和干鲜重并且对其光合机构造成了严重的破坏[17]。铁蛋白对植物体内铁离子平衡和铁胁迫下植物的氧化应激十分重要[18],有研究发现,高铁胁迫能够诱导多种植物体内的铁蛋白基因过量表达[19-20],以缓解高铁胁迫对植物造成的伤害。但是,高浓度的铁胁迫下,植物缺乏有效的应对策略。
较高浓度的Fe2+会对植物造成直接伤害,同时也能够通过影响植株对氮(N)、磷(P)、钾(K)等其他元素的吸收,从而对其产生间接伤害[21]。本研究中,不同浓度的高铁胁迫会不同程度的影响甜菜幼苗对N、P 和K等大量元素的吸收。蔡妙珍和蔺冬梅等人的研究发现[10,22-23],过量的Fe2+会抑制水稻和豌豆对N、P 和K 元素的吸收,出现这种现象的原因可能是高浓度的Fe2+会降低植株的根系活力,从而降低其对其他元素的吸收能力[24]。本研究发现,随着Fe2+浓度的提高,甜菜幼苗植株N、P元素逐渐下降,这与之前的研究一致。有趣的是,幼苗植株内K元素含量随着铁浓度的升高呈现出先升高后降低的趋势。有研究表明,K+能够缓解高铁对水稻产生的毒害作用[25]。本研究中,在中等水平的铁胁迫下,幼苗通过吸收外部K+提高其在体内的含量用于缓解高铁胁迫产生的负面影响,但是随着Fe2+浓度的提高,幼苗根系的膜系统受到严重破坏从而丧失了其对K+的吸收能力,因此甜菜幼苗体内的K+含量在较高程度的亚铁胁迫下较对照组呈下降趋势。
植物根系能够通过其细胞膜表面的铁调节转运蛋白(IRTs)将外界的铁元素转运至细胞内[6,26]。当外界Fe2+浓度较高时,较多的铁被转运至植物细胞内。中低浓度的亚铁胁迫下,虽然植物体内的铁元素含量不断升高,但是其能够通过产生铁储存蛋白、提升液泡内铁离子浓度等方法维持细胞内的铁离子稳态[27]。但是,当植株体内Fe2+超过一定浓度,其体内的铁离子稳态被打破,幼苗就会丧失其维持铁稳态的能力,这也是T5、T6处理组幼苗体内Fe2+浓度急剧上升的主要原因;Mn参与植物的许多生理过程,并且参与一些蛋白质和磷酸化酶的构成[28]。研究发现,高浓度的铁元素会抑制水稻和小白菜对Mn 元素的吸收[29-30]。本研究中,随着铁浓度的提高,甜菜幼苗中的Mn 元素含量整体呈不断下降的趋势,这与之前的研究一致。出现这种显现的原因可能是,Fe 元素与Mn元素原子大小相近,两种元素之间会产生拮抗作用,铁元素占据转运蛋白中心从而抑制植株对Mn 的吸收。白红红[29]研究发现,锰元素能够缓解铁元素对水稻的毒害作用。本实验中T4处理组幼苗植株的Mn 元素含量较T3组含量显著升高,这可能是因为较高铁元素浓度下,植株需要通过增加Mn 元素的吸收量来维持其体内的铁离子平衡;Cu 元素是氧化还原过程中某些氧化酶的组成成分,参与氮代谢,是叶绿素中质体蓝素的组成成分。Zn 元素既是某些酶的组成成分,又可作为某些脱氢酶激酶的活化剂[31]。大量研究发现,高浓度的Fe 元素会抑制植物对Cu元素和Zn 元素的吸收[11,23-24]。有趣的是,本研究结果与上述研究相反,随着Fe2+浓度的不断提高,植株地上部和地下部的Cu 和Zn 含量整体呈现逐渐上升到趋势。有研究发现,较高的Cu 离子浓度会造成植物叶片的失绿,这可能与高铁胁迫下甜菜幼苗叶片发黄萎蔫有关。现有研究对高铁胁迫下植株Cu、Zn 元素含量升高的研究较少,需要进一步探讨此方面的机制。
本研究探讨了不同浓度的亚铁胁迫下,甜菜幼苗对大量元素和主要微量元素的吸收和不同组织中积累的规律,丰富了甜菜幼苗对亚铁胁迫响应机制的研究。但是本研究未探讨更低层次下(如木质部、韧皮部等组织水平和液泡、叶绿体等细胞器水平)的元素转运和积累机制,矿质元素在植株不同组织和细胞器中的含量各不相同,深入探究不同组织和细胞器内矿质元素的转运和积累机制,能进一步丰富关于亚铁胁迫下植物的相应机制和亚铁胁迫对植物的损伤机制的研究。
4 结论
本研究发现:随着Fe2+浓度的上升,幼苗植株地上部与地下部的铁元素浓度不断提高,与CK 处理组相比,T6组幼苗地上部与地下部的Fe 含量分别上升了484%和198%。高浓度的铁又影响幼苗对其他矿质元素元素的吸收,植株地上部和地下部N 元素和P 元素的浓度呈下降趋势,其K元素浓度在中等程度的胁迫下升高而在较高程度的胁迫下又相对对照组显著下降;另外,高铁胁迫下甜菜幼苗植株中Mn元素含量下降,Cu、Zn元素的含量较CK组上升。
