不同内型哮喘小鼠模型中的小气道功能研究及其机制初探
2022-03-04薛艺抒傅强包婺平郝慧娟张旻
薛艺抒 傅强 包婺平 郝慧娟 张旻
支气管哮喘(以下简称哮喘)是以气道慢性炎症、气道高反应性及气道重塑为主要特征的异质性疾病,根据不同内型及个体化治疗的目的,可将哮喘分为Type2(T2)型哮喘和非T2型哮喘。越来越多的研究发现,小气道功能的异常存在于不同严重程度的哮喘患者[1-3];我们的临床研究也发现小气道功能异常者的激发试验阳性率明显增高[4]。呼吸描记图末端的减慢被认为是与小气道的气流阻塞有关的最早变化,因此,肺功能中的变量,如用力呼气50%时的瞬时流速(Forced expiratory flow at 50% of Forced Vital Capacity[FVC],FEF50)、用力呼气75%时的瞬时流速(Forced expiratory flow at 75% of FVC,FEF75)和最大呼气中段流量 (Forced expiratory flow between 25% and 75% FVC,MMEF) 常被用于预测人类小气道功能障碍[5]。然而,在动物哮喘模型中哮喘中小气道功能障碍的观察和研究仍缺乏。通过建立两种不同内型的哮喘模型,本文检测小鼠的小气道功能,并分析其与气道炎症、气道反应性、气道重塑的相关性,为小气道功能障碍在动物哮喘模型中的作用机制提供依据。
资料与方法
一、 材料
C57BL/6小鼠(无特殊病原体级,雄性,5~6周龄,体重18~20g)购自上海吉辉实验动物有限公司,动物合格证号:SCXK(沪)2017-0012,饲养于上海交通大学附属第一人民医院实验动物中心内。饲养环境温度21℃至25℃,湿度40%至60%,自由喂养水和食物(不含OVA),采用12小时为周期的光-暗循环。所有处理流程和实验操作严格按照上海交通大学附属第一人民医院动物研究伦理委员会的规定执行(伦理批号: 2019-A011-01)。舒泰50(Virbac S.A., France),拜特速眠新(拜特生物科技研究所有限公司,长沙),苏木素-伊红染色试剂盒(谷歌生物科技,武汉);卵清蛋白 ( OVA ) ( grade V&Ⅱ, Sigma-Aldrich, St. Louis, Mo. , USA) , 小鼠IL-4、IL-5、IL-17A,、TNF-α ELISA试剂盒(ANOGEN, Ontario, Canada),小鼠IL-13 ELISA试剂盒(Invitrogen, California, USA)。
二、方法
1 两种内型哮喘模型建立
将C57BL/6小鼠随机分为3组,每组6只。T2型哮喘模型(OVA组):在第0天和第7天进行卵清蛋白(ovalbumin,OVA)(1mg/kg)+明矾(体积同OVA)腹腔注射致敏小鼠,从第14天至第22天,隔天以PBS配制5% OVA雾化吸入30分钟,并在休息30分钟后吸入空气2小时;非T2型哮喘模型(OVA+ozone组):其余操作同OVA组,每次OVA雾化结束休息30分钟后,吸入2.5 ppm的臭氧2小时;对照组(Control组):在第0天和第7天进行PBS腹腔注射,从第14天开始隔天PBS雾化吸入30分钟,随后空气吸入2小时至第22天。
2 小鼠肺功能检测
最后一次臭氧暴露后24小时,以舒泰50(25mg/kg)和拜特速眠新(10mg/kg)腹腔注射麻醉小鼠,确认其完全昏睡且痛觉丧失后,将小鼠固定于泡沫操作板上,剪开颈部皮肤后钝性分离周围组织,充分暴露气管,预先将一生理盐水浸湿的结扎线置于气管下,随后在甲状软骨下的环状软骨上沿气管横径剪一小口,将气管插管插入气管中,将结扎线打结,固定气管插管。连接小鼠的气管插管至EMMS eDacq FM(模拟强迫振荡)系统体积描记器上的接头,根据EMMS数据采集系统eDacq软件中预设的程序,模拟经典的临床肺活量测定法检测小鼠大、小气道功能。该系统计算的参数包括用力肺活量(Forced Expiratory Volume,FVC)和呼气中期流量。其中EF50、FEF75、MMEF提示小气道功能。
3 小鼠气道反应性检测
随后进行有创的气道阻力与顺应性检测。将小鼠置入EMMS R&C系统的体积描记器中,采用微型通气系统维持辅助通气,控制通气频率为180次/分,潮气量为210μl,将气管插管导管与EMMS R&C系统呼吸流量测定仪和压力传感器连接。eDacq软件自动记录流速的变化与压力的变化,并计算气道阻力(RL)。与传感器连接后,待小鼠呼吸平稳后通过雾化给药系统吸入10μl PBS(给药时间30秒),停止雾化后RL的检测与记录启动,雾化PBS后的3分钟所记录的RL的均值即为激发前的基础值,随后逐次吸入递增浓度(4,8,16,32,64,128和256mg/mL)的氯化乙酰胆碱(Acetylcholine chloride,ACh)溶液,每次加样体积、雾化时间和记录持续时长需与基线检测保持相同。记录RL,并计算其较基线 (雾化PBS后测得的均值) 增加的百分比(%)。使RL比基线升高100%所需的ACh浓度记为PC100,为了方便数据分析,将RL曲线的横坐标变转换为对数形式。将-log PC100作为反映气道反应性的指征。
4、 肺泡灌洗液中的细胞因子检测
气道阻力检测结束后,并以1.5% 戊巴比妥(200mg/kg)腹腔注射麻醉处死小鼠,将0.6mL冰PBS经气管插管缓慢注入肺部进行全肺灌洗,抽吸2~3次,每只小鼠灌洗3次,收集支气管肺泡灌洗液(Bronchoalveolar lavage fluid,BALF)。将回收的 BALF在3000rpm、4℃条件下,离心10min,吸取上清液,用作细胞因子蛋白检测。根据说明书进行酶联免疫吸附试验(Enzyme-linked immunosorbent assay,ELISA),检测IL-4、IL-5、IL-13、IL-17A、TNF-α的表达水平。
5 肺组织学检测及免疫组织化学染色
小鼠肺组织用4%多聚甲醛(20cmH2O的压力注入)固定后,经脱水,石蜡包埋,切片,脱蜡后进行苏木精-伊红(Hematoxylin-eosin staining,HE)染色和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体处理,分别观察气道炎性细胞浸润和平滑肌增生的情况。在20倍或40倍光镜下,根据支气管或小血管周围炎症细胞浸润情况进行炎症评分[6]:0分,支气管或小血管周围几乎没有炎症细胞浸润;1分:支气管或小血管周围偶有少量炎症细胞浸润;2分:支气管或血管周围被炎症细胞包绕,细胞层较薄(≤5层);3分:支气管或血管周围被厚层细胞(>5层)围绕。每只小鼠计数至少10个视野,将其炎症评分的均数作为观察值进行比较、分析。并对每只小鼠选取10个视野,计数具有完整横切面的支气管旁嗜酸性粒细胞及中性粒细胞,计数宽度(测量时与支气管垂直)控制在100μm左右。计算每只小鼠的支气管旁不同炎症细胞的密度(个/100μm)的均值并统计分析。
三、统计学方法
采用GraphPad PRISM 5.0版本进行统计分析和绘图,数据以平均值±标准差表示。采用Kruskal-Wallis 单因素方差分析(ANOVA)检验进行多组间的比较,差异有显著性时进一步用S-N-K法进行两两比较。采用Spearman分析不同变量之间的相关性。P<0.05表示差异有统计学意义。
结 果
一、 两种内型的哮喘小鼠均出现小气道功能障碍
三组小鼠之间FVC值无统计学差异(图1A)。两种内型的哮喘模型中均存在小气道功能障碍。与对照组相比,非T2型哮喘小鼠模型的MMEF、FEF50和FEF75均下降 (图1 B-D),T2型哮喘小鼠中MMEF、FEF50也降低(图1 B-C)。两种哮喘模型相比较,OVA+ozone组小鼠较OVA组表现出小气道功能更差的趋势,但其差异无统计学意义。

图1 两种内型的哮喘小鼠的小气道功能(n=18,每组6只)。
采用EMMS FM系统检测小鼠小气道功能。(A) FVC。(B-D)小鼠小气道功能 (MMEF、FEF50、FEF75)。*P<0.05,**P<0.01。
二、 两种内型的哮喘模型均表现出相应的气道炎症
与对照组相比,两种哮喘模型小鼠的气道中均出现炎性细胞浸润,并伴有支气管壁增厚(图2A),炎症评分也显示两组小鼠的气道炎症较对照组均加重(图2B)。OVA组较OVA+ozone组表现出更多的嗜酸性粒细胞浸润(图2D),而OVA+ozone组则表现出更多的中性粒细胞浸润(图2C)。
OVA组和OVA+ozone组Th2相关细胞因子IL-4、IL-5和IL-13水平均高于对照组(图2E-G),其中OVA组的IL-13表达水平较OVA+ozone组更高。IL-17A在两种哮喘模型中也都表现为显著升高,其中OVA+ozone组IL-17A水平显著高于OVA组(图2H)。
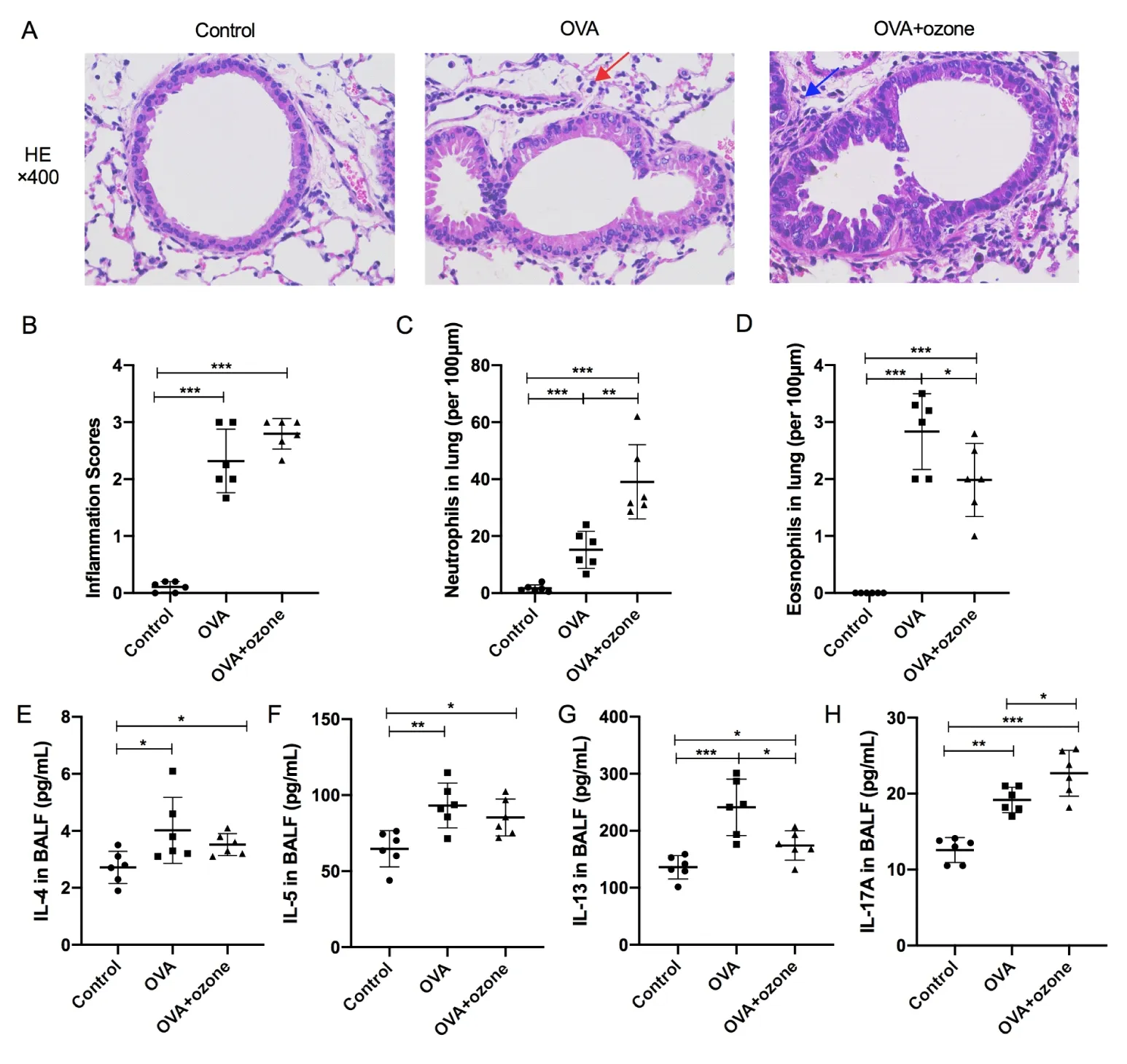
图2 小鼠的气道炎症的病理改变(HE染色,n=18,每组6只)及细胞因子水平变化(ELISA法,n=18,每组6只)
三、 两种内型的哮喘模型均表现出气道高反应性
三组小鼠经PBS雾化后的基线肺阻力(RL)值组间未表现出明显差异。两种哮喘模型中,RL浓度反应曲线都呈现左移的趋势,表明与对照组小鼠相比,两种哮喘模型的气道反应性均增加(图3A)。与对照组相比,T2型哮喘模型小鼠在64和256 mg/mL ACh浓度刺激下的RL值升高;OVA+ozone诱导的非T2型哮喘模型在8、、32 、64 和256mg/mL ACh浓度下均表现出较对照组显著增加的气道阻力。更直观地,将OVA组和OVA+ozone组的-log PC100与对照组相比,我们发现两种哮喘小鼠模型均存在气道高反应性,并且OVA+ozone组似乎表现出更强的气道反应性,但其与OVA组相比没有统计学意义上的差异 (图3B)。

图3 小鼠的气道反应性(n=18, 每组6只)。
(A)HE染色切片的代表性显微照片(放大倍率为400倍,图中红色箭头指向典型嗜酸性粒细胞,蓝色箭头指向典型中性粒细胞)。(B)气道炎症评分。(C)中性粒细胞密度(每100微米)。(D)嗜酸性粒细胞密度(每100微米)。(E-H)小鼠BALF中炎症细胞因子IL-4、IL-5、IL-13及IL-17A的水平。*P<0.05,**P<0.01,***P<0.001。
采用EMMS R&C系统检测小鼠气道阻力。(A) 气道阻力(RL)随ACh浓度增加的平均百分比(横坐标为ACh浓度取对数值)。(B) -logPC100 (使RL较基线增加100%所需的乙酰胆碱浓度)。图A中*代表与对照组比较的统计学差异,*P<0.05,**P<0.01,***P<0.001。
四、两种内型的哮喘模型均表现出气道重塑
OVA组和OVA+ozone组的小鼠较对照组均出现明显的气道平滑肌增生(图4A)。OVA+ozone小鼠中的气道平滑肌增生比OVA组更明显(图4B)。
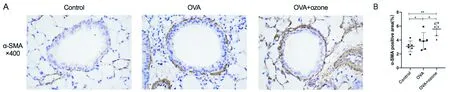
图4 小鼠气道平滑肌改变(免疫组织化学法,n=18,每组6只)
五、两种哮喘模型中小气道功能与气道炎症、气道反应性及气道重塑相关小气道功能指标中,MMEF、FEF50在哮喘模型组较对照组表现出较大差异(图1B-C),所以此处以MMEF、FEF50作为代表,分析了其与反映气道炎症的BALF细胞因子水平、代表气道阻力的-logPC100及反映气道重塑的α-SMA阳性面积百分比的相关性。结果显示MMEF及FEF50与气道阻力、气道平滑肌增生呈现出良好的负相关性(图5A-B、G-H)。BALF中的炎性细胞因子也与小气道功能呈现出相关性(图5C-F、I-L),其中IL-17A与MMEF(r=-0.6677,P=0.0025)和FEF50(r=-0.6677,P=0.0031)均呈现较其他几种所测细胞因子更强的相关性。

图5 小气道功能与气道炎症、气道反应性、气道重塑的相关性(n=18,每组6只)
讨 论
本研究中,OVA和OVA+ozone两种小鼠模型均表现出T2和非T2型哮喘的相应特征,均存在气道炎症、气道高反应性以及气道重塑,但OVA组小鼠表现出更高的嗜酸性粒细胞炎症及Th2型细胞因子,模拟了T2型哮喘内型;OVA +ozone组则表现为中性粒细胞浸润以及Th17相关细胞因子水平升高,与我们之前的研究结果相似[6],模拟了非T2型哮喘内型。小气道功能的异常在哮喘患者的临床研究中起着重要作用[3,7],但在临床患者中难于模拟或收集足够的T2型和非T2型哮喘病例进行研究,本研究在小鼠中建立上述两种内型的哮喘模型,将哮喘中小气道功能的研究扩展到动物模型中。
已有部分研究从病理学角度对从小鼠小气道的病理进行了不同的探讨和定义,包括根据支气管肺泡管连接处的距离、气道直径<100μm或<400μm等方式[8-10],但对于小鼠小气道的定义尚未达成共识。从肺功能的角度评估小鼠小气道功能的研究仍缺乏,本研究采用模拟人类肺功能测定的EMMS eDacq FM系统检测小鼠气道功能,探索了两种哮喘内型中小气道功能是否存在异常及其可能的机制。
气道高反应性、气道炎症和气道重塑是哮喘的典型特征,在哮喘的病理生理机制中起重要作用[11]。所以我们根据不同的代表性指标,分析了小气道与以上三者的相关性。我们的研究表明,小气道功能指标如FEF50、MMEF与BALF中IL-4、IL-5、IL-13和IL-17A水平提示的气道炎症的严重程度相关。既往研究已经发现在哮喘中小气道存在与大气道相似甚至更严重的炎症反应,伴有IL-4、IL-5 mRNA的表达增加[12-14]。本研究的结果进一步证实了小气道功能异常与气道炎症程度的相关性,对于小气道的干预在哮喘气道炎症的治疗中不可忽视。小气道功能障碍与气道高反应性的相关性在临床研究中已有较多发现[15-17],本课题组的前期临床研究也发现小气道功能障碍可能参与了慢性咳嗽患者气道高反应性的发生[18]。本研究进一步在小鼠模型中验证了哮喘环境下气道高反应性与小气道功能障碍密切相关,针对具有小气道功能障碍的患者,能到达更远端气道的气雾剂可能对其治疗具有更大的帮助。慢性气道重塑是哮喘的基础表征之一[19],气道平滑肌增厚是气道重塑的一种主要表现,α-SMA由平滑肌细胞表达并作为平滑肌细胞的标记物[20]。 哮喘中的气道重塑除了涉及大气道外,也涉及小气道[21-22],但关于哮喘中小气道功能障碍与气道重塑的关系研究仍较少。本研究中两种哮喘小鼠模型中均出现气道重塑,并与小气道功能障碍表现出明显的相关性。说明在哮喘环境下,气道重塑也发生在(A) MMEF与气道反应性的相关性。(B) MMEF与气道重塑的相关性。(C-F) MMEF与BALF中炎性细胞因子的相关性。(G) FEF50与气道反应性的相关性。(H) FEF50与气道重塑的相关性。(I-L) FEF50与BALF中炎性因子的相关性。*P<0.05,**P<0.01,***P<0.001。ns,无统计学差异。
小气道,并可能与小气道功能障碍共同促进哮喘的发生发展。有研究表明中性粒细胞可能参与促进气道重塑[23],这可能有助于解释本研究中非T2型哮喘模型比T2型哮喘模型更严重的气道重塑的结果。
此外,尽管T2型和非T2型哮喘模型小气道功能的结果相近,但小气道功能障碍可能存在不同的机制。OVA组中Th2相关细胞因子如IL-13水平更高,而OVA+ozone则诱导产生更高水平的IL-17A以及更严重的中性粒细胞浸润。OVA+ozone组更严重的气道平滑肌增生,也可能影响这一内型哮喘的小气道功能。因此,这两类哮喘的治疗可能需要更个体化的方案,有必要对它们参与小气道功能异常的潜在信号通路进行进一步研究。
综上所述,小气道功能障碍存在于不同内型的哮喘中,其发病机制与气道炎症的严重程度、气道反应性以及气道重塑的情况密切相关,并且在T2型和非T2型哮喘模型中,小气道功能障碍的机制可能不同,仍需进一步研究探索是否干预相应细胞因子可以恢复小气道功能。
