姜黄素介导的光动力技术对副溶血性弧菌与腐败希瓦氏菌的杀灭效果
2022-03-03檀利军胡钰梅陈博文王敬敬刘海泉
檀利军,胡钰梅,陈博文,陈 璐,胡 赵,王敬敬,3,*,刘海泉,4,5,赵 勇,4,5,*
(1.上海海洋大学食品学院,上海 201306;2.南昌大学生命科学学院,江西 南昌 330031;3.佛山科学技术学院食品科学与工程学院,广东 佛山 528225;4.上海水产品加工及贮藏工程技术研究中心,上海 201306;5.农业农村部水产品贮藏保鲜质量安全风险评估实验室(上海),上海 201306)
副溶血性弧菌(Vibrio parahaemolyticus)是一种嗜盐型革兰氏阴性致病菌,广泛存在于各类海产品中[1]。这种细菌被认为是食用生的或未煮熟的海产品引起人类急性肠胃炎或腹泻的主要原因[2]。腐败希瓦氏菌(Shewanella putrefaciens)是嗜冷型革兰氏阴性腐败菌,是海产品等高蛋白食品中常见的优势腐败菌[3]。近年来由于副溶血性弧菌与腐败希瓦氏菌的污染导致了严重的公共卫生问题和巨大的经济损失[4-5],因此,对副溶血性弧菌与腐败希瓦氏菌的研究日益引起社会关注,开发抑制或杀灭这些有害菌的策略显得尤为重要。
为了控制食品加工环境中有害微生物的污染,近年来研究出很多的新型抗菌策略(如酶制剂、紫外线灭菌、高压脉冲电场等)[6]。这些技术方法虽然与传统的抗菌策略(如消毒剂、抗生素等)相比更加绿色环保,但自身也存在很多缺点,包括成本高、可能改变食品原有品质、杀菌效果不稳定以及存在一定的安全问题等[7]。因此,有必要开发新型抗菌技术和有效的根除方法来控制有害微生物的污染。光动力技术(photodynamic technology,PDT)又称光辐射疗法,是一种在临床医学中广泛采用的杀灭致病微生物的新方法[8-9]。这种新型的非热杀菌技术在光敏剂和有氧的条件下通过适当波长的光照射后即可产生活性氧物质(reactive oxygen species,ROS)。ROS能够破坏细胞和微生物的大分子结构进而导致其受损或死亡[10]。然而该技术在食品工业中对有害微生物方面的应用却鲜有报道。
姜黄素是目前世界上使用最为广泛的天然色素之一,其原料来源广、成本低,且无毒无污染[11]。已有研究发现,姜黄素在蓝光下(波长范围420~480 nm)具有光敏活性,对单核细胞增生李斯特菌[12]、假单胞菌[13]、金黄色葡萄球菌[14]等具有很强的杀灭效果。然而,姜黄素介导的PDT对副溶血性弧菌与腐败希瓦氏菌的抗菌作用及其机制尚未明确,此外,对其生物被膜的清除效果鲜见报道。因此,本研究将系统地探究姜黄素介导的PDT对副溶血性弧菌与腐败希瓦氏菌及其生物被膜的抗菌效果,以期为食品工业设计新型高效的非热光动力杀菌技术提供新的思路。
1 材料与方法
1.1 菌株、材料与试剂
副溶血性弧菌ATCC 17802来源于中国科学院微生物研究所;副溶血性弧菌E36、腐败希瓦氏菌E05、E08均由本实验室从对虾中分离获得。
姜黄素(食品级,纯度高于99%) 上海生工生物工程股份有限公司;硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基(thiosulfate citrate bile salts sucrose agar culture medium,TCBS)、胰蛋白胨大豆肉汤培养基(tryptone soy broth,TSB)、铁琼脂培养基 北京陆桥技术股份有限公司;ROS活性氧荧光探针(2’,7’-二氯二氢荧光素-双乙酸酯(2’,7’-dichlorodihydrofluorescein diacetate,DCFH-DA)) 北京索莱宝生物技术有限公司;9,10-蒽二基-双(亚甲基)二甲酸(9,10-anthracenediylbis(methylene) dimalonic acid,ABDA) 美国Sigma公司;3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化铵(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT)(5 mg/mL)、磷酸盐缓冲溶液(phosphate buffered saline,PBS)、体积分数4%多聚甲醛/体积分数2.5%戊二醛扫描电子显微镜固定液、SYBR Green I核酸染料 上海生工生物工程股份有限公司;其他化学分析试剂均购自国药集团化学试剂有限公司。
1.2 仪器与设备
LED蓝光光源(波长455~460 nm,灯管长度30 cm,每秒辐照剂量3.80 mJ/cm2) 飞利浦照明电子(上海)有限公司;Bioscreen C MBR-全自动微生物生长曲线分析仪 芬兰Oy Growth Curves Ab公司;5417R全自动台式离心机 德国Eppendorf公司;TCS SP8激光共聚焦扫描显微镜(confocal laser scanning microscope,CLSM) 德国徕卡公司;SNE-4500M场发射扫描电子显微镜(scanning electron microscope,SEM) 日本电子株式会社;SynergyHTX多功能酶标仪 美国伯腾仪器有限公司;PTR-60分子杂交仪 英国Grant仪器有限公司。
1.3 方法
1.3.1 菌株培养
将两株副溶血性弧菌(-80 ℃下保藏在体积分数50%的甘油管中)分别划线于TCBS平板上,37 ℃下培养12 h后挑取绿色单菌落接种至TSB培养基(含3%(质量分数)NaCl)中,置于恒温(37 ℃)培养箱中过夜培养(200 r/min),随后将两株菌的菌液混合,在4 000 r/min的转速下离心10 min;将两株腐败希瓦氏菌(-80 ℃下保藏在体积分数50%的甘油管中)分别划线接种于铁琼脂平板上,25 ℃下培养24 h后挑取黑色单菌落到TSB培养基中,置于恒温(30 ℃)培养箱中过夜培养(200 r/min),随后将两株菌的菌液混合并用相同条件离心10 min。用质量分数0.85% NaCl溶液分别将上述离心菌体稀释至浓度约为8(lg(CFU/mL))后备用。
1.3.2 光敏剂的配制
称取0.036 84 g姜黄素粉末溶解于100 mL的无水乙醇中,混匀后即可得到浓度为1 000 μmol/L的姜黄素储备液,置于4 ℃避光保存。
1.3.3 PDT对副溶血性弧菌与腐败希瓦氏菌的灭活
将100 μL菌液和不同浓度的姜黄素(副溶血性弧菌对应姜黄素浓度:0.5、0.7、1.0、2.0、3.0 μmol/L;腐败希瓦氏菌对应姜黄素浓度:1、3、5、7、10 μmol/L。光照时间均为8 min)以及质量分数0.85% NaCl溶液加入到离心管中使体系总体积为1 mL。在分子杂交仪中100 r/min孵育20 min后加入24 孔板中光照不同的时间(副溶血性弧菌对应光照时间:2、5、8、10、20 min,姜黄素浓度为1 μmol/L;腐败希瓦氏菌对应光照时间:2、5、8、10、15 min,姜黄素浓度为5 μmol/L)。选择未经光照和姜黄素处理(L-C-)的样品作为阴性对照组,仅光照(L+C-)或仅姜黄素(L-C+)处理的样品作为空白对照组。PDT处理结束后,将副溶血性弧菌与腐败希瓦氏菌的菌液梯度稀释后分别涂布于TCBS平板(12 h、37 ℃)和铁琼脂平板(24 h、25 ℃),培养到指定时间后计数[12]。
1.3.4 ROS和单线态氧的监测
将100 μL菌液加入0.9 mL PBS中使细菌悬浮,加入不同浓度的姜黄素(副溶血性弧菌对应姜黄素浓度:0.5、0.7、1.0 μmol/L;腐败希瓦氏菌对应姜黄素浓度:1、3、5 μmol/L)混合后再分别加入10 μmol/L DCFHDA试剂(监测ROS的产生情况)或100 μmol/L ABDA试剂(监测单线态氧的产生情况)。孵育结束后,光照不同时间(副溶血性弧菌对应光照时间:8、10、20 min;腐败希瓦氏菌对应光照时间:8、10、15 min),分别用多功能酶标仪测其发射波长529 nm处最大荧光发射强度(ROS产生情况)与399 nm波长处的光密度值(单线态氧产生情况)。以未经光照和姜黄素处理为阴性对照组(L-C-)。最终单线态氧产生量以OD399nm(阴性对照组)-OD399nm(实验组)+OD399nm(姜黄素)表示[15]。
1.3.5 细菌再生长能力的评估
将副溶血性弧菌与腐败希瓦氏菌的菌液分别和不同浓度的姜黄素在体系中混合均匀,按1.3.3节条件孵育后光照不同的时间。具体处理条件的组合为副溶血性弧菌:0.5 μmol/L+8 min、1.0 μmol/L+8 min、1.0 μmol/L+20 min;腐败希瓦氏菌:1 μmol/L+8 min、5 μmol/L+8 min、5 μmol/L+15 min。未经光照和姜黄素处理为阴性对照组(L-C-)。随后取每组样品20 μL和180 μL无菌新鲜TSB(副溶血性弧菌组需要额外添加质量分数3% NaCl)加入到100 微孔板中。生长曲线分析仪设置参数为培养温度25 ℃;每隔2 h读取OD600nm一次;总运行时长为48 h,测定PDT处理后副溶血性弧菌与腐败希瓦氏菌的生长曲线[16]。
1.3.6 SEM观察细菌表面形态变化
不同条件的PDT处理结束后,收集菌液到离心管中10 000 r/min离心5 min。弃除上清液后加入1 mL SEM固定液,4 ℃下静置过夜。用体积分数30%、50%、70%、80%、90%、100%和100%的乙醇依次脱水。将样品滴加在无菌玻璃片上,干燥后进行镀金处理,每个样品随机挑选3 个不同视野在SEM(5.0 kV、5 000 倍)下进行观察[17]。
1.3.7 结晶紫法定量生物被膜生物量
将10 μL副溶血性弧菌和腐败希瓦氏菌分别与990 μL的无菌新鲜TSB培养基(副溶血性弧菌额外添加3%(质量分数)NaCl)加入到24 孔板中,随后将孔板放入25 ℃培养箱中静置培养6、12、18、24、36、48 h。培养结束后移除浮游菌,并用PBS清洗3 次,放入55 ℃烘箱干燥后每孔加入1 mL体积分数0.1%结晶紫溶液室温静置30 min。用PBS清洗3 次以除去多余的结晶紫,每孔加入1 mL体积分数95%乙醇溶液,室温下静置30 min后测其在600 nm波长处的光密度值[18],以OD600nm表示生物被膜总生物量。
副溶血性弧菌和腐败希瓦氏菌生物被膜分别培养24 h和18 h后,取出24 孔板并用PBS清洗3 次移除浮游菌。加入不同浓度的姜黄素并光照不同的时间(具体处理条件组合见2.3节图5)。处理结束后,用PBS清洗并放入烘箱干燥,每孔加入1 mL结晶紫溶液后室温静置30 min。用PBS去除多余的结晶紫后,每孔加入1 mL体积分数95%乙醇溶液,室温下静置30 min后测其在600 nm波长处的光密度值[18],以OD600nm表示生物被膜总生物量。
1.3.8 MTT法检测生物被膜细胞活力
副溶血性弧菌与腐败希瓦氏菌生物被膜经过PDT处理后,每孔加入1 mL新鲜TSB培养基(副溶血性弧菌额外添加3%(质量分数)NaCl)和100 μL MTT试剂,置于25 ℃培养箱中静置孵育2 h以上。用PBS清洗以移除浮游菌后每孔加入1 mL二甲基亚砜,室温静置30 min后检测在570 nm波长处的光密度值[19],以OD570nm表示细胞活力。
1.3.9 CLSM观测生物被膜结构变化
副溶血性弧菌与腐败希瓦氏菌生物被膜经过PDT处理后,每孔加入1 mL SEM固定液,4 ℃下固定30 min,用PBS洗3 次以去除多余的固定液。随后每孔加入200 μL核酸染料,室温避光染色30 min。用PBS洗3 次以去除多余的染料,干燥后置于CLSM(200 倍)下随机挑选3 个不同的视野观察并拍照。通过ISA-2生物被膜结构参数分析软件分析导出图像的生物体积、孔隙度、同质性、质构熵以及粗糙度[20]。
1.4 数据处理与分析
每组样品设置3 个平行,并进行3 次独立重复实验后取平均值。通过Microsoft Excel 2010软件进行数据处理;通过SPSS 21.0软件进行单因素方差分析,P<0.05表示具有显著性差异;通过Graphpad Prism 8.4.3和Origin 8.0软件作图。
2 结果与分析
2.1 PDT分别对副溶血性弧菌与腐败希瓦氏菌的杀菌效果
姜黄素浓度对PDT处理副溶血性弧菌与腐败希瓦氏菌的影响分别如图1A、B所示。副溶血性弧菌阴性对照组(L-C-)菌落总数为7.51(lg(CFU/mL)),仅光照(8 min)或仅加姜黄素(3.0 μmol/L)处理时,菌落总数并无显著变化(图1A)。保持光照时间为8 min,当姜黄素浓度为0.5 μmol/L时,菌落总数显著下降至6.22(lg(CFU/mL))(P<0.05)。当姜黄素浓度提高到1.0 μmol/L时,菌落总数进一步下降至4.22(lg(CFU/mL))。此外,添加浓度为3.0 μmol/L的姜黄素并光照8 min时,在平板上不能检测到任何菌落。同样,PDT对腐败希瓦氏菌有类似的杀灭作用(图1B),腐败希瓦氏菌所有对照组之间的菌落总数也没有显著差异;当姜黄素浓度增加到5 μmol/L时,菌落总数下降至3.60(lg(CFU/mL))(P<0.05);进一步提升姜黄素浓度到10 μmol/L时,在平板上无法检测到菌落。
光照时间对PDT处理副溶血性弧菌与腐败希瓦氏菌的影响分别如图1C、D所示。与阴性对照组相比,仅光照或者仅加姜黄素处理,副溶血性弧菌与腐败希瓦氏菌的菌落总数均无显著减少。当加入1 μmol/L姜黄素并光照2 min后,副溶血性弧菌的菌落总数下降至6.23(lg(CFU/mL))(P<0.05);继续延长光照时间至8 min后,菌落总数下降至4.03(lg(CFU/mL));当光照时间达到20 min时,在平板上没有检测到菌落(图1C)。在处理腐败希瓦氏菌中也发现类似的失活趋势。当姜黄素的浓度为5 μmol/L、光照时间为8 min时,菌落总数显著降低至3.34(lg(CFU/mL))(P<0.05);当光照时间延长至15 min时,在平板上已经不可检测到菌落(图1D)。综上,PDT对副溶血性弧菌与腐败希瓦氏菌的杀菌效果均表现出强烈的光敏剂浓度和光照时间的依赖性。

图1 姜黄素介导的PDT在不同处理条件下对副溶血性弧菌(A、C)与腐败希瓦氏菌(B、D)的杀菌效果Fig.1 Inactivation effects of curcumin-mediated PDT on V.parahaemolyticus (A, C) and S.putrefaciens (B, D) under different treatment conditions
为了进一步验证PDT对副溶血性弧菌与腐败希瓦氏菌的抗菌效果,对经过PDT处理后副溶血性弧菌与腐败希瓦氏菌的再生能力进行了评估,结果如图2所示。在阴性对照组(L-C-)中,副溶血性弧菌与腐败希瓦氏菌两者都在经历短暂的迟缓期(2 h)后迅速进入对数期并很快达到稳定期。然而,随着姜黄素浓度的增加和光照时间的延长,副溶血性弧菌的迟缓期明显延长。当姜黄素浓度为0.5 μmol/L、光照时间为8 min时,副溶血性弧菌经历了4 h的迟缓期才开始进入对数期。当姜黄素浓度为1 μmol/L、光照时间为20 min时,副溶血性弧菌的迟缓期达到了8 h;且到达稳定期后的最大OD值(OD600nm≈0.4)只有阴性对照组(OD600nm≈0.8)的一半。此外,腐败希瓦氏菌也得到了类似的结果。值得注意的是,当姜黄素浓度为5 μmol/L、光照时间为15 min时,腐败希瓦氏菌被彻底杀灭并停止生长(图2B)。这进一步证实了PDT对副溶血性弧菌与腐败希瓦氏菌良好的灭活效果。
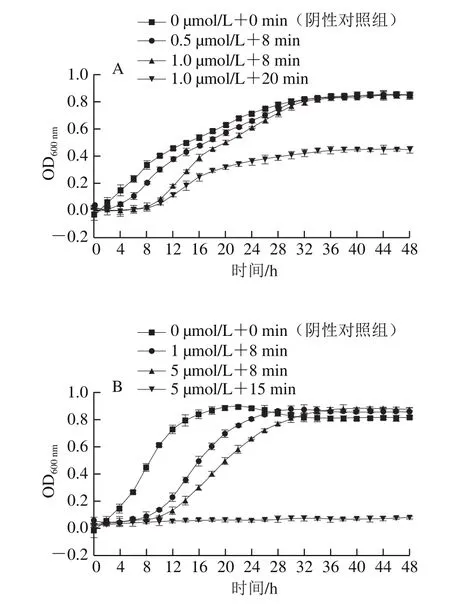
图2 姜黄素介导的PDT处理对副溶血性弧菌(A)与腐败希瓦氏菌(B)再生能力的影响Fig.2 Regrowth evaluation of V.parahaemolyticus (A) and S.putrefaciens (B) treated by curcumin-mediated PDT
为了更加深入探究PDT对副溶血性弧菌与腐败希瓦氏菌的作用机理,通过SEM对细菌的外部形态进行了观察。阴性对照组(L-C-)中的副溶血性弧菌与腐败希瓦氏菌形态饱满、轮廓清晰(图3A1、B1)。经PDT处理后(副溶血性弧菌:0.5 μmol/L+8 min;腐败希瓦氏菌:1 μmol/L+8 min),部分细菌开始发生形变,细胞壁破损,细菌细胞结构开始出现坍塌(图3A2、B2)。进一步提高PDT的处理强度后(副溶血性弧菌:1 μmol/L+20 min;腐败希瓦氏菌:5 μmol/L+15 min),几乎所有的细菌表面都发生了严重的形变,由于细菌细胞内容物流失严重导致整个细菌趋向于扁平态(图3A3、B3)。综上,姜黄素介导的PDT杀灭副溶血性弧菌与腐败希瓦氏菌的根本原因是其能够使细菌细胞壁破损进而导致细菌裂解死亡。

图3 姜黄素介导的PDT处理对副溶血性弧菌(A)与腐败希瓦氏菌(B)细菌形态的影响Fig.3 Effect of curcumin-mediated PDT on cell morphology of V.parahaemolyticus (A) and S.putrefaciens (B)
Deng Xin等[21]研究了亚甲基蓝介导的PDT对副溶血性弧菌的抗菌效果,结果发现,亚甲基蓝在激光照射下,副溶血性弧菌菌落总数最大能降低约5(lg(CFU/mL))。最近,Gong Chen等[13]研究了姜黄素介导的PDT对鲟鱼特定腐败菌(假单胞菌)的杀菌效果,结果发现,在姜黄素30 μmol/L、LED灯功率15 W、照射时间90 s的条件下达到了最强的杀菌效果,假单胞菌的菌落总数大约降低了3(lg(CFU/mL))。本研究发现姜黄素介导的PDT在LED蓝光光源下对副溶血性弧菌(致病菌)与腐败希瓦氏菌(腐败菌)都有着更加显著的杀菌效果(姜黄素浓度分别为3.0 μmol/L与10 μmol/L、光照时间为8 min时,能降低副溶血性弧菌与腐败希瓦氏菌的菌落总数7(lg(CFU/mL))以上),并且这是本课题组首次应用PDT杀灭腐败希瓦氏菌。另外本研究还发现,腐败希瓦氏菌比副溶血性弧菌对姜黄素介导的PDT敏感性更低,这可能与菌株的异质性有关[22]。更重要的是,与有毒的亚甲基蓝相比,姜黄素是一种从植物中分离出来的绿色、无毒的天然活性成分,具有多种药用价值,在许多国家被用作食品添加剂[14]。此外,本研究还发现PDT是最终通过破坏细菌细胞表面结构(细胞壁)以达到杀灭副溶血性弧菌与腐败希瓦氏菌的效果,主要原因是副溶血性弧菌与腐败希瓦氏菌两者均为革兰氏阴性菌,它们的细胞壁由相对不透水的外膜组成,外膜中含有丰富的脂多糖(疏水性),内膜含有磷脂(疏水性)[23],而姜黄素作为一种脂溶性化合物更容易吸附在细胞壁上进而发挥功效[24]。另外,PDT的杀菌效率还与光敏剂的吸收光谱有关[24]。本研究挑选的蓝色LED光源的光谱范围(455~460 nm)正是姜黄素的最大吸收范围,从而让姜黄素发挥出了最大的抗菌功效。因此,姜黄素介导的蓝色LED光动力技术能够破坏副溶血性弧菌与腐败希瓦氏菌的细胞结构,进而导致其死亡。总之,姜黄素介导的PDT有望成为食品工业中有效清除致病菌与腐败菌的一种新途径。
2.2 PDT对副溶血性弧菌与腐败希瓦氏菌的杀菌机制
当特定波长的光照射到微生物表面上时,一部分会被光敏剂吸收,光敏剂被激发到更高的能量状态,在其返回基态的过程中,与邻近的细胞质分子发生碰撞,导致能量转移,随后产生高能量、高反应性分子ROS[24]。ROS通过氧化微生物细胞内的脂质、蛋白质和核酸导致细胞调亡。这些ROS包括单线态氧、羟自由基、超氧阴离子自由基和过氧化氢[24]。在产生的ROS中,单线态氧是最具破坏性的。为了进一步探究PDT灭活副溶血性弧菌与腐败希瓦氏菌过程中所涉及的作用机制,本研究采用DCFH-DA法与ABDA试剂法监测了PDT过程中ROS和单线态氧的产生水平,结果如图4所示。在阴性对照组(L-C-)中均检测到了微弱的ROS荧光信号(DCF荧光发射强度与ROS的产生量成正比)(图4A1、B1),这是由于细菌代谢过程中产生内源ROS的影响。提高姜黄素的浓度(副溶血性弧菌:0.5、0.7、1.0 μmol/L;腐败希瓦氏菌:1、3、5 μmol/L)与延长光照时间(副溶血性弧菌:8、10、20 min;腐败希瓦氏菌:8、10、15 min)时,体系中ROS的水平均显著提升(P<0.05)。单线态氧的产生水平也具有类似的变化趋势。值得注意的是,当保持光敏剂浓度不变,延长光照时间时,单线态氧的水平不再显著增加(图4A2、B2)。出现这种现象的原因可能是随着时间的延长,由于单线态氧不稳定,容易分解或者转换为氧气[10,25]。这些结果间接表明光敏剂浓度与光照时间影响PDT杀菌效率的根本原因是ROS与单线态氧产生水平上的差异。因此,可以推测出姜黄素介导的PDT对副溶血性弧菌与腐败希瓦氏菌的抗菌机制,即在PDT处理过程中,姜黄素分子吸附在疏水性的细胞壁上,在蓝光的照射下产生了大量的ROS,具有强氧化作用的ROS导致细菌发生损伤,随后细胞壁疏松出现破洞,细菌随之裂解死亡。
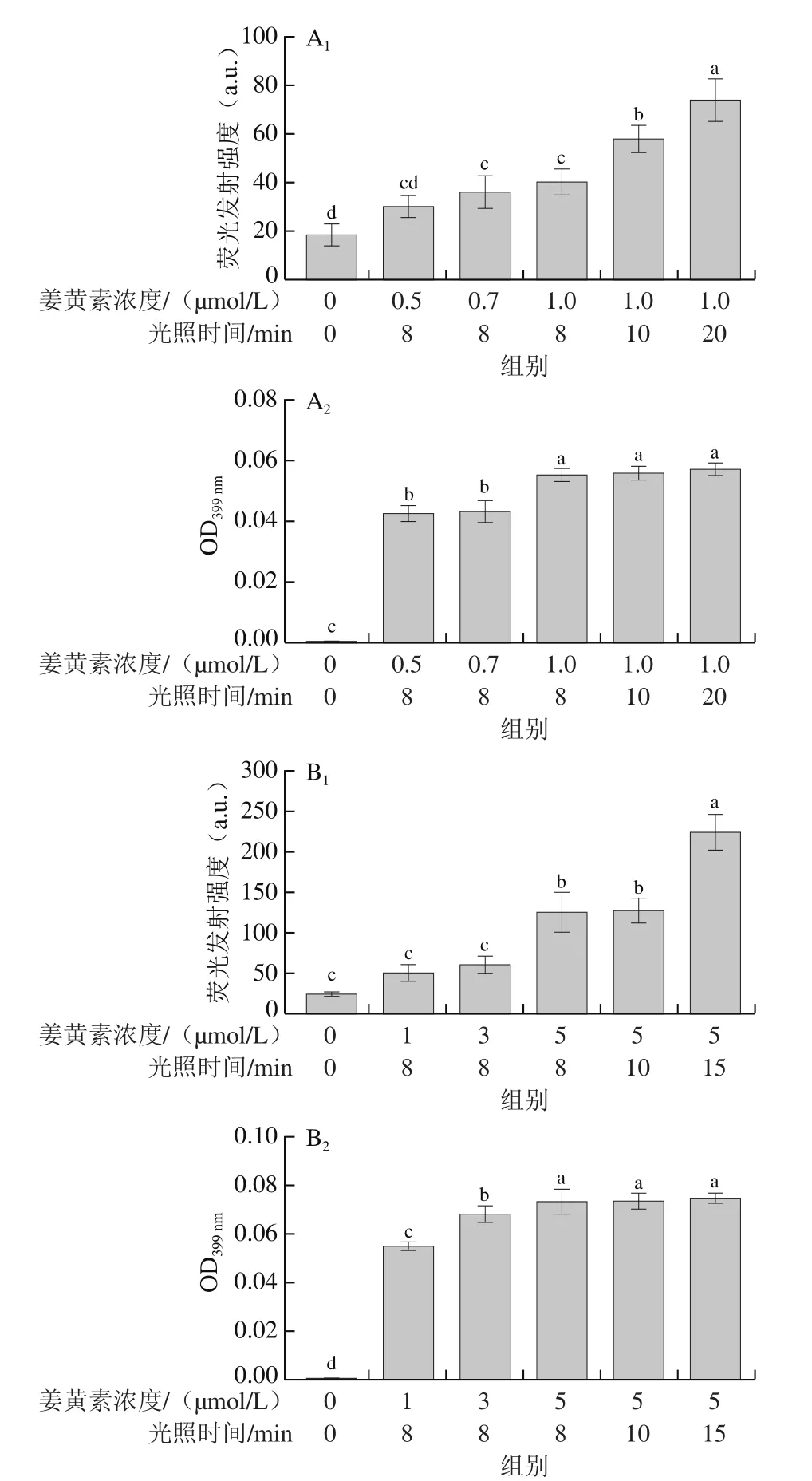
图4 姜黄素介导的PDT在不同处理条件下副溶血性弧菌与腐败希瓦氏菌ROS和单线态氧的产生Fig.4 Production of ROS and singlet oxygen species in V.parahaemolyticus and S.putrefaciens treated by curcumin-mediated PDT under differentt conditions
2.3 PDT分别对副溶血性弧菌与腐败希瓦氏菌生物被膜的清除效果
利用结晶紫染色法监测了副溶血性弧菌与腐败希瓦氏菌生物被膜总生物量随着时间变化的动态形成过程(图5A)。结果表明,副溶血性弧菌(OD600nm=1.81±0.15)与腐败希瓦氏菌(OD600nm=1.99±0.17)生物被膜分别在24 h和18 h后到达成熟期。因此,本研究分别选取该时刻形成的生物被膜来进行后续的PDT实验。
不同浓度姜黄素和不同光照时间对副溶血性弧菌与腐败希瓦氏菌生物被膜的总生物量的影响分别如图5B、C所示。与阴性对照组(L-C-)相比,单独光照(L+C-)或姜黄素(L-C+)处理均不会引起生物被膜的显著变化。当姜黄素浓度为10 μmol/L、光照时间为30 min时,副溶血性弧菌生物被膜总生物量降低了17%;进一步提高姜黄素的浓度到30 μmol/L时,总生物量降低了50%;此外,当姜黄素的浓度为30 μmol/L、光照时间延长至60 min时,生物被膜总生物量下降了70%。PDT处理腐败希瓦氏菌生物被膜也得到了类似的结果,最大清除率约为62%。同时,本研究检测了在PDT处理过程中副溶血性弧菌与腐败希瓦氏菌生物被膜细胞活力的变化。如图5D、E所示,仅光照(L+C-)或姜黄素(L-C+)处理组与阴性对照组(L-C-)相比生物被膜细胞活力并无显著性变化。当姜黄素浓度为10 μmol/L、光照时间为30 min时,副溶血性弧菌生物被膜的细胞活力(OD570nm)出现大幅下降(P<0.05),由对照组的0.523降低至0.285;进一步提高姜黄素的浓度到30 μmol/L,细胞活力下降至0.07;当采用姜黄素浓度为30 μmol/L、光照时间为60 min的组合条件处理时,OD570nm趋近于零。腐败希瓦氏菌生物被膜细胞活力的变化趋势与副溶血性弧菌类似。Araújo等[26]通过荧光光谱法评估了姜黄素介导的蓝色LED光动力技术对耐甲氧西林金黄色葡萄球菌的抗菌功效,结果表明,经过PDT处理后,与对照组相比,菌落总数降低了3.6(lg(CFU/mL));此外,通过荧光光谱图像发现生物被膜数量也明显减少。Quishida等[27]评估了姜黄素介导的PDT对不同生长阶段的念珠菌与链球菌生物被膜的潜在作用。通过结晶紫法和XTT法表征了PDT处理前后念珠菌与链球菌生物被膜的总生物量和细胞活力的变化。结果也同样发现,与对照组相比,PDT处理组的总生物量与细胞活力均出现显著性降低(P<0.05)。这些研究发现进一步证明了姜黄素介导PDT处理不但具有高效的杀菌效果,而且还有良好的抗生物被膜特性。
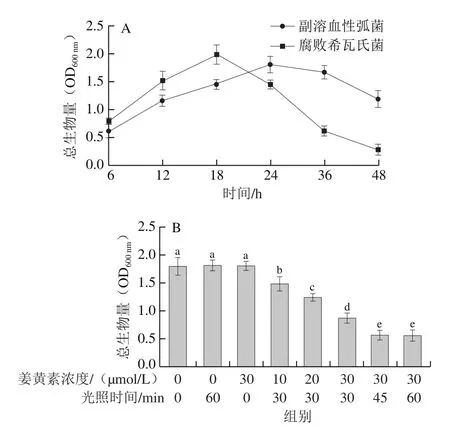
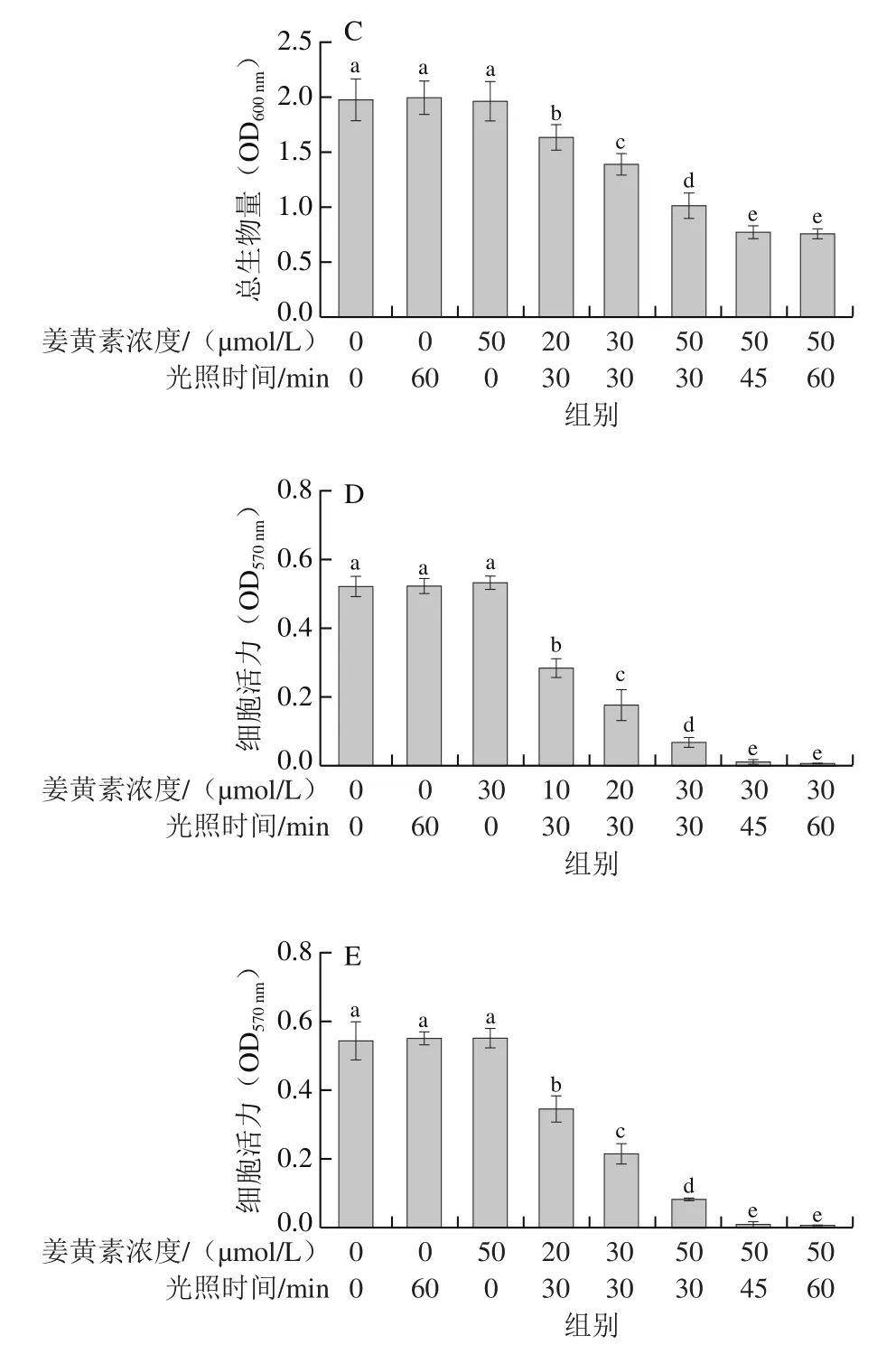
图5 副溶血性弧菌与腐败希瓦氏菌生物被膜随时间的动态形成过程(A)及姜黄素介导的PDT处理对副溶血性弧菌(B、D)与腐败希瓦氏菌(C、E)生物被膜的清除与细胞活力的影响Fig.5 Biofilm formation by V.parahaemolyticus and S.putrefaciens as a function of time (A) and effect of curcumin-mediated PDT on biofilm biomass and cell viability of V.parahaemolyticus (B, D) and S.putrefaciens (C, E)
在此基础上,进一步通过CLSM表征了姜黄素介导的PDT对副溶血性弧菌与腐败希瓦氏菌生物被膜的清除效果,结果如图6所示。阴性对照组的副溶血性弧菌与腐败希瓦氏菌都呈现出紧凑且密集分布的生物结构(图6A1、B1)。然而,当姜黄素浓度分别为10 μmol/L和20 μmol/L、光照时间为30 min时,副溶血性弧菌与腐败希瓦氏菌都呈现出稀疏和不均匀的分散结构(图6A2、B2)。当姜黄素的浓度分别提高到30 μmol/L和50 μmol/L、光照时间为60 min时,与对照组相比,两种细菌的生物被膜都变得极其稀疏、松散(图6A3、A4、B3、B4)。

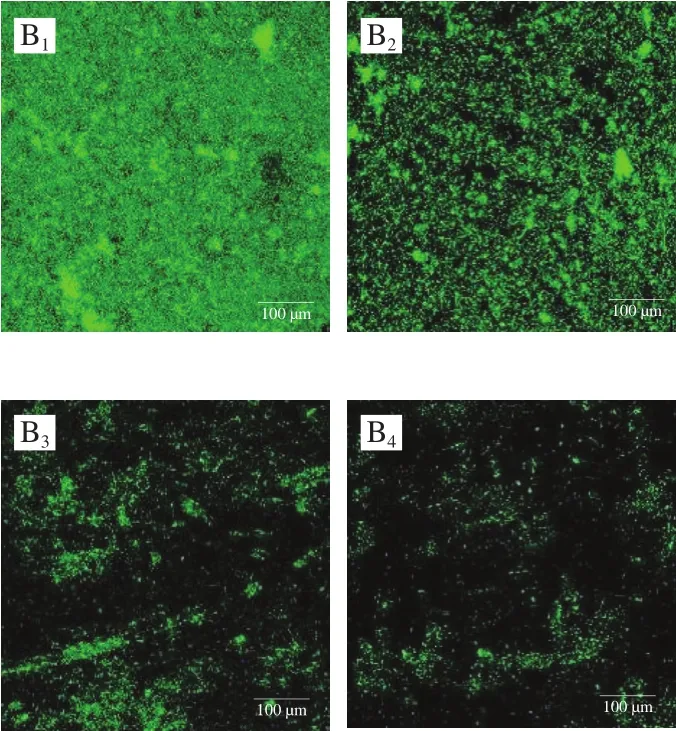
图6 姜黄素介导的PDT在不同处理条件下副溶血性弧菌(A)与腐败希瓦氏菌(B)的CLSM图像Fig.6 Confocal laser scanning microscope images of V.parahaemolyticus (A)and S.putrefaciens (B) after curcumin-mediated PDT treatment under different conditions
生物被膜的定量图像分析结果显示,在经过姜黄素浓度为30 μmol/L(腐败希瓦氏菌为50 μmol/L),经光照60 min处理后(以下分析均为该条件),副溶血性弧菌与腐败希瓦氏菌生物被膜的生物体积分别显著下降至3.2×104μm3和9.0×104μm3(表1),与对照组相比分别大约下降了93%与85%。孔隙度反映了生物被膜之间的致密程度,孔隙度越小,代表生物被膜越致密[28-29]。如表1所示,经过PDT处理后,副溶血性弧菌生物被膜的孔隙度从0.79上升到0.98(P<0.05),腐败希瓦氏菌生物被膜的孔隙度从0.74上升到0.98(P<0.05)。同质性通常用于衡量细胞簇的相似性,同质性越高,表明簇结构越均匀。一般来说,同质性的大小随着细胞簇数量的减少而增加[28-29]。经过PDT处理的副溶血性弧菌与腐败希瓦氏菌生物被膜的同质性均大幅增加(P<0.05)。因此可以得出结论,姜黄素介导的PDT能有效根除生物被膜中副溶血性弧菌与腐败希瓦氏菌的细胞。同时,作为生物被膜图像尺度随机性度量的质构熵的分析结果也印证了表1中同质性的结果。PDT处理后副溶血性弧菌的质构熵由3.50降低至1.73(P<0.05),腐败希瓦氏菌的质构熵由3.53降低至1.74(P<0.05)。质构熵越高,生物膜图像的异质性就越大[28]。这意味着质构熵的降低将有助于异质性的降低。粗糙度提供了生物被膜厚度变化的度量,是反映生物被膜表面异质性的指标[30]。在本研究中,随着姜黄素浓度的增加和光照时间的延长,生物被膜粗糙度显著增加(P<0.05),这与同质性的变化趋势一致。可以推断,生物被膜粗糙度的增加将极大地促进姜黄素附着在生物被膜表面,这可能有助于增强PDT的杀菌能力。综上,姜黄素介导的蓝色LED光动力技术对副溶血性弧菌与腐败希瓦氏菌生物被膜的清除具有同样的高效性。
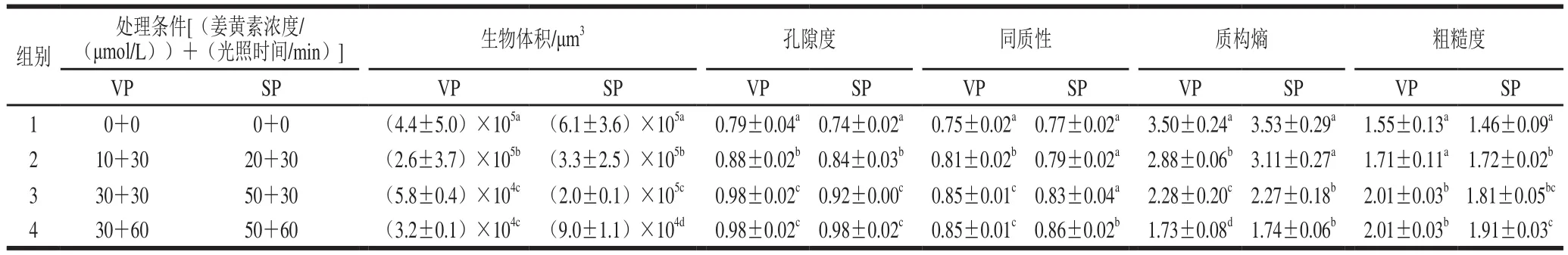
表1 姜黄素介导的PDT在不同处理条件下副溶血性弧菌与腐败希瓦氏菌生物被膜结构参数的变化Table 1 Changes in biofilm structure parameters of V.parahaemolyticus and S.putrefaciens after curcumin-mediated PDT treatments
3 结 论
本研究表明,姜黄素介导的PDT能有效杀灭副溶血性弧菌与腐败希瓦氏菌并清除其成熟的生物被膜。PDT杀菌过程中ROS和单线态氧的产生水平与SEM的结果表明,姜黄素介导的PDT杀菌机制是通过产生大量具有强氧化作用的ROS作用于细菌,并最终导致细菌细胞壁破损进而裂解死亡。此外,本研究还进一步探究了姜黄素介导的PDT的抗生物被膜效果。在宏观层面上通过结晶紫法定量生物被膜,通过MTT法检测细胞活力;在微观层面上通过CLSM观察生物被膜并对其图像的结构参数进行分析,包括生物体积、孔隙率、同质性、质构熵和粗糙度。结果表明,姜黄素介导的PDT对生物被膜同样具有良好的清除效果。综上,姜黄素介导的PDT可有效地控制有害微生物及其生物被膜的形成,从而大大降低食品安全风险。
