“厚味”γ-谷氨酰-缬氨酸增味作用差异性机制
2022-03-03麦锐杰曾晓房白卫东
郭 晶,麦锐杰,董 浩,2,3,4,曾晓房,2,3,4,白卫东,2,3,4,杨 娟,2,3,4,*
(1.仲恺农业工程学院轻工食品学院,广东 广州 510225;2.仲恺农业工程学院 广东省岭南特色食品科学与技术重点实验室,广东 广州 510225;3.仲恺农业工程学院现代农业研究院,广东 广州 510225;4.农业农村部岭南特色食品绿色加工与智能制造重点实验室,广东 广州 510225)
味觉增强剂通常是指那些本身无味但能增强基本味感的物质,这些物质在食品行业越来越受到关注,因为它们往往具有某些特殊属性,例如,无热量甜味增强剂能够取代部分糖用于食品和饮料中,以供如患有肥胖和糖尿病等有健康问题的人群选用[1-2],增咸剂代替部分钠盐的使用可以降低患心血管疾病的风险,同时还能保持食品的口感[3]。因此,健康、天然的味觉增强剂具有重要的保健养生价值和商业价值。
γ-谷氨酰-缬氨酸(γ-Glu-Val)是一种N端含有γ-谷氨酰残基的小分子二肽,广泛存在于菜豆、奶酪、酵母提取物、发酵馒头等食物中[4]。γ-Glu-Val在水溶液中呈现涩味,阈值为3 300 μmol/L[5]。将γ-Glu-Val添加至酱油、鸡汤中可赋予食物厚味味感,其阈值分别为550 μmol/L和400 μmol/L[6],其厚味强度是还原型谷胱甘肽的0.61 倍[7]。γ-Glu-Val可通过谷氨酰胺酶或者谷氨酰转肽酶酶法合成,其产率达到31.7%[6],是一种能够商业化生产的呈味基料。事实上,几乎所有具有厚味呈味特性的γ-谷氨酰肽均具有多变的呈味特性,即它们在水溶液中主要呈涩味[5,8-10],少部分在水溶液中还具有基本呈味特性,如γ-Glu-Glu具有鲜味[11],γ-Glu-Tyr和γ-Glu-Phe具有轻微的酸味[10],γ-Glu-Tyr、γ-Glu-γ-Glu-Tyr、γ-Glu-γ-Glu-γ-Glu-Tyr具有苦味[12];这类肽最主要的特征是可赋予食物浓厚感、满口味、丰富度和持续性等厚味味感[5-6,8-9,11-18];此外,“厚味”γ-谷氨酰肽还可以增强基本呈味物质的呈味强度[9,12,19],如增强食盐的咸度、蔗糖的甜度、味精和鸡汤的鲜度[4,6-7,12,18-20]。而目前对于γ-谷氨酰肽增味作用的关注较少,尤其是机制方面,少量的研究主要集中于其增鲜作用方面[6,12,16,18,20]。
G蛋白偶联受体家族中异源二聚体T1R1-T1R3和T1R2-T1R3[21]是鲜味和甜味的味觉感受器受体,它们除了可以感知鲜味、甜味物质外,也可以感知增鲜、增甜物质,如核苷酸和鲜味肽通过与T1R1-T1R3受体相互作用,表现出鲜味增强作用[22-26];本身无味的小分子增甜剂因能够正向变构调节T1R2-T1R3而被证实具有增甜作用,在食品和饮料中能够取代蔗糖的使用,降低产品中的热量[1-2];此外,有学者通过研究γ-谷氨酰肽与T1R3的相互作用,验证了其增鲜作用[19]。分子对接模拟技术主要用于识别小分子与蛋白受体结合的正确构象和估计蛋白质-配体相互作用的强度,目前已广泛用于分析呈味物质与味觉受体间的相互作用[19,22-24,26]。因此,本实验将通过分子模拟技术和感官实验对γ-谷氨酰肽(以γ-Glu-Val为例)的增味作用机制进行研究,并对γ-Glu-Val的增味作用,尤其是增甜和增鲜作用进行感官验证,同时通过分子模拟实验比较γ-Glu-Val增味作用差异性,以期为进一步验证其呈味机理提供理论支撑,并为此类小肽增味作用的机理研究提供新的思路。
1 材料与方法
1.1 材料与试剂
γ-Glu-Val购于南京肽生物技术有限公司。NaCl、味精和蔗糖均购自广州当地超市。
1.2 仪器与设备
FA2204B型电子天平 上海精密科学仪器有限公司;PHS-3C pH计 上海雷磁创益仪器仪表有限公司。
1.3 方法
1.3.1γ-Glu-Val增味作用的感官分析
参照Oshu等[7]的方法,将2 mmol/Lγ-Glu-Val添加到适当酱油(体积分数1%)或者鸡汤粉(质量分数1%)溶液(pH(6.50±0.05))中,得到相应的混合溶液,对比并记录添加γ-Glu-Val前后溶液所具有的咸味、甜味和鲜味呈味得分,以评价它对基本呈味物质的味觉增强作用)。实验通过五分制评分法进行评分,0 分表示被检测的样品没有味道,5 分则表示样品具有显著的味道。选择11 名经过专业培训的感官评价人员(男、女分别6 名和5 名,年龄在21~32 岁之间),在专业的感官评价室进行呈味评价,室内温度为(23±2)℃。品评员需品尝的样品量为10 mL,样品在口中停留25 s后缓慢吞咽。记录基本味觉评分。
1.3.2 同源建模
利用同源建模软件Modeller 9.20构建T1R1、T1R2和T1R3的三维结构,模板选用1EWK的A链。受体分子从PDB数据库(http://www.rcsb.org/pdb/home/home.do)下载。配体包括谷氨酸、蔗糖和γ-Glu-Val,通过ChemBioOfficer 2010软件画出配体的结构式。
同源建模:在建模过程中,氨基酸序列的叠合利用Modeller 9.20软件自带的align2d script程序进行,T1R1、T1R2和T1R3三维结构的同源构建利用Modeller 9.20软件自带的model-single script程序进行。最后综合利用GA341 score(值越大越好)、molpdf score(值越小越好)、DOPE score(值越负越好)3 个指标选取最优的同源建模结果。
1.3.3 分子对接
为了评价γ-Glu-Val的增味作用机理,首先需要将同源建模得到的受体蛋白结构与1EWK的A链蛋白利用Pymol软件进行分子叠合,得到T1R1-谷氨酸钠(monosodium glautamate,MSG)、T1R2-蔗糖、T1R3-MSG复合物蛋白结构,以此复合蛋白为分子对接受体,在进行分子对接前进行加氢原子和加AMBER7 FF99电荷处理。配体γ-Glu-Val同样需要进行结构优化与加电荷处理。利用Sybyl x-2.1软件进行加氢原子加和Gasteiger-Huckel电荷,利用Sybyl x-2.1软件的Powell能量最小化法进行结构优化,采用的优化最大步长为1 000 步,能量梯度为0.021 kJ/(mol·Å)。此后采用Sybyl x-2.1软件的Surflex分子对接模块进行配体-受体的分子对接,记录对接得分和参与的氨基酸残基情况。
1.3.4 分子动力学模拟
将分子对接得到的3 个复合物的构象作为分子动力学模拟的起始构象,并将3 个动力学模拟体系分别命名为T1R1-Peptideγ-Glu-Val、T1R2-Peptideγ-Glu-Val和T1R3-Peptideγ-Glu-Val。
动力学模拟参数设置:将以上3 个体系分别置于由TIP3P水分子组成的立方体水盒子中心。以标准的AMBER03(ff03)力场和常用的小分子AMBER(gaff)力场分别作用于受体蛋白T1R3和γ-Glu-Val。由于在gaff力场中缺乏γ-Glu-Val的电荷参数,所以先用Gaussian 03软件的HF/6-31G*方法进行结构优化和计算静电势,然后利用Amber 12软件中的Antechamber程序,应用Restrained Electrostatic Potential(RESP)静电势收敛方法计算γ-Glu-Val的静电荷,最后利用Antechamber程序整合所有γ-Glu-Val所需的力场参数。
优化之后采用逐步升温法进行升温,即整个体系要从0 K升到310 K(生理环境的温度),分7 次完成,每次60 ps。最后对每个体系进行10 ns恒温310 K的分子动力学模拟,采用的步长为2.0 fs。在模拟过程中,SHAKE和Particle mesh Ewald算法分别用来处理所有含氢化学键的运动和长程静电相互作用。在构象采样过程中,轨迹每隔1 ps进行保存,可用于后期MM/GBSA法计算结合自由能和分解自由能。T1R-Peptide的结合自由能按公式(1)~(3)计算。
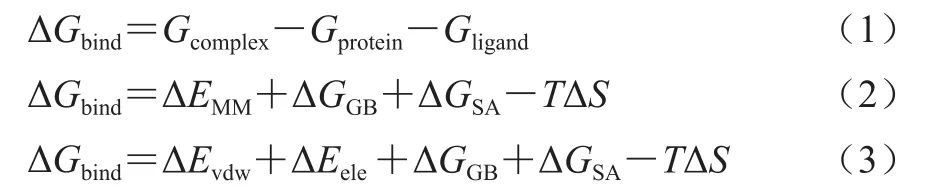
式中:Gcomplex为复合物自由能/(kJ/mol);Gprotein为蛋白自由能/(kJ/mol);Gligand为配体自由能/(kJ/mol);ΔEMM表示蛋白与配体的气相(即真空下)相互作用能/(kJ/mol),它包含范德华力能ΔEvdw/(kJ/mol)和静电相互作用能ΔEele/(kJ/mol);ΔGGB和ΔGSA分别表示极性溶剂效应能/(kJ/mol)和非极性溶剂效应能/(kJ/mol);-TΔS表示在T温度下的构型熵/(kJ/mol)。在ΔGbind计算过程中,溶剂和溶质的介电常数分别设置为80和4,计算所需的构象来源于6~10 ns平均抽样得到的200 帧。考虑到构型熵的计算耗费机时过长且不会影响氨基酸的贡献差异,本项目将不计算TΔS。MM/GBSA自由能分解分析用来计算蛋白的每个残基与配体的相互作用,采用Amber 12软件中的mm_pbsa.pl模块进行。
1.4 数据处理与分析
每个实验重复3 次平行,数据取以平均值±标准差表示,采用Excel软件作图。
2 结果与分析
2.1 γ-Glu-Val的增味作用
γ-Glu-Val已经被证实具有多变的呈味特性[5-7]。为了进一步证实它对于基本味感的增强作用,将适量γ-Glu-Val分别添加到酱油或者鸡汤中,评价溶液基本味感(甜、鲜、咸和酸)和厚味味感的增强作用。如图1所示,γ-Glu-Val的添加可以增强酱油和鸡汤的厚味味感和基本味感(甜、鲜、咸和酸);其中,对于厚味味感的增强效果最为明显,其次是鲜味和咸味。γ-Glu-Val对于酸味也有轻微的增强效果,可能是由于γ-Glu-Val本身含有羧酸基团。对于鲜味和咸味的增强效果明显强于甜味,这与文献[4,6,13]的报道吻合。Yang Juan等[19]的研究表明存在MSG时,γ-谷氨酰肽可以通过与T1R3的交互作用增强鲜味。目前鲜见对于增味作用的差异性机制研究。
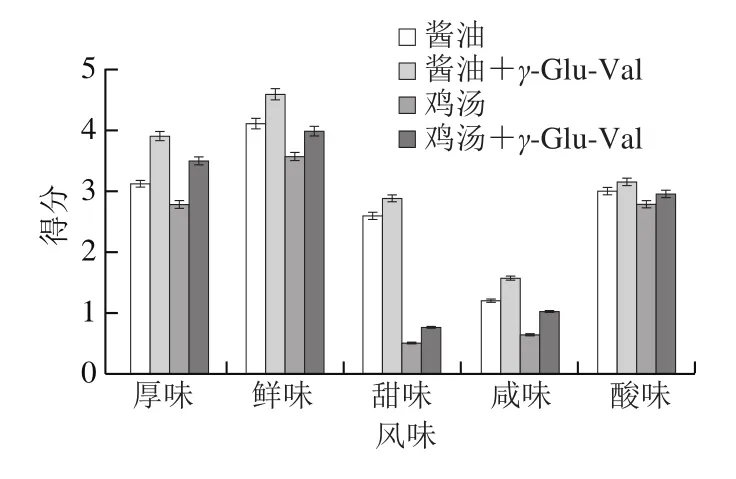
图1 γ-Glu-Val对食品(鸡汤和酱油)风味的增强作用Fig.1 Taste enhancement of foods (chicken broth and soy sauce)by γ-Glu-Val
2.2 γ-Glu-Val的增味作用机理
2.2.1 同源建模分析结果
如图2所示,在T1R1-MSG复合受体中,MSG中的α-羧酸基团与T1R1中Ser-300的羰基基团、Arg-277和Thr-149的—NH基团相互作用;MSG中的—NH基团与Ala-170和Asp-147的羰基基团相互作用;MSG中的γ-羧酸基团与Ala-170的羰基基团相互作用。其中,Asp-147、Thr-149和Arg-277也存在于谷氨酸与T1R1之间的结合位点[22],以及MSG和IMP与T1R1之间的结合位点[21]。在T1R2-蔗糖复合受体中,T1R2的活性中心及附近有6 个关键氨基酸残基(Ser-40、Asp-142、Ser-144、Ser-165、Asp-278和Ser-303)参与受体与蔗糖的交互作用。其中Ser-40、Asp-142、Ser-144、Ser-165和Asp-278也存在于阿斯巴甜与T1R2之间的结合位点[27]。在T1R3-MSG复合受体中,MSG的α-羧酸基团与Gly-168和Asp-190的羰基基团、Ser-170的—NH基团相互作用;MSG的—NH基团与Glu-301的羰基基团相互作用。其中Glu-301和Gly-168被报道分别为茶氨酸与T1R3之间的结合位点[28]、谷氨酸与T1R3之间的结合位点[29]。
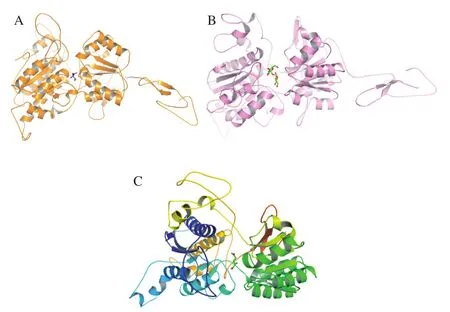
图2 复合受体构象及其氨基酸残基位置Fig.2 Conformations and amino acid locations of taste receptor complexes
2.2.2 分子对接分析结果
采用Sybyl x-2.1软件中Surflex分子对接程序测定γ-Glu-Val与不同受体复合物的亲和力大小,用于评价γ-Glu-Val的味觉增强作用。对接分数越高,说明其与受体的亲和力越高。如表1所示,γ-Glu-Val与3 个受体复合物(T1R1-MSG、T1R3-MSG和T1R2-蔗糖)对接得分分别为8.180 1、6.354 8 分和4.539 7 分,表明γ-Glu-Val对T1R1的亲和力最高,对T1R2的亲和力最低,其中T1R1-T1R3、T1R2-T1R3分别是鲜味和甜味的味觉受体蛋白,此结果也暗示了γ-Glu-Val对鲜味受体的亲和力强于对甜味受体的亲和力。
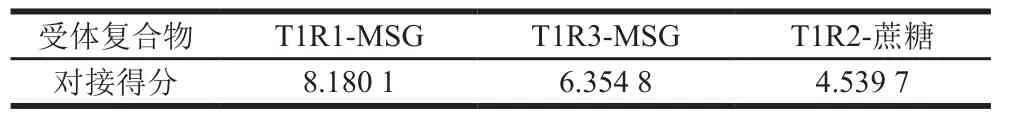
表1 γ-Glu-Val与受体复合物对接得分Table 1 Scores for molecular docking of γ-Glu-Val with receptor complexes
如表2所示,γ-Glu-Val分别调动了3 个受体中的17、7 个和11 个氨基酸残基参与小肽与受体复合物的交互作用,调动的氨基酸数量与文献报道的类似小肽对味觉受体的调动效果[22,26,30-31]基本吻合。由表2可知,仍然是T1R1中被调动的氨基酸残基数更多,显示出小肽与此受体的超强结合力,此结果也暗示γ-Glu-Val对T1R1的亲和力最强。此外,γ-Glu-Val与复合受体中的呈味物质(MSG和蔗糖)有较强的交互作用,表明呈味物质与增味剂在呈味受体活性中心可能存在一定的相互作用。
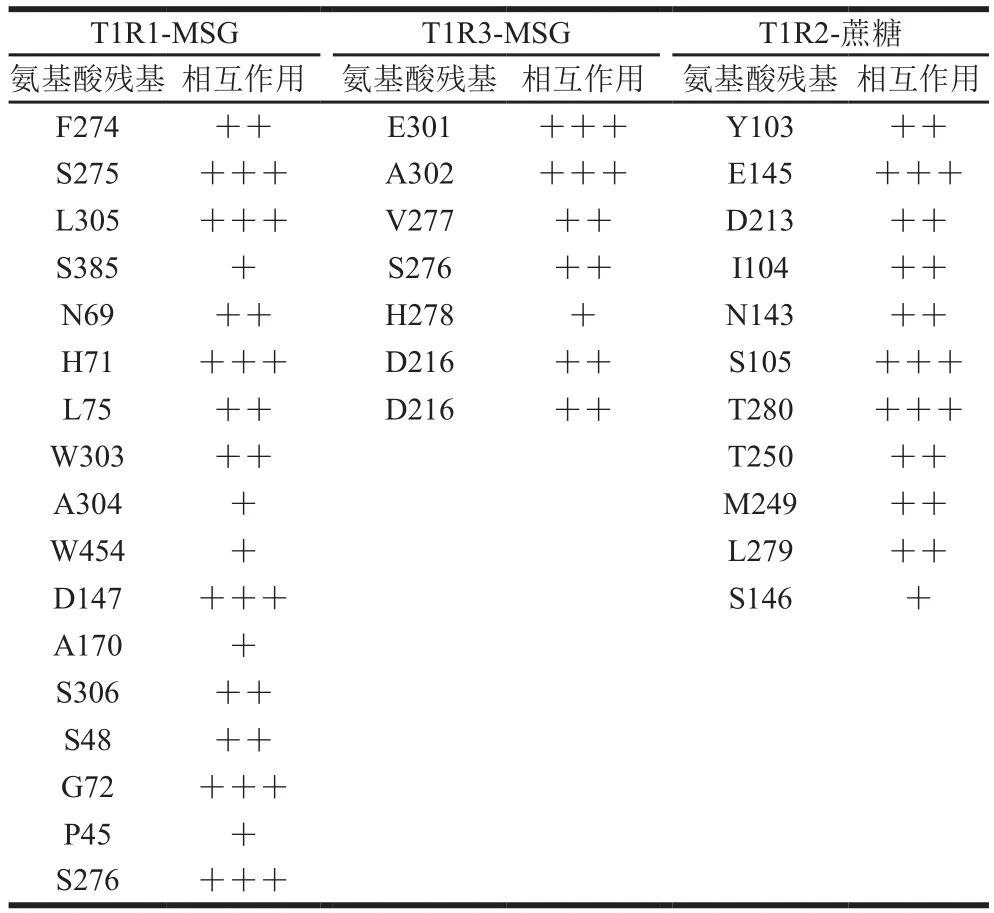
表2 γ-Glu-Val与受体复合物中发生交互作用的氨基酸残基Table 2 Interaction of γ-Glu-Val with amino acid residues in taste receptor complexes
2.2.3 分子模拟分析结果
通过MM/GBSA计算了T1Rx-Peptide间的结合自由能,结果见表3,其中T1R1-Peptideγ-Glu-Val、T1R3-Peptideγ-Glu-Val、T1R2-Peptideγ-Glu-Val3 个配体-受体间总的结合自由能分别为(-165.807 5±10.255 7)、( -118.505 7± 10.716 2) kJ/mol和(-93.557 1±12.013 8)kJ/mol。可以看出,T1R1-Peptideγ-Glu-Val间相互作用力最强,T1R2-Peptideγ-Glu-Val间相互作用力最弱。这3 个体系总的结合自由能中主要贡献来自于范德华力能(ΔEvdw)。虽然各个体系中静电作用力能ΔEele也较大,但极性溶剂效应能ΔGGB几乎完全抵消了静电吸引作用力,即在考虑溶剂效应的情况下,总的静电作用(ΔEele+ΔGGB)对于T1Rx-Peptide间相互作用贡献较小。总的来说,γ-Glu-Val对T1R1的亲和力最强,暗示其对鲜味的增强作用最强。
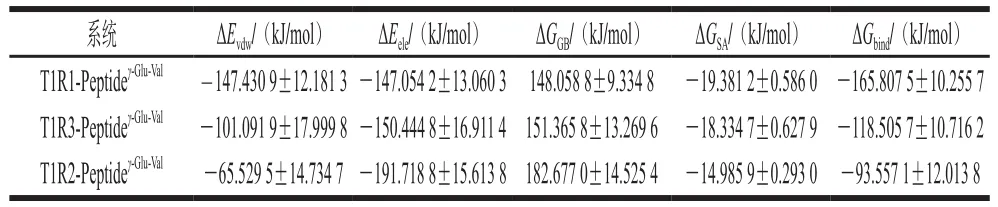
表3 通过MM/GBSA计算结合自由能Table 3 Binding free energy calculated from MM/GBSA
鉴于γ-Glu-Val对T1R1的亲和力最强,为了进一步评价γ-Glu-Val的增味作用差异性,同时揭示γ-Glu-Val与受体进行动力学模拟的过程中是否发生明显的构象变化,计算了受体蛋白T1R1主链原子的均方根偏差(root mean square deviation,RMSD),如图3所示,受体蛋白在6 ns内的时间就很快达到了动态平衡,且RMSD的平均值只有3.0 Å左右,表明受体蛋白T1R1的主链原子位移偏移很小,也说明T1R1-Peptide体系很快达到了动态平衡状态。此外,从图3中可以看出,6 ns后T1R1-Peptide体系处于动态平衡状态,因此在最后4 ns平稳的运动轨迹构象进行MM/GBSA结合自由能计算和自由能分解计算是合理的。
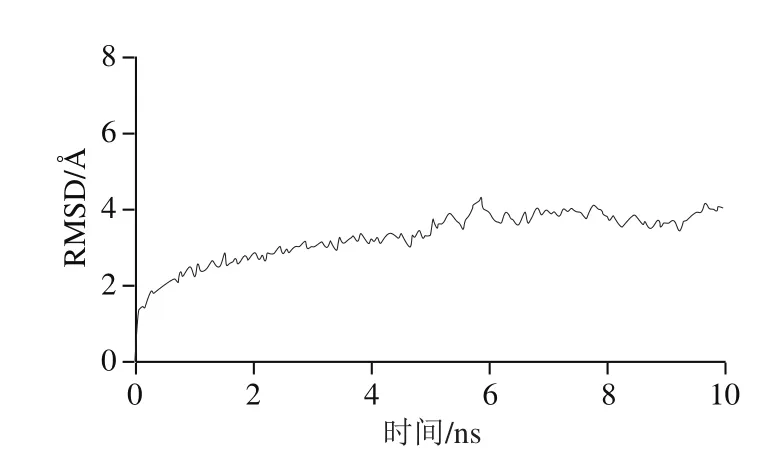
图3 在10 ns的动力学模拟过程中主链原子的均方根偏差Fig.3 Root mean square deviation of backbone atoms during 10 ns kinetic simulation
如图4所示,T1R1-Peptideγ-Glu-Val体系中,T1R1中有6 个氨基酸残基参与了和γ-Glu-Val的交互作用,它们分别为Phe-274、Ser-275、Ser-300、Trp-303、Ala-147、Ala-170。其中γ-Glu-Val与Ser-300侧链羟基、Trp-303侧链吲哚环上的氨基、Ala-147主链羰基形成了5 条氢键。同时γ-Glu-Val与Phe-274、Trp-303和Ala-147间也通过疏水作用相互交联。如图5所示,参与交互作用的各个氨基酸残基,如Phe-274、Ser-275、Ser-300、Trp-303、Ala-170也参与自由能的形成,说明它们对于γ-Glu-Val与受体T1R1的相互作用具有至关重要的作用。
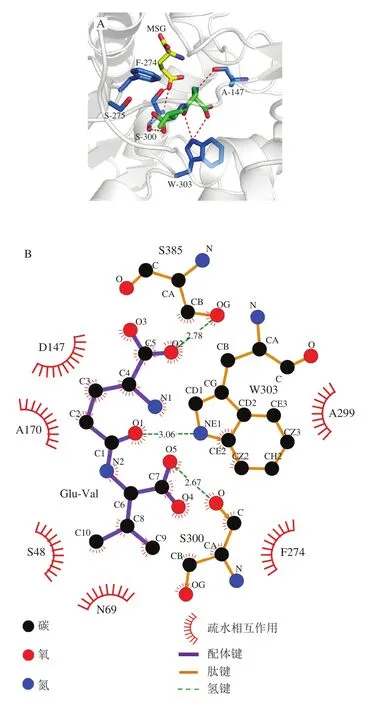
图4 γ-Glu-Val-T1R1-MSG之间结合位点的结构表示(A)和γ-Glu-Val-T1R1-MSG晶体结构的LIGPLOT轮廓(B)Fig.4 Structural representations of binding sites between γ-Glu-Val-T1R1-MSG (A) and LIGPLOT profile of the crystal structure of γ-Glu-Val-T1R1-MSG (B)
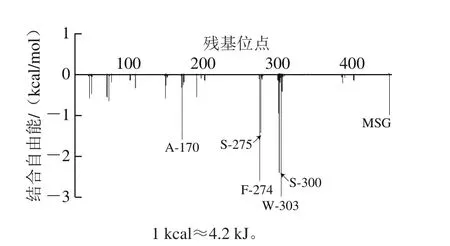
图5 参与自由能形成的γ-Glu-Val-T1R1-MSG的主要氨基酸残基的分解Fig.5 Major amino acid residues involved in binding free energy decomposition of γ-Glu-Val-T1R1-MSG
3 结 论
γ-Glu-Val具有多变的呈味特性,可以通过生物酶制剂大量制备,因此是一种具有潜在商业价值的增味剂。本研究采用感官实验结合分子模拟技术,针对其增味作用差异性进行探究。首先通过感官实验验证了γ-Glu-Val的增味作用,结果显示此小肽具有增强味精和酱油厚味和基本味感的作用,其中对于鲜味和咸味的增强效果明显强于甜味。利用同源建模软件Modeller 9.20分别构建得到T1R1-MSG、T1R2-蔗糖和T1R3-MSG 3 种受体复合物构象,模拟基本呈味物质和γ-Glu-Val同时作用于受体的生理环境。γ-Glu-Val对3 个味觉受体的亲和力大小(对接得分)分别是:T1R1-MSG对接得分8.180 1 分、T1R3-MSG对接得分6.354 8 分、T1R2-蔗糖对接得分4.539 7 分,说明此γ-Glu-Val对于鲜味受体的亲和力明显强于对甜味受体的亲和力。计算得到γ-Glu-Val与T1R1间相互作用力最强。T1R1中有6 个氨基酸残基参与了和γ-Glu-Val的交互作用,它们分别为Phe-274、Ser-275、Ser-300、Trp-303、Ala-147、Ala-170。分子对接验证结果与感官评定结果相符合,表明γ-Glu-Val对于鲜味的增强效果优于对于甜味的增强效果,其原因可能在于γ-Glu-Val与鲜味受体结合更为紧密,能调动更多受体的活性位点参与两者的交互作用。研究结果为此类小肽的增味作用机理性研究提供了新的思路。
