磺胺间甲氧嘧啶对蛋鸡粪便菌群结构的影响
2022-03-03王静鸽吉小凤丁保安
王静鸽,吉小凤,吴 静,杨 华,唐 标,*,丁保安
(1.青海大学 农牧学院,青海 西宁 810016;2.浙江省农业科学院 农产品质量安全与营养研究所,浙江 杭州 310021;3.浙江省农业科学院 农产品质量安全危害因子与风险防控国家重点实验室,浙江 杭州 310021)
自2020年7月起,我国全面禁止向饲料中添加抗生素。在此之前,我国每年有数万吨的抗生素在畜禽养殖中被当作动物促生长剂使用。畜禽使用抗生素后,30%~90%的药物会连同这些抗生素的初级代谢物一起随粪、尿被排出动物体外。同时,在抗生素的选择压力下,细菌的耐药性日益增强,导致动物疾病的预防和治疗难度大幅提高,且严重影响食品安全和公共卫生安全。目前,抗生素在畜禽养殖过程中的不合理使用已成为环境中抗生素污染的重要来源之一。
抗生素在畜禽饲养过程中的滥用,可破坏动物肠道菌群平衡,并导致机体耐药性上升。王亚楠采集多省家禽市场的新鲜鸡粪样品进行高通量测序,发现鸡肠道微生物中90.7%以上是细菌,其中抗生素抗性基因(ARGs)分布广泛,共检测到235种耐药基因型,且多黏菌素耐药基因-1检出率高达54.62%。这一结果与抗生素在家禽养殖中的滥用,以及家禽体内的代谢机制密切相关。
磺胺类药物(SAs)具有广谱、高效、低成本等特点,已成为继四环素类药物之后欧盟最常用的兽用抗生素,常作为饲料添加剂用于预防和治疗动物胃肠道疾病和呼吸道疾病。SAs的分子结构中含有1个苯环、1个甲氧嘧啶磺酰胺基和1个对位氨基,在肉鸡和蛋鸡饲养中多通过口服方式给药,是养殖废水中最常见的抗生素之一。磺胺间甲氧嘧啶(SMM)是SAs中抗菌作用最强的药物之一。研究表明,黄羽肉鸡连续饲喂SMM(每1 kg饲料中添加50 mg)7 d,停药30 d之后,体内仍有药物残留。食用这些有SAs残留的动物食品,可致人体发生过敏反应,且具有致癌风险。Willmann等报道,病人使用SAs进行治疗后,肠道微生物中与SAs有关的ARGs的相对丰度增加148.1%,且携带ARGs质粒的丰度也显著增加,说明SAs可促进细菌耐药性的传播。目前,关于畜禽饲用SMM的研究多集中在药动学和药物残留等方面,关于其对畜禽肠道菌群影响的研究尚不充足。为此,本试验在蛋鸡饮用水中添加SMM,探究蛋鸡粪便样品中细菌群落结构的变化,以期揭示养殖过程中饲用SMM对蛋鸡肠道菌群的影响。
1 材料与方法
1.1 试验样品与试验设计
在杭州市余杭区某养殖场选取遗传背景相近、日龄相同(32周)、体型均一(1.4~1.6 kg)的健康海兰褐蛋鸡260只,随机将其分为2组,每组130只(13个重复,每个重复10只鸡)。A1组(对照组),饮用水中不添加SMM;B1组(用药组),饮用水中添加SMM(配制浓度为530 mg·L)。所有蛋鸡在试验期间自由采食饮水,饲喂5 d后每组每个重复随机抽取一只蛋鸡作为样本,使用无菌棉签在蛋鸡泄殖腔采集新鲜粪便样品。样品采集后,B1组的饮用水中停止添加SMM,重新编号为B2组;A1组重新编号为A2组,作为B2组的对照组。两组继续饲养7 d后,从每组每个重复中随机挑选一只蛋鸡采集新鲜粪便。每次采集完新鲜粪便样品后,在干冰保护下将粪便样品带回实验室,并置于-80 ℃冰箱保存。
1.2 试验方法
1.2.1 基因组总DNA提取
每份粪便样品称取180~220 mg,使用DNA提取试剂盒(QIAampFast DNA Stool Mini Kit),按照说明书中的操作方法提取样品基因组DNA,利用1%琼脂糖凝胶电泳检测所提DNA的完整性,使用Nano Drop 2000分光光度计(美国Thermo)检测所提DNA的浓度与纯度。
1.2.2 16S rDNA扩增与Illumina MiSeq测序
采用通用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对16S rDNA的V3~V4区进行扩增。PCR程序:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,循环40次;72 ℃延伸5 min。用2%琼脂糖凝胶电泳检测扩增产物,对符合要求的PCR产物进行回收纯化。回收产物采用建库试剂盒(TruSeqDNA Sample Prep Kit)进行文库构建,利用Illumina Mi-Seq平台(上海美吉生物医药科技有限公司)测序。
1.2.3 高通量测序数据分析
对测序得到的原始数据进行质量评估,开展质控,并过滤区分样本,利用Mothur软件计算样品的操作分类单元(OTU)。使用美吉生物云线上平台(www.majorbio.com)对测序结果进行多样性分析、菌群结构分析和组间差异分析。
2 结果与分析
2.1 高通量测序数据统计
对采集的52份粪便样品16S rDNA的V3~V4区进行高通量测序,结果显示,共获得有效序列1 952 306条,有效碱基数862 404 860 bp,单序列平均长度为441.75 bp。对粪便样本中的菌群进行分类统计,结果共涉及22门75目,共1 726个OTU。
用OTU数量代表样品中物种的丰度,由样品OTU韦恩图(图1)可知,A1、B1、A2、B2组OTU的数量分别为1 419、1 463、1 327、1 401,各组独有的OTU数分别为85、55、5和17。A1组与B1组共有和独有(即仅被A1组和B1组共同占有,以下依次类推)的OTU数分别是1 220和105;B1与B2组、A2与B2组、A1与A2组共有的OTU数分别是1 239、1 247、1 128,独有的OTU数分别是36、42和11。
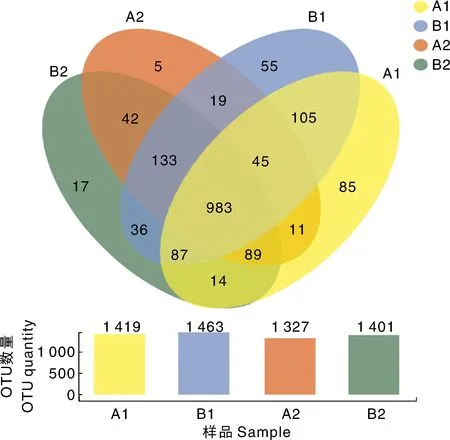
图1 样品OTU韦恩图
2.2 多样性指数分析
在OTU水平进行α多样性指数分析(表1),所有样本的coverage指数均大于0.99,说明测序结果可信。B1组样品的Ace指数低于A1组和B2组,而B2组样品的Ace指数与A2组相近,说明SMM的使用降低了蛋鸡粪便样品中的菌群物种总数,但停止用药后,蛋鸡粪便中的菌群物种总数明显增加,且基本恢复至对照水平。Simpson指数与菌群的多样性负相关,B1组的Simpson指数高于A1组和B2组,说明SMM的使用降低了蛋鸡粪便样品中的菌群多样性,停止用药后,蛋鸡粪便样品中的菌群多样性得到恢复。Sobs指数可反映物种丰富度,经统计分析,B1组的Sobs指数显著(<0.05)低于A1、A2、B2组,但B2组的Sobs指数与A2组无显著差异,说明SMM的使用降低了蛋鸡粪便样品中菌群的物种丰富度,停止用药后,两组蛋鸡粪便样品中菌群的物种丰富度接近,菌群多样性得到恢复。
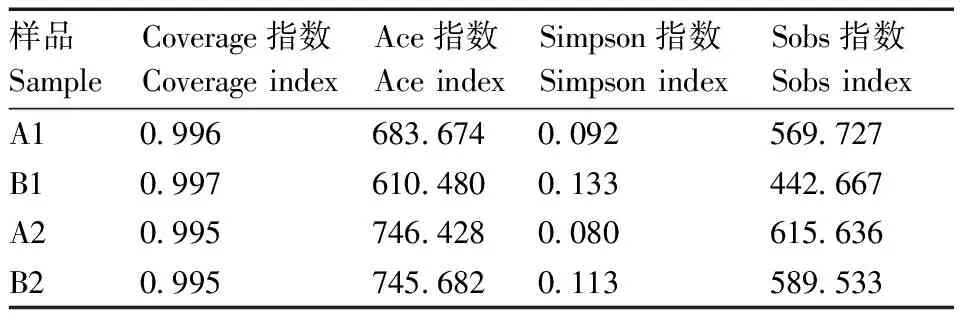
表1 多样性分析统计
2.3 菌群结构分析
在门水平上对样本的菌群结构进行分析(图2),结果所示,在所有样品中,优势菌群主要包括厚壁菌门(Firmicutes,59.59%)、拟杆菌门(Bacteroidetes,20.99%)、变形菌门(Proteobacteria,6.81%)和梭杆菌门(Fusobacteria,4.36%)。与A1组相比,B1组样本中的拟杆菌门、蓝藻门(Cyanobacteria)和热袍菌门(Thermotogae)的相对丰度分别从25.26%、6.50%、1.45%降低至12.36%、1.05%、0.67,但厚壁菌门(60.44%)和变形菌门(12.15%)的相对丰度分别从52.77%、5.68%上升至60.44%、12.15%,梭杆菌门(6.81%)、软壁菌门(Tenericutes,2.64%)和放线菌门(Actinobacteria,2.84%)的相对丰度也分别从2.82%、0.36%、2.61%上升至6.81%、2.64%、2.84%。整体来看,B1组蛋鸡粪便样品的物种多样性下降,但厚壁菌门、变形菌门、梭杆菌门、软壁菌门和放线菌门的相对丰度增加。停止用药后,蛋鸡粪便样品中菌群的物种多样性增加,与对照组差异减小,拟杆菌门的相对丰度上升11.75百分点至24.11%,与A2组(24.22%)接近,蓝藻门的相对丰度上升0.24百分点至1.29%,但与A2组(2.54%)仍有差异。
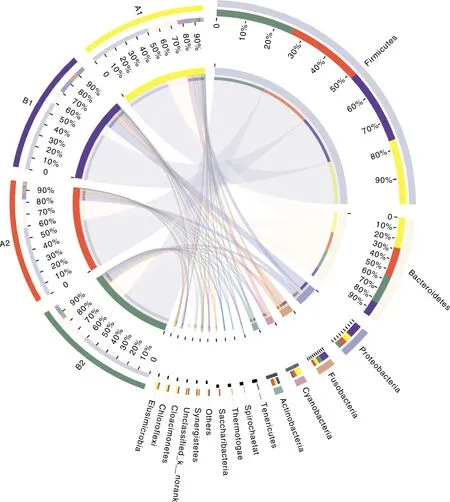
图2 不同样品在门水平上的菌群组成Circos图
分析不同样品在属水平上的菌群组成(图3),在所有样品中,优势菌属依次为乳杆菌属(,24.11%)、拟杆菌属(,9.80%)、肠球菌属(,6.37%)和(5.53%)。与A1组相比,B1组样品中的副拟杆菌属()、普雷沃氏菌科_UCG-001(Prevotellaceae_UCG-001)、的相对丰度分别从1.11%、0.80%、1.23%下降至0.53%、0.17%、0.17%;停止用药后,副拟杆菌属、普雷沃氏菌科_UCG-001、的相对丰度有所上升,分别达到0.69%、0.79%、0.55%,但与A2组(0.81%、1.13%、1.12%)相比依然较低,表明还未得到完全恢复。由此可见,上述3个属的菌群对SMM敏感,用药后其相对丰度若要恢复至与对照组相同的水平,需要一定的时间。与A1组相比,B1组样品中乳杆菌属的相对丰度增加15.92百分点(A1组、B1组的相对丰度分别为15.06%、30.98%),停止用药后,B2组样品中乳杆菌属的相对丰度下降7.54百分点至23.44%,与A2组的水平(24.69%)相近。
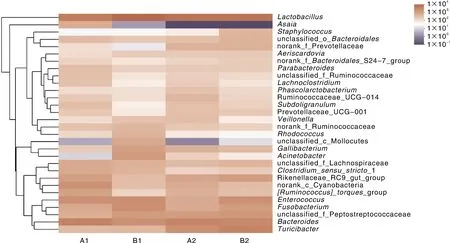
图3 不同样品在属水平上的菌群组成热图
在属水平上对样本进行偏最小二乘法判别分析(PLS-DA)(图4),结果显示:B1组和A1组的样品结果分离,说明SMM的使用对蛋鸡粪便样品的菌群结构产生了影响;B2组与B1组的样品结果分离,说明停止用药后,蛋鸡粪便样品的菌群结构再次发生变化;A2组和B2组样品的空间距离接近,表明停止用药一段时间后,两组蛋鸡粪便样品中的菌群结构重新趋于一致。
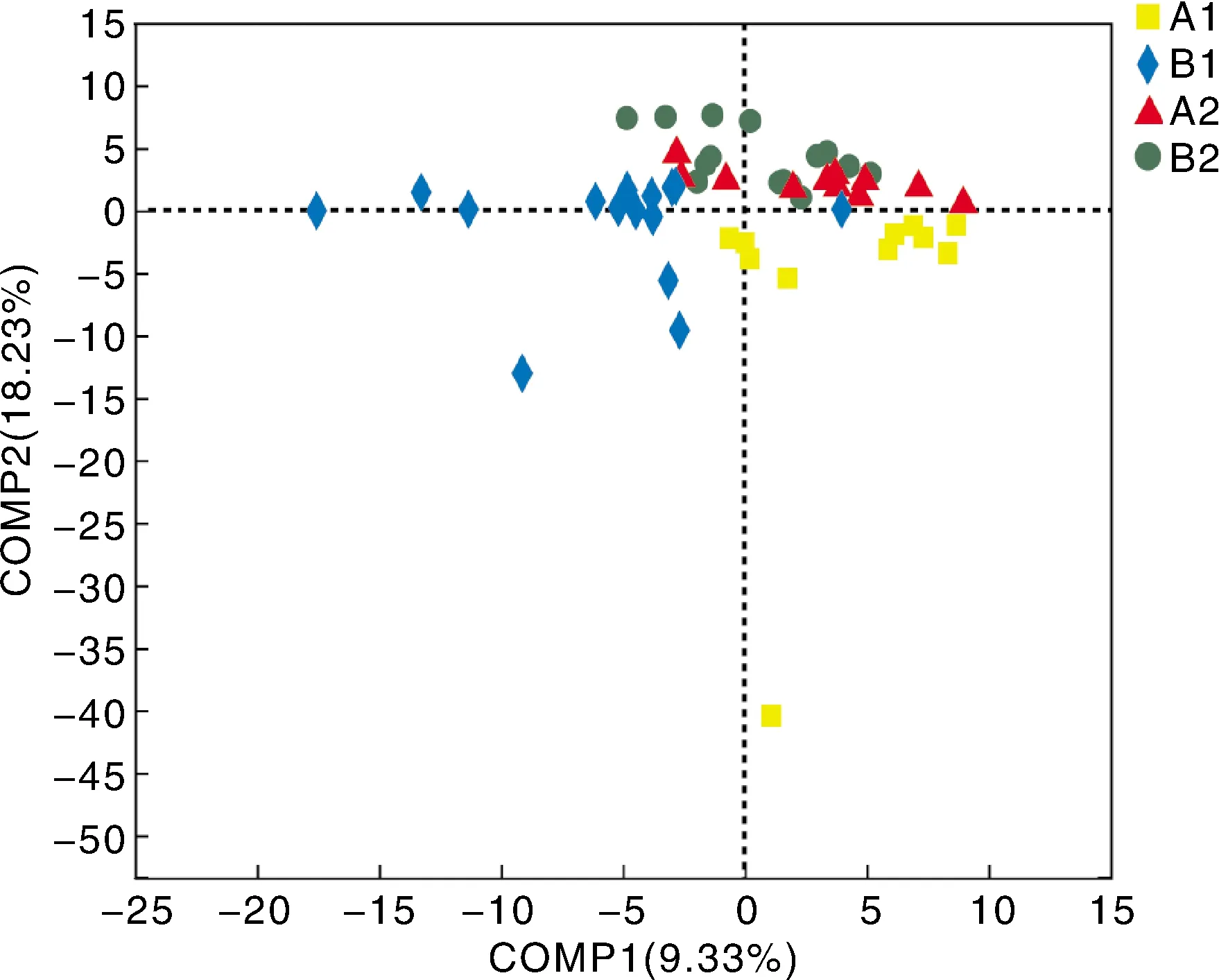
图4 样品间属水平上的菌群差异分析
在属水平上对组间样本的物种组成进行分析(图5):B1组乳杆菌属和不动杆菌属()的丰度显著(<0.05)高于A1组,而拟杆菌属和理研菌科RC9肠道群(Rikenellaceae_RC9_gut_group)的丰度显著(<0.05)低于A1组,扭链瘤胃球菌群([]__group)的丰度极显著(<0.01)低于A1组。
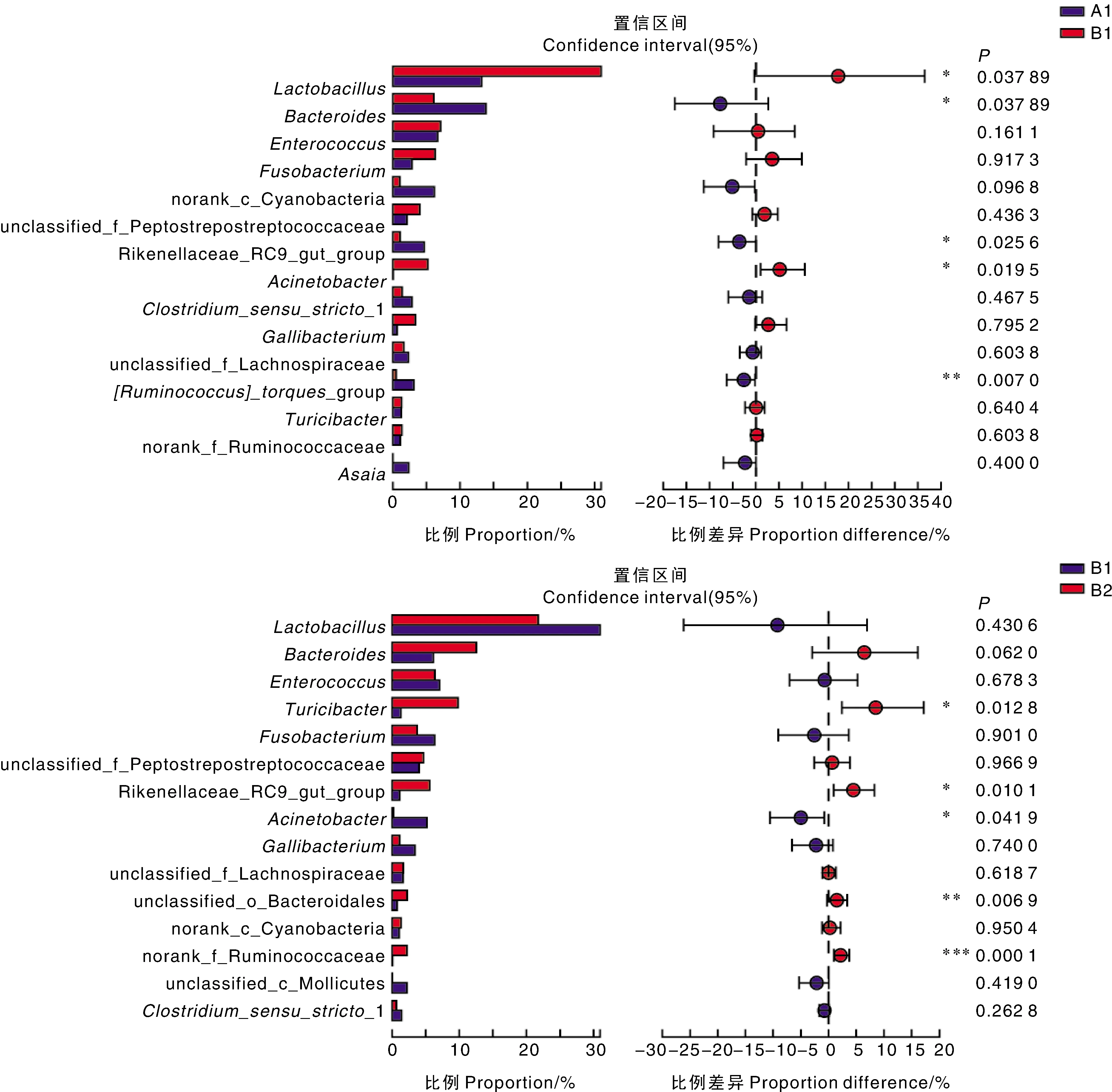
圆点对应的数值表示物种在两组中平均相对丰度的差值,圆点颜色显示为物种丰度占比较大的分组颜色,圆点上的I型区间为差值的上下限值,最右边为P值。*,0.01 B1组与B2组相比:B2组和理研菌科RC9肠道群的丰度显著(<0.05)高于B1组,unclassified_o_Bacteroidales、norank_f_Prevotellaceae的丰度极显著(<0.01)高于B1组,而不动杆菌属的丰度显著(<0.05)低于B1组。这说明,停止用药后,B2组蛋鸡粪便中的微生物菌群结构会发生很大变化,尤以norank_f Prevotellaceae的变化最为明显。停止用药后,除不动杆菌属的丰度显著下降外,其他4个属的丰度皆显著上升。其中,不动杆菌属正是SMM饲喂后丰度显著上升的菌属之一,而理研菌科RC9肠道群是SMM饲喂后丰度显著降低的菌属,说明蛋鸡粪便菌群中对SMM敏感的菌属,在停止用药后明显得到恢复。 研究发现,肠道菌群参与了肠道和大脑之间的双向交流,甚至扮演着“第二大脑”的角色,可导致阿尔茨海默病等神经退行性疾病。健康的肠道菌群结构在鸡的整个生命周期中都起着重要的作用。动物肠道微生物处于动态平衡中,菌群种类及其在肠道中的分布与机体的健康密切相关。 本研究对蛋鸡粪便样品中的微生物群落组成进行分析,结果显示,样品中的优势菌群在门水平上依次是厚壁菌门、拟杆菌门和变形菌门,在属水平上依次为乳杆菌属、拟杆菌属和肠球菌属。这与周妍等报道的不同生长阶段无特定病原体鸡粪便菌群中厚壁菌门、变形菌门和拟杆菌门相对丰度占整体丰度95%以上,以及乳杆菌属、拟杆菌属和肠球菌属为优势菌属的研究结果相似;与Schreuder等发现的蛋鸡粪便中优势菌门是厚壁菌门和拟杆菌门的结果一致。谭诺研发现,对1日龄岭南黄鸡连续饲喂硫酸新霉素(50 mg·kg)42 d后,肠道乳杆菌属占比49.46%,比未饲喂抗生素组显著增加。这与本试验饲喂SMM后乳杆菌属菌群丰度增加的结果一致,但比例上有一定的差异,可能与鸡的品种、年龄、生长环境、饲料组成,以及饲喂抗生素的种类、含量和时间有关。乳杆菌属菌株可以产生乳酸,降低肠道pH值,从而影响其他细菌菌群的生长。本试验中,添加SMM后,蛋鸡粪便中菌群的物种丰度显著下降,可能与乳杆菌属细菌的丰度增加有关。 向蛋鸡饮用水中添加SMM后,蛋鸡粪便样品中的菌群丰度显著下降,与Willmann等报道的磺胺类抗生素导致肠道菌群多样性显著降低的结果相似,与Hill等使用氨苄西林、庆大霉素、甲硝唑、新霉素和万古霉素等抗生素药物导致大肠中细菌数量减少10%的报道一致,说明不同种类的抗生素均可使肠道菌群的丰度下降,但对各个菌属的具体影响程度不同。本研究中,使用SMM后蛋鸡粪便样本中的物种丰度和多样性下降,其中,拟杆菌门的丰度降低明显。除抗生素种类外,杜海洋等报道,同一种抗生素的使用时间不同也会造成鼠肠道菌群结构的明显差异。 停止饲喂SMM后,B2组菌群的丰度上升,与对照组(A2组)趋于一致,但菌群结构仍有差异。朱姗姗研究发现,饲喂恩诺沙星、地克珠利可以改变30日龄京红鸡的肠道菌群组成,停药后,肠道菌群向正常菌群组成恢复,并在这一趋势中形成新的菌群结构。朱燕娜等报道,抗生素使用后7 d,受抑制的菌群丰度逐渐升高,可能是这些菌群中部分对抗生素较为敏感的菌株被抑制或杀死后,没有被抑制的不敏感菌株快速繁殖引起的。本试验在停止用药后,蛋鸡粪便样本中菌群的物种多样性和丰度增加,可能是敏感菌群逐渐恢复,连同耐药菌株快速繁殖共同作用的结果。本研究中,使用SMM后,蛋鸡粪便样品中的不动杆菌属丰度显著升高。不动杆菌作为条件致病的非发酵菌,是引起感染的重要机会致病菌之一,具有快速获得抗生素抗性的能力。Ubeda等发现,停止万古霉素干预2周后,小鼠肠道肠球菌属、梭状芽孢杆菌属()和肠杆菌属()等条件致病菌的含量升高。Tanaka等报道,口服广谱抗生素头孢氨苄后,肠球菌属和肠杆菌属的丰度增加。Zhang等发现,围产期小鼠口服SMM后,哺乳动物雷帕霉素靶蛋白(mTOR)途径和-甲基--天冬氨酸受体2B(NR2B)基因表达受到影响,神经内分泌功能被扰乱,幼崽表现焦虑、脂肪累积和认知障碍等不良现象。综上所述,不同种类抗生素对不同动物的肠道菌群结构均会产生影响,并会增加肠道病原菌的含量。肠道病原菌的含量上升,破坏了动物肠道正常的菌群结构,影响机体消化代谢,致其生产性能下降,甚至产生疾病。肠道菌群复杂多样,在宿主的生长、代谢和免疫中起着重要作用;因此,在动物养殖过程中,应减少抗生素的干预。本研究发现,SMM可以降低鸡肠道菌群的丰富性和多样性,增加致病菌的丰度,但其具体作用机制还有待进一步的研究。 综上,本试验利用16S rDNA扩增子高通量测序发现,SMM可以通过增加乳杆菌属和不动杆菌属的丰度改变肠道菌群结构,降低蛋鸡粪便中的细菌菌群多样性和物种丰度;停止使用SMM一周后,粪便样品菌群的物种多样性和丰度得到恢复。研究结果可为临床使用SMM,及确定停药时间等提供参考。3 讨论
