miR-203a-3p靶向调控VEGF-C表达对卵巢癌恶性生物学特征的影响
2022-02-25杨雯迪李亚军
杨雯迪,李亚军
(清华大学第一附属医院妇科,北京 100016)
卵巢癌作为临床常见的女性生殖系统肿瘤,早期症状隐匿,当患者出现明显症状时,大多已是晚期,故而卵巢癌的存活时间较发病率相对更高的宫颈癌和子宫体癌更短,其死亡率在妇科生殖系统肿瘤中居首位[1-2]。卵巢癌与遗传、激素等有着密切的关系,同时任何年龄段的女性均有患上卵巢癌的可能性[3]。已有研究显示,miRNA通过与下游相关靶基因相互作用,在肿瘤发生、发展中具有关键调控功能[4]。miR-203a-3p是近年来研究较多的一种miRNA,在调控肿瘤的恶性生物学特征中起着重要的作用。Zhen等[5]研究表明,miR-203a-3p过表达可以通过调控AKT信号通路抑制胃癌细胞的增殖。Liu等[6]研究表明,miR-203a-3p可以通过AKT/GSK-3β信号通路抑制卵巢癌细胞的恶性生物学特征。张海生[7]研究表明,miR-203a-3p可以通过抑制KCNE2表达靶向调控非小细胞肺癌细胞系的转移潜能。但关于miR-203a-3p对卵巢癌增殖、侵袭和迁移的影响,相关研究较少且观点不完全统一。本文旨在通过体外实验探究miR-203a-3p靶向调控血管内皮生长因子C(vascular endothelial growth factor C,VEGF-C)表达对卵巢癌细胞生物学行为的影响及其机制,以期寻找新的抗卵巢癌治疗靶点。
1材料与方法
1.1标本来源
收集2019年2月至10月在清华大学第一附属医院就诊的20例卵巢癌患者手术切除的癌组织及对应癌旁组织(已经过伦理审查),将手术切除的组织标本经10%福尔马林固定、梯度乙醇脱水后制作石蜡包块并切片。
1.2细胞及主要试剂
SKOV3细胞株(湖南丰晖生物科技有限公司);miR-203a-3p mimic(Invitrogen公司),VEGF-C、PCNA抗体(Abcam公司);TRAIL(英国Pepro Tech公司);E-cadherin、Vimentin、N-cadherin抗体(碧云天公司);双荧光素酶报告基因检测试剂盒(美国Promega公司);显微镜(Olympus公司);RPMI1640培养基(武汉普诺塞生物生命科技有限公司);CO2细胞培养箱(美国Forma公司)。
1.3方法
1.3.1分组及转染
SKOV3细胞于配好的RPMI 1640完全培养液中,置于37℃,5%CO2细胞培养箱中培养。实验设Control组、miR-203a-3p组、pc-VEGF-C组和miR-203a-3p+pc-VEGF-C组。Control组使用空白质粒转染;miR-203a-3p组转染miR-203a-3p mimic;pc-VEGF-C组使用VEGF-C重组质粒转染;miR-203a-3p+pc-VEGF-C组使用miR-203a-3p mimic和VEGF-C重组质粒共同转染,严格按照脂质体转染步骤进行操作。
1.3.2荧光素酶报告基因验证靶基因
TargetScanHuman预测miR-203a-3p与VEGF-C结合位点,将含有VEGF-C结合位点的miR-203a-3p 3′-UTR片段及其突变体插入到pLV-EGFP(2A)Puro载体荧光素酶报告基因的下游,分别命名为VEGF-C wt和VEGF-C mut,与miR-203a-3p mimics共转染SKOV3细胞,培养48h后,以双荧光素酶报告基因检测试剂盒检测荧光素酶活性变化。
1.3.3 Western blot检测蛋白表达水平
二喹啉甲酸(BCA)法对提取的蛋白样品进行定量后,取适量经SDS-PAGE电泳转印至PVDF膜,5%脱脂牛奶室温封闭2h,以GAPDH为内参,分别加入兔抗大鼠VEGF-C、PCNA、E-cadherin、Vimentin、N-cadherin、GAPDH一抗(1∶500),4℃过夜后以TBST洗膜,加入二抗(1∶1 000)常温反应2h,增强化学发光(ECL)法显色,Image J分析计算目的蛋白与内参的灰度比值。
1.3.4实时荧光定量聚合酶链式反应
提取的总RNA经反转录合成cDNA后PCR仪扩增,以GAPDH为内参,2-ΔΔCt法计算目的RNA相对表达量。
GAPDH:上游引物为5′-CTCAGACACCATGGGGAGGTGA-3′,下游引物为5′-ATGATCTTGAGGCTGTTGTCATA-3′。
VEGF-C:上游引物为5′-GAGGAGCATTACGGTCTGTG-3′,下游引物为5′-TCCCCTTAGCTGACAATTGT-3′。
miR-203a-3p:上游引物为5′-GGCATGGGTGCCCCGACGTT-3′,下游引物为5′-AGAGGCCTCAATCCATGGCA-3′。
1.3.5克隆形成实验
取对数生长期细胞消化后配成单细胞悬液,以500个/孔接种于6孔板,每间隔3d更换新鲜培养基,待培养2w后肉眼可见克隆形成,终止培养、依次使用中性甲醇固定、结晶紫染色后拍照。
1.3.6 Transwell实验
取对数生长期的细胞常规消化后,以无血清培养液调整细胞密度为1×105个/mL,取200μL细胞悬液加入铺好Matrigel基质胶的上室,24孔板下室内加入500μL含10%FBS的培养液,培养48h后,用结晶紫对侵至小室下层的细胞进行染色并计数。
1.3.7划痕实验
取对数生长期细胞消化后配成单细胞悬液,并接种在6孔板中(5×105个/孔),置于培养箱中继续培养,待细胞铺满单层,使用200μL移液枪头于培养孔内划一直线,PBS洗涤后更换无血清培养液培养,显微镜观察0、24h划痕宽度并拍照。
1.4统计学方法
应用SPSS 20.0统计学软件分析数据,两组间比较采用t检验;多组间比较行单因素方差分析,进一步两两比较采用SNK-q法;P<0.05为差异有统计学意义。
2结果
2.1 miR-203a-3p在卵巢癌组织中的表达
与正常癌旁组织中miR-203a-3p表达(0.99±0.09)比较,卵巢癌组织中miR-203a-3p表达(0.47±0.10)显著下调(t=17.112,P<0.05),见图1。
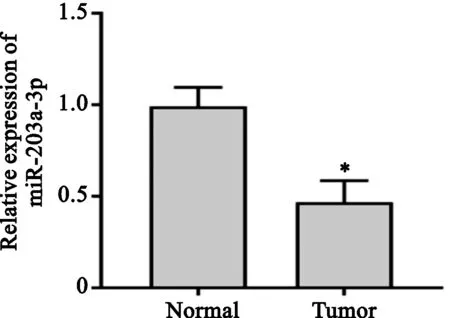
注:*与正常癌旁组织比较P<0.05。图1 miR-203a-3p在卵巢癌组织中的表达Fig.1 Expression of miR-203a-3p in ovarian cancer tissues
2.2 miR-203a-3p与VEGF-C靶向的关系
miR-203a-3p与VEGF-C存在可结合的位点,相比Control组,miR-203a-3p组VEGF-C蛋白相对表达水平、荧光素酶活性显著降低(q值分别为12.430、5.047,P<0.05),pc-VEGF-C组VEGF-C蛋白相对表达水平上调(q=10.146,P<0.05),荧光素酶活性无显著变化(q=0.131,P>0.05);相比pc-VEGF-C组,miR-203a-3p+pc-VEGF-C组VEGF-C蛋白相对表达水平显著降低(q=6.710,P<0.05),提示miR-203a-3p与VEGF-C存在靶向结合关系,见图2、表1。
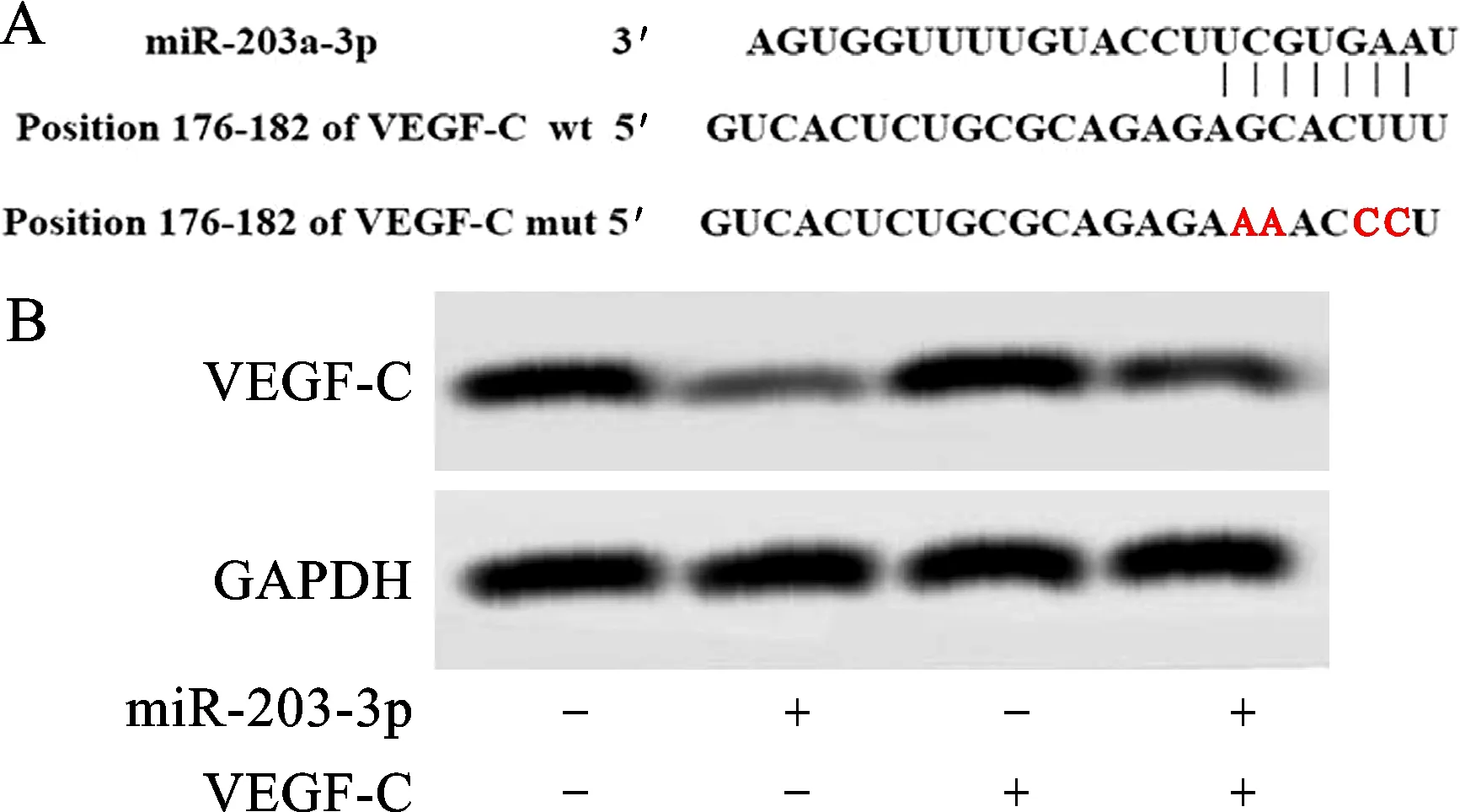
注:A为miR-203a-3p与靶细胞结合位点;B为VEGF-C表达情况。
表1 各组miR-203a-3p与VEGF-C靶向关系检测的比较Table 1 Comparison of miR-203a-3p and VEGF-C targeting relationship detection in each
2.3 miR-203a-3p对卵巢癌细胞增殖的影响
克隆形成实验显示,相比Control组,miR-203a-3p组卵巢癌细胞克隆形成率、PCNA蛋白相对表达水平均显著降低(q值分别为11.773、12.246,P<0.05),pc-VEGF-C组克隆形成率、PCNA蛋白相对表达水平均显著增加(q值分别为5.753、3.034,P<0.05),miR-203a-3p+pc-VEGF-C组克隆形成率显著增加(q=3.914,P<0.05)、PCNA蛋白相对表达水平无显著变化(q=0.700,P>0.05);相比pc-VEGF-C组,miR-203a-3p+pc-VEGF-C组卵巢癌细胞克隆形成率、PCNA蛋白相对表达水平均显著降低(q值分别为3.086、3.342,P<0.05),提示miR-203a-3p通过靶向调控VEGF-C表达抑制SKOV3细胞的体外增殖,见图3、表2。
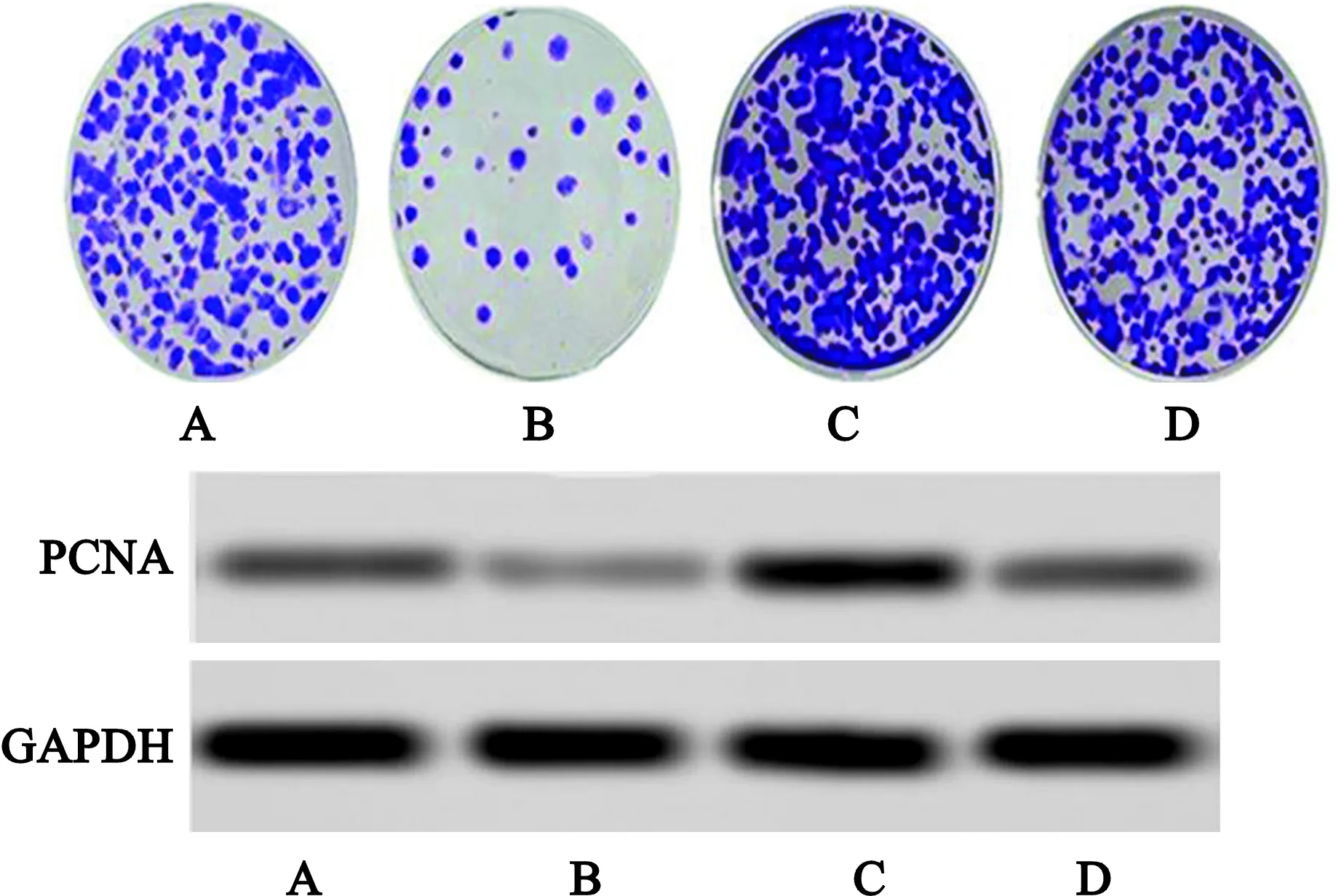
注:A为Control组;B为miR-203a-3p组;C为pc-VEGF-C组;D为miR-203a-3p+pc-VEGF-C组。
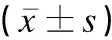
表2 各组卵巢癌细胞克隆形成率的比较Table 2 Comparison of clone formation rate of ovarian cancer cells in each
2.4 miR-203a-3p对卵巢癌细胞侵袭和迁移的影响
Transwell实验和划痕实验显示,相比Control组,miR-203a-3p组单位面积细胞侵袭数和细胞愈合率均显著降低(q值分别为6.258、5.325,P<0.05),pc-VEGF-C组单位面积细胞侵袭数和细胞愈合率均显著增加(q值分别为12.286、12.267,P<0.05),miR-203a-3p+pc-VEGF-C组单位面积细胞侵袭数和细胞愈合率均显著增加(q值分别为3.583、5.984,P<0.05);相比pc-VEGF-C组,miR-203a-3p+pc-VEGF-C组单位面积细胞侵袭数和细胞愈合率均显著降低(q值分别为6.343、5.364,P<0.05),提示miR-203a-3p通过靶向调控VEGF-C表达抑制SKOV3细胞的体外侵袭和迁移,见表3、图4。
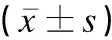
表3 各组卵巢癌细胞侵袭数和细胞愈合率的比较Table 3 Comparison of the invaded ovarian cancer cell number and cell healing rate in each
注:A为Transwell实验;B为划痕实验;1为Control组;2为miR-203a-3p组;3为pc-VEGF-C组;4为miR-203a-3p+pc-VEGF-C组。
2.5 miR-203a-3p对卵巢癌细胞E-cadherin和Vimentin及N-cadherin蛋白表达的影响
与Control组比,miR-203a-3p组E-cadherin表达显著升高,Vimentin、N-cadherin表达均显著降低(q值分别为4.082、7.746、7.570,P<0.05),pc-VEGF-C组E-cadherin表达显著降低,Vimentin、N-cadherin表达均显著升高(q值分别为7.386、3.979、3.861,P<0.05),miR-203a-3p+pc-VEGF-C组E-cadherin、Vimentin、N-cadherin表达均显著降低(q值分别为3.430、3.055、2.961,P<0.05);与pc-VEGF-C组比,miR-203a-3p+pc-VEGF-C组E-cadherin表达显著升高,Vimentin、N-cadherin表达均显著降低(q值分别为5.586、5.115、3.778,P<0.05),见图5、表4。
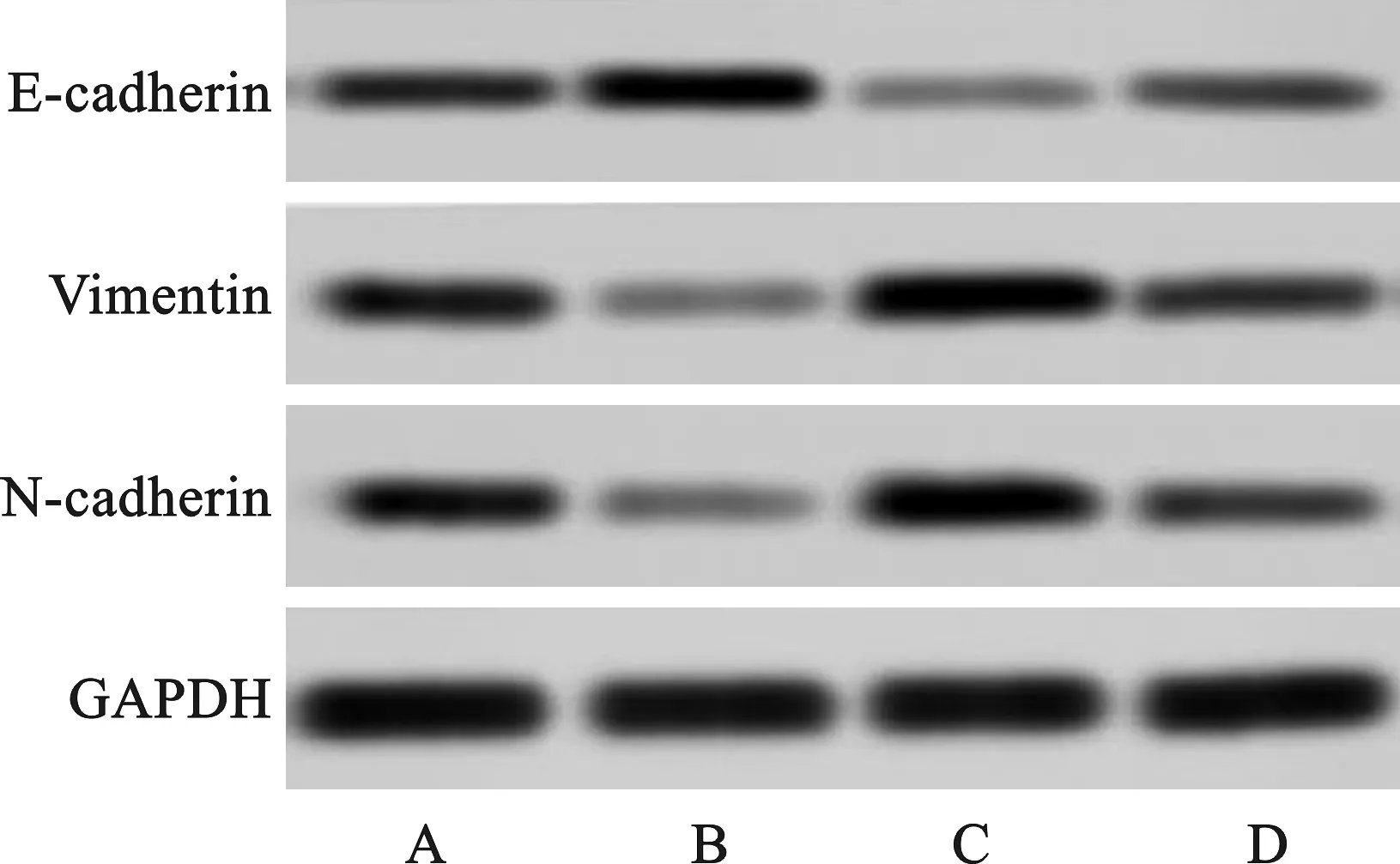
注:A为Control组;B为miR-203a-3p组;C为pc-VEGF-C组;D为miR-203a-3p+pc-VEGF-C组。
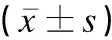
表4 各组卵巢癌细胞E-cadherin、Vimentin、N-cadherin蛋白表达的比较Table 4 Comparison of E-cadherin,Vimentin and N-cadherin protein expression in ovarian cancer cells in each
3讨论
3.1 miR-203a-3p靶向结合VEGF-C mRNA的3′UTR区并抑制VEGF-C的表达
细胞增殖、凋亡、侵袭、迁移等众多生物学过程参与癌变,在这一复杂的病理生理过程中,存在着由大量癌基因和抑癌基因组成的调控网络,其中miRNA正是这一调控网络中的关键成员。miR-203a-3p是一种新型的miRNA,在多种肿瘤细胞及组织中均可检测到其表达。Liu等[6]的研究表明,miR-203a-3p参与调控了卵巢癌细胞的生物学行为。作为一类调控血管内皮细胞生长的重要生长因子,VEGF已被发现存在多个亚型,并在肿瘤的生长、侵袭及迁移等相关恶性生物学行为的调控中发挥着重要的作用[8]。既往研究中,miRNA通过调控VEGF-C表达抑制包括肝癌[9]、膀胱癌[10]等的侵袭及转移过程。本研究首先使用靶基因预测软件TargetScanHuman提示miR-203a-3p可能具有VEGF-C的结合位点,并通过双荧光素酶报告基因实验进行了验证,实验中表现为miR-203a-3p组荧光素酶活性相比Control组显著降低,表明VEGF-C确实存在和miR-203a-3p的结合位点,为后续功能实验的开展奠定了基础。在功能实验中,VEGF-C对SKOV3细胞生物学行为的影响被miR-203a-3p削弱,进一步提示miR-203a-3p可能通过靶向调控VEGF-C调节卵巢癌SKOV3细胞的恶性生物学行为。
3.2 miR-203a-3p下调VEGF-C表达抑制卵巢癌细胞的增殖
肿瘤细胞异常升高的增殖能力是导致肿瘤恶性生长的主要原因,也保证了其向周围组织浸润及发生远处转移的数量基础[11]。本研究表明,miR-203a-3p通过靶向调控VEGF-C抑制肿瘤细胞的增殖。肿瘤的恶性增殖与相关增殖蛋白的表达关系密切,其中PCNA与细胞增殖和分化关系密切。Barboule等[12]研究提示,当PCNA表达高时,卵巢癌细胞增殖能力提高,而PCNA表达水平低时,则其增殖能力被抑制。本研究显示,与单独转染VEGF-C相比,共转染miR-203a-3p和VEGF-C使PCNA蛋白表达下降,这提示miR-203a-3p通过靶向调控VEGF-C表达并引起下游PCNA表达降低,从而抑制SKOV3细胞的恶性增殖。相关研究证实微小RNA在体外实验中通过调节VEGF-C表达,抑制PCNA表达而抑制肿瘤细胞的恶性增殖行为[13],本研究与该结论相符合。
3.3 miR-203a-3p下调VEGF-C表达抑制上皮间质转化介导的卵巢癌细胞侵袭和迁移
侵袭和转移是恶性肿瘤的主要特征,在该生物学过程中,上皮间质转化过程为关键的起始环节,其中调节上皮粘附连接的相关分子被一些连接灵活性较大的分子所取代,从而导致细胞分离和运动性增强,肿瘤细胞更易于侵入血管,并穿过血管壁外渗,形成继发性转移灶[14-16]。本研究提示miR-203a-3p通过靶向调控VEGF-C可以有效地抑制SKOV3细胞的侵袭和迁移能力,表现为视野内单位面积细胞侵袭数和细胞愈合率相比显著降低。在功能上,miRNAs通过靶向其下游分子调控癌变。本研究显示,miR-203a-3p在SKOV3细胞中调控其下游靶点的表达,如E-cadherin、N-cadherin和Vimentin;而以往研究中,其三者是人卵巢癌细胞上皮间质转化过程中的关键调控因子[17],说明miR-203a-3p通过靶向调控VEGF-C来抑制SKOV3细胞的上皮间质转化过程,实现抑制肿瘤细胞的侵袭及转移。叶俊等[18]的研究表明,miRNA可以通过调控VEGF-C,抑制肿瘤细胞的上皮间质转化过程,抑制其侵袭和迁移能力,本研究与其研究结果相符合。
综上所述,miR-203a-3p在卵巢癌组织中表达下调,其可通过靶向抑制VEGF-C表达,抑制卵巢癌SKOV3细胞的增殖、侵袭及上皮间质转化发挥抑癌基因作用。本研究为卵巢癌靶向位点治疗提供了一定的理论基础,但还需要更多的功能性体内实验来验证miR-203a-3p调控卵巢癌进程的具体机制。
