前列腺癌中PCDH9 与CyclinD1 C-myc表达的相关性及意义*
2022-02-24龙琼先伍季彭勇张旭乾刘欣雅
龙琼先 伍季 彭勇 张旭乾 刘欣雅
(南充市中心医院·川北医学院第二临床医学院 1.病理科;2.泌尿外科;3.妇产科,四川 南充 637000)
前列腺癌是目前全球男性发病率第二高的恶性肿瘤,居男性癌症死因的第五位,2018年全球前列腺癌新发病例约127.6万例,约35.9万例患者死于前列腺癌[1]。目前研究显示在初诊为前列腺癌的患者中转移性前列腺癌(mPC)患者大约占54%,其五年生存率相比非转移性前列腺癌低了两倍,同时mPC对药物耐药逐年增加,使优化其治疗方案显得更为重要。原钙黏蛋白9(Protocadherin 9, PCDH9)属于非聚集型原钙粘蛋白家族,和已证实的抑癌基因 PCDH8、PCDH17、PCDH20同位于染色体13q21,可介导细胞间的粘附作用,以及调节多种效应分子,其表达缺失可引起肿瘤增殖甚至转移[2]。有研究发现前列腺癌组织中存在PCDH9缺失,可以作为一个新的潜在前列腺癌抑制基因[3]。现有研究发现PCDH9在胶质细胞瘤、胃癌、肝癌组织中表达下降,且与患者的预后相关。但PCDH9在前列腺癌的发生、发展中的作用机制仍不清。细胞周期是指细胞从第一次分裂结束产生新细胞到第二次分裂结束所经历的全过程,如果细胞周期发生紊乱,细胞的增殖将失控,进而促进癌的形成。为此,本研究探讨前列腺癌中PCDH9表达缺失与细胞周期调控基因CyclinD1和C-myc的相关性,分析前列腺癌中PCDH9表达缺失在调节肿瘤细胞周期中的作用。
1 资料与方法
1.1 一般资料 收集南充市中心医院2018~2020年间存档的92例前列腺癌、36例良性前列腺的石蜡包埋组织,所有病例组织常规HE染色后都经过2位以上的病理学专家诊断。前列腺癌患者年龄48~87岁,平均(64.33±5.46)岁。按照2016版与前列腺癌预后相关的WHO/ISUP分级分组系统将前列腺癌分为1~5个组别:1组8例,2组15例,3组17例,4组21例,5组31例。术前前列腺癌特异性抗原(Prostate-specific antigen,PSA) ≤20 ng/mL 23例,>20 ng/mL 69例。所有患者均行手术切除治疗,患者术前未接受放、化疗或抗雄激素等治疗。
1.2 主要试剂 PDDH9兔抗人抗体购自Abcam公司,CyclinD1和C-myc抗体均购自福州迈新生物公司;免疫组化检测试剂盒和DAB 显色剂均购自福州迈新生物公司。
1.3 免疫组化染色 取石蜡包埋组织蜡块连续3 μm厚切片,常规脱蜡至水。Multimer标记两步法检测,由全自动多功能病理检测系统(Benchmark GX,罗氏公司)按步骤操作。基本条件设定为:抗原修复30 min,用缓冲液冲洗,加入UV DAB inhibitor(Ultraview Universal DAB Detection Kit,罗氏公司),37℃ 4 min。缓冲液冲洗,加一抗(PCDH9、CyclinD1和c-myc),37℃ 30 min。缓冲液冲洗,加UV HRP multimer(Ultraview Universal DAB Detection Kit,罗氏公司),37℃ 8 min。缓冲液冲洗,加入等体积的DAB和DAB H2O2(Ultraview Universal DAB Detection Kit,罗氏公司),37℃ 8 min。缓冲液冲洗,加入UV copper(DAB试剂盒内),37℃ 4 min。缓冲液冲洗,苏木精Ⅱ核复染,37℃ 8 min。用缓冲液冲洗,加入bluing reagent,37℃ 4 min,缓冲液冲洗,封片。用PBS代替一抗作阴性对照。
组织切片由两名病理学医师重复观察,随机选取5个高倍镜视野,按阳性细胞数比例分级,无细胞着色评定为0分,细胞着色≤10%评定为1分,细胞着色10%~25% 评定为2分,细胞着色26%~50%评定为3分,细胞着色51%~100%评定为4分;组织切片无色评定为0分,淡黄色评定为1分,棕黄色评定为2分,棕褐色评定为3分。两者积分相加≤2分为阴性;反之为阳性。
1.4 统计学分析 采用SPSS 22.0软件进行统计学分析。样本率的比较应用卡方检验,相关性分析采用Spearman等级相关检验,以P<0.05为差异有统计学意义。
2 结果
2.1 PCDH9、CyclinD1和C-myc在列腺癌组织和良性前列腺组织中的表达 PCDH9染色阳性呈棕黄色或棕褐色颗粒,主要定位于细胞浆。PCDH9蛋白在前列腺癌组织中低表达,阳性率为72.8%(67/92),显著低于良性前列腺癌组织的阳性率 (100%),差异有统计学意义(2=12.157,P=0.000)(见图1A、图1B)。细胞周期调控基因CyclinD1在前列腺癌组织中的阳性表达率为68.5%(63/92),C-myc在前列腺癌组织中的阳性表达率为64.1%(59/92),与良性前列腺组织相比,差异有统计学意义(P<0.05),见图1C、图1D。

图1 免疫组化检测结果(200×)
2.2 前列腺癌组织中PCDH9、CyclinD1和C-myc表达与临床病理特征的关系 分析前列腺癌组织中PCDH9、CyclinD1和C-myc表达与患者年龄、WHO/ISUP分级分组、脉管神经侵犯、PSA水平及临床分期的关系,发现不同WHO/ISUP分级分组、PSA水平、临床分期的前列腺癌患者PCDH9阳性率差异有统计学意义(P<0.01),高WHO/ISUP分级分组、PSA>20 ng/mL及Ⅲ+Ⅳ期前列腺癌患者PCDH9阳性率明显降低,而PCDH9表达与患者年龄、脉管神经侵犯无关(P>0.05)。前列腺癌患者CyclinD1和C-myc表达与WHO/ISUP分级分组、脉管侵犯、PSA水平及临床分期等相关(P<0.05),但不同年龄组及有无神经侵犯组间的表达差异无统计学意义(P>0.05)。见表1。

表1 前列腺癌组织中PCDH9、CyclinD1和c-myc表达与临床病理特征的关系
2.3 PCDH9 与CyclinD1 、C-myc在前列腺癌中表达的相关性 63例CyclinD1阳性表达的前列腺癌组织中有25例存在PCDH9蛋白的表达缺失,25例PCDH9表达缺失的病例显示有C-myc蛋白的过表达。同时Spearman检验分析前列腺癌组织中PCDH9的表达与CyclinD1 、C-myc的表达呈负相关(r=-0.414、-0.457,P<0.01 ),差异均有统计学意义(P<0.05),见表2。
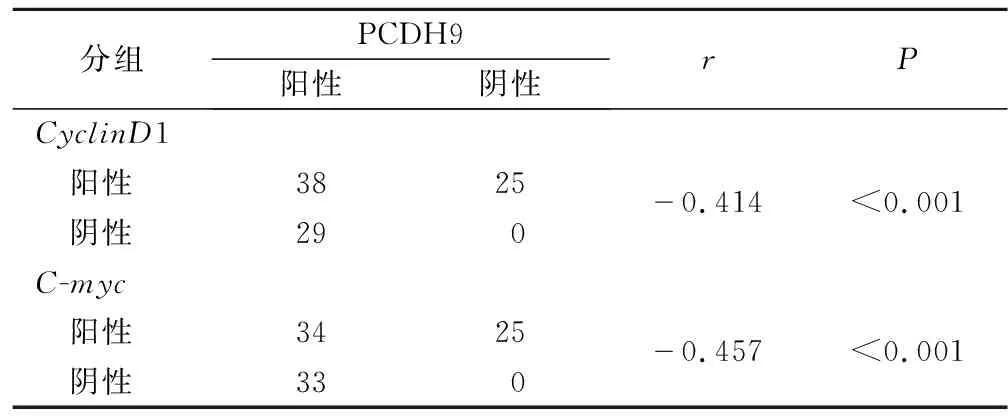
表2 前列腺癌PCDH9表达缺失与CyclinD1和c-myc过表达的关系
3 讨论
近年来,已经有证据证明原钙粘蛋白的一亚型——非聚集型原钙粘蛋白 (δ-PCDHs)在人类肿瘤发生过程中也扮演着重要角色,δ-PCDHs表达下降或缺失是导致恶性肿瘤的原因之一[4]。PCDH9是一种抑瘤基因,它编码一种在多种组织类型中表达的蛋白质[5]。先前的研究表明,由于基因拷贝数的改变,非结节套细胞淋巴瘤和胶质母细胞瘤中PCDH9的表达被下调[6-7],而PCDH9的外源表达可以抑制肿瘤细胞的迁移。在肝细胞肝癌中,PCDH9通过诱导细胞周期阻滞在G0 /G1期来抑制肝细胞肝癌细胞系的细胞增殖[8]。另一项研究表明,miR-200a-3p在卵巢癌中表达上调,过表达的 miR-200a-3p 通过靶向PCDH9促进卵巢癌细胞的增殖[9]。本研究发现和良性前列腺组织相比,前列腺癌组织中PCDH9的表达有下调,其表达缺失率为27.2%,且与前列腺癌的分级分组、临床分期和PSA水平等预后指标有密切关系。最近研究显示前列腺癌细胞中PCDH9的下调导致AKT磷酸化和活性增加, PCDH9在转录后受piR-001773和piR-017184调控,进一步揭示了前列腺癌中PCDH9表达下调的意义[10]。究其肿瘤组织中PCDH9表达缺失的原因,有研究发现肝癌细胞中不仅存在PCDH9的杂合性缺失,而且还存在DNA甲基化[11];而在胶质母细胞瘤中miR-215-5p可以通过结合其启动子和 3′UTR 来抑制 PCDH9 表达[12]。除了 miRNA 靶向 PCDH9 mRNA 影响蛋白表达,蛋白-蛋白互作也可能造成PCDH9 表达缺失。
几乎所有肿瘤细胞的生物学特征都是细胞周期紊乱导致的失控性生长[13]。CyclinD1即细胞周期蛋白之一,是目前公认的原癌基因及细胞周期重要的调节因子。作为细胞周期G1期重要的调控因子,其在G1/S期转换中起着正性调节的作用,促进DNA的合成,加快细胞由G1期进人S期,从而导致细胞失控性生长,促进肿瘤的发生[14]。CyclinD1在正常组织中表达量很少甚至不表达,而在多数恶性肿瘤中过度表达。研究发现卵巢癌中CyclinD1的表达明显高于卵巢良性肿瘤,其表达与肿瘤的分级、FIGO分期、T分期和淋巴结转移有关,且CyclinD1阳性表达组的LVD计数高于CyclinD1阴性表达组[15]。本研究中发现前列腺癌组织中CyclinD1的表达明显高于前列腺良性肿瘤,且随肿瘤分级分组、临床分期的增高而增高,与前列腺癌的预后有着密切关系。研究也发现CyclinD1在尿路上皮癌中的表达与其预后有关,其高表达增加复发风险,可以作为尿路上皮癌复发/进展的预后标志物[16]。但近来的研究显示CyclinD1的表达在不同肿瘤中的预后意义不尽相同,一项研究发现透明细胞肾细胞癌中CyclinD1 的mRNA水平随着肿瘤等级的增加和复发率的升高而降低,高CyclinD1水平的患者似乎有一个更有利的预后[17]。吴跃龙等[18]应用免疫组化方法检测62例前列腺癌原发灶癌组织及癌旁正常组织中CyclinD1蛋白的表达,发现癌灶组织中CyclinD1蛋白染色阳性占41.9%。C-myc基因是一个在细胞增殖、分化、凋亡和细胞周期中起重要作用的核内癌基因,位于染色体8q24[19]。C-MYC已经被证明在多种人类癌症组织中呈高表达,并且与肿瘤的发生发展有关[20]。当染色体易位或信号通路基因突变等情况发生时,C-myc会发生不依赖于生长因子刺激的扩增,导致不受控制的细胞增殖和肿瘤产生[21]。本研究实验结果显示C-myc在前列腺癌组织的表达明显高于前列腺良性组织,且其表达率随着Gleason评分及TNM分期的增高而增高,与谢鸣等[22]的研究结果一致。
本实验中进一步分析前列腺癌组织PCDH9的表达下调与细胞周期相关蛋白CyclinD1和C-myc过表达的关系,发现PCDH9的表达缺失率随着CyclinD1和C-myc过表达率增高而增高,PCDH9的表达缺失病例常有CyclinD1和C-myc的过表达,提示前列腺癌组织中PCDH9的表达缺失可能会引起肿瘤细胞周期紊乱,导致肿瘤细胞的失控性生长。恢复 PCDH9 的表达降低了肿瘤细胞活力,诱导细胞凋亡并引起 G0/G1细胞周期停滞;同时上调 Bax 蛋白表达,但使 Bcl-2和cyclinD1表达下调[23]。一项研究发现PCDH9、BAG-1S蛋白表达可预示非小细胞肺癌新辅助化疗预后状况,其中PCDH9阳性表达越高,BAG-1S阳性表达越低,疾病预后越佳[24]。本研究发现具有PCDH9表达缺失、CyclinD1和C-myc过表达的病例,其临床分期、病理分级高于无PCDH9表达缺失、CyclinD1和C-myc低表达的病例,进一步提示前列腺癌组织中PCDH9的表达缺失与肿瘤的进展有密切关系,PCDH9可能成为反映肿瘤生物学行为的参考指标。
4 结论
本研究结果表明,在前列腺癌的发生、发展过程中可能存在PCDH9的表达缺失,其作用机制可能是通过调节细胞周期蛋白,进而促进肿瘤细胞的增殖。
