SHP-2抑制剂PHPS1对动脉粥样硬化斑块作用及其机制的研究
2022-02-22李新新朱学灿帖彦清
张 雪,马 倩,李新新,谭 鹤,朱学灿,帖彦清
易损动脉粥样硬化(atherosclerotic, AS)斑块是导致心肌梗死、卒中等致死、致残性心脑血管疾病的主要病因,又被称为“犯罪斑块”,所以如何稳定易损斑块是重要的研究方向,对减少疾病发生具有重要临床意义。AS易损斑块的主要病理学特征为大的坏死核心,其上覆盖有薄的、并不连续的纤维帽,胶原成分及斑块内平滑肌细胞(smooth muscle cells, SMCs)减少,巨噬细胞成分增加[1-2]。巨噬细胞是参与斑块形成和炎症因子分泌的主要细胞,其可通过分泌多种基质金属蛋白酶(matrix metalloproteinase, MMPs)来降解胶原,促使斑块不稳定性增加,极易破裂受损,其中研究较多,作用较清晰的为MMP-1、MMP-2、MMP-9等,所以抑制这些基质金属蛋白酶的分泌可以加强斑块的稳定性,使其不易破裂。巨噬细胞内部有许多信号通路,通过这些信号通路来调节体内各种反应,有些研究[2-4]中表明:巨噬细胞中的细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)信号通路是调节基质金属蛋白酶(MMP-9)表达的主要调控途径,ERK通路的激活是决定斑块破裂的重要原因之一。研究[5]表明蛋白酪氨酸磷酸酶SHP-2(scr homology 2 domain-containing protein tyrosine phosphatase-2,SHP-2)主要通过调控ERK的活性来影响斑块,该研究使用SHP-2特异性抑制剂PHPS1干预ApoE-/-小鼠来说明抑制SHP-2对AS稳定性的影响。
1 材料与方法
1.1 实验动物、试剂及实验仪器16只8周龄体质量(20±5)g SPF级ApoE-/-小鼠购自常州卡文斯实验动物技术有限公司,饲养于河北省人民医院临研中心SPF级动物房,每笼4~6只,适应性饲养1周后开始实验,本动物实验经过了医学伦理委员会的批准并按实验动物使用的 3R 原则给予人道关怀;抗CD 68、抗MMP-9、抗ERK及p-ERK、山羊抗兔 IgG H&L (HRP)、山羊抗鼠IgG H&L(Alexa Fluor®488)预吸附二抗购自英国Abcam 公司;DAB显色试剂盒购自北京中杉金桥公司;蛋白裂解液、PMSF、蛋白酶磷酸酶抑制剂、BCA蛋白试剂盒均购自北京索莱宝公司;PHPS1及天狼星红染液均购自美国sigma aldrich公司;西方膳食饲料购自江苏美迪森生物医药有限公司;正置显微镜(德国Carl zeiss公司)、石蜡切片机(德国Leica公司)。
1.2 动物分组及标本取材16只6~8周龄雄性ApoE-/-小鼠随机分为2组,8只/组。PHPS1处理组给予腹腔注射3 mg/(kg·d) PHPS1,对照组给予腹腔注射同等剂量0.9% NaCl溶液,同时喂养西方膳食饲料(1.25%胆固醇、7%脂肪、其余为基础饲料)16周,以构建AS模型。实验中期每组死亡1只小鼠,实验结束后,取出主动脉根部存于福尔马林中,固定后石蜡包埋,制备连续切片,用于Movat染色、天狼星红染色、免疫组化和免疫荧光双染色;整条降主动脉浸入液氮中,研磨提取蛋白后于-80 ℃冰箱保存。
1.3 Movat及天狼星红染色每个主动脉根部标本切片30张,每间隔6张切片选取1张分别做Movat、天狼星红染色。Movat染色分别经过阿尔新蓝染色细胞外基质,乙醇氨水返蓝,铁苏木素染色动脉弹力板,比布列希猩红染色血管平滑肌,乙醇藏红花染斑块内胶原成分;天狼星红染色特异性评估胶原成分,天狼猩红-苦味酸饱和溶液染30 min, 无水乙醇分化脱水, 中性树胶封片,显微镜下观察拍照。
1.4 免疫组化染色将石蜡切片放置于65 ℃恒温箱中烘烤2 h,依次经过脱蜡、水化后置于3%的H2O2中以消除内源性过氧化物酶的活性,用蒸馏水冲洗2~3次,5 min/次, 将切片放入盛有pH值6.0柠檬酸缓冲液的容器中,置于90~95 ℃的微波炉中加热25~30 min,修复结束后取出容器,冷却至室温,用正常山羊血清室温封闭孵育30 min后加入一抗CD68 (1 ∶100)孵育4 ℃过夜,第二天PBS冲洗3次,5 min/次,洗去未结合抗体的后,加入山羊抗兔 IgG H&L (HRP) 的二抗室温孵育45 min,用PBS冲洗3次,5 min/次,然后DAB显色、苏木精复染细胞核、常规脱水、透明后中性树胶封片,自然晾干后使用Carl zeiss显微镜采图后,经使用Image Pro Plus 6.0测算斑块面积、分析组化染色光密度值,观察动脉粥样硬化斑块内单核巨噬细胞的阳性面积。
1.5 免疫荧光染色将切片放于恒温烤箱中烘烤2 h,依次经梯度乙醇脱蜡后,用免疫组化笔在标本附近画一个圆圈,滴加3%的H2O2,室温封闭30 min,取出切片放入TBS中冲洗3次,5 min/次,甩干切片,滴加2 % BSA 封闭液室温封闭2 h,加入一抗CD68(1 ∶50)、MMP-9(1 ∶80)置于湿盒内4 ℃过夜;第二天取出湿盒,平衡至室温,用TBS冲洗3次,5 min/次,加入山羊抗鼠IgG H&L(Alexa Fluor®488)预吸附二抗,室温避光孵育45 min后TBS冲洗3次,5 min/次,加入DAPI封片,盖上盖玻片,避免气泡,全程避光,倒置荧光显微镜下观察,并采集图像。
1.6 Westen blot实验将主动脉蛋白提取,将主动脉放入研磨皿中研磨,加入蛋白裂解液500 μl、5 μl PMSF、蛋白酶磷酸酶抑制剂5 μl混合物,在冰上充分研磨30 min后4 ℃,12 000 r/min离心10 min,取上清液置于1.5 ml EP管中,按照BCA蛋白试剂盒操作测定蛋白浓度,按4:1的 比例加入 5×上样缓冲液,煮沸10 min,-20 ℃保存备用。10 %聚丙烯酰胺SDS-PAGE电泳120 V,60 min,PVDF膜半干式转膜300 mA,90 min后,封闭PVDF膜过夜,TBST缓冲液充分震荡洗膜,一抗(ERK/p-ERK和MMP-9浓度均为1 ∶1 000),4 ℃过夜孵育后,TBST震荡洗脱未结合的一抗2 h,加入二抗(1 ∶2 000)室温孵育2 h,TBST缓冲液摇床震荡洗膜,ECL发光液曝光。

2 结果
2.1 小鼠主动脉根部斑块面积大小与对照组相比,PHPS 1处理组主动脉根部斑块面积大小有差异(F=3.703,P<0.01)。见图1。

图1 两组小鼠主动脉根部Movat染色评估斑块 ×40与对照组比较:**P<0.01
2.2 斑块内胶原成分结果显示,与对照组相比,实验组PHPS1斑块内胶原成分含量增加(F=2.702,P<0.01)。见图2。
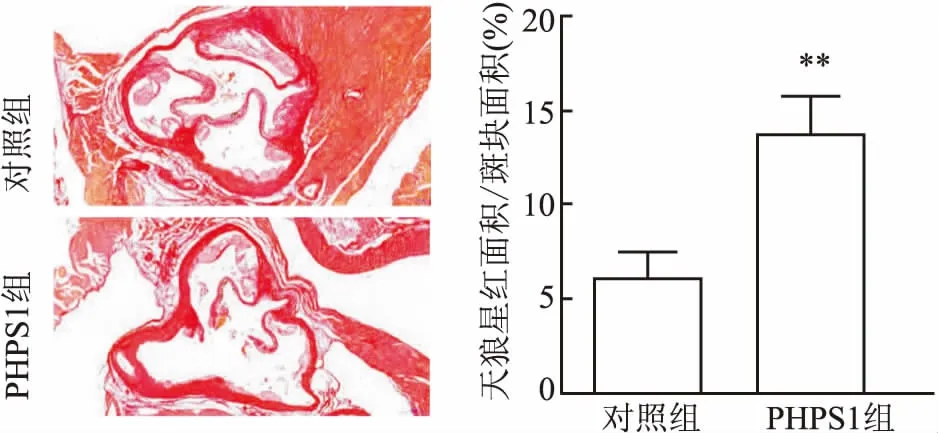
图2 主动脉根部切片天狼星红染色评估胶原成分 ×40与对照组比较:**P<0.01
2.3 斑块内容物评估对照组和实验组斑块内巨噬细胞成分阳性面积/斑块面积分别为:(0.799±0.031)、(0.621±0.043),实验组小鼠主动脉斑块内巨噬细胞阳性面积减少(F=1.911,P<0.01)。见图3;免疫荧光双染可见实验组抑制了巨噬细胞(CD 68)分泌的MMP-9的表达量,MMP-9荧光强度减弱(F=1.117,P<0.01)。见图4。

图3 两组小鼠主动脉根部切片巨噬细胞(CD68)免疫组化染色 ×40与对照组比较:**P<0.01
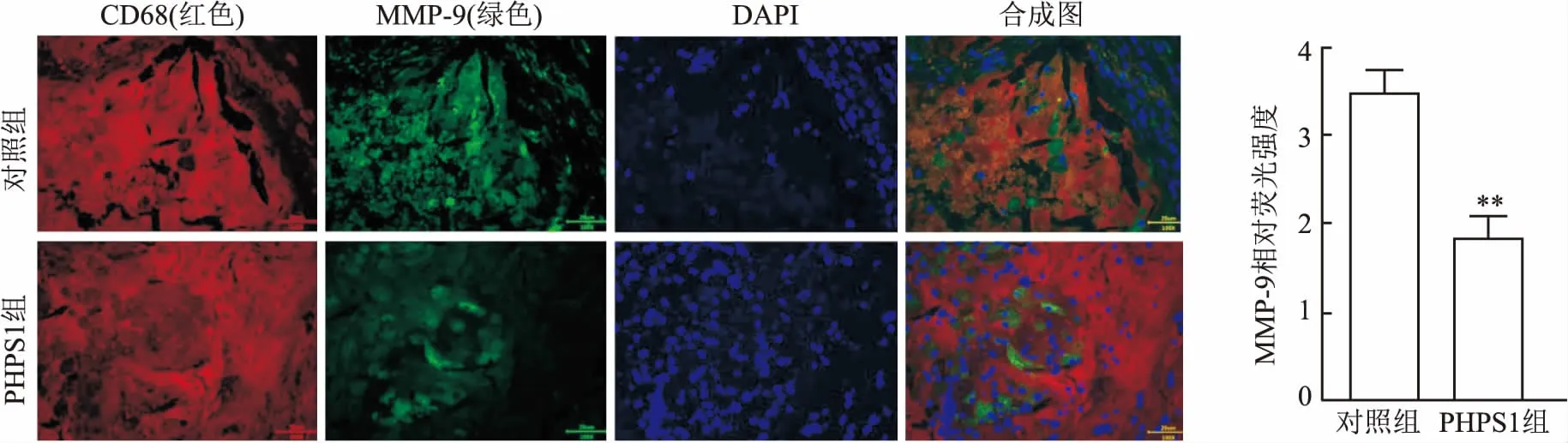
图4 免疫荧光检测小鼠主动脉根部CD68及MMP-9的表达 ×100与对照组比较:**P<0.01
2.4 Western blot检测降主动脉内蛋白水平实验结果显示,经过PHPS1处理后的小鼠降主动脉内ERK活性下降(F=1.222,P<0.01),同时伴随着其调控的下游MMP-9蛋白表达量也降低(F=37.49,P<0.01)。见图5。
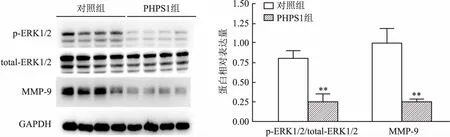
图5 Western blot检测小鼠降主动脉内ERK/p-ERK、MMP-9蛋白表达水平与对照组比较:**P<0.01
3 讨论
蛋白酪氨酸磷酸酶(protein tyrosine phosphatase, PTPase) SHP-2主要通过调控细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)包括ERK1和ERK 2(total ERK1/2)发挥作用,是参与AS进程的关键蛋白之一[4-6]。动脉粥样硬化的发展程度取决于斑块的大小、稳定性,稳定性决定了动脉管壁的状态,斑块不稳定是由于纤维帽的连续性差,厚度薄,当血流冲击时,易引起不稳定的斑块脱落,导致严重的临床后果[7-9]。斑块的纤维帽主要是由胶原构成的,胶原可以抵抗血流对血管壁的冲击,也可以保护斑块的完整性。在动脉粥样硬化的发展中,单核细胞迁移到血管内皮,分化为易损斑块中的巨噬细胞[10-12],巨噬细胞分泌基质金属蛋白酶(MMPs),可以降解不稳定斑块的纤维帽, MMP-9是MMPs的一种, MMP-9活性升高,可加速细胞外基质降解,降低动脉粥样硬化斑块的稳定性,加速斑块破裂的速度,加重AS的进展[13]。
ERK通路是参与AS进程发展的蛋白之一,也是调控基质金属蛋白酶(MMP-9)分泌的关键[13]。由于SHP-2是蛋白酪氨酸磷酸酶家族的一员[14],其主要是通过调控ERK蛋白活性而达到不同的生物学作用[3-5]。PHPS1可以特异性地结合SHP-2的生物活性区域,进而顺利打入细胞内部,所以是理想的SHP-2抑制剂[15]。该研究以3 mg/(kg·d) PHPS1腹腔注射ApoE-/-小鼠来观察SHP-2在AS中的作用,以斑块大小/动脉总面积代表动脉的堵塞或者狭窄程度。结果表明PHPS1处理后可影响小鼠主动脉根部斑块的面积,斑块面积减小。斑块内胶原成分的含量是评估斑块稳定性的重要因素之一,胶原是构成纤维帽的主要成分,经过天狼星红特异性病理染色观察斑块内胶原含量,显示PHPS1组小鼠主动脉根部切片斑块内纤维帽连续性较好并且厚度增加,提示PHPS1可以稳定斑块。AS斑块主要由平滑肌和巨噬细胞构成,其中斑块内平滑肌是分泌胶原成分的主要细胞,具有增强斑块稳定性的作用;而巨噬细胞是AS斑块内最主要的细胞成分,可以分泌多种炎症因子和MMPs降解胶原成分,促进细胞凋亡,是加速斑块进展、导致斑块不稳定的主要的细胞,通过免疫组化染色发现:PHPS1组小鼠主动脉斑块内巨噬细胞成分阳性面积减少,提示PHPS1具有抑制炎症的作用。该实验通过免疫荧光双染进一步发现CD68标记的巨噬细胞和其分泌的细胞因子MMP-9分布具有一致性,提示PHPS1可能是通过抑制MMP-9的表达进而抑制了胶原的降解。进一步,该实验通过Western blot进行验证,结果表明在经PHPS1处理后MMP-9蛋白含量减少,并检测降主动脉中ERK/p-ERK的活性(磷酸化水平),结果表明PHPS1抑制了ERK/p-ERK的磷酸化水平,提示其下游的MMP-9的表达量降低,可能是由于ERK的活性被抑制。
综上所述,该研究表明PHPS1可以通过抑制ERK通路的蛋白活性,降低基质金属蛋白酶MMP-9的表达,来保持斑块纤维帽的完整,加强动脉粥样硬化斑块的稳定性,所以该实验结果提示SHP-2的活化能够导致易损斑块不稳定性增强。该研究表明SHP-2调控ERK/P-ERK通路而影响MMP-9的表达及活性,可为AS进一步临床研究提供研究方向、思路及相对客观理论依据。
