转谷氨酰胺酶2基因敲低对肺癌细胞增殖和侵袭的抑制作用
2022-02-22张建新刘雨露朱子贵姚平波
张建新, 刘雨露, 朱子贵, 赵 红, 姚平波
肺癌是一种与吸烟、辐射、遗传、环境等因素有关的呼吸道恶性肿瘤,早期通常不表现明显症状,随病情发展可出现咳嗽、咯血、胸痛、消瘦等[1]。肺癌恶性程度较高,可以直接扩散或者经血、淋巴道转移至周围的组织,预后较差[2]。转谷氨酰胺酶2(transglutaminase 2,TGM2)属于转谷氨酰胺家族,可以催化蛋白质多肽内部的结构变化,调控蛋白分子间的相互作用,调控多种肿瘤细胞的生长和转移[3-4]。近年来研究[5]显示,TGM2高表达可以促进肺癌细胞的侵袭,在肺癌的恶性进展中发挥重要作用。但目前国内关于TGM2在肺癌中研究报道较少,且其作用于肺癌的机制尚不明确。该研究探讨了TGM2基因干扰对肺癌细胞的作用及可能机制,旨在为肺癌新靶向药物的研发提供一定的理论支撑。
1 材料与方法
1.1 材料与仪器3111型CO2培养箱购自美国Thermo Scientific公司;多功能酶标检测仪(iMark 680)购自美国Bio-Rad公司;光学显微镜(BX60型)购自日本Olympus公司;IQTM5型荧光定量PCR仪购自美国Bio-Rad公司;FACScan流式细胞仪购自美国FranklinLakes;A549细胞购自中科院上海生命科学研究院;TGM2-shRNA质粒(TGM2-shRNA1:5′-CCGGTGAGAAATACCGTGACTGCCTCTCGAGAGGC AGTCACGGTATTTCTCATTTTT-3′,作用位点为NM_004613.x-1779s1c1;TGM2-shRNA2:5′-CCGGCCACCCACCATATTGTTTGATCTCGAGATCAAACAATATG GTGGGTGGTTTTT-3′,作用位点为NM_004613.x-2519s1c1;TGM2-shRNA3:5′-CCGGAGAAATACCGTGACTGCCTTACTCGAGTAAGGCAGTCACGGTATTTC TTTTTT-3′,作用位点为NM_004613.x-1781s1c1;shRNA NC:5′-CCGGTTCTCCGAACGTGTCACGTTT CAAGAGAACGTGACACGTTCGGAGAATTTTT-3′)、TGM2 mRNA的RT-PCR引物由上海生工生物工程有限公司合成;RT-PCR反应相关试剂盒、lipofectamineTM2000试剂盒、Annexin V-FITC/PI细胞凋亡检测试剂盒购自上海源叶生物科技有限公司;兔抗人E钙黏蛋白(E-cadherin,E-cad)、N钙黏蛋白(N-cadherin,N-cad)、纤连蛋白(fibronectin,FN)和血管内皮生长因子(vascular endothelial growth factor,VEGF)、β-actin、辣根过氧化酶(horseradish peroxidase,HRP)标记羊抗兔二抗购自美国CST中国公司。
1.2 A549细胞培养及转染将A549细胞接种于含10%胎牛血清的RPMI 1640培养液,37 ℃、5% CO2培养箱中培养至80%融合时,开始进行传代培养。取对数期细胞进行脂质体转染,按照操作说明将lipofectamineTM2000分别与shRNA-NC、TGM2-shRNA1、TGM2-shRNA2和TGM2-shRNA3进行稀释混合,瞬时转染6 h后,更换为完全培养基继续培养24 h后,收取细胞。采用RT-PCR检测转染各组A549细胞中TGM2 mRNA水平,PCR上游引物:5′-CCCAGCAGGGCTTTATCTACCA-3′,下游引物:5′-GCAGATGTCTAGGATCCCATCTTCA-3′,以GAPDH为内参,采用2-ΔΔCt法分析TGM2 mRNA的相对表达量。Western blot检测转染各组A549细胞中TGM2蛋白表达水平。选择干扰后相对表达量最低的shRNA1进行后续的细胞实验。
1.3 细胞分组取对数生长期A549细胞,调整细胞浓度为1×105个/ml,将其分为对照组(Control)、shRNA-NC组(shRNA-NC)、TGM2-shRNA1组(TGM2- shRNA1)。对照组只加入lipofectamineTM2000,shRNA-NC组转染shRNA-NC,TGM2-shRNA1组转染TGM2-shRNA1。
1.4 A549细胞的克隆形成率测定取各组转染后对数生长期A549细胞,调整为单细胞悬液(1×105个/ml),以2×104个/孔接种于37 ℃、5%CO2培养箱中继续培养12~14 d,待孔中大多数克隆中的细胞数量大于50个,PBS轻轻洗涤2次,每孔加入4%多聚甲醛室温固定10 min后,每孔加入1%结晶紫染色5 min,观察每孔内A549细胞的克隆形成情况。
1.5 CCK-8法检测A549细胞的增殖取各组转染后对数生长期A549细胞,调整为单细胞悬液(1×105个/ml),以2×104个/孔接种于96孔板中培养,每组设置3个复孔,继续培养,分别于培养1、2、3、4 d进行CCK-8检测,严格按照试剂盒的说明书进行操作,采用酶标仪检测波长为450 nm时,各个孔的吸光度值。
1.6 流式细胞仪检测A549细胞凋亡取各组转染后对数生长期A549细胞,调整为单细胞悬液(1×105个/ml),PBS洗涤2次后,采用Annexin V-FITC/PI双染法进行染色,上流式细胞仪检测细胞凋亡率,严格按照凋亡试剂盒的说明书进行实验操作。
1.7 Transwell检测A549细胞的侵袭力取各组转染后对数生长期A549细胞,调整为单细胞悬液(1×105个/ml),向Transwell上室(自带Matrigel胶)加入100 μl稀释好的细胞悬液,然后加入200 μl的无血清培养基,下室为常规的含质量分数10%胎牛血清的RPMI 1640培养液,培养48 h后,取出Transwell小室,除去上腔底部剩余的细胞,采用Diff-Quik Fix固定2 min,diff-quick染色液进行染色,清水洗3次以上,显微镜下观察观察下室侵袭的细胞数。
1.8 小管形成实验检测A549细胞小管形成数目取各组转染后对数生长期A549细胞,调整为单细胞悬液(1×105个/ml),以2×104个/孔接种于铺Matrigel基质胶(冰上预冷,避免气泡出现)的24孔板,进行常规培养,每间隔4 h,密切监测细胞小管结构变化,在显微镜下观察A549细胞的小管结构,继续培养16 h后,计数细胞小管形成数目。
1.9 Western blot检测E-cad、N-cad、FN和VEGF蛋白表达水平取各组转染后对数生长期A549细胞,采用细胞裂解液提取A549细胞的总蛋白,并进行蛋白定量,经聚丙烯酰胺凝胶电泳后,转膜至PVDF,加入5%脱脂牛奶室温封闭2 h,加入一抗(分别为E-cad、N-cad、FN和VEGF,β-actin为内参,稀释比例均为1 ∶1 000),4 ℃孵育过夜,洗膜缓冲液洗膜后加入二抗(稀释比例为1 ∶5 000),室温孵育2 h,化学发光显影,采用凝胶图像分析系统对比条带强弱。

2 结果
2.1 TGM2基因干扰后肺癌细胞中TGM2表达RT-PCR和Western blot检测结果显示,TGM2-shRNA组细胞TGM2 mRNA水平和蛋白表达低于shRNA-NC组(F=277.416、348.639,P<0.05),其中转染TGM2-shRNA1后TGM2 mRNA水平和蛋白表达最低。见图1。
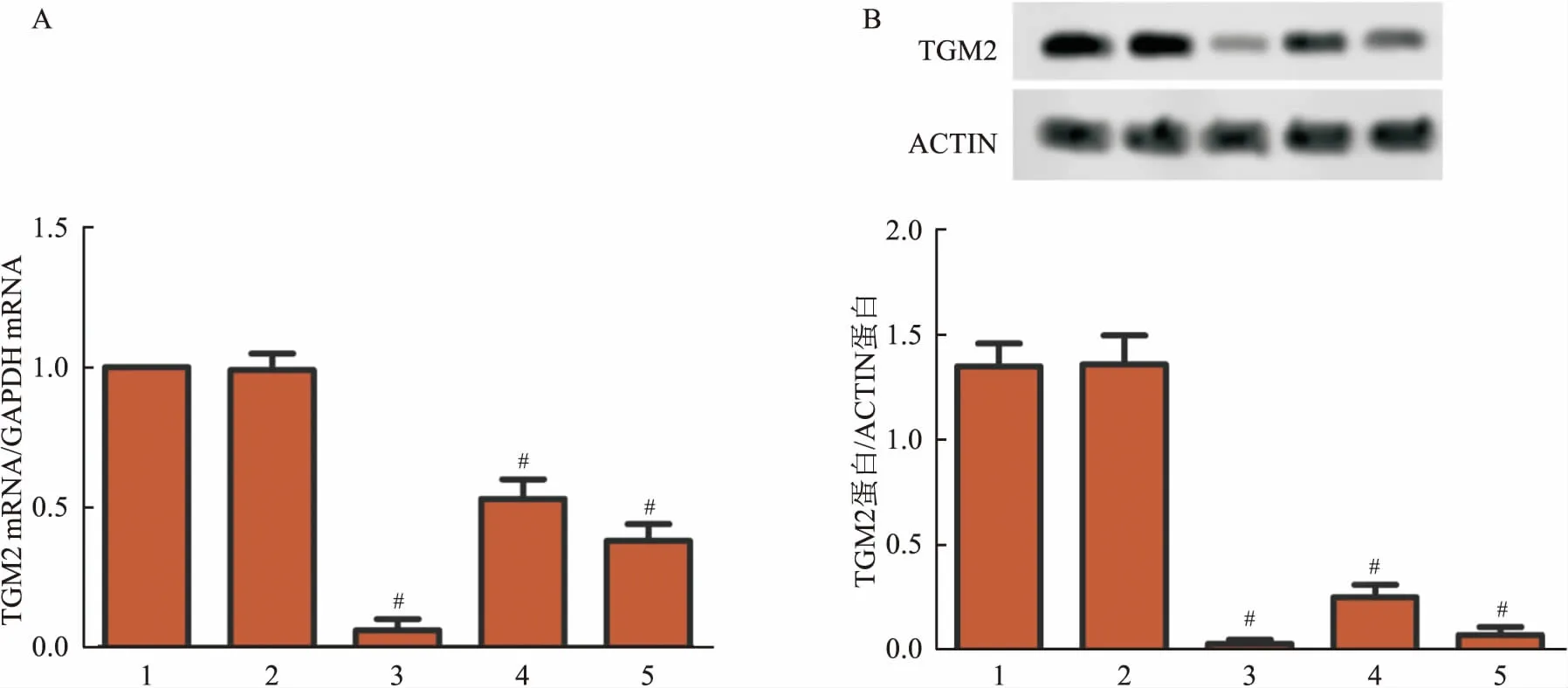
图1 TGM2基因干扰后肺癌细胞中TGM2表达A:RT-PCR检测A549细胞mRNA水平;B:Western blot检测A549细胞TGM2蛋白表达;1:对照组;2:shRNA-NC组;3:TGM2-shRNA1组;4:TGM2-shRNA2组;5:TGM2-shRNA3组;与shRNA-NC组比较:#P<0.05
2.2 TGM2基因干扰对肺癌细胞克隆形成率的影响克隆形成实验结果显示,对照组与shRNA-NC组A549细胞的克隆形成率差异无统计学意义;与shRNA-NC组比,TGM2-shRNA1组A549细胞的克隆形成率降低(F=62.534,P<0.05)。见图2。
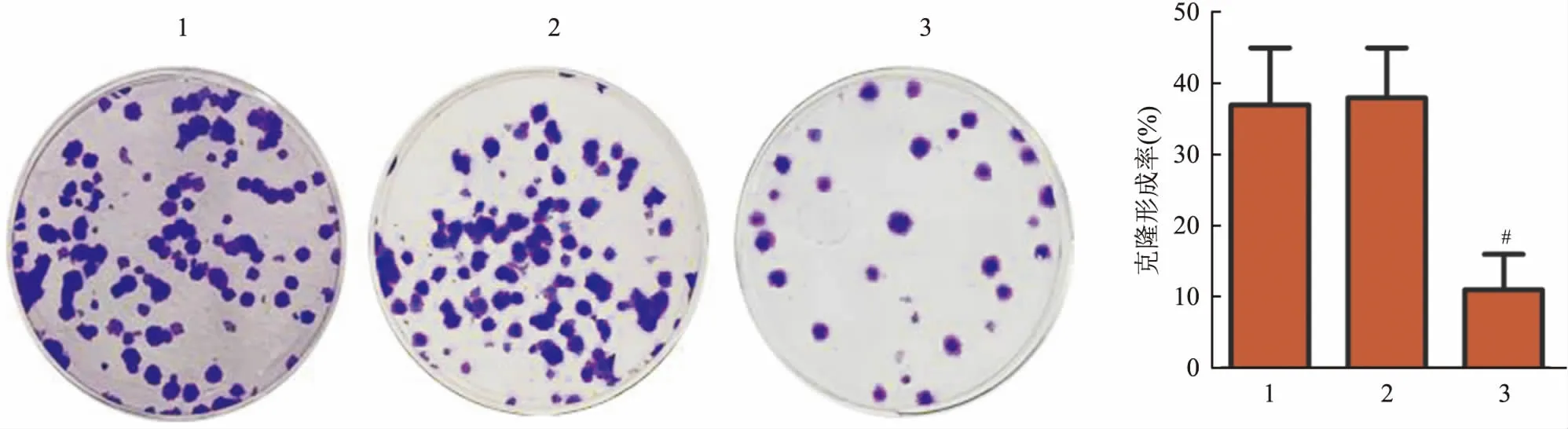
图2 TGM2基因干扰对肺癌细胞克隆形成率的影响 结晶紫染色×100A:克隆形成实验检测A549细胞克隆形成情况;B:A549细胞克隆形成率;1:对照组;2:shRNA-NC组;3:TGM2-shRNA1组;与shRNA-NC组比较:#P<0.05
2.3 TGM2基因干扰对肺癌细胞增殖活性的影响CCK-8检测结果显示,对照组与shRNA-NC组A549细胞的增殖活性差异无统计学意义;与shRNA-NC组比,TGM2-shRNA1组A549细胞的增殖活性降低(F=47.339,P<0.05)。见图3。

图3 TGM2基因干扰对肺癌细胞的增殖活性的影响与shRNA-NC组比较:#P<0.05
2.4 TGM2基因干扰对肺癌细胞凋亡率的影响流式细胞仪检测结果显示,与shRNA-NC组相比,对照组A549细胞的凋亡率差异无统计学意义; TGM2-shRNA1组A549细胞的凋亡率升高,差异有统计学意义(F=75.827,P<0.05)。见图4。

图4 TGM2基因干扰对肺癌细胞凋亡率的影响A:流式细胞仪检测A549细胞凋亡;B:A549细胞凋亡率;1:对照组;2:shRNA-NC组;3:TGM2-shRNA1组;与shRNA-NC组比较:#P<0.05
2.5 TGM2基因干扰对肺癌细胞侵袭能力的影响Transwell检测结果显示,与shRNA-NC组相比,对照组侵袭A549细胞数差异无统计学意义;TGM2-shRNA1组侵袭A549细胞数下降,差异有统计学意义(F=52.930,P<0.05)。见图5。

图5 TGM2基因干扰对肺癌细胞侵袭能力的影响 Diff-Quik×400A:Transwell检测A549细胞侵袭;B:侵袭A549细胞数;1:对照组;2:shRNA-NC组;3:TGM2-shRNA1组;与shRNA-NC组比较:#P<0.05
2.6 TGM2基因干扰对肺癌细胞侵袭相关蛋白的影响Western blot检测结果显示,与shRNA-NC组相比,对照组A549细胞E-cad、N-cad和FN蛋白表达差异无统计学意义;TGM2-shRNA1组A549细胞E-cad蛋白表达升高,N-cad和FN蛋白表达下降,差异有统计学意义(F=76.315、143.342、102.716,P<0.05)。见图6。
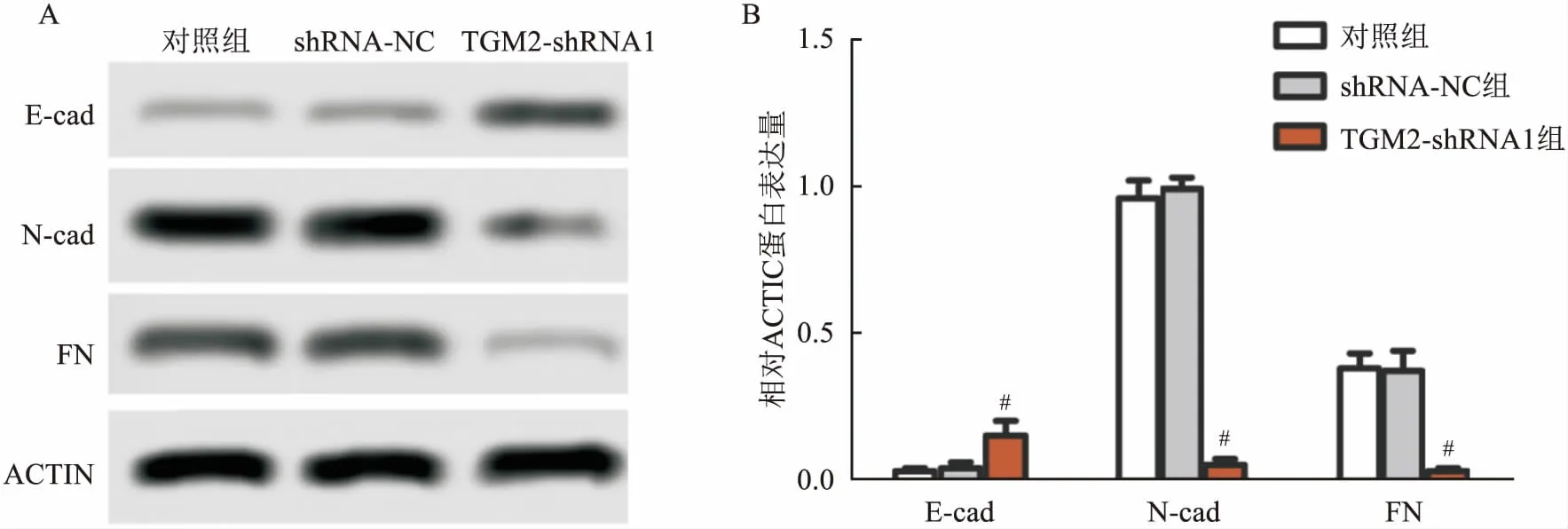
图6 TGM2基因干扰对肺癌细胞侵袭相关蛋白的影响A:Western blot检测A549细胞蛋白表达图谱;B:A549细胞E-cad、N-cad和FN蛋白相对表达量;与shRNA-NC组比较:#P<0.05
2.7 TGM2基因干扰对肺癌细胞小管形成数及VEGF蛋白表达的影响小管形成实验结果显示,对照组与shRNA-NC组A549细胞小管形成数差异无统计学意义;与shRNA-NC组比,TGM2-shRNA1组A549细胞小管形成数减少(F=53.373,P<0.05)。Western blot检测结果显示,与shRNA-NC组相比,对照组A549细胞VEGF蛋白表达差异无统计学意义;TGM2-shRNA1组A549细胞VEGF蛋白表达下降,差异有统计学意义(F=162.451,P<0.05)。见图7。
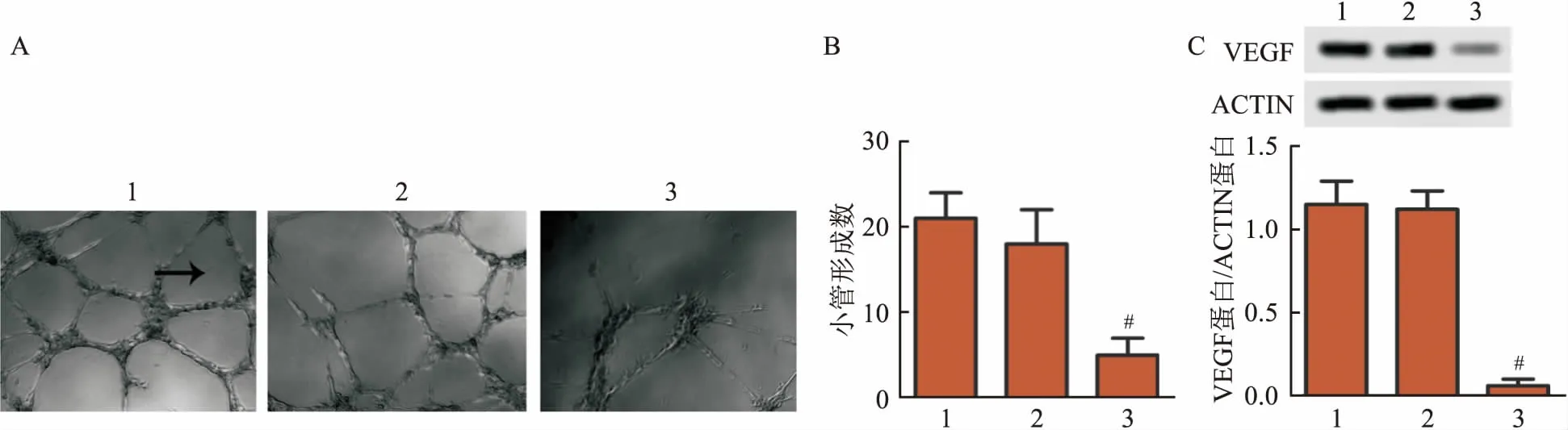
图7 TGM2基因干扰对肺癌细胞小管形成数及VEGF蛋白表达的影响A:小管形成实验检测A549细胞小管形成数,箭头所指为小管 ×40;B:A549细胞小管形成数;C:Western blot检测A549细胞蛋白表达;1:对照组;2:shRNA-NC组;3:TGM2-shRNA1组;与shRNA-NC组比较:#P<0.05
3 讨论
肺癌是一种预后较差的呼吸道恶性肿瘤,近年来有研究基于肺癌的发病机制,研发了多种小分子靶向药物,并将其应用于临床,取得了较好的临床疗效,可以改善晚期肺癌患者的预后[6]。TGM2是近年来研究比较多的一种广泛存在于人体的蛋白质酰基转移酶,在胃癌、乳腺、肺癌等许多恶性肿瘤中均出现表达异常升高,且异常升高的TGM2可以调控肿瘤细胞的恶性进展。该研究中,相较于正常的A549细胞,TGM2基因沉默后,A549细胞的克隆形成率和增殖活性降低,细胞的凋亡率升高。研究结果表明,TGM2基因可以调控A549细胞恶性生物学行为,TGM2基因沉默可以抑制肺癌A549细胞的生长,诱导细胞凋亡。研究[7]显示,TGM2高表达可以调节Wnt/β-catenin信号通路表达,促进结直肠癌细胞的血管生成,还可以激活NF-κB信号通路,改变肿瘤微环境,促进肿瘤细胞增殖,抑制细胞凋亡,提示TGM2基因可能通过调节相关蛋白的表达,调控肺癌的恶性进展,有望成为肺癌治疗的新靶点,但其具体的调控机制有待于进一步研究。
该研究中,TGM2基因沉默后,A549细胞的侵袭细胞数降低。肺癌细胞的侵袭力是肿瘤细胞侵犯邻近血管、组织的基础,是影响患者肺癌预后的关键,提示TGM2基因沉默可以抑制肺癌的转移,改善患者预后。该研究中,TGM2基因沉默可以促进A549细胞E-cad蛋白表达,抑制N-cad和FN蛋白表达水平。E-cad和N-cad蛋白均为机体重要的Ca2+依赖的跨膜蛋白,其中E-cad广泛分布于多种正常上皮细胞,对于维持细胞形态和细胞间连接具有重要的作用,可以介导肿瘤细胞间的相互作用,其表达下调是细胞发生间质转换的标志[8]。N-cad在正常上皮细胞表达水平较低,N-cad蛋白表达上调可以诱导细胞表型发生间质转换,介导肿瘤细胞表面的黏附作用,增强肺癌细胞侵袭的能力[9]。FN是广泛存在于细胞表面的蛋白,是细胞外基质的重要组成成分,也可以介导细胞间黏附作用,参与肿瘤细胞的迁移、黏附、侵袭等多种生物学过程[10]。Shan et al[11]研究表明,TGM2可以调节细胞外基质稳定性,诱导细胞内骨架重建,调节肿瘤细胞的间质转化和侵袭,提示TGM2基因沉默可以影响细胞外基质的形成,抑制A549细胞的表型转换,抑制肿瘤转移。
该研究中,TGM2基因沉默后,A549细胞的小管形成数降低。小管形成实验是临床常用的一种评估血管生成的方法,可以反应肿瘤细胞的血管形成情况[12]。已有研究[13]显示,血管形成数可以反映肿瘤细胞的增殖和侵袭能力,抑制肿瘤细胞的血管形成,可以抑制肿瘤的恶性进展,提示TGM2基因沉默后,A549细胞的血管形成减少,增殖活性和侵袭能力下降。该研究中,TGM2基因沉默后,A549细胞VEGF蛋白表达降低。VEGF是细胞内最重要的促血管生成因子,可以促进肺癌细胞血管的生成,为肺癌细胞恶性增殖提供营养,同时也为肺癌的侵袭和迁移提供途径[14]。Lee et al[15]研究显示,TGM2干扰可以抑制VEGF蛋白表达,抑制VEGF诱导的纤维化,促进血管内皮E-cad蛋白表达,提示TGM2基因沉默可能通过抑制A549细胞VEGF蛋白的表达,抑制肺癌细胞的恶性生物学行为。
综上所述,TGM2基因沉默可以抑制A549细胞VEGF蛋白表达,抑制血管形成,抑制肺癌细胞的增殖和侵袭,诱导细胞凋亡。
