3-二氟甲基-1-甲基吡唑-4-羧酸肟酯衍生物的合成及抑菌活性
2022-02-22张兴甲魏志敏王宇佳杨龙港袁含笑冯俊涛高艳清马志卿
张兴甲, 魏志敏, 王宇佳, 杨龙港, 袁含笑,冯俊涛, 高艳清, 雷 鹏, 马志卿
(西北农林科技大学 植物保护学院,陕西 杨凌 712100; 陕西省生物农药工程技术研究中心,陕西 杨凌 712100)
吡唑是一类含氮五元杂环化合物,具有广泛的杀虫[1-2]、杀菌[3-4]和除草[5]活性。吡唑环上有4 个取代位点,分别可形成吡唑-1-基、吡唑-3-基、吡唑-4-基和吡唑-5-基共4 类化合物。其中,吡唑-4-甲酰类化合物主要表现出良好的杀菌活性,是农用杀菌剂研发的热点结构,相关商品化品种有氟苯吡菌胺 (fluxapyroxad)、苯并烯氟菌唑 (benzovindiflupyr)和氟唑菌酰羟胺 (pydiflumetofen) 等[6](图式1)。

图式 1 氟苯吡菌胺、苯并烯氟菌唑和氟唑菌酰羟胺的化学结构式Scheme 1 Structural formula of fluxapyroxad, benzovindiflupyr and pydiflumetofen
肟类化合物 (肟醚和肟酯) 具有优良的生物活性[7-9],是农用杀菌剂中常见结构之一,如肟菌酯(trifloxystrobin)、烯肟菌胺 (fenaminstrobin) 和醚菌酯 (kresoxim-methyl) 等均含有肟结构。本研究组前期报道了系列具有较好抑菌活性的吡唑-5-羧酸肟酯衍生物,其中,化合物L1 (图式2) 对番茄灰霉病菌Botrytis cinerea的EC50值为7.04 μg/mL,优于商品化对照药剂肟菌酯 (19.79 μg/mL)[10]。为了发现结构简单并具有高抑菌活性的农药新分子,本研究以L1 为先导化合物,探讨吡唑环不同位置取代对抑菌活性的影响,设计合成了18 个未见文献报道的吡唑-4-羧酸肟酯衍生物 (图式2 和图式3),并测定了其对4 种植物病原菌的抑菌活性。

图式 2 目标化合物的设计思路Scheme 2 Design strategy of the target compounds

图式 3 目标化合物的合成路线Scheme 3 Synthetic routes of the target compounds
1 实验部分
1.1 仪器与试剂
Bruker AVANCE III 500 MHz 或 400 MHz 核磁共振仪 (以CDCl3为溶剂,TMS 为内标);AB SCIEX 高分辨质谱仪;Bruker D8 Venture X 射线单晶衍射仪;X-6 型数字熔点仪 (北京泰克仪器有限公司);柱层析硅胶 (200~300 目) 和薄层层析硅胶板 (GF254型) 均购自青岛海洋化工厂;先导化合物L1(本课题组自制[10]);对照药剂97%肟菌酯原药(上海毕得医药科技股份有限公司);其余所用试剂均为市售分析纯或化学纯,除特别注明外,所用溶剂未经无水处理。
1.2 化合物的合成
1.2.1 化合物取代苯甲醛肟 (3) 的合成 参考文献方法[11]进行。在100 mL 单口瓶中,加入3.28 g 无水醋酸钠 (40 mmol)、2.08 g 盐酸羟胺 (30 mmol)和40 mL 80%的乙醇水溶液,室温下搅拌30 min后,加入取代苯甲醛 (20 mmol),加热回流1 h,薄层色谱 (TLC,V(石油醚) :V(乙酸乙酯) = 5 : 1)监测至反应终点。旋转蒸发浓缩后加入50 mL 二氯甲烷溶解,用50 mL 水洗涤3 次,有机相浓缩,柱层析纯化 (V(石油醚) :V(乙酸乙酯) =15 : 1),干燥后得化合物3。
1.2.2 化合物3-二氟甲基-1-甲基吡唑-4-羧酸 (8)的合成 参考文献[12]的方法合成。
1.2.3 目标化合物9 的合成 参考文献方法[13]进行。在50 mL 单口瓶中,加入化合物8 (0.97 g,5.5 mmol)、二环己基碳二亚胺 (DCC) (1.13 g,5.5 mmol)、取代苯甲醛肟 (3,5.0 mmol) 和20 mL二氯甲烷,室温下搅拌过夜。反应完成后,经柱层析 (V(石油醚) :V(乙酸乙酯) = 4 : 1)纯化,干燥后即得目标化合物9。
化合物9 的结构均经1H NMR、13C NMR 和HRMS 确证,相关数据如下。
(E)-2-甲基苯甲醛-O-(3-二氟甲基-1-甲基-1H-吡唑-4-羰基) 肟 (9a):白色固体,收率 73%,m.p. 114.3~115.4 ℃.1H NMR (500 MHz, CDCl3),δ: 8.71 (s, 1H), 8.03 (s, 1H), 7.87(d,J= 7.6 Hz, 1H), 7.37 (dd,J= 7.4, 6.6 Hz, 1H), 7.28 – 7.03(m, 3H), 4.00 (s, 3H), 2.51 (s, 3H).13C NMR (125 MHz,CDCl3),δ: 159.22, 155.86, 146.67 (t,2J= 25.3 Hz), 138.29,135.19, 131.53, 131.08, 128.53, 128.33, 126.39, 111.07, 109.33(t,1J= 237.1 Hz), 39.79, 19.98. HRMS:C14H13F2N3NaO2[M + Na]+,计算值316.0868,测试值316.0863.
(E)-3-甲基苯甲醛-O-(3-二氟甲基-1-甲基-1H-吡唑-4-羰基) 肟 (9b):白色固体,收率 95%,m.p. 114.6~115.7 ℃.1H NMR (500 MHz, CDCl3),δ: 8.42 (s, 1H), 8.03 (s, 1H), 7.65(s, 1H), 7.52 (d,J= 7.1 Hz, 1H), 7.35 – 7.30 (m, 2H), 7.12 (t,2JFH= 53.8 Hz, 1H), 4.00 (s, 3H), 2.39 (s, 3H).13C NMR(125 MHz, CDCl3),δ: 159.21, 156.93, 146.57 (t,2J= 25.1 Hz),138.83, 135.31, 132.74, 129.85, 128.80, 128.64, 126.03,111.04, 109.36 (t,1J= 237.1 Hz), 39.79, 21.18. HRMS:C14H13F2N3NaO2[M + Na]+,计算值316.0868,测试值316.0875.
(E)-4-甲基苯甲醛-O-(3-二氟甲基-1-甲基-1H-吡唑-4-羰基) 肟 (9c):白色固体,收率 47%,m.p. 136.0~137.1 ℃.1H NMR (400 MHz, CDCl3),δ: 8.43 (s, 1H), 8.03 (s, 1H), 7.67(d,J= 8.1 Hz, 2H), 7.25 (d,J= 7.6 Hz, 2H), 7.13 (t,2JFH=53.8 Hz, 1H), 4.01 (s, 3H), 2.41 (s, 3H).13C NMR (100 MHz,CDCl3),δ: 159.28, 156.77, 146.51 (t,2J= 25.0 Hz), 142.53,135.29, 129.68, 128.46, 127.07, 111.03, 109.33 (t,1J= 237.1 Hz), 39.83, 21.65. HRMS:C14H13F2N3NaO2[M + Na]+,计算值316.0868,测试值316.0877.
(E)-2-溴苯甲醛-O-(3-二氟甲基-1-甲基-1H-吡唑-4-羰基) 肟 (9d):白色固体,收率 63%,m.p. 131.1~132.4 ℃.1H NMR (500 MHz, CDCl3),δ: 8.86 (s, 1H), 8.11 (dd,J= 7.6,1.7 Hz, 1H), 8.05 (s, 1H), 7.62 (dd,J= 7.8, 1.1 Hz, 1H), 7.40 –7.33 (m, 2H), 7.14 (t,2JFH= 53.8 Hz, 1H), 4.01 (s, 3H).13C NMR (125 MHz, CDCl3),δ: 159.01, 155.98, 146.87 (t,2J=25.1 Hz), 135.25, 133.33, 133.03, 129.54, 128.87, 127.91,125.00, 110.66, 109.25 (t,1J= 237.1 Hz), 39.86. HRMS:C13H10BrF2N3NaO2[M + Na]+,计算值379.9817,测试值379.9816.
(E)-3-溴苯甲醛-O-(3-二氟甲基-1-甲基-1H-吡唑-4-羰基) 肟 (9e):白色固体,收率 88%,m.p. 139.6~141.9 ℃.1H NMR (500 MHz, CDCl3),δ: 8.41 (s, 1H), 8.04 (s, 1H), 7.97(s, 1H), 7.69 (d,J= 7.6 Hz, 1H), 7.62 (d,J= 8.0 Hz, 1H), 7.33(t,J= 7.9 Hz, 1H), 7.09 (t,2JFH= 53.8 Hz, 1H), 4.01 (s, 3H).13C NMR (125 MHz, CDCl3),δ: 155.32, 146.60 (t,2J=25.7 Hz), 135.51, 134.81, 132.00, 131.07, 130.46, 127.14,123.14, 110.73, 109.28 (t,1J= 236.9 Hz), 39.84. HRMS:C13H10BrF2N3NaO2[M + Na]+,计算值379.9817,测试值379.9802.
(E)-4-溴苯甲醛-O-(3-二氟甲基-1-甲基-1H-吡唑-4-羰基) 肟 (9f):白色固体,收率 45%,m.p. 158.2~159.3 ℃.1H NMR (500 MHz, CDCl3),δ: 8.42 (s, 1H), 8.03 (s, 1H), 7.66(d,J= 8.5 Hz, 2H), 7.60 (d,J= 8.5 Hz, 2H), 7.09 (t,2JFH=53.8 Hz, 1H), 4.01 (s, 3H).13C NMR (100 MHz, CDCl3),δ:161.71, 155.68, 153.92, 146.58 (t,2J= 25.3 Hz), 135.49,132.30, 130.97, 129.80, 116.36, 110.18 (t,1J= 236.5 Hz),39.86. HRMS:C13H10BrF2N3NaO2[M + Na]+,计算值379.9817,测试值379.9816.
(E)-2-氯苯甲醛-O-(3-二氟甲基-1-甲基-1H-吡唑-4-羰基) 肟 (9g):白色固体,收率 91%,m.p. 137.1~138.0 ℃.1H NMR (500 MHz, CDCl3),δ: 8.89 (s, 1H), 8.12 (d,J= 7.5 Hz, 1H), 8.05 (s, 1H), 7.43 – 7.42 (m, 2H), 7.35 – 7.32 (m,1H), 7.14 (t,2JFH= 53.8 Hz, 1H), 4.01 (s, 3H).13C NMR (125 MHz, CDCl3),δ: 158.99, 153.67, 146.81 (t,2J= 25.6 Hz),135.25, 135.13, 132.81, 130.03, 128.45, 127.93, 127.29, 110.64,109.26 (t,1J= 237.1 Hz), 39.81. HRMS:C13H10ClF2N3NaO2[M + Na]+,计算值336.0322,测试值336.0329.
(E)-3-氯苯甲醛-O-(3-二氟甲基-1-甲基-1H-吡唑-4-羰基) 肟 (9h):白色固体,收率 52%,m.p. 128.1~129.1 ℃.1H NMR (500 MHz, CDCl3),δ: 8.41 (s, 1H), 8.03 (s, 1H), 7.81(s, 1H), 7.64 (d,J= 7.6 Hz, 1H), 7.47 (d,J= 7.4 Hz, 1H), 7.39(t,J= 7.8 Hz, 1H), 7.09 (t,2JFH= 53.8 Hz, 1H), 4.00 (s, 3H).13C NMR (125 MHz, CDCl3),δ: 158.93, 155.41, 146.59 (t,2J=25.1 Hz), 135.46, 135.16, 131.85, 131.75, 130.22, 128.11,126.69, 110.70, 109.39 (t,1J= 237.1 Hz), 39.83. HRMS:C13H10ClF2N3NaO2[M + Na]+,计算值336.0322,测试值336.0324.
(E)-4-氯苯甲醛-O-(3-二氟甲基-1-甲基-1H-吡唑-4-羰基) 肟 (9i):白色固体,收率 52%,m.p. 163.2~164.3 ℃.1H NMR (500 MHz, CDCl3),δ: 8.43 (s, 1H), 8.03 (s, 1H), 7.73(d,J= 8.5 Hz, 2H), 7.43 (d,J= 8.5 Hz, 2H), 7.09 (t,2JFH=53.8 Hz, 1H), 4.00 (s, 3H).13C NMR (125 MHz, CDCl3),δ:159.01, 155.56, 146.55 (t,2J= 25.3 Hz), 138.08, 135.44,129.65, 129.34, 128.49, 110.83, 109.40 (t,1J= 237.1 Hz), 39.82.HRMS:C13H10ClF2N3NaO2[M + Na]+,计算值336.0322,测试值336.0325.
(E)-3-氟苯甲醛-O-(3-二氟甲基-1-甲基-1H-吡唑-4-羰基) 肟 (9j):白色固体,收率 82%,m.p. 189.6~190.4 ℃.1H NMR (500 MHz, CDCl3),δ: 8.74 (s, 1H), 8.08 (t,J= 6.9 Hz, 1H), 8.04 (s, 1H), 7.49 (dd,J= 13.6, 6.2 Hz, 1H), 7.25 –7.02 (m, 3H), 4.01 (s, 3H).13C NMR (100 MHz, CDCl3),δ:162.87 (d,1J= 247.8 Hz), 158.95, 155.60, 146.56 (t,2J= 25.6 Hz), 135.47, 132.06 (d,3J= 7.8 Hz), 130.61 (d,3J= 8.1 Hz),124.60 (d,4J= 3.1 Hz), 118.95 (d,2J= 21.4 Hz), 114.76 (d,2J=23.1 Hz), 110.72, 109.36 (t,1J= 237.1 Hz), 39.86. HRMS:C13H10F3N3NaO2[M + Na]+,计算值320.0617,测试值320.0632.
(E)-4-氟苯甲醛-O-(3-二氟甲基-1-甲基-1H-吡唑-4-羰基) 肟 (9k):白色固体,收率 96%,m.p. 143.5~144.9 ℃.1H NMR (500 MHz, CDCl3),δ: 8.44 (s, 1H), 8.03 (s, 1H), 7.79(dd,J= 8.6, 5.4 Hz, 2H), 7.14 (t,J= 8.6 Hz, 2H), 7.10 (t,2JFH= 53.8 Hz, 1H), 4.01 (s, 3H).13C NMR (125 MHz,CDCl3),δ: 164.94 (d,1J= 253.4 Hz), 159.09, 155.55, 146.54(t,2J= 25.6 Hz), 135.40, 130.58 (d,3J= 8.9 Hz), 126.26,116.28 (d,2J= 22.2 Hz), 110.92, 109.40 (t,1J= 236.9 Hz),39.80. HRMS:C13H10F3N3NaO2[M + Na]+,计算值320.0617,测试值320.0621.
(E)-4-叔丁基苯甲醛-O-(3-二氟甲基-1-甲基-1H-吡唑-4-羰基) 肟 (9l):白色固体,收率 77%,m.p. 126.3~127.8 ℃.1H NMR (400 MHz, CDCl3),δ: 8.43 (s, 1H), 8.03 (s, 1H), 7.71(d,J= 8.4 Hz, 2H), 7.46 (d,J= 8.4 Hz, 2H), 7.14 (t,2JFH=53.8 Hz, 1H), 4.00 (s, 3H), 1.34 (s, 9H).13C NMR (100 MHz,CDCl3),δ: 159.28, 156.68, 155.60, 146.53 (t,2J= 25.1 Hz),135.28, 128.34, 127.03, 125.94, 111.03, 109.32 (t,1J= 237.0 Hz),39.83, 35.08, 31.11. HRMS:C17H19F2N3NaO2[M + Na]+,计算值358.1338,测试值358.1343.
(E)-4-甲氧基苯甲醛-O-(3-二氟甲基-1-甲基-1H-吡唑-4-羰基) 肟 (9m):白色固体,收率 47%,m.p. 133.6~134.7 ℃.1H NMR (500 MHz, CDCl3),δ: 8.40 (s, 1H), 8.04 (s, 1H),7.72 – 7.68 (m, 1H), 7.51 – 7.48 (m, 1H), 7.28 – 7.23 (m, 2H),7.08 (t,2JFH= 53.8 Hz, 1H), 5.30 (s, 3H), 4.01 (s, 3H).13C NMR (100 MHz, CDCl3),δ: 162.56, 159.36, 156.35, 146.46 (t,2J= 25.0 Hz), 135.27, 130.24, 122.30, 114.42, 111.12, 109.33(t,1J= 237.1 Hz), 55.43, 39.83. HRMS:C14H13F2N3NaO3[M + Na]+,计算值332.0817,测试值332.0820.
(E)-4-三氟甲氧基苯甲醛-O-(3-二氟甲基-1-甲基-1H-吡唑-4-羰基) 肟 (9n):白色固体,收率 54%,m.p. 110.8~111.8 ℃.1H NMR (500 MHz, CDCl3),δ: 8.46 (s, 1H), 8.03 (s,1H), 7.83 (d,J= 8.7 Hz, 2H), 7.29 (d,J= 8.3 Hz, 2H), 7.10 (t,2JFH= 53.8 Hz, 1H), 4.00 (s, 3H).13C NMR (125 MHz,CDCl3),δ: 159.02, 155.25, 151.68, 146.57 (t,2J= 25.6 Hz),135.47, 130.11, 128.53, 121.37, 121.11, 110.75, 109.41 (t,1J=237.0 Hz), 39.83. HRMS:C14H10F5N3NaO3[M + Na]+,计算值386.0535,测试值386.0533.
(E)-4-三氟甲基苯甲醛-O-(3-二氟甲基-1-甲基-1H-吡唑-4-羰基) 肟 (9o):白色固体,收率 55%,m.p. 142.7~143.2 ℃.1H NMR (500 MHz, CDCl3),δ: 8.51 (s, 1H), 8.05 (s, 1H), 7.91(d,J= 8.1 Hz, 2H), 7.72 (d,J= 8.2 Hz, 2H), 7.09 (t,2JFH=53.8 Hz, 1H), 4.01 (s, 3H).13C NMR (100 MHz, CDCl3),δ:158.88, 155.26, 146.56 (t,2J= 25.6 Hz), 135.55, 133.36 (t,3J=16.4 Hz), 128.71, 125.93 (q,4J= 3.7 Hz), 123.61 (q,1J=272.5 Hz), 110.53, 109.39 (t,1J= 237.1 Hz), 39.88. HRMS:C14H10F5N3NaO2[M + Na]+,计算值370.0585,测试值370.0595.
(E)-2,4-二氟苯甲醛-O-(3-二氟甲基-1-甲基-1H-吡唑-4-羰基) 肟 (9p):白色固体,收率 78%,m.p. 106.7~107.3 ℃.1H NMR (500 MHz, CDCl3),δ: 8.67 (s, 1H), 8.10 (dd,J=14.9, 8.3 Hz, 1H), 8.03 (s, 1H), 7.21 – 6.96 (m, 2H), 6.92 –6.88 (m, 1H), 4.01 (s, 3H).13C NMR (125 MHz, CDCl3),δ:158.60, 153.87, 146.60 (t,2J= 25.8 Hz), 135.77, 132.69 (d,2J= 33.8 Hz), 132.34, 128.23, 125.08, 123.89, 121.72, 110.23,109.49 (t,1J= 237.1 Hz), 39.86. HRMS:C13H9F4N3NaO2[M + Na]+,计算值338.0523,测试值338.0524.
(E)-3,5-二 (三氟甲基) 苯甲醛-O-(3-二氟甲基-1-甲基-1H-吡唑-4-羰基) 肟 (9q):白色固体,收率 89%,m.p.128.7~129.7 ℃.1H NMR (500 MHz, CDCl3),δ: 8.57 (s, 1H),8.25 (s, 2H), 8.07 (s, 1H), 8.00 (s, 1H), 7.05 (t,2JFH= 53.8 Hz,1H), 4.02 (s, 3H).13C NMR (100 MHz, CDCl3),δ: 158.62,153.87, 146.58 (t,2J= 26.0 Hz), 135.77, 132.64 (q,2J=34.1 Hz), 132.28, 128.23 (d,4J= 2.9 Hz), 125.08 (dt,J= 7.2,3.6 Hz), 122.78 (d,1J= 272.9 Hz), 110.17, 109.46 (t,1J=237.1 Hz), 39.88. HRMS:C15H9F8N3NaO2[M + Na]+,计算值438.0459,测试值438.0453.
(E)-2-氯-6-氟苯甲醛-O-(3-二氟甲基-1-甲基-1H-吡唑-4-羰基) 肟 (9r):白色固体,收率 88%,m.p. 152.5~153.4 ℃.1H NMR (500 MHz, CDCl3),δ: 8.77 (s, 1H), 8.06 (s, 1H), 7.42 –6.37 (m, 1H), 7.30 (d,J= 8.1 Hz, 1H), 7.21 – 6.99 (m, 2H),4.02 (s, 3H).13C NMR (125 MHz, CDCl3),δ: 159.00, 155.24,151.67, 146.55 (t,2J= 25.5 Hz), 135.45, 130.09, 128.51,121.35, 121.09, 119.30, 110.72, 109.40 (t,1J= 237.0 Hz),39.82. HRMS:C13H9ClF3N3NaO2[M + Na]+,计算值354.0228,测试值354.0228.
为进一步确定目标化合物的结构,选取9g 对其进行X 射线单晶衍射分析。将9g 溶解于乙酸乙酯中,配制成适当浓度的药液,静置。待缓慢挥发溶剂后析出无色、透明、符合单晶衍射要求的晶体,用于X 射线衍射分析。
1.3 抑菌活性测试
采用菌丝生长速率法[14]测定目标化合物对4种植物病原菌的抑制活性。供试菌种分别为番茄灰霉病菌Botrytis cinerea、油菜菌核病菌Sclerotinia sclerotiorum、苹果树腐烂病菌Valsa mali和小麦全蚀病菌Gaeumannomyces gramini,由西北农林科技大学陕西省生物农药工程技术研究中心提供。试验药剂为目标化合物9a~9r、先导化合物L1 和肟类商品化对照药剂肟菌酯。
选取50 μg/mL 下抑制率大于80%的化合物测定其EC50值。依据上述方法,分别测试化合物质量浓度在25、12.5、6.25、3.13、1.56 和0.78 μg/mL时的抑制率,然后计算EC50值和95% 置信限。
2 结果与讨论
2.1 目标化合物的合成
根据逆合成分析,目标化合物可由取代苯甲醛肟 (3) 和3-二氟甲基-1-甲基-1H-吡唑-4-羧酸 (8)反应得到。首先,取代苯甲醛 (1) 与盐酸羟胺 (2)经缩合反应制备得到中间体3。再以4,4-二氟乙酰乙酸乙酯 (4) 和原甲酸三乙酯 (5) 为原料,在乙酸酐作用下生成2-乙氧亚甲基-4,4-二氟乙酰乙酸乙酯 (6);然后6 与甲基肼反应,生成化合物3-二氟甲基-1-甲基-1H-吡唑-4-羧酸乙酯 (7);再经水解、酸化生成中间体8。最后,中间体8 与3 反应生成目标化合物9。
根据前文[10]的结果,制备的取代苯甲醛肟的构型为E式,推测本文制备的相应肟酯的构型也为E式。选择化合物9g 进行单晶培养,并对其进行X 射线单晶衍射分析,结果证明其构型为E式,与推测结果一致。晶体结构见图1。相关晶体学数据保存在剑桥晶体学数据中心,保存号为CCDC 2086669.

图1 化合物9g 的晶体结构图Fig. 1 Crystal structure of compound 9g
2.2 化合物的波谱分析
以高活性化合物9d (图式4) 为例,对其1H NMR与13C NMR 谱图数据进行分析。

图式 4 化合物9d 的化学结构式Scheme 4 Structural formula of compound 9d
在1H NMR 中,亚胺碳上1 个质子的吸收峰化学位移值在8.86 处;吡唑环上1 个质子的吸收峰为8.05 处的单峰;苯环上4 个质子的吸收峰分别在8.11 和7.62 处的dd 峰和7.40~7.33 处的多重峰;7.14 处的三重峰为二氟甲基处的质子,因受氟原子的影响,裂分为三重峰,偶合常数2JFH=53.8 Hz;化学位移值在4.01 处的单峰为吡唑环上甲基质子的吸收峰。在13C NMR 中,化学位移值为159.01 处的吸收峰为羰基碳的信号峰;化学位移值为155.98 处的吸收峰为亚胺碳的信号峰;吡唑环上与二氟甲基相连的碳吸收峰在146.87,因其受氟原子的影响,裂分为三重峰,偶合常数2JFC= 25.1 Hz;吡唑环上无取代基的碳吸收峰在135.25;吡唑环上与羰基相连的碳吸收峰在110.66;二氟甲基碳的吸收峰在109.25,因受氟原子的影响,裂分为三重峰,1JFC= 237.1 Hz;化学位移值在39.86 处的峰为吡唑环上甲基碳的吸收峰。
2.3 抑菌活性
抑菌活性测定结果(表1)表明,目标化合物对番茄灰霉病菌、苹果树腐烂病菌和小麦全蚀病菌均表现出一定的抑制作用。其中,化合物9m既保留了先导化合物L1 对番茄灰霉病菌的高活性,同时活性优于肟菌酯;与L1 相比,化合物9d 和9g 对苹果树腐烂病菌以及化合物9r 对小麦全蚀病菌的活性有了显著提高,表现出与肟菌酯类似或更优的抑菌活性,表明吡唑-4-羧酸肟酯衍生物的抑菌活性优于此类吡唑-5-羧酸肟酯衍生物。
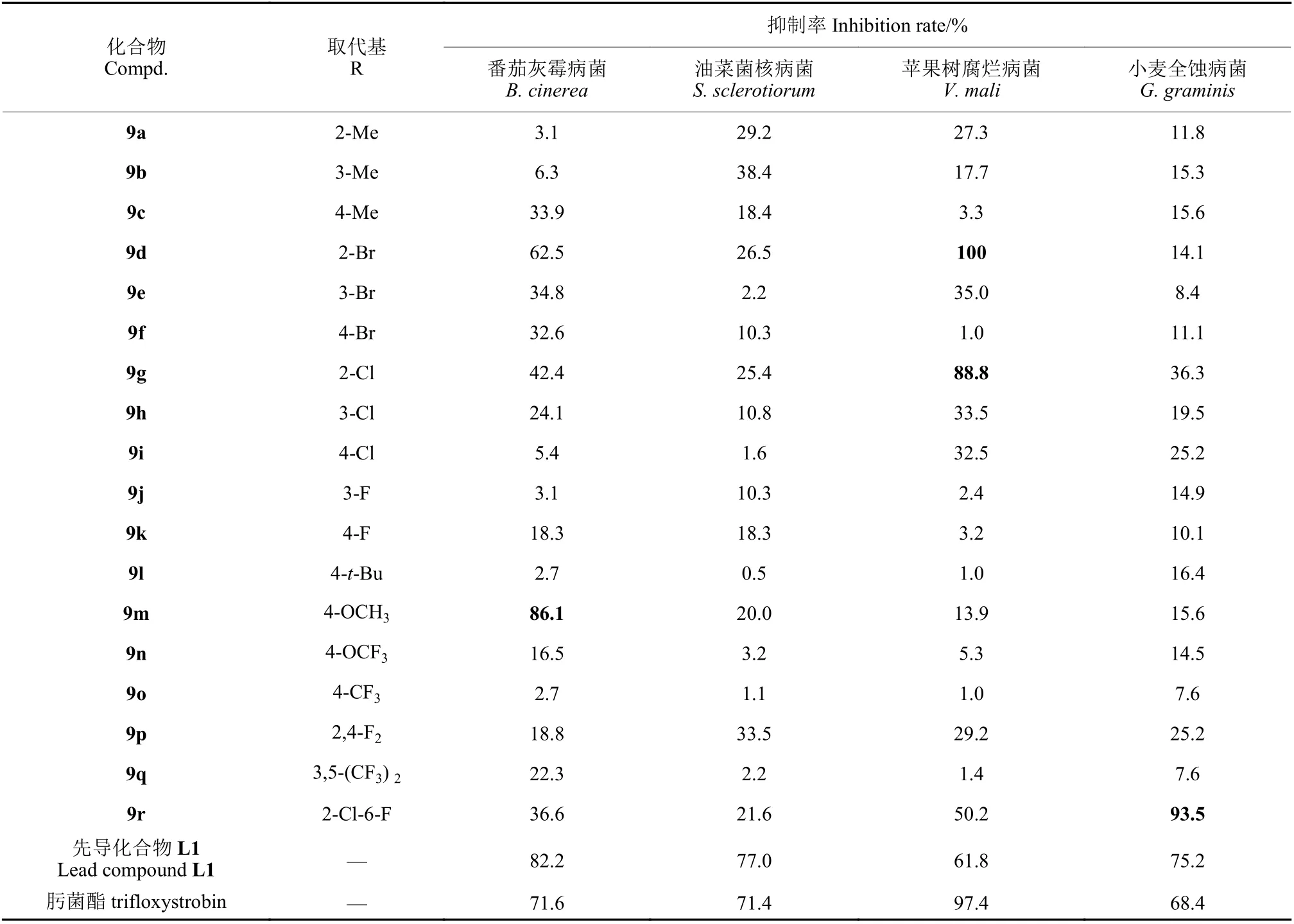
表1 目标化合物9a~9r 在50 μg/mL 下的离体抑菌活性Table 1 Antifungal activities in vitro of target compounds 9a-9r at a concentration of 50 μg/mL
初步构效关系分析表明,当取代基R 为吸电子基时,取代位置对化合物的活性有较大影响,邻位取代化合物的活性要优于间位和对位取代的活性 (9d>9e 和9f, 9g>9h 和9i);大取代基团对化合物的高活性是不利的 (9l < 9c);当取代基含氧原子时,其活性要优于对应的不含氧基团 (9m>9c,9n>9o);双取代的活性优于单取代的活性 (9p>9j和9k, 9q>9o)。
选取在50 μg/mL 下抑制率大于80%的化合物以及先导化合物L1 和对照药剂肟菌酯进行了EC50值的测试,结果见表2。对于番茄灰霉病菌,化合物9m 的EC50值为7.41 μg/mL,与L1 (10.8 μg/mL)和肟菌酯 (17.0 μg/mL) 表现出相似或略优的活性;对于苹果树腐烂病菌,化合物9d 和9g 表现出优异的活性,EC50值分别为0.89 μg/mL 和5.65 μg/mL,显著优于L1 (13.6 μg/mL);对于小麦全蚀病菌,9r 的EC50值为3.34 μg/mL,与L1(6.07 μg/mL) 和肟菌酯 (7.48 μg/mL) 的活性相似。

表2 部分目标化合物对3 种病原菌的EC50 值Table 2 EC50 values of some target compounds against three pathogenic fungi
3 结论
本文以课题组前期发现的高活性化合物L1(E-2-氯-6-氟苯甲醛-O-(1-甲基-3-苯基-1H-吡唑-5-羰基)肟)为先导,设计合成了18 个未见文献报道的新型3-二氟甲基-1-甲基吡唑-4-羧酸肟酯衍生物,并对其抑菌活性及构效关系进行了研究。抑菌活性结果表明,目标化合物对番茄灰霉病菌、苹果树腐烂病菌和小麦全蚀病菌均表现出一定的抑菌活性。化合物9m 保留了L1 对番茄灰霉病菌的高活性。此外,化合物9d 对苹果树腐烂病菌以及9r 对小麦全蚀病菌的活性在L1 的基础上有了显著提高,与商品化对照药剂肟菌酯相比也表现出类似或更优的活性。本文结果表明,吡唑-4-羧酸肟酯与此类吡唑-5-羧酸肟酯衍生物相比,表现出更好的抑菌活性。化合物9m、9d 和9r 具有活性较高、结构简单、易于合成等优点,可以作为先导化合物进一步优化研究。
