香豆素型呋虫胺光控化合物的设计、合成、光学特性及杀虫活性
2022-02-22陈睿嘉邵旭升
杜 康, 陈睿嘉, 李 忠, 邵旭升
(华东理工大学 药学院,上海市化学生物学(芳香杂环)重点实验室,上海 200237)
呋虫胺 (dinotefuran,以下简称为DIN) 是日本三井公司于2002 年上市的第3 代新烟碱类杀虫剂,与传统的同类杀虫剂相比,其效力更高,杀虫谱更广,对哺乳动物及鸟类也更为安全[1]。现今,呋虫胺已被广泛应用于农业虫害的综合治理中。不过,呋虫胺对蜜蜂具有较高毒性。有研究表明,呋虫胺对蜜蜂幼虫的化蛹和羽化过程有明显的抑制作用,对意大利蜜蜂Apis melliferaL.的48h-LD50值为0.033 μg/蜂[2]。此外,呋虫胺在土壤中具有较高的稳定性,半衰期为50~100 d,对土壤存在潜在的污染风险[3]。因此,呋虫胺必须在合理范围内使用。
目前,农药的不合理施用现象依然严重,主要表现为“高剂量、高频次”的使用,而导致该现象的一大诱因即是传统方式的农药释放并不可控[4]。据报道,以传统方式施用的农药利用率较低且流失率偏高,并不能精准地抵达目标,而且农药会在挥发、淋溶和降解中消耗或流入环境中[5]。为弥补损耗,常常只能以超出临界值的浓度和频率施用农药,给农业经济发展和生态环境安全造成极大危害[6]。为了解决这一问题,研究者们提出了农药的多种加工方案,如环糊精包合[7]、纳米微球载体[8]、光响应胶束[9]等。这些给药策略在一定程度上控制了农药的释放速率,但依然无法做到释放时间和空间的可控。
目前,光控释放药物正逐渐成为药物研究的重要方向。药物与光敏保护基团 (photolabile protecting group,PPG) 结合成“笼” (cage) 后,只能在特定波长范围的光照条件下才会释放。通过光的调控,药物可以在靶标处定时、定量、定位地释放并发挥效力[10]。这种给药策略洁净、高效,不仅可提高药物的持效期,减少用药量,还能降低对非靶标的毒性,并实现药物监测的可视化。近年来,光控释放技术在农药领域也得到了较为广泛的应用,如光控释放的2,4-D[11]、植物生长调节剂[12]和性信息素[13]等均已见报道。
本课题组在前期研究中一直致力于香豆素(coumarin) 类PPG 的农药光控释放研究[14-15]。与其他保护基团 (如硝基苄基和安息香等) 相比,香豆素类PPG 具有稳定性好、摩尔吸光系数高、释放速率快、释放波长可调、结构改造简单、固有毒性低、生物相容性佳、对生态环境较为友好以及骨架与杀虫活性契合度高等优点[16-19]。为了开发光控释放的新烟碱类杀虫剂,本研究将呋虫胺与作为光敏保护基团的7-二乙基氨基香豆素 (7-diethylamino coumarin,以下简称为COU) 相结合 (图式1) ,设计、合成了以COU 为“笼”的呋虫胺 (coumarincaged dinotefuran,以下简称COU-DIN)光控化合物 ,合成路线见图式2,并研究了所得目标化合物的光物理性质、光控释放行为和杀虫活性。
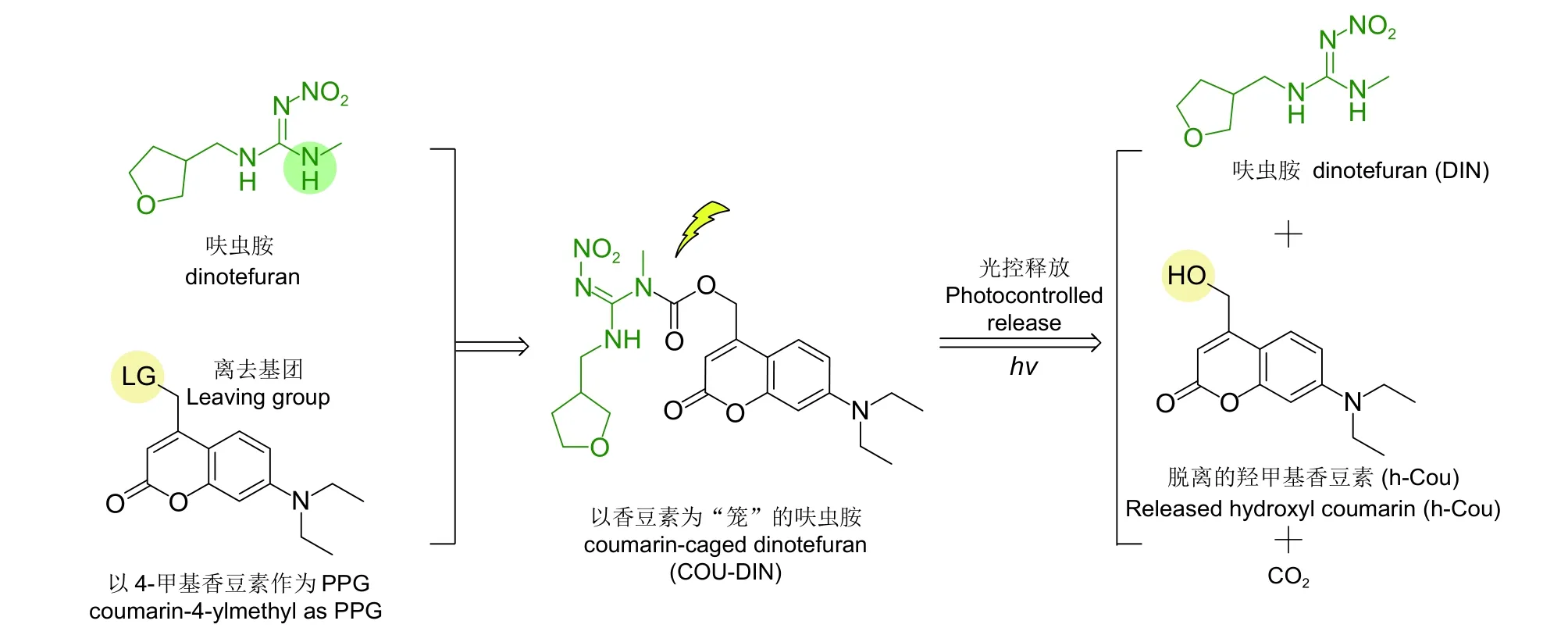
图式 1 目标化合物COU-DIN 的设计和光控释放过程Scheme 1 Design and photocontrolled release of our title compound COU-DIN
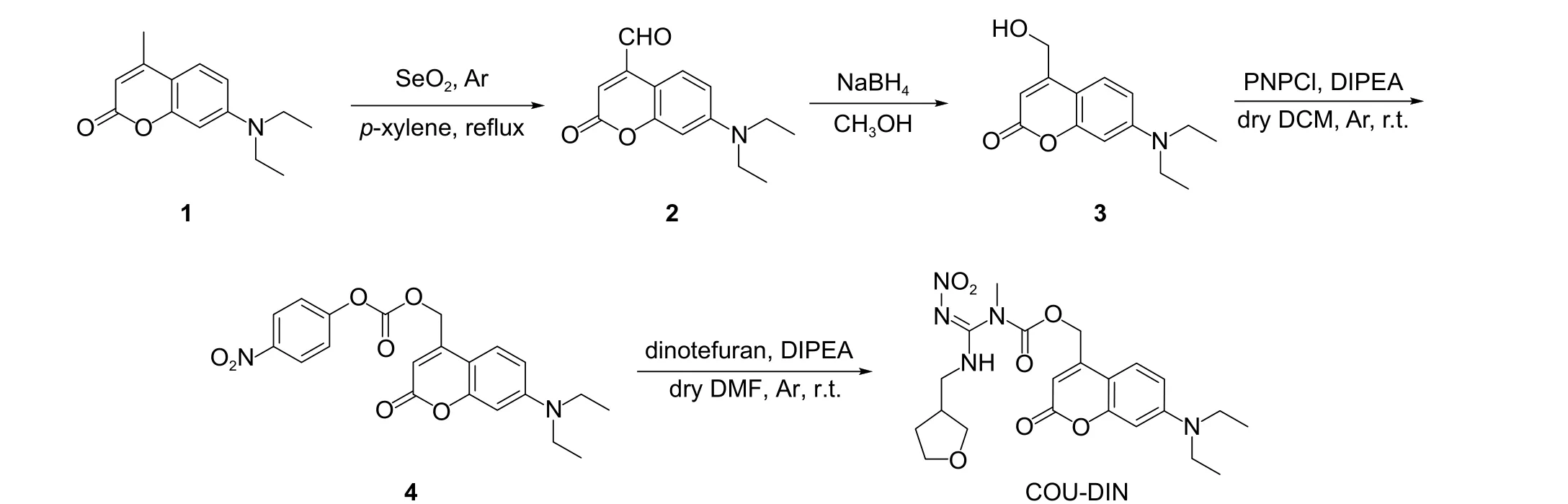
图式 2 目标化合物COU-DIN 的合成路线Scheme 2 Synthesis route of the title compound COU-DIN
1 实验部分
1.1 仪器与试剂
MicroMass GCT CA055 质谱仪 (ESI 源, Micro Mass, Manchester, England) ;Büchi Melting Point B-540 熔点仪 (Büchi, Flawil, Switzerland) ,温度未校正;Bruker AM-400 (400 MHz) 核磁共振仪(Bruker, Fällanden, Switzerland) ,以TMS 为内标,CDCl3为溶剂;Mettler-Toledo EL204 万分之一电子天平 (Mettler-Toledo, Zurich, Switzerland) ;Varian Cary Eclipse 荧光分光光度计 (Varian, Palo Alto, America) ;PerkinElmer Lambda 650 紫外-可见分光光度计 (PerkinElmer, Waltham, America) ;Waters Acquity 超高效液相色谱仪 (UPLC, Waters,Milford, America) ;Leica DMI3000B Fluorescent Microscope 荧光显微镜 (Leica, Wetzlar, Germany) ;JSZ6 光学显微镜 (江南永信,南京,中国) 。
所用试剂均为市售分析纯。
1.2 化合物的合成
目标化合物的合成参考文献方法[1,14]并稍作调整。
1.2.1 中间体7-二乙基氨基-4-甲醛基香豆素 (2)的合成 将7-二乙基氨基-4-甲基香豆素 (1,2.6 mmol) 和二氧化硒 (SeO2,3.1 mmol) 依次加入氯苯 (100 mL) 中,回流下搅拌反应72 h。薄层色谱(V石油醚:V乙酸乙酯= 5 : 1) 监测至反应完全。冷却,过滤,滤液在真空下浓缩,即得化合物2 粗品,黑色油状物,无需进一步处理直接用于下一步反应。
1.2.2 中间体7-二乙基氨基-4-羟甲基香豆素 (3)的合成 将化合物2 粗品溶于无水四氢呋喃(THF,50 mL) 中,冰浴下加入无水甲醇 (30 mL)和硼氢化钠 (NaBH4,2.6 mmol) ,搅拌10 min 后恢复至室温,再搅拌反应5 h。薄层色谱 (V石油醚:V乙酸乙酯= 2 : 1) 监测至反应完全。反应液用稀盐酸淬灭,10 min 后旋转蒸发除去多余溶剂。加入二氯甲烷 (30 mL) ,分离两相。有机相用饱和食盐水 (20 mL) 洗涤两次,干燥,浓缩,得油状粗品。该粗品经柱层析 (梯度洗脱,V石油醚:V乙酸乙酯=100 : 1~3 : 1) 分离纯化,得化合物3,墨绿色粉末,两步综合收率30.1% , m.p. 102.8~103.5 °C。1H NMR (400 MHz, CDCl3),δ: 7.31 (d,J= 9.0 Hz,1H), 6.55 (dd,J= 9.0, 2.6 Hz, 1H), 6.47 (d,J= 2.6 Hz, 1H), 6.28 (s, 1H), 4.85 – 4.82 (m, 2H), 3.39 (q,J= 7.0 Hz, 4H), 2.95 (br., 1H), 1.19 (t,J= 7.0 Hz,6H);13C NMR (100 MHz, CDCl3),δ: 162.90, 156.09,155.16, 150.50, 124.40, 108.62, 106.33, 105.28,97.68, 60.87, 44.72, 12.45. ESI-HRMS C14H18NO3[M + H]+计算值:248.1287;测定值:248.1288.
1.2.3 中间体(7-(二乙基氨基)-2-氧代-2H-色烯-4-基)甲基(4-硝基苯基)碳酸酯 (4) 的合成 将对硝基苯基氯甲酸酯 (PNPCl,2.0 mmol) 溶解于无水二氯甲烷 (DCM,15 mL) 中,在氩气保护及冰浴条件下,缓慢滴加化合物3 (4 mmol) 的DCM 溶液(5 mL) 和二异丙基乙胺 (DIPEA,6.0 mmol) 。室温下搅拌反应24 h。薄层色谱 (V二氯甲烷:V甲醇=100 : 1) 监测至反应完全后,加入水 (50 mL) 。分离两相,有机相用饱和食盐水 (20 mL) 洗涤两次,干燥,浓缩,得油状粗品。该粗品经柱层析 (梯度洗脱,V二氯甲烷:V甲醇= 100 : 1 ~ 40 : 1) 分离纯化,得化合物4,黄色固体,收率40.3%, m.p.121.7 ~ 122.8 °C。1H NMR (400 MHz, CDCl3),δ:8.35 – 8.27 (m, 2H), 7.46 – 7.39 (m, 2H), 7.32 (d,J=9.0 Hz, 1H), 6.61 (dd,J= 9.0, 2.6 Hz, 1H), 6.54 (d,J= 2.6 Hz, 1H), 6.23 (s, 1H), 5.43 – 5.40 (m, 2H),3.43 (q,J= 7.0 Hz, 4H), 1.22 (t,J= 7.0 Hz, 6H);13C NMR (100 MHz, CDCl3),δ: 161.64, 156.40,155.23, 152.17, 150.89, 147.72, 145.64, 125.44,124.31, 121.75, 108.82, 106.92, 105.57, 97.93, 65.77,44.82, 12.43. ESI-HRMS C21H20N2O7Na [M + Na]+计算值:435.1168;测定值:435.1166.
1.2.4 目标化合物COU-DIN 的合成 将化合物4(1.0 mmol) 溶解于无水N,N-二甲基甲酰胺 (DMF,8 mL) 中,在氩气保护、避光及冰浴条件下,向其中缓慢滴加呋虫胺 (DIN,3.0 mmol) 的DMF(2 mL) 溶液和DIPEA (3.0 mmol) ,避光搅拌反应48 h。薄层色谱 (V二氯甲烷:V甲醇= 20 : 1) 监测至反应完全后,加入DCM (30 mL) 和水 (50 mL),分离两相,有机相用饱和食盐水 (20 mL) 洗涤两次,干燥,浓缩,得油状粗品。该粗品经柱层析(梯度洗脱,V二氯甲烷:V甲醇= 100 : 1 ~ 25 : 1) 分离纯化,得目标化合物 (COU-DIN) ,黄色固体,收率45.1%, m.p. 140.4 ~ 141 °C。1H NMR (400 MHz,CDCl3),δ: 7.21 (d,J= 9.0 Hz, 1H), 6.52 (dd,J= 9.0, 2.5 Hz, 1H), 6.44 (d,J= 2.5 Hz, 1H), 5.98 (s,1H), 5.24 (s, 2H), 3.83 (td,J= 8.4, 5.2 Hz, 1H), 3.73(dd,J= 9.1, 6.8 Hz, 1H), 3.65 (td,J= 8.4, 7.3 Hz,1H), 3.48 (dd,J= 9.1, 4.6 Hz, 1H), 3.35 (q,J=7.1 Hz, 4H), 3.29 (dd,J= 6.9, 5.6 Hz, 2H), 3.22 (s,3H), 2.58 – 2.40 (m, 1H), 2.04 (dtd,J= 13.0, 8.2,5.2 Hz, 1H), 1.53 (dtd,J= 13.0, 7.6, 5.2 Hz, 1H),1.14 (t,J= 7.1 Hz, 6H);13C NMR (101 MHz,CDCl3),δ: 161.73, 158.87, 156.28, 153.19, 150.80,148.56, 124.48, 109.04, 106.61, 105.76, 97.89, 70.88,67.61, 64.27, 47.23, 44.88, 38.29, 35.75, 29.71, 12.38.ESI-HRMS C22H29N5O7Na [M + Na]+计算值:498.1966;测定值:498.1967.
1.3 光学性质分析
1.3.1 标准曲线的绘制 参考相关文献进行标准曲线绘制[14]。以甲醇及水为溶剂 (V甲醇:V水= 1 : 1) ,配制一系列质量浓度分别为10、20、30、40、50 和60 mg/L 的待测化合物 (COU-DIN、DIN和羟甲基香豆素(hydroxymethyl coumarin, 以下简称h-COU)) 溶液,经UPLC 分析后建立标准曲线。色谱条件:Waters ACQUITY BEH C18色谱柱(50 mm × 2.1 mm, 1.7 μm) ;柱温40 °C;流动相:A 为含三氟乙酸 (φ= 0.01%) 的去离子水溶液,B 为乙腈;流速0.4 mL/min;梯度洗脱程序:0~1 min,10% B;>1~12 min, 10%~100% B;>12~14 min,100% B。
1.3.2 光控释放过程的分析 将待测化合物溶于无水甲醇配制成浓度为1 × 10−4mol/L 的母液,以超纯水稀释至5.0 × 10−5mol/L (V甲醇:V水=1 : 1) 。若无特殊说明,测试光源均为1 W、420 nm 的蓝光或夏季正午太阳光 (时间:7–8 月,11:00 –12:00;气温:(32 ± 1) °C) 。
将上述5.0 × 10−5mol/L 的溶液分为多组,每组一边搅拌一边用420 nm 蓝光或太阳光照射不同时长,以未光照组为对照。对各组进行UPLC、紫外-可见光吸收光谱 (UV-Vis) 和荧光发射光谱的分析,以COU-DIN 的峰消失或面积再无明显变化为测试终点。
根据标准曲线,计算出各处理组经光照处理后化合物的质量浓度,建立其自然对数值与光照时间的曲线,根据曲线公式得到k值。按公式 (1)计算化合物的光解半衰期 (t1/2) 。

同时,根据各组光照不同时间后化合物的质量浓度,计算出各时间点呋虫胺的释放率,测试终点处为总释放率。
1.4 杀虫活性测试
试虫为:苜蓿蚜Aphis craccivora、白纹伊蚊Aedes albopictus和东方黏虫Mythimna separate,均引进自上海南方农药研究中心。
待测药液的配制:将称量好的待测化合物溶于二甲基亚砜 (DMSO) ,用加有曲拉通 (ω= 0.05%)的清水稀释成所需质量浓度。
每个测试均分3 组重复进行,并设置空白、DIN 和h-COU 组作为对照。
1.4.1 对苜蓿蚜的杀虫活性测定 参考文献方法进行[20]。测试质量浓度为5、10、12.5、20、25、40、50、100、150 和200 mg/L 共10 个梯度。A组为经420 nm 蓝光照射0.5 h;B 组为经太阳光照射0.5 h;C 组为不做光照处理黑暗中保存0.5 h。取3~4 cm 蚕豆苗,每苗接入10 只经饥饿处理后的苜蓿蚜无翅成蚜。待试虫于叶片上稳定后,将豆苗浸于待测药液中5 s,阴干。置于 (25±1) °C、黑暗的观察室内培养。48 h 后观察结果,虫体触之无反应即视为死亡。按公式 (2) 计算虫死亡率(空白对照组的死亡率<5%),再根据所得各浓度下的死亡率建立毒力回归线,并计算出LC50值。
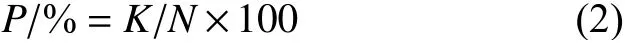
式中:P为死亡率,%;K为死亡虫数,头;N为总试虫数,头。
1.4.2 对白纹伊蚊的杀虫活性测定 参考文献方法进行[14,21]。测试质量浓度为0.13、0.25、0.5、1、2、4、8、16、32 和64 mg/L 共10 个梯度。每只离心管中接入10 只4 龄白纹伊蚊幼虫,加入待测药液,置于 (25±1) °C、黑暗的观察室内培养。24 h 后观察结果,虫体触之无反应即视为死亡。按1.4.1 节方法计算虫死亡率和LC50值。
1.4.3 对东方黏虫的杀虫活性测定 参考文献方法进行[20]。测试质量浓度为10、20、40、60、80、100、200、300、400 和500 mg/L 共10 个梯度。取5~6 cm 玉米叶浸于待测药液中5 s 后取出,阴干,接入10 只经饥饿处理后的东方黏虫3 龄幼虫,置于 (25±1) °C、黑暗的观察室内培养。72 h 后观察结果,虫体触之无反应即视为死亡。按1.4.1 节方法计算虫死亡率和LC50值。
2 结果与分析
2.1 目标化合物的合成
如图式2 所示,以市售的7-二乙基氨基-4-甲基香豆素 (1) 为原料,经4 步反应得到目标化合物COU-DIN。首先,化合物1 经“氧化-还原”得到4-羟甲基香豆素 (3) 。其中,对氧化过程,宜选用新鲜的SeO2;在进行还原反应时,须在冰浴下缓慢加入NaBH4,否则易发生副反应。之后再经两步反应,通过PNPCl 使化合物3 以氨基甲酸酯桥与呋虫胺偶联,即得目标产物COU-DIN。通过对不同的碱加以筛选,最终确定在DIPEA 条件下,两步反应的综合产率均可达40%。
2.2 COU-DIN 的光学性质
2.2.1 光物理学性质 首先,采用紫外-可见分光光度计对目标化合物COU-DIN 进行全波段扫描(200~700 nm) ,以寻找合适的光控释放波段。结果 (表1 和图1) 表明,COU-DIN 在275 和396 nm处有两个良好的紫外吸收峰,分别对应呋虫胺与香豆素部分,其中396 nm 为COU-DIN 的最大吸收波长,属近可见紫光区,且摩尔吸光系数 (ε)

图1 COU-DIN (A)和呋虫胺(B)的紫外吸收光谱Fig. 1 UV-Vis for COU-DIN (A) and dinotefuran (B)

表1 COU-DIN 和呋虫胺紫外-可见光谱数据Table 1 UV-Vis data for COU-DIN and dinotefuran
为1.62 ×104L·mol−1·cm−1。这说明COU-DIN 对光具有较高的灵敏度,可以利用396 nm 左右的光进行照射,以促进其释放呋虫胺。同时,此波长处于可见光区,对生物体较为安全[11,18,22-23],预示COU-DIN 可能具有较好的实际应用价值。
2.2.2 光控释放性能 鉴于420 nm 的蓝光可以被COU-DIN 很好地吸收,且其对生物体的危害也比396 nm 的紫外光更小[11,18,22-23],同时为了直接模拟实际的田间给药过程,本研究分别选择可见光范围内的蓝光 (1 W、420 nm,A 组) 和太阳光 (B 组)进行COU-DIN 的光控释放性能研究。
图2 展示了在UPLC 监测下COU-DIN 的光控释放过程。COU-DIN 的保留时间t= 5.6 min,该处峰面积随光照时间的延长而逐渐减少,说明420 nm 蓝光和太阳光均能调控COU-DIN 的裂解,且在太阳光照下的裂解速度更快;而在t=1.8 min 和t= 4.5 min 处,保留时间分别与作为对照DIN 和h-COU 的一致,且两处峰面积均随光照时间的延长而增加,说明DIN 和h-COU 是COUDIN 的光控释放产物。根据已报道的光控释放反应机理[11,13,18],推测t=5.89 min 的峰是4-甲氧基甲基香豆素。
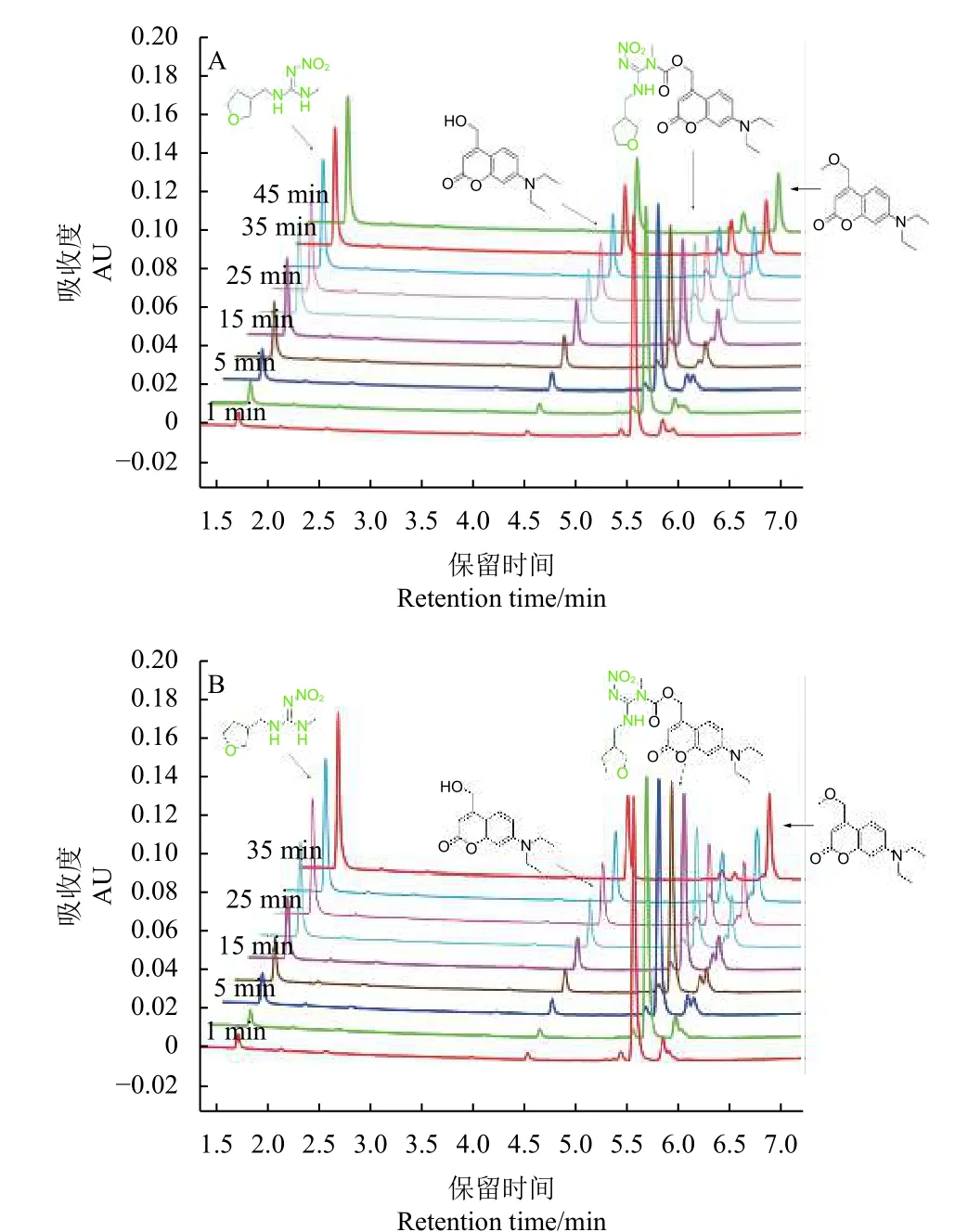
图2 COU-DIN 在420 nm 蓝光 (A) 和太阳光 (B) 下的光控释放过程Fig. 2 Photocontrolled release of COU-DIN under 420 nm blue light (A) and sunlight (B)
同时以紫外-可见光吸收光谱和荧光发射光谱监测了420 nm 光照下COU-DIN 的光控释放过程。该过程中,长波紫外区域的最大吸收波长会出现蓝移,短波区的吸光度会不断增加 (图3-A) ;而荧光强度则随光照时间的增加而增强,并发生蓝移 (图3-B) 。这些现象均表明,光控释放产物h-COU 和DIN 会随光照时长的增加而增多,并趋于稳定。
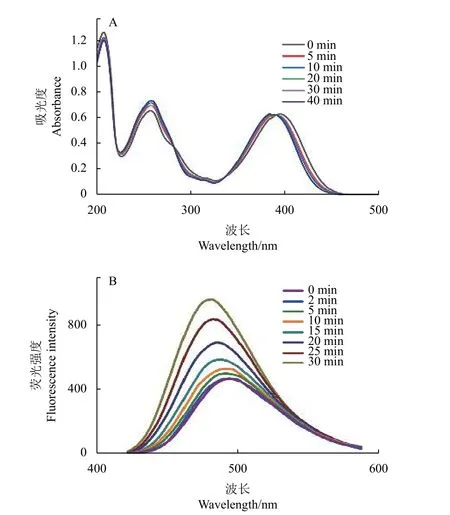
图3 COU-DIN 的紫外-可见光吸收光谱(A)及荧光发射光谱(B)随光照时间的变化Fig. 3 Changes of UV-Vis (A) and fluorescence spectra(B) for COU-DIN with irradiation
进一步测定了COU-DIN 在420 nm 蓝光照射下的光控释放曲线。如图4 所示,得到了直线方程:y= −0.0835x+ 0.2243,R² = 0.9873。可见,COU-DIN 可以稳定高效地光控释放,其过程符合一级反应动力学,反应速率常数k= 0.0835 min−1,光分解半衰期t1/2= 8.30 min。
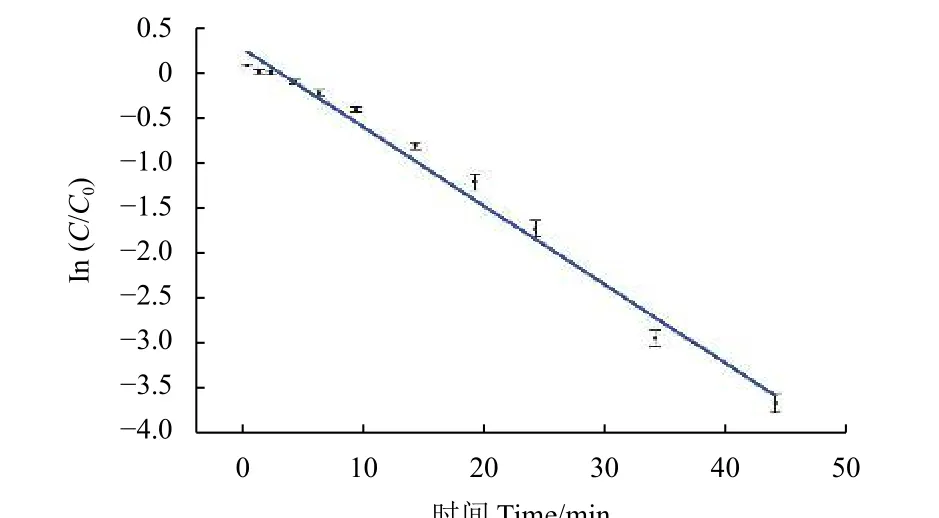
图4 COU-DIN 的光控释放曲线Fig. 4 Photocontrolled release curve of COU-DIN
将COU-DIN 在室温、黑暗状态及V(水) :V(甲醇) = 1 : 1 的溶液中保存14 d,分解率< 10%,证明该化合物对水具有较好的稳定性,光控释放过程不受其他因素影响。
图5 表明了不同420 nm 光照模式下的COUDIN 光控释放过程。当光一直照射时,呋虫胺的释放量会随着光照时间的延长而增多,直至最终达到饱和 (图5-A) ;而采用“开-关”间歇式光照时,呋虫胺的释放量也会呈阶梯式上升 (图5-B) 。两种光控释放模式下,呋虫胺的总释放量均约90%。这说明COU-DIN 的田间实用价值较好,可以通过控制光照条件以定时定量地精准释放出呋虫胺。
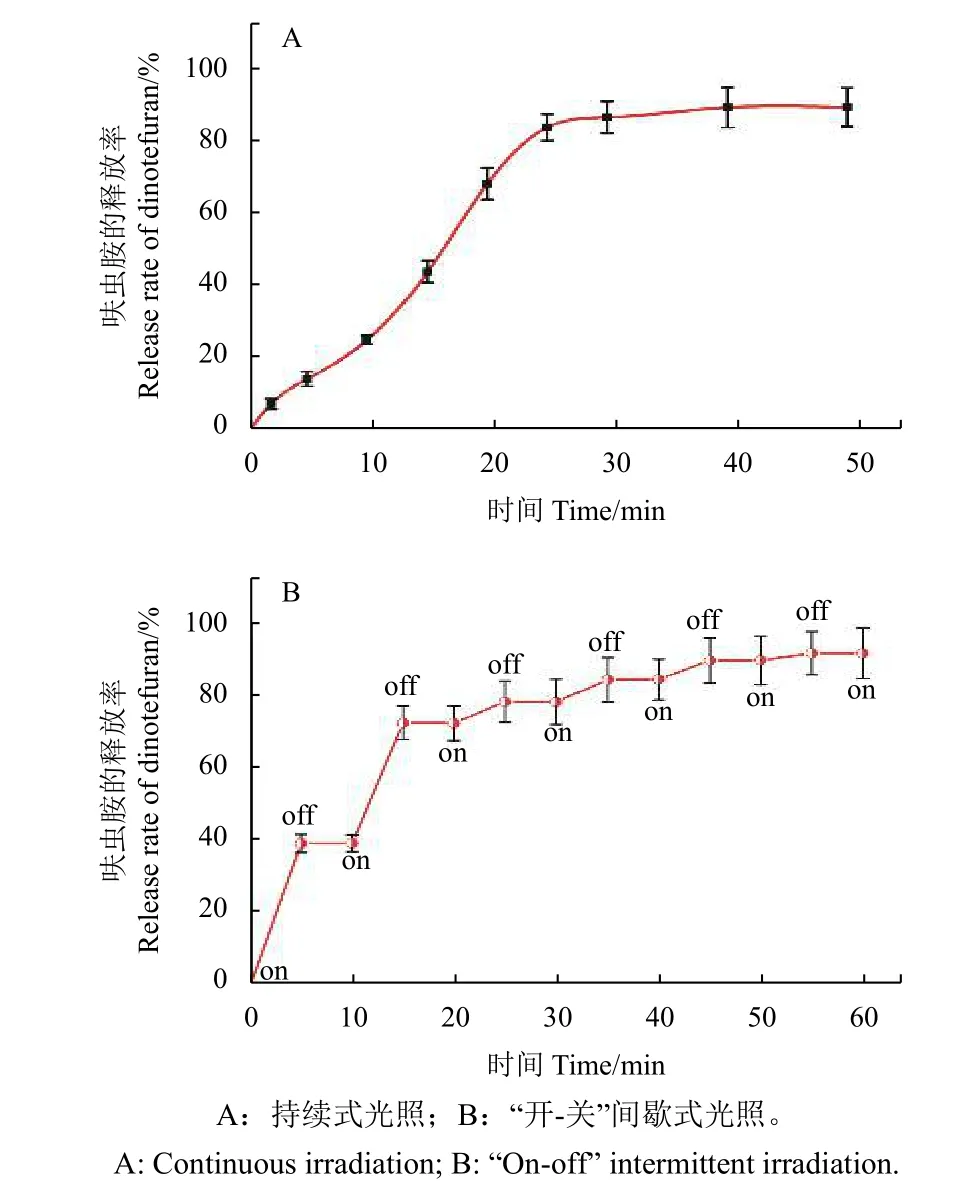
图5 不同光控模式下的呋虫胺释放率Fig. 5 Release rate of dinotefuran under different light modes
2.3 COU-DIN 的杀虫活性
测定了光照前后COU-DIN 对苜蓿蚜、白纹伊蚊及东方黏虫的LC50值。结果 (表2) 表明: h-COU对各靶标试虫的LC50值均远高于COU-DIN 或呋虫胺;光照组与未光照组两种条件相比,COU-DIN的杀虫活性存在明显差异。同时,COU-DIN 组的试虫中毒症状与呋虫胺的中毒症状相同 (试虫抽搐后麻痹、停止进食,最终死亡) 。这说明所测得的COU-DIN 组的杀虫活性均来自于原化合物本身或释放出的呋虫胺。对所有靶标试虫,COU-DIN 经太阳光照后的LC50值均大于蓝光照射后的值,其原因如前所述,太阳光能比单波长的蓝光能更好地激发COU-DIN 中的呋虫胺进行光释放。但在两种光照条件下,COU-DIN 对所有靶标试虫的LC50值均大于呋虫胺本身,这是因为COU-DIN在两种光照条件下的释放率仅90%,还有待进一步提高。总体而言,COU-DIN 可以有效地受光调控释放出呋虫胺并发挥杀虫作用。
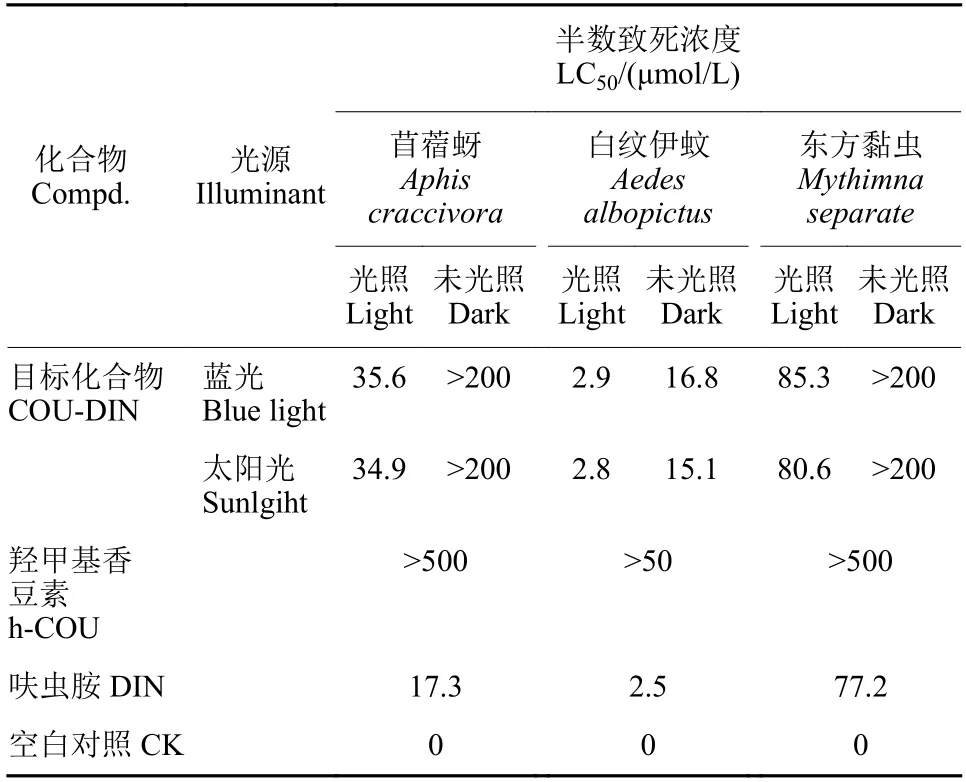
表2 COU-DIN 对3 种靶标的杀虫活性Table 2 Insecticidal activities of COU-DIN against 3 targets
3 结论
将香豆素类光敏保护基团与呋虫胺相连接,设计合成了目标化合物COU-DIN,首次实现了新烟碱类杀虫剂呋虫胺的光控释放。COU-DIN 可由420 nm 蓝光或太阳光照控制释放出呋虫胺并发挥杀虫效力。该化合物在水中稳定性好,40 min 即可受释放完全,释放效率高达90%,对苜蓿蚜、白纹伊蚊、东方黏虫的杀虫活性与呋虫胺相当,具有田间实用的潜力。进一步的研究正在本课题组中开展。
