响应曲面法优化白花前胡总香豆素提取及抑菌和抗氧化活性
2022-02-20葛红光郭少波郑锦丽
史 娟, 葛红光, 郭少波, 朱 斌, 郑锦丽
(陕西省催化重点实验室,陕西理工大学化学与环境科学学院,汉中 723000)
高频率、大剂量抗菌药物的长期使用以及药剂新品种缺乏所导致的细菌、真菌的耐药现象近年来不断发生,农作物病菌性危害已成为影响农业生产的主要病害之一,对作物产量和品质造成了较大影响。马吴杰等[1]采用菌丝生长速率法对河北、内蒙古等地区采集分离的马铃薯晚疫病菌菌株检测发现,马铃薯晚疫病菌对氟吡菌胺的敏感性趋于下降,普遍产生低水平抗性,平均抗性倍数为3.45,平均抗性指数为0.48;所有供试菌株中抗性菌株频率占90.80%,其中低抗菌株占90.35%。寻找开发广谱、高效、安全、低廉且抑菌性能较好的天然抗菌剂成为农作物病害防治的重点。香豆素具有顺式邻位羟基肉桂酸的内酯结构,是植物次生代谢产物,因其结构、药用作用点特殊,环境友好等优点,在农药先导分子的开发中发挥了重要作用。如简单蛇床子素作为一种杀虫抑菌的生物农药已被广泛用于农业生产;含有香豆素母核的东莨菪素、滨蒿内酯、花椒毒素、补骨脂素和秦皮乙素等可有效抑制或杀灭耐药菌;引入吡唑、咪唑杂环的香豆素衍生物可进一步增强抗菌活性和广谱性[2]。近年来,香豆素类物质还被报道具有清除自由基活性、抗氧化活性[3],这为克服全球人口老龄化所产生的抗衰老生物学带来了新的切入点。目前,植物源香豆素多采用传统溶剂提取法、超临界流体提取法、微波提取法及超声波提取法等。溶剂提取法操作简单、成本低,但提取时间长、溶剂用量大,且有机残留多、杂质多;超声波辅助萃取法操作简单、低温提取、提取物活性高、提取率高,但提取量小[4]。
前胡为伞形科植物白花前胡(PeucedanumpraeruptorumDunn)的干燥根,在我国山东、陕西、安徽、江苏等省分布较广,具有化痰降气、祛风解热等功效。现代药理学研究表明,前胡具有镇咳、祛痰[5]、神经保护[6]、降糖、降压、抗氧化及抗癌等作用[7]。目前白花前胡的研究工作多集中在前胡化学成分分析、鉴定及其对小鼠心肺功能药理活性[8-10]。如汪康等[9]从白花前胡中分离得到异紫花前胡内酯(Nodakenetin)、噢洛内酯(Oroselol)、紫花前胡素D、Pd-C-Ⅱ、Marmesin-11-O-β-D- glucopyranosyl(1→6)-β-D-glucopyranoside等5个化合物;周晓霞等[10]研究发现白花前胡有效成分Pd-Ia可明显减轻急性肺损伤肺部的炎症反应。而对有效成分总香豆素的优化提取和抑菌、抗氧化活性研究较少[11-13]。本研究尝试利用超声预处理-乙醇回流法提高香豆素收率,响应面实验获得白花前胡总香豆素最佳提取工艺条件,并对纯化后的香豆素进行植物病原菌及多种自由基的抑制实验,以期为白花前胡在功能食品、保健品领域的应用提供参考依据。
1 材料与方法
1.1 材料与仪器
白花前胡;4-羟基香豆素(纯度≥98%);葡萄糖、琼脂、酵母浸粉、胰蛋白胨均为分析纯;实验用水为蒸馏水。
马铃薯干腐病菌标准菌株(Fusariumsulphureum,F.s.)、番茄灰霉病菌标准菌株(Botrytiscinerea,B.c.)、尖孢镰刀病菌标准菌株(Fusariumoxysporum,F.o.)、苹果炭疽病菌标准菌株(Colletotrichumgloeosporioide,C.g.)、水稻稻瘟病菌标准菌株(PyriculariaGrisea,P.g.)、苹果腐烂病菌标准菌株(Cytosporasp,C.s.),由陕西理工大学生物科学与工程学院微生物实验室提供,2~8 ℃冷藏保存。
SB3200DTDN型超声波清洗机,RE52-9型旋转蒸发器,AR124CN型电子天平,LD4-2A(Ⅱ)型离心机,DGG-9140B型电热恒温鼓风干燥箱,UV-2600型紫外分光光度计,ZHJH-C1112B型智城超净工作台,MGC-P光照培养箱,LDZF-75L立式高压蒸汽灭菌器。
1.2 实验方法
1.2.1 提取及含量计算
精确称取4-羟基香豆素10 mg,以无水乙醇为溶剂配制0.1 mg/mL香豆素标准溶液,再将其稀释得到一定浓度梯度的系列标品溶液,320 nm下测定各浓度的吸光值。以标准品浓度X为横坐标,吸光值Y为纵坐标,绘制标准曲线后得到回归方程:Y=0.022 09X+1.966 52,r2=0.993 2。
白花前胡洗净,真空干燥,粉碎,过20目筛,石油醚回流脱脂后的粉末加入一定体积乙醇溶液,在水浴温度50 ℃,功率250 W、振动频率40 kHz条件下超声波处理30 min,继续在一定温度下提取一定时间后,过滤得到白花前胡总香豆素的提取液。按照回归方程测试范围对提取液进行稀释,由吸光度求出提取液中的总香豆素质量浓度,并按公式计算白花前胡香豆素提取率。每个实验平行3次,取平均值。
式中:C为从线性回归方程中求出的白花前胡香豆素质量浓度/mg/mL,V为提取液体积/mL,n为测试稀释倍数,m为原料前胡的质量/g。
1.2.2 单因素实验
提取时间对提取率的影响:准确称取2.0 g脱脂前胡粉末,按料液比1∶40 g/mL,加入体积分数为60%的乙醇溶液80 mL,超声处理后,在提取温度为80 ℃条件下,改变提取时间为0.5、1.0、1.5、2.0和2.5 h,考察提取时间对提取率的影响。
乙醇体积分数对提取率的影响:固定料液比1∶40 g/mL,提取温度80 ℃,提取时间2 h,改变乙醇体积分数为50%、60%、70%、80%和90%,研究乙醇体积分数对提取率的影响。
料液比对提取率的影响:以60%乙醇溶液做溶剂,提取温度80 ℃,提取时间2 h,考察料液比1∶20、1∶30、1∶40、1∶50和1∶60 g/mL下香豆素的提取率。
提取温度对提取率的影响:60%乙醇溶液为提取溶剂,料液比1∶40 g/mL,提取时间为2 h,考察提取温度分别为50、60、70、80和90 ℃下香豆素的提取率。
1.2.3响应面实验设计

表1 响应面分析因素与水平表
在单因素实验基础上,按照Box-Behnken设计原理,选择提取时间、乙醇体积分数、液料比和提取温度为自变量,以前胡总香豆素提取率为响应值,利用Design-Expert 8.0.5软件进行响应曲面分析优化提取条件,响应面实验因素编码及水平设计见表1。
1.2.4 香豆素的纯化
将所得白花前胡提取液65 ℃减压旋蒸浓缩,得到棕褐色黏稠状膏体,加入少量中性氧化铝粉末拌均匀,烘干,进行硅胶柱层析[11, 12]。先后用石油醚、乙酸乙酯及65%甲醇和水进行洗脱。将甲醇洗脱液合并,浓缩得到淡黄色粉末。
1.2.5 抑菌活性研究
1.2.5.1 供试菌株的活化及平板涂布培养
在121 ℃、0.1~0.15 MPa、30 min条件下高压灭菌,将冰箱冷藏保存的马铃薯干腐病菌(F.s.)、番茄灰霉病菌(B.c.)、尖孢镰刀病菌(F.o.)、苹果炭疽病菌(C.g.)、水稻稻瘟病菌(P.g.)和苹果腐烂病菌(C.s.)6种植物病菌的标准菌株在马铃薯培养基上划线接种,28 ℃下置于培养箱内倒置培养,活化7 d后备用。
采用菌丝生长抑制法测定白花前胡香豆素在50 mg/mL下对1.2.5.1所述6种植物病菌的抑制活性测试。
称取纯化后白花前胡香豆素0.05 g,将其用丙酮溶解后倒入一定体积的马铃薯培养基中混合,得到质量浓度50 mg/mL的带药培养基,趁热倒板。待培养基凝固后,用已干燥灭菌直径为6 mm开孔器于活化好的真菌培养基上打孔,无菌镊子夹取菌饼置于含样平板呈“品”字摆放,所有实验平行进行3次,并用相同体积溶剂丙酮做空白对照。所有含菌平板放置于28 ℃的恒温培养箱培养3 d,取出平板后采用十字交叉法测量菌圈直径大小。
1.2.5.3 IC50测定
参照文献[13]方法使用质量浓度倍减法将供试白花前胡香豆素用溶剂溶解后制备100、50、25、12.5、6.25、3.125 mg/mL梯度的带药培养基,以溶剂丙酮为空白对照,按照1.2.5.2实验步骤,得到各质量浓度下真菌的菌圈直径,并按公式计算抑制率。
抑菌率=(A-B)/(A-6)×100%
式中:A代表空白对照组的菌圈直径;B代表样品的菌圈直径。
1.2.6 抗氧化活性研究
狗可以不懂事,人必须明事理。依法养犬,文明养犬,是每个养犬人的义务。从现实来看,大多数养狗之人也是爱狗之人,日常能够做到文明养犬。但也有一些养狗人只图自己开心方便,无视公共利益和他人权益。他们或认为自家爱犬听话、不会咬人,或认为拴狗绳对狗健康不利,或认为犬只随地便溺反正有环卫工人清扫,何必污了自己的手。如此一来,势必将自己的爱犬置于矛盾的焦点,不仅是对爱犬的不负责任,也会影响所有爱狗人士的形象。
1.2.6.1 清除DPPH自由基活性的测定
参考文献方法[14],将2 mL香豆素乙醇溶液与2 mL DPPH溶液(0.1 mmol/L)加入10 mL试管中,振摇均匀后室温避光30 min,517 nm处测量吸光度值,记为Ax;同时,测定2 mL DPPH+ 2 mL乙醇吸光度,记为A0;测定2 mL香豆素乙醇溶液+2 mL乙醇吸光度,记为Ai。按清除率=[1-(Ax-Ai)/A0]×100%,计算不同浓度香豆素溶液对DPPH自由基的清除率。再以香豆素乙醇溶液浓度为横坐标,清除率为纵坐标绘制浓度-抑制率图形。
1.2.6.2 清除羟基自由基( OH-·)活性的测定
利用Fenton反应原理,将浓度为6 mmol/L FeSO4溶液3 mL、6 mmol/l水杨酸溶液3 mL及1 mL香豆素乙醇溶液、6 mmol/L H2O2溶液3 mL,依次加入25 mL容量瓶,定容,摇匀后静置。510 nm下测其吸光度,记为Ax。同上步骤,以等体积水代替6 mmol/L水杨酸溶液测定吸光度,记为Ai;再以乙醇代替香豆素溶液测得空白对照吸光度,记为A0,采用1.2.6.1公式计算得到不同浓度香豆素溶液对羟基自由基的清除率,并绘图。
在325 nm下测定0.5 mL邻苯三酚+4.5 mL磷酸盐+盐酸混合溶液的吸光度,记为A0;4.5 mL磷酸盐+0.1 mL样品+0.4 mL邻苯三酚+盐酸混合溶液的吸光度,记为Ax;4.9 mL磷酸盐+0.1 mL样品+盐酸混合溶液的吸光度,记为Ai。采用1.2.6.1公式计算得到不同浓度香豆素溶液对羟基自由基的清除率,并绘图。
2 结果与分析
2.1 单因素实验结果
提取时间、乙醇体积分数、液料比和提取温度对白花前胡总香豆素提取的影响如图1所示。
观察图1中提取时间变化对香豆素提取率的影响发现,0.5~2.0 h范围内,前胡香豆素提取率随提取时间延长而不断增大。这是因为香豆素分子刚性较强,溶解度较小,增加提取时间有利于药材粉末与提取溶剂的充分接触,使得香豆素溶出更为充分。提取时间达到2 h时,香豆素提取率达到最高值1.51%;继续增加提取时间,提取率出现了小幅降低,这可能与过长时间加热所导致的物质结构破坏及杂质析出增加有关,故最佳提取时间选择2.0 h为宜。
图1亦反映了乙醇提积分数对提取率的影响。相同条件下以60%乙醇作为提取溶剂时,香豆素提取率可达最高值1.71%。这是因为香豆素在乙醇中的溶解度大,在水中溶解度小,乙醇浓度升高,有利于香豆素的溶出。但乙醇质量浓度大于60%后,香豆素提取率不增反降,这是因为乙醇浓度过高,易导致前胡所含其他脂溶性成分与乙醇-水分子结合,从而与香豆素形成溶出竞争关系,导致香豆素提取率降低。因此选60%乙醇作为最佳提取溶剂。
图1中反映料液比对提取率影响关系的曲线中,所示的料液比越小,意味着使用相同质量的前胡提取香豆素时,所加入的溶剂就越多。提取溶剂体积增大,有利于前胡粉末的充分浸润,可以有效地提高香豆素的提取率。但溶剂量使用过大不仅带来实验的高成本,还会因为溶剂中水量过高造成香豆素溶出受阻,且水溶性蛋白、多糖等杂质附带析出,会对测试带来较大干扰,因此选择最优料液比为1∶40 g/mL。
在图1所示50 ℃至80 ℃的温度范围,香豆素提取率逐渐增高。当温度升至80 ℃时,提取率达到最大值。这是因为植物细胞在较高温度时容易破裂,且温度升高分子运动加速,可以促进前胡香豆素的有效溶出。但温度大于80 ℃易造成香豆素结构受到破坏,提取率反而下降,故最佳提取温度应为80 ℃。
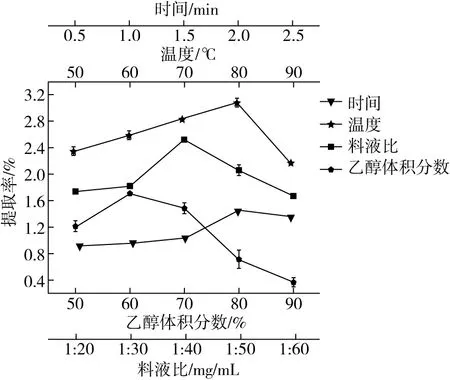
图1 不同因素对白花前胡香豆素提取率的影响
2.2 响应面法优化提取工艺
2.2.1 响应面实验结果
分析表2实验结果,得到回归方程。
Y= 4.23-0.0003A-0.028B-0.0064C+0.066D+0.017AB-0.041AC-0.032AD+0.005BC-0.010BD-0.010CD- 0.15A2-0.13B2-0.23C2-0.33D2。
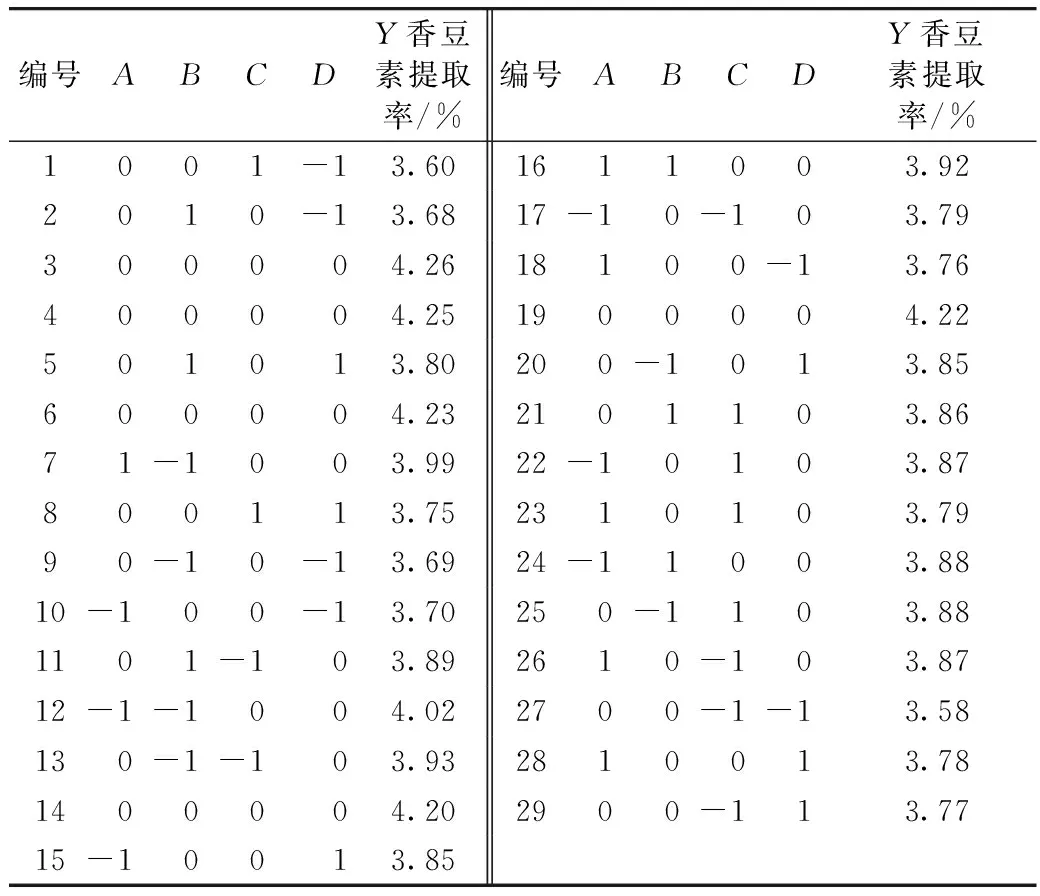
表2 响应面实验设计及结果
2.2.2 响应面结果分析

此外,表3中的一次项D(提取温度),二次项A2、B2、C2、D2对响应值影响极显著(P<0.01);一次项B(乙醇体积分数)、交互项AC对响应值影响显著(P<0.05);其余A(提取时间)、B(乙醇体积分数)和C(料液比)、交互项AB、AD、BC、BD、CD各项对提取率的影响均不显著。继续比较F值,可知各因素对响应值影响力度为:D>B>C>A。

表3 回归方程模型及方差分析
2.2.3 响应曲面分析及提取工艺优化
Design-Expert 8.0.6软件对所得提取数据进行解析,可得到超声辅助提取白花前胡总香豆素三维响应图,分析发现,提取溶剂乙醇的体积分数和提取温度固定零水平时,随着提取时间延长和料液比降低,香豆素提取率有较为明显的增加,在响应面变曲线上呈现出了坡度较陡的现象;同时等高线趋向呈椭圆形,这说明提取时间和料液比的交互作用显著[15]。
在此基础上,通过Design-Expert 8.0.6软件求解方程,对回归方程进行分析处理,获得超声辅助提取白花前胡总香豆素的最优提取工艺为:回流时间为1.99 h、乙醇浓度58.86%、料液比1∶39.84 g/mL、回流温度81.04 ℃,此条件下,白花前胡总香豆素提取率的理论预测值为4.237%。为验证响应面法所得结果的可靠性,兼顾实际操作可行性,将最佳提取工艺参数修正为:回流时间2 h、乙醇浓度59%、料液比1∶40 g/mL、回流温度81 ℃,在优化条件下重复实验3次,实际测得的白花前胡总香豆素平均提取率为(4.249±0.03)%,与预测值基本吻合,进一步验证了该理论模型的可行性,也说明由该模型优化得出的最佳工艺对于超声预处理-乙醇回流法提取白花前胡香豆素的工艺具有实际应用价值。
2.3 白花前胡总香豆素抑菌活性
2.3.1 药敏实验结果
表4为用菌丝生长抑制法所测定的白花前胡香豆素在50 mg/mL下对6种植物病菌的抑制结果。实验组菌圈代表了真菌菌饼在含有香豆素的带药培养基上培养3 d后的情况,实验组菌圈直径越小,空白组菌圈圈越大,表示白花前胡香豆素对真菌的抑制率越强。表4直观给出的结果是白花前胡香豆素对马铃薯干腐菌和水稻稻瘟菌的菌丝生长抑制效果较好,而对尖孢镰刀菌抑制效果较差。

表4 前胡总香豆素对植物真菌的抑菌圈直径
2.3.2 抑菌率测定结果
图2表明前胡香豆素对6种供试植物病菌均具有抑菌作用,且抑菌效果与香豆素浓度呈现显著量效关系。前胡香豆素对马铃薯干腐病菌、苹果炭疽病菌和水稻稻瘟病菌为抑制较优组,在最高质量浓度下(200 mg/mL),抑制率分别达到97.5%、94.8%和99.4%。其中,马铃薯干腐菌和水稻稻瘟菌最低抑菌浓度(MIC)均为3.125 mg/mL,苹果炭疽病菌MIC为6.25 mg/mL。苹果腐烂病菌和番茄灰霉病菌为抑制中等组,最高浓度时,抑菌率保持在73.5%和70.5%,香豆素对2种菌的MIC为6.25 mg/mL;尖孢镰刀菌抑制率最低,最高值抑制率仅为28.3%,MIC为12.5 mg/mL。
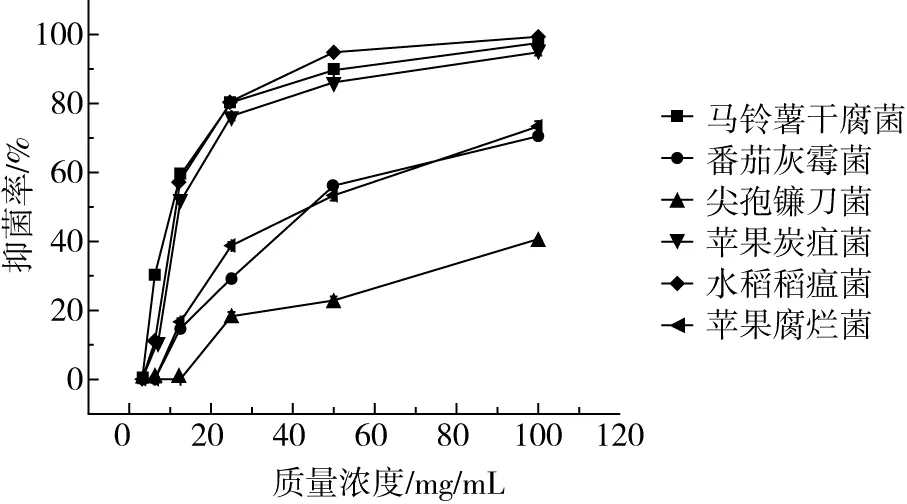
图2 前胡香豆素对植物真菌的抑菌率
2.4 白花前胡总香豆素的抗氧化作用
图3~图5为前胡香豆素对DPPH自由基、超氧自由基和羟基自由基的清除活性测试结果。前胡香豆素对DPPH自由基、羟基自由基和超氧阴离子自由基存在不同程度的清除活性,且活性指标随香豆素浓度增加而增强,与样品浓度存在量效关系。同一浓度时,前胡香豆素对3种自由基清除率次序为:羟基自由基>超氧阴离子自由基>DPPH自由基。前胡香豆素对羟基自由基清除活性最好,在质量浓度达到0.1 mg/mL后,抑制率可以达到78%以上,与VC清除能力接近。这是因为香豆素分子所含酚羟基与黄酮酚羟基类似,因其自身具有提供氢原子的能力,故可有效参与引起生命体衰老的自由基链反应[16],从而发挥阻断生命体自由基链反应的作用。

图3 前胡香豆素对DPPH自由基的清除活性

图4 前胡香豆素对超氧自由基的清除活性

图5 前胡香豆素对羟基自由基的清除活性
3 结论
本实验以乙醇溶液为溶剂,超声预处理-乙醇回流法得到白花前胡所含总香豆素,在单因素实验基础上,通过响应面法确定了最佳提取工艺条件。结果表明在回流时间2 h、乙醇体积分数59%、料液比1∶40 g/mL、回流温度81 ℃条件下白花前胡香豆素提取率最高为(4.249±0.03)%。白花前胡香豆素具有良好的抑菌能力和抗氧化,可有效抑制六种测试植物真菌的生长,活性顺序为:水稻稻瘟菌>马铃薯干腐菌>苹果炭疽菌>苹果腐烂菌>番茄灰霉菌>尖孢镰刀菌,白花前胡香豆素对水稻稻瘟菌和马铃薯干腐菌MIC为3.125 mg/mL;对苹果炭疽菌、苹果腐烂菌和番茄灰霉菌MIC为6.25 mg/mL;对尖孢镰刀菌的MIC最大,为12.5 mg/mL。总香豆素对三种测试自由基清除活性次序为:羟基自由基>超氧自由基>DPPH自由基,氧化抑制率随香豆素浓度的增大逐渐增高。
