不同产区掌叶大黄酒蒸前后指纹图谱的建立及3种差异性成分的含量测定
2022-02-20荣晓惠刘艳王秋茹李紫薇匡海学杨炳友
荣晓惠 刘艳 王秋茹 李紫薇 匡海学 杨炳友






中圖分类号 R284 文献标志码 A 文章编号 1001-0408(2022)03-0280-07
DOI 10.6039/j.issn.1001-0408.2022.03.05
摘 要 目的 建立掌叶大黄酒蒸前后高效液相色谱(HPLC)指纹图谱,并测定其中3种差异性成分的含量。方法 采用HPLC法建立掌叶大黄(酒蒸前)、熟大黄(酒蒸后)各15批样品的指纹图谱并进行相似度评价,通过主成分分析、聚类分析、偏最小二乘法-判别分析、正交偏最小二乘法-判别分析对指纹图谱进行化学模式识别分析。对30批样品中的3种差异性成分没食子酸、白藜芦醇-4′-O-葡萄糖苷、白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷进行含量测定。结果 指纹图谱研究中掌叶大黄标定了48个共有峰,熟大黄标定了47个共有峰,并指认出17个共有峰。聚类分析与主成分分析显示,青海产掌叶大黄酒蒸前后均与四川、甘肃产掌叶大黄酒蒸前后存在显著差异。含量测定结果显示,青海产掌叶大黄酒蒸前后3种差异性成分的含量均高于其他2个产区样品,各产区熟大黄中没食子酸含量均高于掌叶大黄,各产区掌叶大黄中的白藜芦醇-4′-O-葡萄糖苷、白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷含量均高于熟大黄。结论 该研究建立的指纹图谱及含量测定方法能够快速、科学、准确地评价不同产区掌叶大黄及其酒蒸炮制品的质量,为掌叶大黄炮制规范及质量控制提供依据。
关键词 掌叶大黄;熟大黄;高效液相色谱法;指纹图谱;含量测定;差异性成分
Establishment of fingerprint and content determination of 3 differential components in Rheum palmatum before and after steaming with wine derived from different producing areas
RONG Xiaohui,LIU Yan,WANG Qiuru,LI Ziwei,KUANG Haixue,YANG Bingyou(School of Pharmacy, Heilongjiang University of Chinese Medicine/Key Laboratory of Basic and Applied Research of Northern Chinese Materia Medica of Ministry of Education, Harbin 150040, China)
ABSTRACT OBJECTIVE To establish HPLC fingerprint of Rheum palmatum before and after steaming with wine, and to determine the contents of 3 differential components. METHODS HPLC method was used to establish the fingerprints of 15 batches of R. palmatum (before wine-steaming) and prepared rhubarb (after wine-steaming) and the similarity evaluation was conducted. The chemical pattern recognition analysis was carried out by principal component analysis, cluster analysis, partial least squares- discriminant analysis and orthogonal partial least squares-discriminant analysis. The contents of gallic acid, resveratrol-4′-O- glucoside and resveratrol-4′-O-(6″-galloyl)-glucoside in 30 batches of samples were determined. RESULTS In the fingerprint study, 48 common peaks were demarcated for R. palmatum and 47 for prepared rhubarb as well as 17 common peaks were identified by reference substance. Cluster analysis and principal component analysis showed that R. palmatum derived from Qinghai before and after steaming with wine could be distinguished from those from Sichuan and Gansu. The results of content determination showed that the contents of 3 differential components in R. palmatum derived from Qinghai before and after steaming with wine were higher than those from other two production areas; the contents of gallic acid in prepared rhubarb derived from those production areas were higher than R. palmatum; the contents of resveratrol-4′-O-glucoside and resveratrol-4′-O-(6″-galloyl)-glucoside in R. palmatum derived from those production areas were higher than prepared rhubarb. CONCLUSIONS Fingerprint and content determination method established in this study can quickly, scientifically and accurately evaluate the quality of R. palmatum from different producing areas before and after wine steaming, which provide a basis for the processing specification and quality control of R. palmatum.
KEYWORDS Rheum palmatum; prepared rhubarb; HPLC; fingerprint; content determination; differential component
大黄为蓼科植物掌叶大黄Rheum palmatum L.、唐古特大黄Rheum tanguticum Maxim. ex Balf.或药用大黄Rheum officinale Baill.的干燥根和根茎[1],主产于甘肃、青海、四川等地,具有攻积泻下、凉血解毒、利湿退黄等功效[2]。大黄的化学成分复杂,主要包括蒽醌类、蒽酮类、鞣质类、苯丁酮类和二苯乙烯类,其中蒽醌类成分中的结合蒽醌和蒽酮类成分中的番泻苷类具有良好的泻下作用,游离蒽醌具有良好的抑菌、抗肿瘤作用,鞣质类成分中的儿茶素和没食子酸具有良好的止血作用,苯丁酮类成分中的莲花掌苷和异莲花掌苷是大黄抗炎镇痛的主要成分,二苯乙烯类成分是大黄清除自由基和抗衰老的主要成分[3-5]。对于大黄、熟大黄的质量控制,2020年版《中华人民共和国药典》(以下简称《中国药典》)中仅对其中的游离蒽醌和总蒽醌含量制定了标准,但通过临床及药理作用研究发现,大黄酒蒸为熟大黄后在减缓泻下作用、减少胃气损伤的同时,还能增强活血化瘀之功效,这不仅与蒽醌类成分有关,还与蒽酮类、鞣质类、苯丁酮类、二苯乙烯类成分的变化有关[6-7]。大黄在《中国药典》中共收载3个基原,其中掌叶大黄较其他两个基原的大黄主产地资源丰富,采收较容易,资源易得到保证,且在临床应用广泛[8-9]。近年来,虽有大量关于不同产地掌叶大黄指纹图谱的研究,但是仅局限于对蒽醌类、蒽酮类及鞣质类成分的质量控制[10-13],对其炮制品的研究也局限于同一产地甚至同一批次各炮制品炮制前后的差异性成分分析[14],目前仍缺乏整体综合评价掌叶大黄酒蒸前后质量的方法。本课题组通过前期实验发现不同产地掌叶大黄中没食子酸、白藜芦醇-4′-O-葡萄糖苷、白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷在酒蒸前后存在着较大的差异且含量较高可测,因此本研究通过对蒽醌类、蒽酮类、苯丁酮类、二苯乙烯类、鞣质类共5类主要成分的定性分析和没食子酸、白藜芦醇-4′-O-葡萄糖苷、白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷3种差异性成分的定量分析以及对不同产区掌叶大黄酒蒸前后高效液相色谱(HPLC)指纹图谱的比较,探讨不同产区掌叶大黄酒蒸前后化学成分的差异,为掌叶大黄的规范化炮制生产提供理论依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有2695-2998型HPLC仪(美国Waters公司),N-1300D-WB型旋转蒸发仪(日本东京理化器械株式会社),AL204型万分之一电子分析天平(上海梅特勒-托利多国际贸易有限公司),KQ-250E型超声波清洗器(昆山超声仪器有限公司),YXQ-LS-50A型立式压力蒸汽灭菌器(上海博讯实业有限公司医疗设备厂)等。
1.2 主要药品与试剂
没食子酸(批号CHB180114,纯度≥98%)、儿茶素(批号CHB180809,纯度≥98%)、番泻苷A(批号CHB180729,纯度≥98%)、芦荟大黄素-8-O-葡萄糖苷(批号CHB190115,纯度≥98%)、大黄酸-8-O-β-D-葡萄糖苷(批号CHB180726,纯度≥98%)、大黄酚-8-O-β-D-葡萄糖苷(批号CHB180726,纯度≥98%)、大黄素-8-β-D-吡喃葡萄糖苷(批号CHB180727,纯度≥98%)、大黄素甲醚-8-O-β-D-葡萄糖苷(批号CHB201109,纯度≥98%)对照品均购自成都克洛玛生物科技有限公司;大黄酸(批号HR152461198,纯度≥98%)、大黄素(批号HR4919S1,纯度≥98%)、大黄酚(批号HR19415S1,纯度≥98%)、芦荟大黄素(批号HR16119S1,纯度≥98%)、大黄素甲醚(批号HR20425W1,纯度≥98%)对照品均购自宝鸡晨光生物科技有限公司;莲花掌苷(批号YL19121001,纯度≥98%)、异莲花掌苷(批号YL20012123,纯度≥98%)、白藜芦醇-4′-O-葡萄糖苷(批号YL20061703,纯度≥98%)、白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷(批号YL20030506,纯度≥98%)对照品均购自上海一林生物科技有限公司。
15批掌叶大黄饮片均购自广州采芝林药业有限公司,编号为S1~S15(表1),经黑龙江中医药大学药学院药用植物教研室樊锐锋教授鉴定为蓼科植物掌叶大黄R. palmatum L.的干燥根和根茎。结合《中国药典》[1]并参考文献[6],取大黄饮片100 g,加黄酒30 g,闷润4 h,蒸制温度105 ℃,蒸制时间10 h,制备得熟大黄(与掌叶大黄样品一一对应编号为ZS1~ZS15),并根据《中国药典》方法[1]对掌叶大黄、熟大黄进行含量测定后发现其游离蒽醌含量分别不低于0.35%、0.50%,总蒽醌含量均不低于1.50%,均为合格样品。
2 方法与结果
2.1 色谱条件
色谱柱为Symmtrey C18(250 mm×4.6 mm,5 μm);流动相为甲醇(A)-0.1%磷酸溶液(B),梯度洗脱(0~20 min,5%A→37%A;20~59 min,37%A→76%A;59~61 min,76%A→85%A;61~75 min,85%A;75~77 min,85%A→100%A);流速为1.0 mL/min;检测波长为280 nm;柱温为30 ℃;进样量为10 μL。
2.2 不同产区掌叶大黄酒蒸前后HPLC指纹图谱的建立与分析
2.2.1 混合对照品溶液的制备 分别取对照品没食子酸、儿茶素、番泻苷A、芦荟大黄素-8-O-葡萄糖苷、大黄酸-8-O-β-D-葡萄糖苷、大黄酚-8-O-β-D-葡萄糖苷、大黄素-8-β-D-吡喃葡萄糖苷、大黄素甲醚-8-O-β-D-葡萄糖苷、大黄酸、大黄素、大黄酚、芦荟大黄素、大黄素甲醚、莲花掌苷、异莲花掌苷、白藜芦醇-4′-O-葡萄糖苷、白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷适量,精密称定,用甲醇溶解并稀釋,配制成质量浓度分别为0.190 1、0.165 3、0.082 6、0.082 6、0.107 4、0.082 6、0.082 6、0.082 6、0.082 6、0.082 6、0.107 4、0.082 6、0.082 6、0.148 8、0.082 6、0.061 1、0.061 1 mg/mL的混合对照品溶液,过0.22 μm微孔滤膜,即得。
2.2.2 供试品溶液的制备 精密称取饮片粉末(过三号筛)1.0 g,置于50 mL具塞锥形瓶中,加甲醇25 mL,称定质量,超声(600 W,40 kHz)30 min后,补足减失质量,摇匀,过滤,取滤液,用0.22 μm微孔滤膜过滤,即得。
2.2.3 精密度试验 精密称取S6样品,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件连续进样6次,以没食子酸为参照峰,计算各共有峰的相对保留时间和相对峰面积。结果,各共有峰相对保留时间和相对峰面积的RSD均小于3.00%(n=6),表明仪器进样精密度良好。
2.2.4 稳定性试验 精密称取S6样品,按“2.2.2”项下方法制备供试品溶液,分别在室温下放置0、2、4、6、12、24 h时按“2.1”项下色谱条件进样分析,以没食子酸为参照峰,计算各共有峰的相对保留时间和相对峰面积。结果,各共有峰相对保留时间和相对峰面积的RSD均小于3.00%(n=6),表明供试品溶液在室温24 h内是稳定的。
2.2.5 重复性试验 精密称取S6样品6份,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样分析,以没食子酸为参照峰,计算各共有峰的相对保留时间和相对峰面积。结果,各共有峰相对保留时间和相对峰面积的RSD均小于3.00%(n=6),表明该方法重复性好。
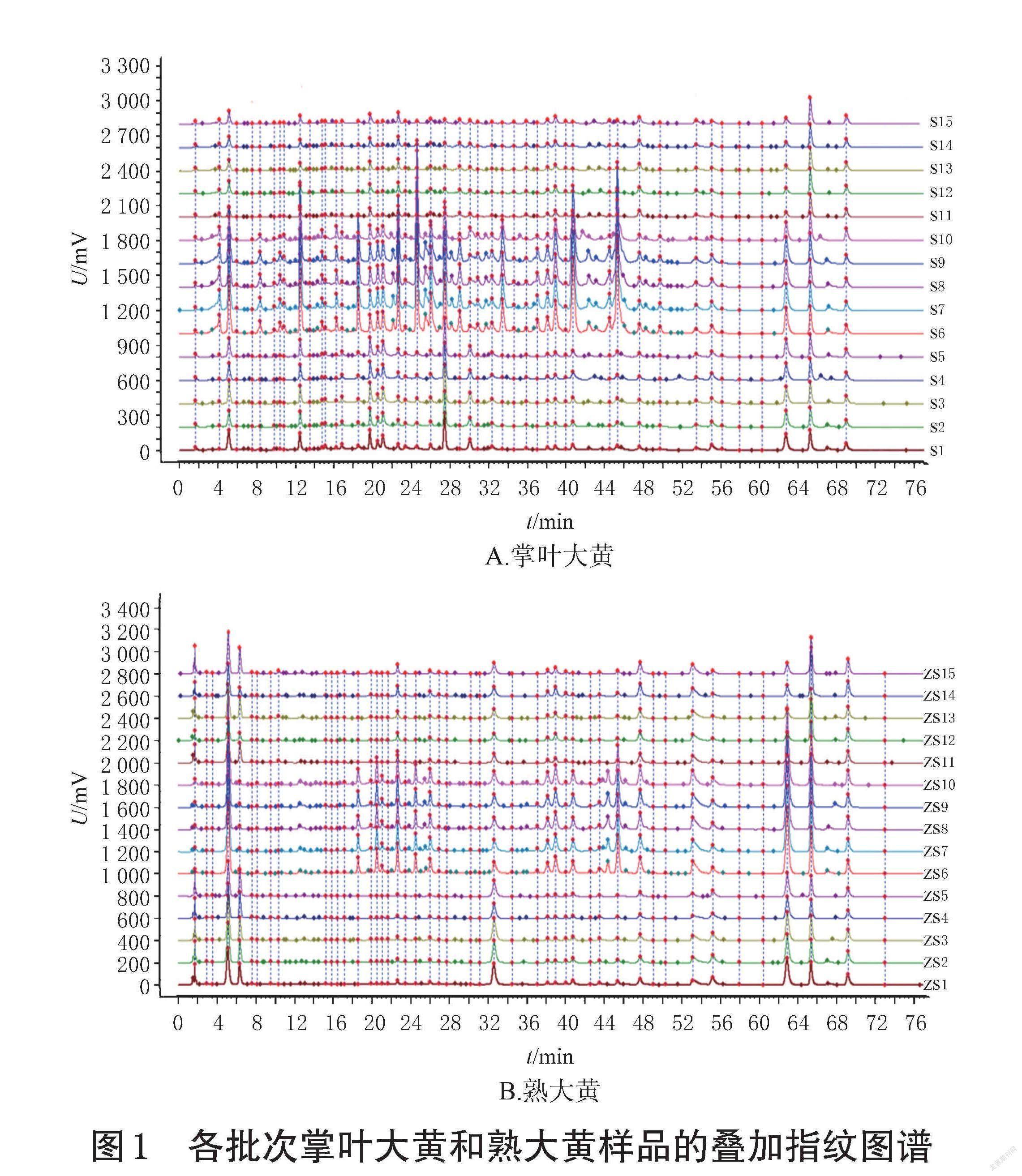
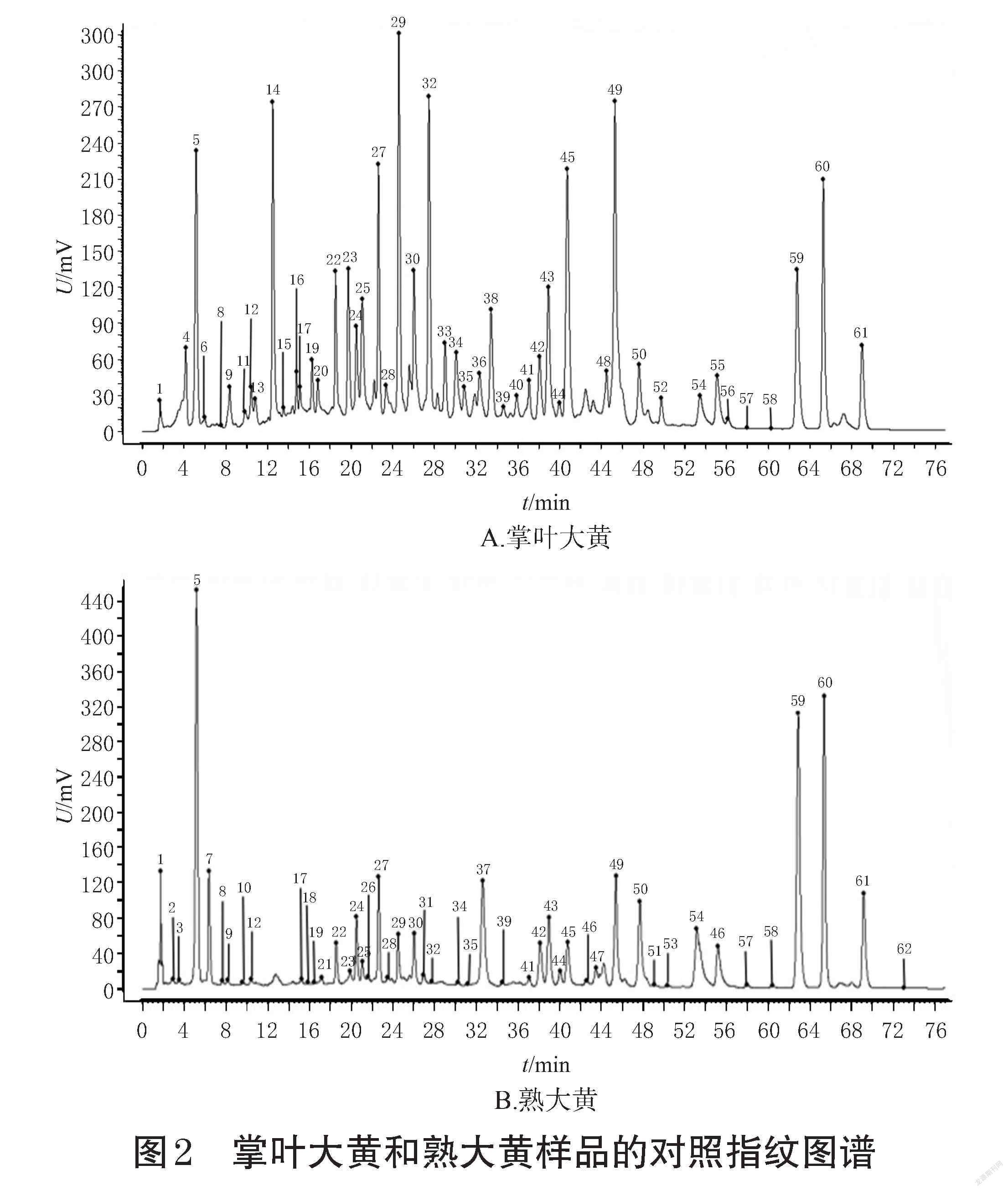
2.2.6 各批次掌叶大黄和熟大黄HPLC指纹图谱建立、相似度评价及色谱峰指认 取15批掌叶大黄、15批熟大黄样品,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录色谱图。将所得色谱数据导入《中药色谱指纹图谱相似度评价系统(2012版)》,采用中位数法,设定时间窗为0.20 min,分别以S6、ZS6为参照图谱,经多点校正后,生成指纹图谱共有模式,并以此作为对照指纹图谱(R、R′)。结果显示,掌叶大黄有48个共有峰,熟大黄有47个共有峰,详见图1、图2。
采用《中药色谱指纹图谱相似度评价系统(2012版)》,对掌叶大黄酒蒸前后的各样品指纹图谱进行相似度评价,结果见表2。甘肃、四川产掌叶大黄相似度为0.779~0.840,青海产掌叶大黄相似度为0.949~0.978,甘肃、青海、四川产熟大黄相似度为0.873~0.972,表明各产区的掌叶大黄具有相似的色谱信息,且甘肃、四川产掌叶大黄与青海产掌叶大黄之间存在着一定差异,熟大黄的质量则较均一稳定。
根据掌叶大黄、熟大黄样品的HPLC指纹图谱生成结果,选择图谱中峰面积较大且分离度较好的色谱峰作为特征峰。结果显示,掌叶大黄、熟大黄共有62个特征峰,与混合对照品溶液HPLC图(图3)进行比对,共指认出17个色谱峰,分别为5号峰(没食子酸)、14号峰(儿茶素)、22号峰(白藜芦醇-4′-O-葡萄糖苷)、24号峰(异莲花掌苷)、25号峰(莲花掌苷)、27号峰(芦荟大黄素-8-O-葡萄糖苷)、29号峰[白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷]、30号峰(大黄酸-8-O-β-D-葡萄糖苷)、33号峰(番泻苷A)、43号峰(大黄酚-8-O-β-D-葡萄糖苷)、45号峰(大黄素-8-β-D-吡喃葡萄糖苷)、49号峰(大黄素甲醚-8-O-β-D-葡萄糖苷)、50号峰(芦荟大黄素)、55号峰(大黄酸)、59号峰(大黄素)、60号峰(大黄酚)、61号峰(大黄素甲醚)。
2.3 化学模式识别分析
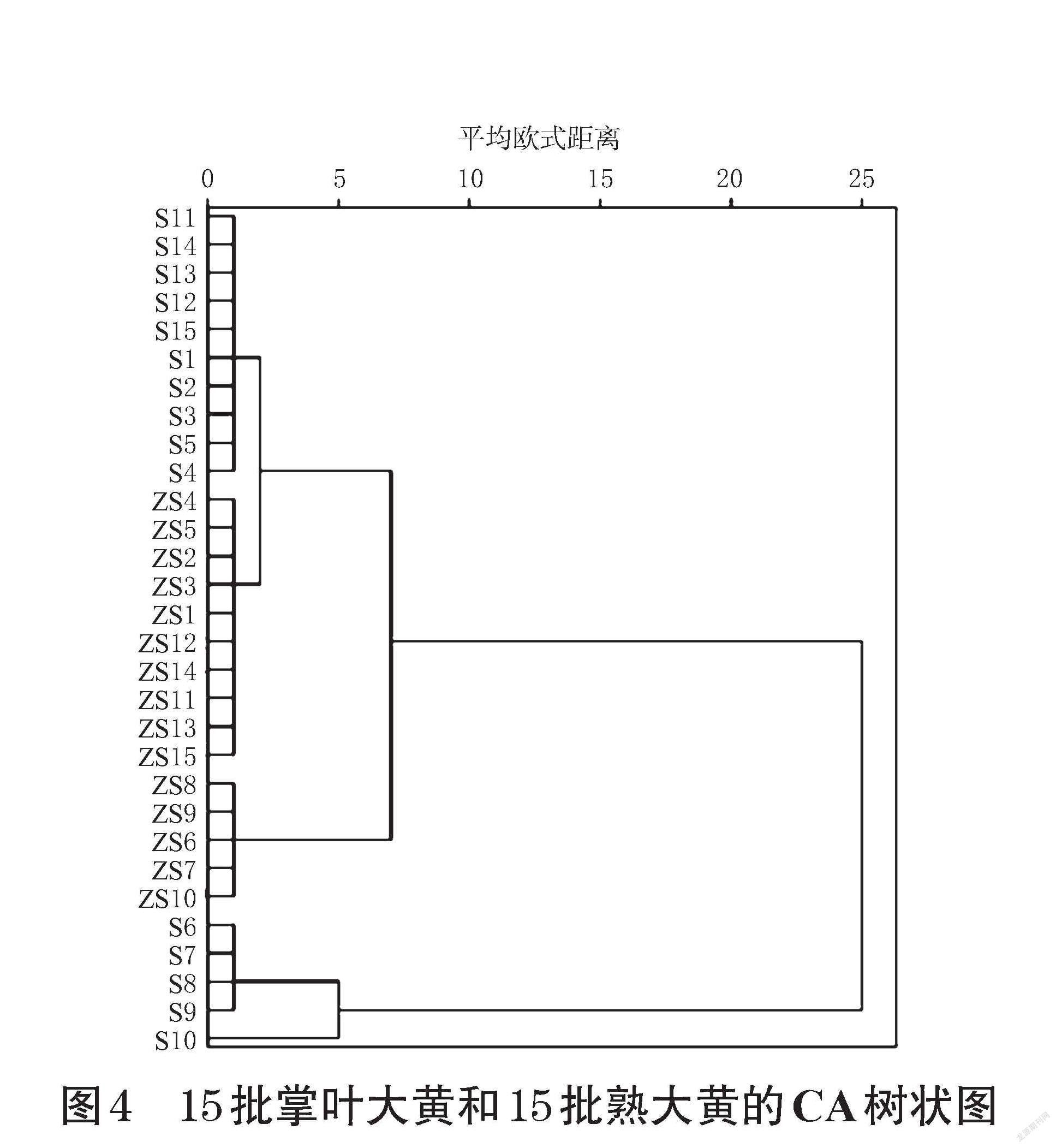
2.3.1 聚类分析 以15批不同产区掌叶大黄酒蒸前后的62个特征峰峰面积为变量,采用组间联接,借助SPSS 23.0软件进行系统聚类分析(cluster analysis,CA)[15],结果见图4。从图4可知,当平方欧式距离为5时,30批样品被明显聚为4类:青海产掌叶大黄(S6~S9)聚为一类,青海产掌叶大黄(S10)聚为一类,青海产熟大黄(ZS6~ZS10)聚为一类,甘肃、四川产掌叶大黄及熟大黄(S1~S5、S11~S15、ZS1~ZS5、ZS11~ZS15)聚为一类;当平方欧式距离为25时,30批样品被明显聚为2类:青海产掌叶大黄(S6~S10)单独聚为一类,其余样品聚为一类。
2.3.2 主成分分析 主成分分析(principal component analysis,PCA)可快速表征样本的差异信息[16]。将15批不同道地产区掌叶大黄酒蒸前后指纹图谱的62个特征峰峰面积组成62×30阶矩阵导入SIMCA-P14.1软件,建立PCA模型,绘制PCA散点图。结果显示,30批样品大体可聚为两类:青海产掌叶大黄(S6~S10)聚为一类,其余样品聚为一类。其结果与CA结果基本一致,详见图5。
2.3.3 偏最小二乘法-判别分析 由相似度、CA和PCA结果可知,青海产区的掌叶大黄与其他2个产区的掌叶大黄存在着明显区别,因此选择偏最小二乘法-判别分析(partial least squares-discriminant analysis,PLS-DA)[15]对甘肃、青海、四川3个产区的掌叶大黄及熟大黄进行产地差异性成分表征。
将15批不同产区掌叶大黄的48个共有峰峰面积导入SIMCA-P14.1软件,进行PLS-DA分析。结果显示,自变量累积解释能力参数(R2X)为0.993,因变量累积解释能力参数(R2Y)为0.995,预测能力参数(Q2)为0.994,均大于0.5,表明该模型拟合效果较好[17]。以变量投影重要性(variable importance in the projection,VIP)值>1为标准,筛选质量差异标志物。结果共得到17个差异性成分,依次为峰32、峰49(大黄素甲醚-8-O-β-D-葡萄糖苷)、峰25(莲花掌苷)、峰59(大黄素)、峰23、峰45(大黃素-8-β-D-吡喃葡萄糖苷)、峰29[白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷]、峰34、峰14(儿茶素)、峰24(异莲花掌苷)、峰43(大黄酚-8-O-葡萄糖苷)、峰33(番泻苷A)、峰27(芦荟大黄素-8-O-葡萄糖苷)、峰4、峰38、峰30(大黄酸-8-O-β-D-葡萄糖苷)、峰5(没食子酸),详见图6。
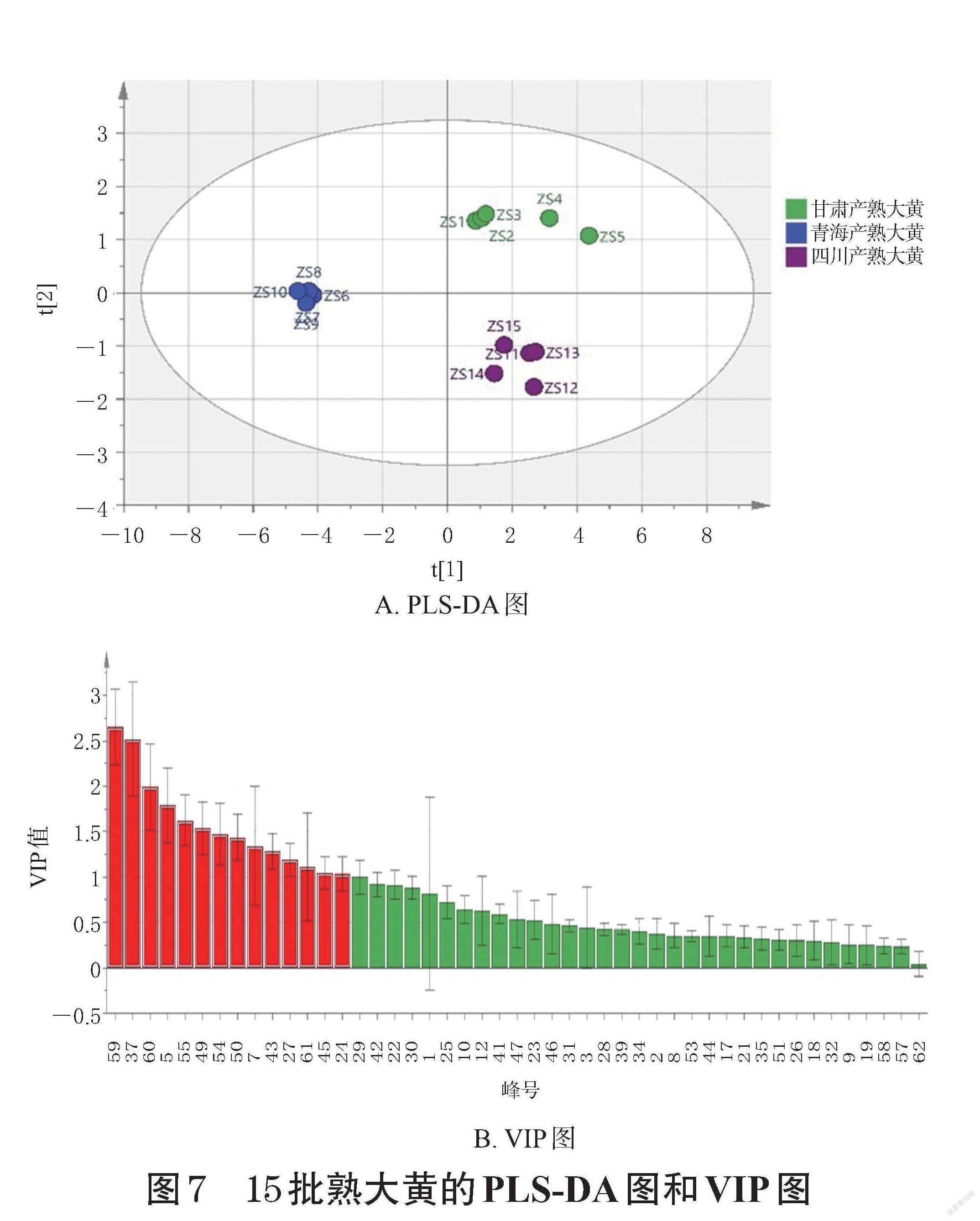
将15批不同产区熟大黄的47个共有峰峰面积导入SIMCA-P14.1软件,进行PLS-DA分析。结果显示,R2X为0.974,R2Y为0.990,Q2为0.979,均大于0.5,表明该模型预测能力好[17]。以VIP值>1为标准,筛选质量差异标志物。结果共得到14个差异性成分,依次为峰59(大黄素)、峰37、峰60(大黄酚)、峰5(没食子酸)、峰55(大黄酸)、峰49(大黄素甲醚-8-O-β-D-葡萄糖苷)、峰54、峰50(芦荟大黄素)、峰7、峰43(大黄酚-8-O-葡萄糖苷)、峰27(芦荟大黄素-8-O-葡萄糖苷)、峰61(大黄素甲醚)、峰45(大黄素-8-β-D-吡喃葡萄糖苷)、峰24(异莲花掌苷),详见图7。
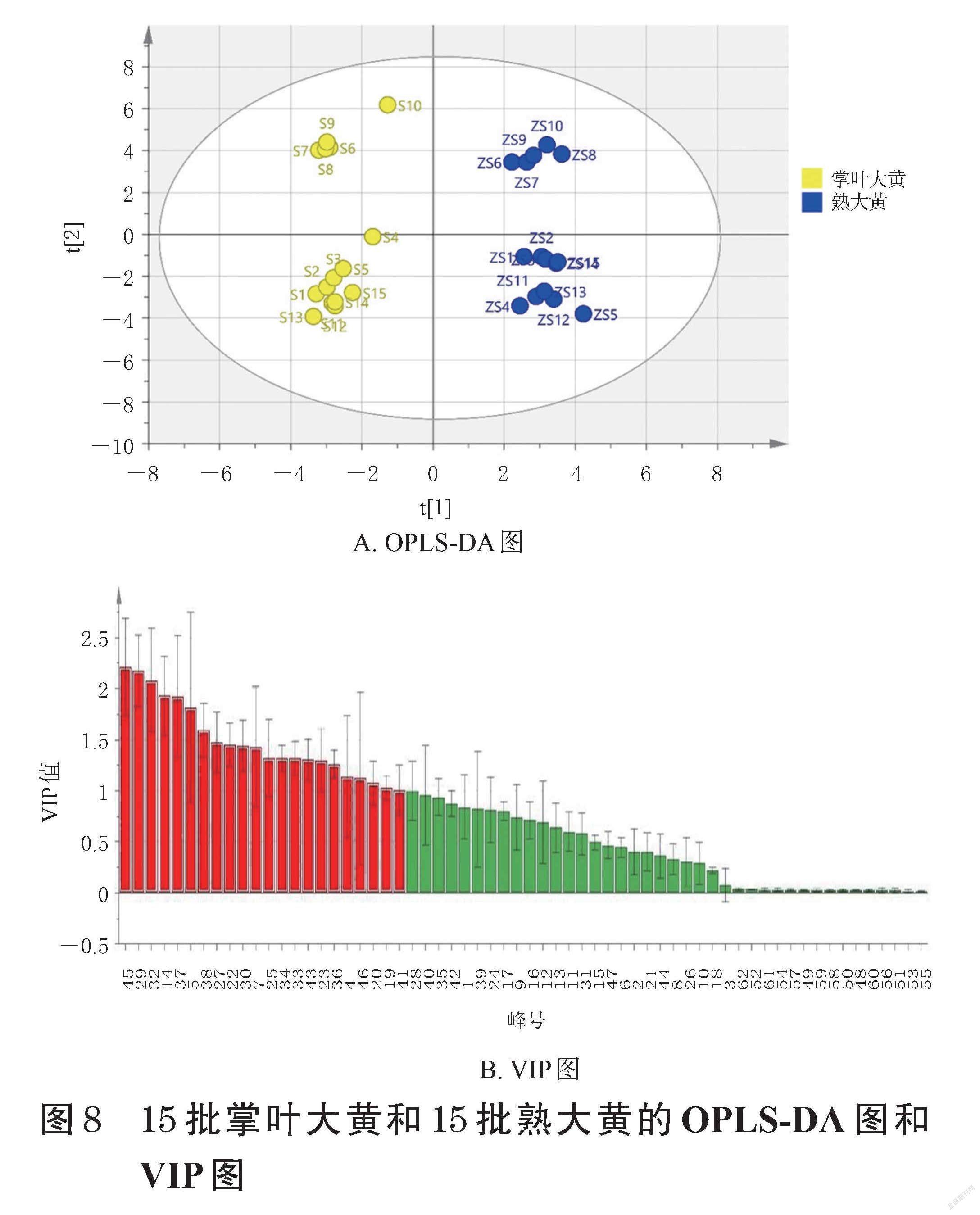
2.3.4 正交偏最小二乘法-判别分析 将15批不同产区掌叶大黄酒蒸前后指纹图谱的62个特征峰峰面积导入SIMCA-P14.1软件,进行有监督模式的正交偏最小二乘法-判别分析(orthogonal partial least squares- discriminant analysis,OPLS-DA)[18],分析各批次掌叶大黄酒蒸前后的差异。结果显示,R2X为0.916,R2Y为0.951,Q2为0.940,均大于0.5。以VIP值>1为参考值得到22个差异性成分,依次为峰45(大黄素-8-β-D-吡喃葡萄糖苷)、峰29[白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷]、峰32、峰14(儿茶素)、峰37、峰5(没食子酸)、峰38、峰27(芦荟大黄素-8-O-葡萄糖苷)、峰22(白藜芦醇-4′-O-葡萄糖苷)、峰30(大黄酸-8-O-β-D-葡萄糖苷)、峰7、峰25(莲花掌苷)、峰34、峰33(番泻苷A)、峰43(大黄酚-8-O- β-D-葡萄糖苷)、峰23、峰36、峰4、峰46、峰20、峰19、峰41,详见图8。
2.4 没食子酸、白藜芦醇-4′-O-葡萄糖苷、白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷的含量测定
2.4.1 3种成分混合对照品贮备液的制备 分别取没食子酸、白藜芦醇-4′-O-葡萄糖苷、白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷对照品适量,精密称定,用甲醇溶解并稀释,配制成质量浓度分别为1.875 0、0.350 0、1.100 0 mg/mL的混合对照品贮备液。
2.4.2 线性关系考察 分别精密吸取“2.4.1”项下混合对照品贮备液(6号工作液)各1.5 mL,加甲醇稀释至2、3、5、30、75 mL得5、4、3、2、1号工作液。精密吸取上述工作液(1~6号)各10 μL,按照“2.1”项下色谱条件进样测定,记录峰面积。以待测成分质量浓度为横坐标(X)、对应峰面积为纵坐标(Y)作线性回归,得到没食子酸、白藜芦醇-4′-O-葡萄糖苷、白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷的回归方程分别为Y=10 510 614.561 6X- 219 016.339 0(r=0.999 9)、Y=24 643 758.406 3X- 101 355.909 8(r=0.999 9)、Y=15 107 174.438 8X- 188 775.455 4(r=0.999 9),其检测质量浓度的线性范围分别为0.037 5~1.875 0、0.007 0~0.350 0、0.022 0~1.100 0 mg/mL。
2.4.3 精密度试验 精密吸取“2.4.2”项下4号工作液,按照“2.1”项下色谱条件进样测定,连续进样6次,记录峰面积。结果显示,没食子酸、白藜芦醇-4′-O-葡萄糖苷、白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷峰面积的RSD分别为2.51%、2.76%、2.69%(n=6),表明仪器精密度良好。
2.4.4 稳定性试验 取同一样品(S6)粉末1.0 g,精密称定,按照“2.2.2”项下方法制成供试品溶液,分别于室温下放置0、2、6、10、12、24 h时按照“2.1”项下色谱条件进样测定,记录峰面积。结果显示,没食子酸、白藜芦醇-4′-O-葡萄糖苷、白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷峰面积的RSD分别为0.71%、0.77%、0.81%(n=6),表明供试品溶液在室温下放置24 h内稳定。
2.4.5 重复性试验 取同一样品(S6)粉末共6份,每份1.0 g,精密称定,分别按照“2.2.2”项下方法制成供试品溶液,再按照“2.1”项下色谱条件进样测定,记录峰面积并按标准曲线法计算样品中各待测成分的含量。结果显示,没食子酸、白藜芦醇-4′-O-葡萄糖苷、白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷含量的RSD分别为1.84%、0.98%、2.63%(n=6),表明該方法重复性较好。
2.4.6 加样回收率试验 取同一批已知含量的掌叶大黄样品(S1)粉末约0.2 g,共6份,分别置于具塞锥形瓶中,精密加入混合对照品贮备液[没食子酸、白藜芦醇-4′-O-葡萄糖苷、白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷质量浓度分别为1.495 4、0.171 9、0.276 4 mg/mL]1 mL,再分别加入甲醇9 mL,其余按照“2.2.2”项下方法制成供试品溶液,然后按照“2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率。结果显示,3种成分的平均加样回收率分别为102.15%、100.99%、101.59%,RSD分别为1.95%、2.85%、2.87%(n=6),表明该方法准确度较好,详见表3。
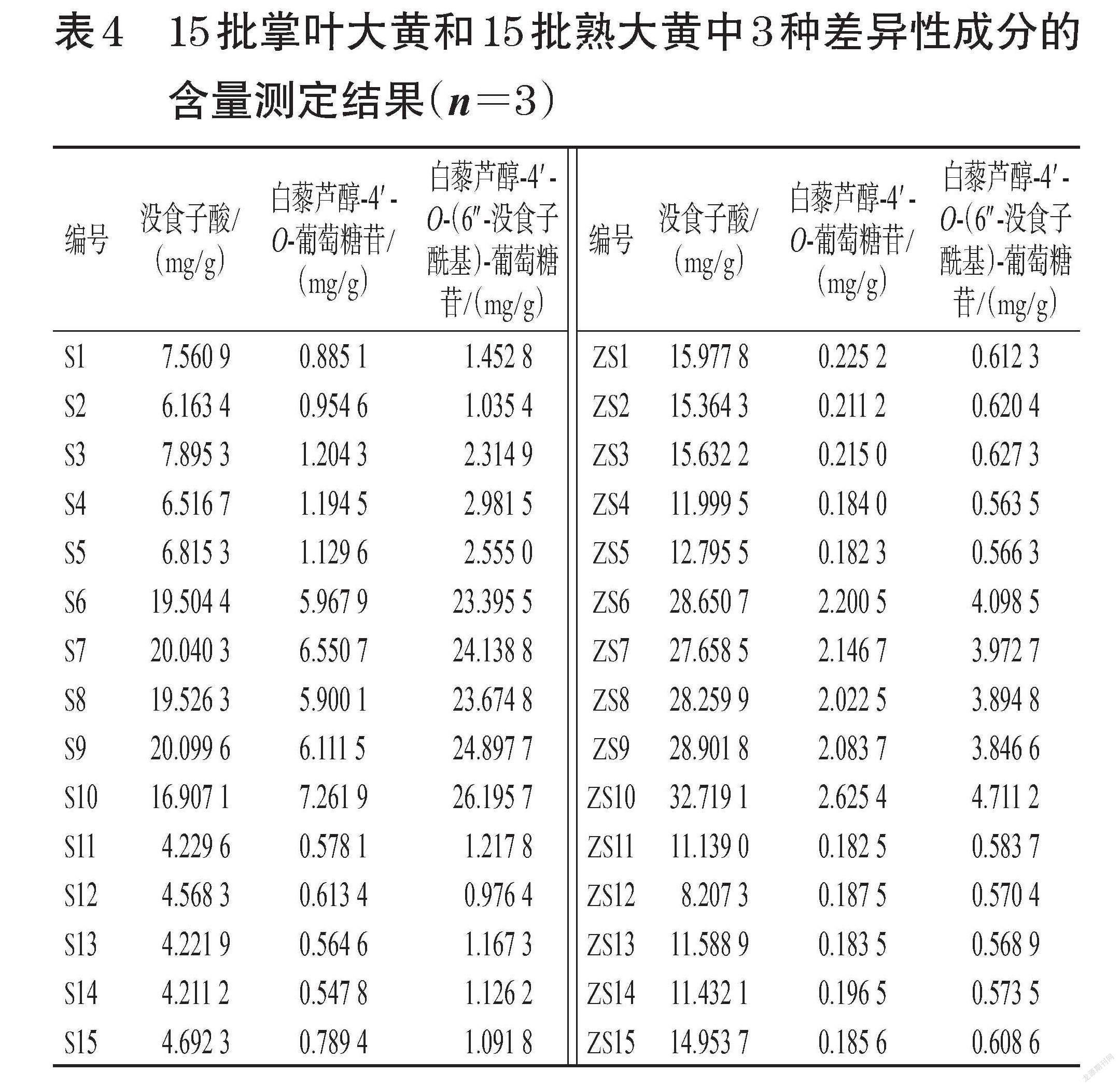
2.4.7 含量测定 分别称取30批样品粉末约1.0 g,按照“2.2.2”项下方法制成供试品溶液后,再按照“2.1”项下色谱条件进样测定,记录峰面积并采用标准曲线法分别计算样品中没食子酸、白藜芦醇-4′-O-葡萄糖苷、白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷的含量。平行测定3次,取平均值。结果显示,30批样品中3种成分的含量分别为4.211 2~32.719 1、0.182 3~7.261 9、0.563 5~26.195 7 mg/g,详见表4。
3 讨论
本研究前期对样品的提取条件进行考察,发现超声30 min与浸泡12 h后超声30 min无明显差异,故选择超声30 min作为提取条件。对色谱条件进行考察发现,以甲醇-0.1%磷酸溶液为流动相、280 nm为检测波长时,色谱峰较多,各主要色谱峰可达到较好的分离,且基线较平稳。
本研究通过对不同产区掌叶大黄酒蒸前后的相似度、CA、PCA结果进行分析,发现各产区样品之间存在着较大差异,尤其是青海产掌叶大黄,其与青海产熟大黄及四川、甘肃产掌叶大黄和熟大黄都存在着较大差异。对PLS-DA结果进行分析发现:酒蒸前掌叶大黄差异性成分主要为蒽醌类、蒽酮类、鞣质类、苯丁酮类和二苯乙烯类,其中白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷的差异性影响较大(VIP值>1.5),推测苯丁酮类和二苯乙烯类成分对掌叶大黄的质量控制也起着重要作用;酒蒸后其差异性成分主要为蒽醌类、鞣质类和苯丁酮类,推测可进一步通过对蒽醌类、鞣质类和苯丁酮类成分的含量测定来对熟大黄进行质量控制。对OPLS-DA结果进行分析发现:峰45(大黄素-8-β-D-吡喃葡萄糖苷)、峰29[白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷]、峰32、峰14(儿茶素)、峰37、峰5(没食子酸)、峰38对掌叶大黄酒蒸前后的差异性影响较大(VIP值>1.5),推测可进一步通过对这些成分的质量控制来对炮制终点进行判定。
根据上述分析结果,本研究进一步选择了不同产区间及酒蒸前后差异性较大且鲜有报道的鞣质类成分(没食子酸)、二苯乙烯类成分[白藜芦醇-4′-O-葡萄糖苷、白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷]进行含量测定。对含量测定结果进行分析发现:各产区掌叶大黄酒蒸后没食子酸含量增加,白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷、白藜芦醇-4′-O-葡萄糖苷含量减少;不同产区中青海产掌叶大黄中3种差异性成分的含量最高,甘肃产掌叶大黄次之。同时,结合指纹图谱进行研究发现,青海产掌叶大黄中3种差异性成分含量明显高于其他2个产区样品,推测其原因可能与海拔差异、栽培方式不同等有关[19]。
综上所述,相对于以往研究,本研究建立了不同道地产区掌叶大黄酒蒸前后指纹图谱,并对其中差异性较大的没食子酸、白藜芦醇-4′-O-(6″-没食子酰基)-葡萄糖苷、白藜芦醇-4′-O-葡萄糖苷进行了含量测定,所建立的HPLC指纹图谱和含量测定方法稳定、可靠,可用于不同道地产区掌叶大黄及酒蒸炮制品的质量评价,为大黄其他两个基原的质量评价研究提供了参考,同时也为不同产区大黄及其不同炮制品的深入研究奠定了基础。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版. 北京:中国医药科技出版社,2020:24-25.
[ 2 ] 杨秀娟,马冬妮,戴海蓉,等.掌叶大黄产地加工与炮制一体化可行性的探讨[J].时珍国医国药,2019,30(2):328- 330.
[ 3 ] 高亮亮.唐古特大黄、药用大黄和掌叶大黄的化学成分和生物活性研究[D].北京:北京协和医学院,2012.
[ 4 ] TANG T,YIN L W,YANG J,et al. Emodin,an anthraquinone derivative from Rheum officinale Baill,enhances cutaneous wound healing in rats[J]. Eur J Pharmacol,2007,567(3):177-185.
[ 5 ] 曾芳,李媛.大黄有效化学成分及其药理作用[J].当代医学,2013,19(12):149-150.
[ 6 ] 王云,张雪,麻印莲,等.熟大黄的炮制、药效及临床应用研究进展[J].中国实验方剂学杂志,2018,24(24):219-226.
[ 7 ] 宋亚南,王云,高雅,等.基于“表里关联”的大黄酒蒸过程质量传递规律分析[J].中国实验方剂学杂志,2021,27(19):157-164.
[ 8 ] 赵倩,陈育鹏,崔旭盛,等.掌叶大黄UPLC多指标成分测定及指纹图谱研究[J].药物分析杂志,2018,38(10):1697-1710.
[ 9 ] 张金胜.大黄的功用及临床配伍体会[J].中国民康医学,2012,24(20):2491-2492.
[10] 李丹丹,张慧,李思雨,等.基于HPLC指纹图谱及UPLC- Q-TOF-MS法的3种不同来源大黄差异成分研究[J].中国药房,2019,30(23):3240-3245.
[11] 李丹丹,裴文菡,郭泰麟,等.不同道地来源大黄药材的多指标成分测定、指纹图谱研究及一致性评价[J].中南药学,2020,18(4):641-647.
[12] 单家明,孟岩,李焐仪,等. FT-IR和HPLC对不同产地大黄药材的鉴别分析[J].井冈山大学学报(自然科学版),2021,42(4):96-102.
[13] 董瑞珍,陈垣,郭凤霞,等.大黄HPLC指纹图谱建立[J]. 中成药,2020,42(9):2505-2510.
[14] 胡永淑.大黃炮制前后物质基础变化研究[J].中国药房,2014,25(11):1016-1018.
[15] 尹燕,王淼,阳志强,等.化学模式识别在中药炮制中的应用[J].中草药,2021,52(17):5369-5377.
[16] 阿基业,何骏,孙润彬.代谢组学数据处理:主成分分析十个要点问题[J].药学学报,2018,53(6):929-937.
[17] 徐锋,杨澜,成婷婷,等.地瓜藤的UPLC指纹图谱建立及聚类分析、主成分分析[J].中国药房,2019,30(24):3388-3392.
[18] 成颜芬,聂欣,谭睿,等.基于经典“九蒸九晒”法不同炮制程度何首乌的化学质量概貌评价[J].中国中药杂志,2019,44(23):5151-5158.
[19] 李莉.不同道地产区大黄资源现状与药材质量特征及其形成机制研究[D].长春:长春中医药大学,2014.
(收稿日期:2021-09-24 修回日期:2021-12-14)
(编辑:曾海蓉)
基金项目:国家重点研发计划项目(No.2018YFC1707103)
硕士研究生。研究方向:中药药效物质基础。E-mail:rxh_4376@163.com
通信作者:教授,博士生导师,博士。研究方向:中药药效物质基础。电话:0451-82193007。E-mail:ybywater@163.com
