新型氨基酸类衍生物的设计、合成及抗肿瘤活性研究
2022-02-19郭易华黄志勇王福东李龙李荣东
郭易华 黄志勇 王福东 李龙 李荣东


〔摘要〕 目的 将氨基酸引入喹唑啉母核,探究含喹唑啉结构的氨基酸衍生物的抗肿瘤细胞增殖活性。方法 以DL-苯丙氨酸、L-苯丙氨酸、D-苯丙氨酸和3-氨基-3-苯基丙酸为原料合成关键中间体,与喹唑啉母核连接合成一系列4-苯氨基喹唑啉衍生物。采用CCK-8法测试目标化合物对非小细胞肺癌细胞(A549)的抗增殖活性。通过LeDock软件测试目标化合物与EGFR蛋白的结合效果。结果 合成了21个新型4-苯氨基喹唑啉衍生物,经1H NMR、LC-MS确证其结构。体外抗肿瘤实验结果表明,目标化合物12u与12o的抗肿瘤活性与阳性对照药吉非替尼相当。LeDock软件测试结果与体外抗肿瘤实验结果一致。结论 新型4-苯氨基喹唑啉衍生物具有抗非小细胞肺癌的作用,为进一步探究含喹唑啉的氨基酸抗肿瘤药物打下基础。
〔关键词〕 氨基酸衍生物;喹唑啉;非小细胞肺癌;A549;细胞增殖;化学合成
〔中图分类号〕R284.3 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.01.011
〔Abstract〕 Objective To introduce amino acids into the quinazoline core to explore the anti-tumor cell proliferation activity of amino acid derivatives containing quinazoline structure. Methods DL-phenylalanine, L-phenylalanine, D-phenylalanine and 3-amino-3-phenylpropionic acid were used as raw materials to synthesize key intermediates, which were connected to the quinazoline core to synthesize a series 4-phenylaminoquinazoline derivatives. The CCK-8 method was used to test the anti-proliferative activity of the target compound on non-small cell lung cancer cells (A549). LeDock software was used to test the binding effect of the target compound and EGFR protein. Results 21 novel 4-phenylaminoquinazoline derivatives were synthesized, and their structures were confirmed by 1H NMR and LC-MS. The results of in vitro anti-tumor experiments showed that the antitumor activity of compound 12u and 12o was equivalent to that of the positive control drug gefitinib. The LeDock software test results were consistent with the results of in vitro anti-tumor experiments. Conclusion The novel 4-phenylaminoquinazoline derivatives have anti-non-small cell lung cancer effects, which lay the foundation for further exploration of quinazoline containing amino acid anti-tumor drugs.
〔Keywords〕 amino acid derivatives; quinazoline; non-small cell lung cancer; A549; cell proliferation; chemical synthesis
肺癌是嚴重病威胁人们生命的恶性肿瘤之一[1]。随着表皮生长因子受体(epidermal growth factor rece?鄄
ptor, EGFR)、渐变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)和神经营养因子受体络氨酸激酶(neurotrophin receptor kinase, NTRK)等几种酪氨酸激酶抑制剂的发展,肺癌患者的存活率略有改善[2-4]。喹唑啉是重要的杂环衍生物,具有抗肿瘤活性[5-7]。吉非替尼为第一代可逆性EGFR抑制剂,在2003年被美国FDA批准为局部晚期或转移性非小细胞肺癌(non-small cell lung cancer, NSCLC)患者的单一治疗药物[8]。此外,埃罗替尼和阿法替尼也是用于治疗非小细胞肺癌的EGFR抑制剂[9-10],且他们都是含喹唑啉结构的上市抗肿瘤药物。氨基酸是构成蛋白质的基本单位,具有良好的生物相容性和亲和性,将其引入药物分子,可提高抗肿瘤活性以及代谢稳定性,增加药物的溶解性,促进细胞对药物的吸收,降低对正常细胞的毒性,为寻求高效、低毒的抗肿瘤药物开辟途径[11-14]。本文以喹唑啉环为母核,将修饰后的氨基酸与喹唑啉4位连接,并对喹唑啉环6位进行结构改造,设计合成了21个新型含喹唑啉的氨基酸衍生物,并测试其对人肺癌细胞株A549的抗增殖活性。
1 仪器与试药
Water Xevo G2-XS TOf型质谱仪(沃特世科技有限公司);核磁共振波谱仪AVANCE Ⅲ HD 600 MHz(布鲁克科技有限公司);RE-2000B型旋转蒸发仪(巩义市予华仪器有限公司);DFY-10L型低温恒温反应浴槽(巩义市予华仪器有限公司);SHZ-D(Ⅲ)循环水式真空泵(巩义市予华仪器有限公司);ZNCL-DL-G2智能磁力搅拌器(爱博特科技有限公司);DB-2BC型真空干燥箱(巩义市予华仪器有限公司);Multiskan MK3型多功能酶标仪(赛默飞世尔科技公司);人肺癌细胞株A549由湖南中医药大学中西医结合心脑疾病防治实验室赠予;吉非替尼PS180501(河南普赛化工产品有限公司)。实验所用试剂均为市售化学纯或分析纯,所有试剂使用前都未作处理。
2 方法与结果
2.1 目标化合物的合成
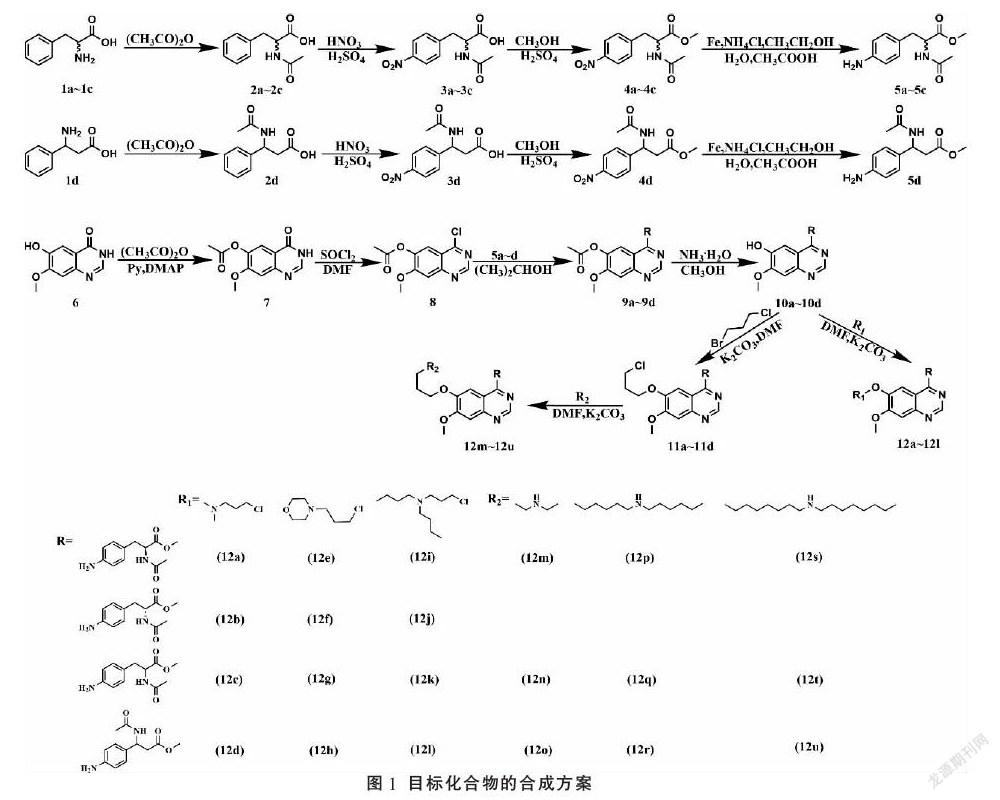
目标化合物12a~12u的合成方案如图1所示,合成路线分为两部分。第一部分,以DL-苯丙氨酸、L-苯丙氨酸、D-苯丙氨酸以及3-氨基-3-苯基丙酸为起始原料,经乙酰化、硝化、酯化和还原,得到重要中间体5a~5d。第二部分以6-羟基-7-甲氧基-3H-喹唑啉-4-酮为原料,经乙酰化保护羟基,氯化亚砜氯化得到7-甲氧基-6-乙酰氧基-4-氯喹唑啉,然后与第一部分重要中间体对接,脱保护得到重要中间体10a~10d,再对6位羟基进行修饰,得到目标化合物12a~12u。
2.1.1 (S)-2-乙酰氨基-3-苯基丙酸(2a)[15]的制備 L-苯丙氨酸(15 g,0.091 mol)和水(200 mL)室温搅拌10 min,缓慢滴加饱和NaOH水溶液,调节溶液的pH值至苯丙氨酸全溶,缓慢滴加乙酸酐(15 mL)。乙酸酐滴加过程中,由于pH值的改变,L-苯丙氨酸析出,滴加饱和NaOH水溶液维持反应液的弱碱性环境(pH=8.0)。室温反应3 h,TLC检测反应完全后,滴加盐酸调节反应液的pH值至2,产物完全析出,抽滤,干燥得白色固体16.6 g,收率:88.2%。
目标化合物2b~2d的合成方法参照上述方法。
2.1.2 (S)-2-乙酰氨基-3-(4-硝基苯基)丙酸(3a)[16]的制备 在250 mL烧瓶中缓慢加入98%硫酸 (9.6 mL)和67%硝酸(8.0 mL),控温-20 ℃搅拌0.5 h,取出,置于冰浴中搅拌,分批加(S)-2-乙酰氨基-3-苯基丙酸(10 g,0.048 mol)。18 h后停止反应,将反应液倒入200 mL冰水中,搅拌,产物析出,抽滤,干燥得白色固体6.9 g,收率:56.7%。
目标化合物3b~3d的合成方法参照上述方法。
2.1.3 (S)-2-乙酰氨基-3-(4-硝基苯基)丙酸甲酯(4a)[17]的制备 (S)-2-乙酰氨基-3-(4-硝基苯基)丙酸(6 g,0.024 mol)溶于甲醇(60 mL),85 ℃搅拌0.5 h,缓慢滴加98%浓硫酸(0.84 mL),回流反应7 h,停止反应,冷却至室温。减压蒸除甲醇,加乙酸乙酯(100 mL)提取,滴加饱和Na2CO3溶液,调节pH值至7,水相用乙酸乙酯(50 mL×2)萃取,合并有机相,加水(50 mL×2)洗涤,无水硫酸镁干燥有机相4 h。过滤,滤液减压浓缩,得黄色固体5.8 g,收率:91.6%。
目标化合物4b~4d的合成方法参照上述方法。
2.1.4 (S)-2-乙酰氨基-3-(4-氨基苯基)丙酸甲酯(5a)[18]的制备 还原铁粉(11.1 g,0.199 mol)、氯化铵(0.68 g,0.013 mol)、乙醇(56 mL)、水(14 mL)和冰醋酸(3.4 mL),90 ℃机械搅拌1.5 h,加入(S)-2-乙酰氨基-3-(4-硝基苯基)丙酸甲酯(5.1 g,0.019 mol)继续反应3 h。趁热抽滤,滤液减压浓缩,加二氯甲烷(150 mL)提取,加水(50 mL×2)洗涤,无水硫酸镁干燥有机相4 h。过滤,滤液减压浓缩,得黄白色固体3.4 g,收率:75.2%。
目标化合物5b~5d的合成方法参照上述方法。
2.1.5 7-甲氧基-6-乙酰氧基-4-氯喹唑啉(8)[19]的制备 6-羟基-7-甲氧基-4-酮喹唑啉(10 g,0.052 mol)、乙酸酐(108 mL)和吡啶(22.4 mL),100 ℃搅拌1 h,加入4-二甲氨基吡啶(1.4 g,0.012 mol),继续搅拌4 h,停止反应。冷却至室温,倒入冰水(500 mL)搅拌,抽滤,滤饼烘干,得黄白色固体。将其溶于氯化亚砜(107 mL),80 ℃搅拌0.5 h,滴加DMF(4.6 mL,0.059 mol)。4 h后停止反应,冷却至室温,减压回收氯化亚砜,倒入冰水搅拌,抽滤,烘干滤饼,得灰白色固体10.5 g,收率:80.0%。
2.1.6 (S)-2-乙酰氨基-3-(4-((6-乙酰氧基-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(9a)的制备 (S)-2-乙酰氨基-3-(4-氨基苯基)丙酸甲酯(3.7 g,0.016 mol)溶于异丙醇(37 mL),95 ℃搅拌0.5 h,加入7-甲氧基-6-乙酰氧基-4-氯喹唑啉(4.8 g,0.014 mol)。4 h后趁热抽滤,烘干滤饼,得白色固体5.0 g,收率:70.6%。熔点:199.9~201.2 ℃。HRMS(ESI)m/z: 453.1791 [M+H]+。
目标化合物9b~9d的合成方法参照上述方法。
2.1.7 (S)-2-乙酰氨基-3-(4-((6-羟基-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(10a)的制备 (S)-2-乙酰氨基-3-(4-((6-乙酰氧基-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(3 g,0.007 mol)溶于甲醇(20 mL),70 ℃搅拌0.5 h,加入氨水(5.2 mL)。5 h后冷却至室温,反应液减压浓缩,得黄色油状物。加入乙酸乙酯(30 mL)搅拌,出现黄色固体,抽滤,烘干滤饼,得黄色固体2.5 g,收率:91.9%。熔点:197.5~198.8 ℃。HRMS(ESI) m/z: 411.1613 [M+H]+。
目标化合物10b~10d的合成方法参照上述方法。
2.1.8 (S)-2-乙酰氨基-3-(4-((6-(3-(二甲基氨基)丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12a)的制备 (S)-2-乙酰氨基-3-(4-((6-羟基-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(2.8 g,0.007 mol)溶于DMF(14 mL),95 ℃搅拌0.5 h,加入碳酸钾(1.2 g,0.009 mol)、碘化鉀(0.02 g)和N,N-二甲基-3-氯丙胺(1.5 mL,0.011 mol)。继续反应8 h,TLC检测反应完全后,停止反应。冷却至室温,加入冰水(70 mL),搅拌2 h,抽滤得粗产品。将粗产品溶于甲醇(10 mL)搅拌,缓慢滴加盐酸,有白色固体产生,抽滤,烘干滤饼,得白色固体1.6 g,收率:47.3%。
目标化合物12b~12l的合成方法参照上述方法。
2.1.9 (S)-2-乙酰氨基-3-(4-((6-(3-氯丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(11a)的制备 (S)-2-乙酰氨基-3-(4-((6-羟基-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(2.5 g,0.006 mol)溶于DMF(10 mL),75 ℃搅拌0.5 h,加入碳酸钾(1.0 g,0.007 mol)、碘化钾(0.02 g)和1,3-溴氯丙烷(0.78 mL,0.008 mol)。继续反应8 h,TLC检测反应完全后,停止反应。冷却至室温,加冰水(50 mL),搅拌2 h,抽滤得粗产品,加丙酮洗涤,烘干滤饼,得黄色固体2.3 g,收率:77.4%。熔点:130.2~131.7 ℃。HRMS(ESI) m/z: 487.1737 [M+H]+。
目标化合物11b~11d的合成方法参照上述方法。
2.1.10 (S)-2-乙酰氨基-3-(4-((6-(3-(二乙氨基)丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12m)的制备 (S)-2-乙酰氨基-3-(4-((6-(3-氯丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(2.3 g,0.005 mol)溶于DMF(10 mL),95 ℃搅拌0.5 h,加入碳酸钾(1.04 g,0.008 mol)、碘化钾(0.02 g)和二乙胺(0.8 mL,0.007 mol)。继续反应8 h,TLC检测反应完全后,停止反应。冷却至室温,加冰水(50 mL),搅拌2 h,抽滤得粗产品。将粗产品溶于甲醇(10 mL),缓慢滴加盐酸,有白色固体产生,抽滤,烘干滤饼,得黄白色固体1.2 g,收率:48.8%。
目标化合物12n~12u的合成方法参照上述方法。
2.2 目标化合物的图谱数据
2.2.1 (S)-2-乙酰氨基-3-(4-((6-(3-(二甲基氨基)丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12a) 白色固体,收率:41.6%。熔点:165.1~167.5 ℃。1H NMR (600 MHz, CD3OD) δ 8.51 (s, 1H), 7.88 (s, 1H), 7.61 (d, J=8.5 Hz, 2H), 7.30 (d, J=8.4 Hz, 2H), 7.22 (s, 1H), 4.49-4.44 (m, 1H), 4.12 (s, 3H), 3.75 (s, 3H), 3.63-3.60 (m, 2H), 3.24-3.19 (m, 2H), 3.08-3.00 (m, 2H), 1.97 (s, 3H), 1.27 (s, 6H), 0.90-0.87 (m, 2H)。HRMS(ESI) m/z: 496.3410 [M+H]+。
2.2.2 (R)-2-乙酰氨基-3-(4-((6-(3-(二甲基氨基)丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12b) 白色固体,收率:38.9%。熔点:153.3~154.5 ℃。1H NMR (600 MHz, CD3OD) δ 8.58 (s, 1H), 7.90 (s, 1H), 7.63 (d, J=8.2 Hz, 2H), 7.31 (d, J=8.2 Hz, 2H), 7.23 (s, 1H), 4.75-4.71 (m, 1H), 4.12 (s, 3H), 3.73 (s, 3H), 3.33 (s, 6H), 3.30-3.25 (m, 2H), 3.24-3.18 (m, 2H), 3.04-2.95 (m, 2H), 2.48-2.34 (m, 2H), 1.95 (s, 3H)。HRMS(ESI) m/z: 496.3407 [M+H]+。
2.2.3 2-乙酰氨基-3-(4-((6-(3-(二甲基氨基)丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12c) 白色固体,收率:47.3%。熔点:171.7~174.6 ℃。1H NMR (600 MHz, CD3OD) δ 8.53 (s, 1H), 7.93 (s, 1H), 7.63 (d, J=8.2 Hz, 2H), 7.30 (d, J=8.4 Hz, 2H), 7.27 (s, 1H), 4.49-4.45 (m, 1H), 4.12 (s, 3H), 3.75 (s, 3H), 3.68-3.62 (m, 2H), 3.23-3.18 (m, 2H), 3.07-3.01 (m, 2H), 1.98 (s, 6H), 1.29-1.25 (m, 2H), 1.21 (s, 3H)。HRMS(ESI) m/z: 496.3421 [M+H]+。
2.2.4 3-乙酰氨基-3-(4-((6-(3-(二甲基氨基)丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12d) 白色固体,收率:47.3%。熔点:145.7~146.6 ℃。1H NMR (600 MHz, CD3OD) δ 8.65 (s, 1H), 8.18 (s, 1H), 7.73 (d, J=8.4 Hz, 2H), 7.45 (d, J=8.4 Hz, 2H), 7.26 (s, 1H), 5.39 (t, J=7.4 Hz, 1H), 4.42 (t, J=4.9 Hz, 2H), 4.09 (s, 3H), 3.66 (s, 3H), 3.47-3.41 (m, 4H), 3.00 (s, 6H), 2.43-2.33 (m, 2H), 1.98 (s, 3H)。HRMS(ESI) m/z: 496.2431 [M+H]+。
2.2.5 (S)-2-乙酰氨基-3-(4-((6-(3-嗎啉代丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12e) 白色固体,收率:36.7%。熔点:168.0~170.2 ℃。1H NMR (600 MHz, CD3OD) δ 8.57 (s, 1H), 8.22 (s, 1H), 7.69 (d, J=7.9 Hz, 2H), 7.61 (s, 1H), 7.34 (d, J=8.3 Hz, 2H), 4.53-4.40 (m, 1H), 4.08 (s, 3H), 4.04-3.98 (m, 2H), 3.51-3.41 (m, 4H), 3.35 (s, 3H), 3.30-3.16 (m, 4H), 3.06 (dt, J=13.8, 6.9 Hz, 2H), 2.52-2.40 (m, 2H), 1.98 (s, 3H), 1.20 (t, J=7.0 Hz, 2H)。HRMS(ESI) m/z: 538.2517 [M+H]+。
2.2.6 (R)-2-乙酰氨基-3-(4-((6-(3-吗啉代丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12f) 白色固体,收率:41.6%。熔点:153.0~155.2 ℃。1H NMR (600 MHz, CD3OD) δ 8.59 (s, 1H), 8.23 (s, 1H), 7.70 (d, J=8.4 Hz, 2H), 7.63 (s, 1H), 7.34-7.27 (m, 2H), 4.46 (t, J=5.6 Hz, 1H), 4.09 (s, 3H), 3.99 (t, J=12.2 Hz, 2H), 3.74 (s, 3H), 3.46 (t, J=7.4 Hz, 2H), 3.34 (t, J=1.6 Hz, 4H), 3.24-3.16 (m, 4H), 3.08-2.99 (m, 2H), 2.50-2.42 (m, 2H), 1.98 (s, 3H)。HRMS(ESI) m/z: 538.2521 [M+H]+。
2.2.7 2-乙酰氨基-3-(4-((6-(3-吗啉代丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12g) 白色固体,收率:33.7%。熔点:171.0~172.9 ℃。1H NMR(600 MHz, CD3OD) δ 8.57 (s, 1H), 8.24 (s, 1H), 7.70 (d, J=8.4 Hz, 2H), 7.56 (s, 1H), 7.31 (d, J=7.0 Hz, 2H), 4.46 (t, J=5.2 Hz, 1H), 4.09 (s, 3H), 4.01 (t, J=12.1 Hz, 4H), 3.75 (s, 3H), 3.45 (t, J=7.2 Hz, 2H), 3.37-3.33 (m, 4H), 3.24-3.15 (m, 2H), 3.09-3.04 (m, 2H), 2.47 (t, J=6.5 Hz, 2H), 1.98 (s, 3H)。HRMS(ESI) m/z: 538.2553 [M+H]+。
2.2.8 3-乙酰氨基-3-(4-((6-(3-吗啉代丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12h) 白色固体,收率:41.6%。熔点:148.5~150.1 ℃。1H NMR(600 MHz, CD3OD) δ 8.60 (s, 1H), 8.20 (s, 1H), 7.72 (d, J=8.4 Hz, 2H), 7.47 (d, J=8.4 Hz, 2H), 7.23 (s, 1H), 5.41 (t, J=7.1 Hz, 1H), 4.09 (s, 3H), 3.95 (t, J=12.3 Hz, 2H), 3.69-3.60 (m, 4H), 3.46 (t, J=6.7 Hz, 2H), 3.34 (s, 3H), 2.89 (s, 2H), 2.88-2.78 (m, 2H), 2.53-2.36 (m, 4H), 2.00 (s, 3H)。HRMS(ESI) m/z: 538.2518 [M+H]+。
2.2.9 (S)-2-乙酰氨基-3-(4-((6-(3-(二丁基氨基)丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12i) 白色固体,收率:46.2%。熔点:180.4~182.1 ℃。1H NMR (600 MHz, CD3OD) δ 8.60 (s, 1H), 8.29 (s, 1H), 7.72 (d, J=8.3 Hz, 2H), 7.66 (s, 1H), 7.31 (d, J=8.5 Hz, 2H), 4.46 (t, J=5.0 Hz, 1H), 4.09 (s, 3H), 3.74 (s, 3H), 3.45 (t, J=7.4 Hz, 2H), 3.34 (t, J=1.6 Hz, 4H), 3.24-3.17 (m, 2H), 3.09-3.01 (m, 2H), 1.97 (s, 3H), 1.84-1.70 (m, 4H), 1.53-1.40 (m, 4H), 1.29-1.23 (m, 2H), 1.04 (t, J=7.3 Hz, 6H)。HRMS(ESI) m/z: 580.3360 [M+H]+。
2.2.10 (R)-2-乙酰氨基-3-(4-((6-(3-(二丁基氨基)丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12j) 白色固体,收率:46.2%。熔点:171.9~173.8 ℃。1H NMR (600 MHz, CD3OD) δ 8.57 (s, 1H), 8.32 (s, 1H), 7.71 (d, J=8.2 Hz, 2H), 7.31 (d, J=8.8 Hz, 2H), 7.27 (s, 1H), 4.46 (t, J=6.3 Hz, 1H), 4.09 (s, 3H), 3.75 (s, 3H), 3.47-3.44 (m, 2H), 3.24-3.22 (m, 4H), 3.20-3.19 (m, 2H), 2.43-2.38 (m, 2H), 1.98 (s, 3H), 1.82-1.74 (m, 4H), 1.64-1.61 (m, 2H), 1.51-1.44 (m, 4H), 1.03 (t, J=7.4 Hz, 6H)。HRMS(ESI) m/z: 580.3364 [M+H]+。
2.2.11 2-乙酰氨基-3-(4-((6-(3-(二丁基氨基)丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12k) 白色固体,收率:51.2%。熔点:184.2~186.6 ℃。1H NMR (600 MHz, CD3OD) δ 8.63 (s, 1H), 8.25 (s, 1H), 7.71 (d, J=8.4 Hz, 2H), 7.32 (d, J=8.4 Hz, 2H), 7.28 (s, 1H), 4.44 (t, J=5.5 Hz, 1H), 4.09 (s, 3H), 3.73 (s, 3H), 3.49-3.41 (m, 2H), 3.35-3.30 (m, 4H), 3.25-3.18 (m, 2H), 3.07-2.99 (m, 2H), 2.42-2.32 (m, 2H), 1.96 (s, 3H), 1.82-1.71 (m, 4H), 1.52-1.39 (m, 4H), 1.03 (t, J=7.4 Hz, 6H)。HRMS(ESI) m/z: 580.3368 [M+H]+。
2.2.12 3-乙酰氨基-3-(4-((6-(3-(二丁基氨基)丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12l) 白色固体,收率:43.3%。熔点:152.6~153.9 ℃。1H NMR (600 MHz, CD3OD) δ 8.64 (s, 1H), 8.21 (s, 1H), 7.74 (d, J=8.4 Hz, 2H), 7.45 (d, J=8.4 Hz, 2H), 7.27 (s, 1H), 5.40 (t, J=7.4 Hz, 1H), 4.43 (s, 3H), 4.14-4.09 (m, 2H), 4.08 (s, 3H), 3.46 (t, J=7.7 Hz, 2H), 2.90-2.80 (m, 2H), 2.40-2.35 (m, 4H), 1.98 (s, 3H), 1.51-1.43 (m, 8H), 1.22 (t, J=7.1 Hz, 2H), 1.03 (t, J=7.4 Hz, 6H)。HRMS(ESI) m/z:580.3367 [M+H]+。
2.2.13 (S)-2-乙酰氨基-3-(4-((6-(3-(二乙氨基)丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12m) 白色固體,收率:40.4%。熔点:176.3~177.9 ℃。1H NMR (600 MHz, CD3OD) δ 8.43 (s, 1H), 7.79 (s, 1H), 7.51 (d, J=8.2 Hz, 2H), 7.24 (d, J=8.3 Hz, 2H), 7.09 (s, 1H), 4.48 (t, J=4.9 Hz, 1H), 3.97 (s, 3H), 3.44-3.38 (m, 2H), 3.38 (s, 3H), 3.34-3.27 (m, 4H), 3.23-3.18 (m, 2H), 3.10-3.01 (m, 2H), 2.56-2.48 (m, 2H), 1.97 (s, 3H), 1.41 (t, J=7.3 Hz, 6H)。HRMS(ESI) m/z: 524.2720 [M+H]+。
2.2.14 2-乙酰氨基-3-(4-((6-(3-(二乙氨基)丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12n) 黄白色固体,收率:48.8%。熔点:179.9~181.8 ℃。1H NMR (600 MHz, CD3OD) δ 8.51 (s, 1H), 7.67 (s, 1H), 7.66 (d, J=8.5 Hz, 2H), 7.30 (d, J=8.2 Hz, 2H), 7.22 (s, 1H), 4.81-4.73 (m, 1H), 4.16-4.08 (m, 2H), 4.06 (s, 3H), 3.39 (s, 3H), 3.30-3.23 (m, 4H), 3.10-3.04 (m, 2H), 2.57 (t, J=6.2 Hz, 2H), 1.98 (s, 3H), 1.31-1.24 (m, 6H), 0.93-0.80 (m, 2H)。HRMS(ESI) m/z: 524.2716 [M+H]+。
2.2.15 3-乙酰氨基-3-(4-((6-(3-(二乙氨基)丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12o) 白色固体,收率:40.4%。熔点:166.6~168.3 ℃。1H NMR (600 MHz, CD3OD) δ 8.41 (s, 1H), 7.85 (s, 1H), 7.64 (d, J=8.5 Hz, 2H), 7.39 (d, J=8.5 Hz, 2H), 7.11 (s, 1H), 5.41-5.35 (m, 1H), 4.50 (t, J=5.9 Hz, 2H), 4.03 (s, 3H), 3.97 (s, 3H), 3.45-3.44 (m, 2H), 2.87-2.77 (m, 4H), 2.53-2.49 (m, 2H), 2.02-1.97 (m, 6H), 1.41 (t, J=7.2 Hz, 2H), 1.28 (s, 3H)。HRMS(ESI) m/z: 524.2868 [M+H]+。
2.2.16 (S)-2-乙酰氨基-3-(4-((6-(3-(二己基氨基)丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12p) 白色固體,收率:45.4%。熔点:186.3~188.9 ℃。1H NMR (600 MHz, CD3OD) δ 8.41 (s, 1H), 7.80 (s, 1H), 7.52 (d, J=8.4 Hz, 2H), 7.25 (d, J=8.4 Hz, 2H), 7.10 (s, 1H), 4.64-4.61 (m, 1H), 4.48 (t, J=4.8 Hz, 2H), 3.96 (s, 3H), 3.38 (s, 3H), 3.35-3.33 (m, 16H), 3.22-3.18 (m, 2H), 3.07-3.01 (m, 2H), 2.50 (t, J=5.9 Hz, 4H), 1.97-1.96 (m, 6H), 1.95-1.93 (m, 2H), 1.28 (s, 3H)。HRMS(ESI) m/z: 636.4132 [M+H]+。
2.2.17 2-乙酰氨基-3-(4-((6-(3-(二己基氨基)丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12q) 白色固体,收率:40.5%。熔点:191.1~193.6 ℃。1H NMR (600 MHz, CD3OD) δ 8.58 (s, 1H), 8.12 (s, 1H), 7.64 (d, J=8.3 Hz, 2H), 7.34 (d, J=8.4 Hz, 2H), 7.20 (s, 1H), 4.75-4.72 (m, 1H), 4.54 (t, J=5.9 Hz, 2H), 4.08 (s, 3H), 4.04 (s, 3H), 3.89-3.82 (m, 2H), 3.35-3.31 (m, 16H), 3.30-3.19 (m, 4H), 3.02-3.00 (m, 2H), 1.95 (s, 3H), 1.28 (t, 6H), 0.95-0.87 (m, 2H)。HRMS(ESI) m/z: 636.4010 [M+H]+。
2.2.18 3-乙酰氨基-3-(4-((6-(3-(二己基氨基)丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12r) 白色固体,收率:48.5%。熔点:191.3~192.9 ℃。1H NMR (600 MHz, CD3OD) δ 8.61 (s, 1H), 8.22 (s, 1H), 7.71 (d, J=8.2 Hz, 2H), 7.43 (d, J=8.3 Hz, 2H), 7.23 (s, 1H), 5.57-5.17 (m, 1H), 4.55 (t, J=5.5 Hz, 2H), 4.04 (s, 3H), 3.67 (s, 3H), 3.66-3.60 (m, 4H), 3.35-3.31 (m, 8H), 3.00-2.76 (m, 10H), 1.99 (s, 3H), 1.41-1.33 (m, 2H), 1.19 (t, J=7.0 Hz, 6H), 0.93 (t, J=6.9 Hz, 2H)。HRMS(ESI) m/z: 636.4010 [M+H]+。
2.2.19 (S)-2-乙酰氨基-3-(4-((6-(3-(二辛基氨基)丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12s) 白色固体,收率:43.3%。熔点:202.6~204.1 ℃。1H NMR (600 MHz, CD3OD) δ 8.43 (s, 1H), 7.82 (s, 1H), 7.54 (d, J=8.4 Hz, 2H), 7.27 (d, J=8.3 Hz, 2H), 7.10 (s, 1H), 4.69-4.65 (m, 1H), 4.50 (s, 3H), 3.98 (s, 3H), 3.46-3.44 (m, 2H), 3.36-3.31 (m, 24H), 3.24-3.18 (m, 2H), 3.08-3.00 (m, 4H), 2.55-2.44 (m, 2H), 1.98-1.94 (m, 6H), 1.28 (s, 3H), 0.96-0.77 (m, 2H)。HRMS(ESI) m/z: 692.4746 [M+H]+。
2.2.20 2-乙酰氨基-3-(4-((6-(3-(二辛基氨基)丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12t) 白色固体,收率:44.5%。熔点:206.0~208.9 ℃。1H NMR (600 MHz, CD3OD) δ 8.20 (s, 1H), 7.90 (s, 1H), 7.75 (d, J=7.6 Hz, 2H), 7.64 (d, J=7.4 Hz, 2H), 7.54 (s, 1H), 4.16-4.14 (m, 1H), 4.11-4.08 (m, 2H), 3.74 (s, 3H), 3.57 (s, 3H), 3.46-3.43 (m, 2H), 3.39-3.33 (m, 24H), 3.22-3.21 (m, 4H), 2.70 (s, 2H), 1.30-1.25 (m, 6H), 0.89 (s, 3H), 0.87-0.86 (m, 2H)。HRMS(ESI) m/z: 692.3880 [M+H]+。
2.2.21 3-乙酰氨基-3-(4-((6-(3-(二辛基氨基)丙氧基)-7-甲氧基喹唑啉-4-基)氨基)苯基)丙酸甲酯(12u) 白色固体,收率:43.2%。熔点:199.7~201.4 ℃。1H NMR (600 MHz, CD3OD) δ 8.39 (s, 1H), 7.81 (s, 1H), 7.63 (d, J=7.8 Hz, 2H), 7.39 (d, J=7.5 Hz, 2H), 7.11 (s, 1H), 5.38-5.34 (m, 1H), 4.48 (s, 3H), 3.96 (s, 3H), 3.33 (s, 24H), 3.03-2.98 (m, 2H), 2.90-2.85 (m, 2H), 2.82-2.73 (m, 4H), 2.53-2.48 (m, 2H), 2.01-1.95 (m, 6H), 1.32-1.24 (m, 2H), 0.88 (s, 3H)。HRMS(ESI) m/z: 692.4747 [M+H]+。
2.3 体外抗肿瘤活性实验
采用CCK-8法测定目标化合物12a~12u对非小细胞肺癌细胞A549的体外抗肿瘤增殖实验,以吉非替尼为阳性对照药物。将处于对数生长期的A549癌细胞消化种于96孔板中(8×104个·mL-1),置于37 ℃、5% CO2条件下的培养箱中贴壁培养24 h,弃去原培养基。设置空白对照组、阳性药对照组以及药物组,按照浓度梯度0.5、1、5、10、25、50、100 μmol/L给药(每个药物浓度设6个复孔),每孔100 μL,置于37 ℃、5% CO2培养箱中培养(一块96孔板测定1个目标化合物,且每块板均有阳性对照物)。细胞培养48 h后,每孔加入CCK-8
10 μL培养基置于培养箱中继续培养1 h后,用酶标仪在450 nm波长下测其OD值,并计算各化合物的IC50值。IC50值见表1。
2.4 目标化合物的分子对接
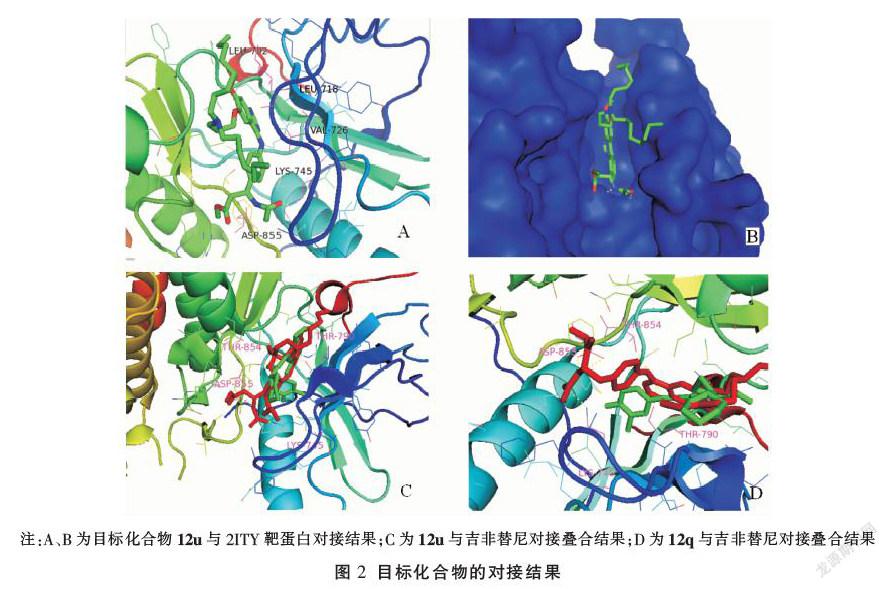
查阅文献并从RCSB[20]蛋白库网站(https://www.rcsb.org/)获取EGFR蛋白的X-衍射晶体结构(PDB编号为2ITY[21]),利用LeDock软件对目标化合物和EGFR进行分子对接。(1)利用Chemdraw 3D软件对目标化合物进行能量优化,并保存为mol2格式。(2)根据下载的EGFR蛋白分子的配体的位置确定对接盒子的对接参数。(3)通过LeDock软件进行分子对接,得出目标化合物与EGFR蛋白分子的最低结合自由能(表2)。(4)通过Pymol软件展示和分析目标化合物与EGFR蛋白分子对接的具体情况。对接结果表明,大部分目标化合物都是与氨基酸残基ASP-855和LYS-745形成氢键,少部分与氨基酸残基ASP-800、LYS-716和LYS-728形成氢键。L构型的目标化合物的最低结合自由能△G(kcal·mol-1)普遍比DL构型和D构型的目标化合物高。其中目标化合物12u的最低结合自由能最小△G=-9.13 kcal·mol-1,它能很好地插入蛋白的结合口袋并与不同的氨基酸发生相互作用,主要为疏水作用和氢键作用(图2A-B)。12u结构中乙酰基部分的氮和氧分别与ASP-855和LYS-745形成氫键,碳链和苯环部分与VAL-726、LEU-718和LEU-792形成疏水作用。与活性最差的目标化合物12q相比,尽管目标化合物12u/吉非替尼(图2C)与目标化合物12q/吉非替尼(图2D)对接叠合的整体结构相似,但苯环上侧链之间的相对位置略有变化,12u/吉非替尼对接叠合比12q/吉非替尼对接叠合更紧密,能更加严密地镶嵌在靶点中。LeDock软件对接结果与体外抗肿瘤活性实验结果基本符合,推测目标化合物的作用靶点为EGFR蛋白。
3 讨论
本文以DL-苯丙氨酸、L-苯丙氨酸、D-苯丙氨酸和3-氨基-3-苯基丙酸为原料,经乙酰化、硝化、酯化和还原,得到4个重要中间体,通过氨基将中间体引入7-甲氧基-6-乙酰氧基-4氯喹唑啉的4位,并对喹唑啉6位羟基脱保护后进行修饰得到21个目标化合物,经1H NMR、LC-MS进行结构表征。
CCK-8法体外抗肿瘤活性实验结果表明,与DL构型和D构型目标化合物相比,L构型目标化合物的抗肿瘤活性更好,这可能是因为L构型的目标化合物是由L-苯丙氨酸合成的,而L-苯丙氨酸是人体必需氨基酸。通过对比L构型目标化合物的IC50,发现抗肿瘤效果12e>12i>12p>12a>12m、12s,其C-6位的取代基分别为3-吗啉丙氧基、3-二丁胺丙氧基、3-二己胺丙氧基、3-二甲胺丙氧基、3-二乙胺丙氧基、3-二辛胺丙氧基。而由3-氨基-3-苯基丙酸合成的目标化合物的抗肿瘤活性与L构型目标化合物恰好相反,其抗肿瘤效果12u>12o>12d>12r>12l、12h,其6位的取代基分别为3-二辛胺丙氧基、3-二乙胺丙氧基、3-二甲胺丙氧基、3-二己胺丙氧基、3-二丁胺丙氧基、3-吗啉丙氧基。其中12u和12o的抗肿瘤活性与阳性对照药吉非替尼相当。分子对接结果表明21个目标化合物与EGFR蛋白均有较好的结合效果,目标化合物最低结合自由能与体外抗肿瘤活性实验结果基本一致。
4 结论
设计、合成了一系列含喹唑啉的氨基酸抗肿瘤衍生物,通过喹唑啉与氨基酸衍生物连接,并对喹唑啉结构进行修饰得到21个目标化合物,通过1H NMR、LC-MS认证其结构。通过体外抗肿瘤活性实验,发现目标化合物12u和12o的抗肿瘤活性与阳性对照药吉非替尼相当,分子对接结果与体外抗肿瘤活性基本一致,为开发新型含喹唑啉结构的氨基酸抗肿瘤药物提供新思路。
参考文献
[1] NASIM F, SABATH B F, EAPEN G A. Lung cancer[J]. Medical Clinics of North America, 2019, 103(3): 463-473.
[2] DUMA N, SANTANA-DAVILA R, MOLINA J R. Non-small cell lung cancer: Epidemiology, screening, diagnosis, and treatment[J]. Mayo Clinic Proceedings, 2019, 94(8): 1623-1640.
[3] YONEDA K, IMANISHI N, ICHIKI Y, et al. Treatment of non-small cell lung cancer with EGFR-mutations[J]. Journal of UOEH, 2019, 41(2): 153-163.
[4] ROSKOSKI R Jr. Properties of FDA-approved small molecule protein kinase inhibitors: A 2020 update[J]. Pharmacological Research, 2020, 152: 104609.
[5] ZAYED M F. New fluorinated quinazolinone derivatives as anticonvulsant agents[J]. Journal of Taibah University Medical Sciences, 2014, 9(2): 104-109.
[6] SHARMA M J, KUMAR M S, MURAHARI M, et al. Synthesis of novel gefitinib-based derivatives and their anticancer activity[J]. Archiv Der Pharmazie, 2019, 352(5): e1800381.
[7] 黄 珍,方宇希,黄志勇,等.新型TOPK抑制剂的设计、合成及抗肿瘤活性研究[J].湖南中医药大学学报,2020,40(3):298-304.
[8] COHEN M H, WILLIAMS G A, SRIDHARA R, et al. FDA drug approval summary: Gefitinib (ZD1839) (Iressa) tablets[J]. The Oncologist, 2003, 8(4): 303-306.
[9] ABDELGALIL A A, AL-KAHTANI H M, AL-JENOOBI F I. Erlotinib[M]//Profiles of Drug Substances, Excipients and Related Methodology. Amsterdam: Elsevier, 2020: 93-117.
[10] WECKER H, WALLER C F. Afatinib[J]. Small Molecules in Oncology, 2018: 199-215.
[11] GARRETT A R, WEAGEL E G, MARTINEZ A D, et al. A novel method for predicting antioxidant activity based on amino acid structure[J]. Food chemistry, 2014, 158: 490-496.
[12] 黃志勇,郭易华,黄 珍,等.氨基酸在抗肿瘤中药有效成分结构修饰中的应用[J].中国现代应用药学,2021,38(10):1275-1280.
[13] 金玉坤,陆 伟,罗 雁.不平衡氨基酸的研究进展[J].医学综述, 2010,16(11):1647-1649.
[14] HOSIOS A M, HECHT V C, DANAI L V, et al. Amino acids rather than glucose account for the majority of cell mass in proliferating mammalian cells[J]. Developmental Cell, 2016, 36(5): 540-549.
[15] 余 焓,廉 翔,韩 生,等.一种安普那韦中间体的制备方法,中国,105348224A[P].2016-02-24.
[16] MAITY S K, KUMAR R, AMBAST D K, et al. Self-assembly and nonlinear optical properties of a synthetic dipeptide[J]. Journal of Materials Chemistry, 2012, 22(41): 22198-22203.
[17] 陈 翀,吴生文,李文革,等.一种Melphalan中间体及其制备方法, 中国,110041214A[P].2019-07-23.
[18] MAITY S, KUMAR R, MAITY S K, et al. Synthesis and study of 2-acetyl amino-3-[4-(2-amino-5-sulfo-phenylazo)-phenyl]-propionic acid: a new class of inhibitor for hen egg white lysozyme amyloidogenesis[J]. MedChemComm, 2013, 4(3): 530-536.
[19] 刘 霞,苏长会.一种喹唑啉衍生物及其制备方法:106045980A[P].2016-10-26.
[20] ROSE P W, PRLI A, BI C, et al. The RCSB Protein Data Bank: views of structural biology for basic and applied research and education[J]. Nucleic acids research, 2015, 43(D1): D345-356.
[21] YUN C H, BOGGON T J, LI Y, et al. Structures of lung cancer-derived EGFR mutants and inhibitor complexes: mechanism of activation and insights into differential inhibitor sensitivity[J]. Cancer Cell, 2007, 11(3): 217-227.
