苦参素通过MAPK信号通路对EAE小鼠巨噬细胞M1/M2极化的影响
2022-02-18赵晓玉史香芬楚尧娟张英杰杜书章
赵晓玉,朱 琳,史香芬,刘 楠,楚尧娟,张 婉,张英杰,杜书章
郑州大学第一附属医院药学部 郑州 450052
多发性硬化(multiple sclerosis,MS)属中枢神经系统慢性自身免疫炎性疾病,主要以髓鞘脱失、进行性神经功能紊乱为特征。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)小鼠模型是目前研究MS的理想模型,其发病过程、病理表现与MS基本一致[1]。目前,激素冲击、免疫抑制等方法对MS具有明确疗效,但因骨质疏松、癫痫等不良反应而限制了临床应用[2]。因此,寻找安全有效的MS治疗药物成为研究重点。既往研究[3]发现,巨噬细胞的激活及极化在EAE进展过程中发挥重要作用,脊髓、脾脏等靶器官中促炎分子随M1型巨噬细胞的增多而增多,抗炎分子随M2型巨噬细胞增多而增多,提示寻找调控巨噬细胞的激活及活化的药物,有望成为EAE治疗的关键。苦参素是从豆科植物中提取的一种活性生物碱,具有确切的抗炎、免疫调节作用[4],推测其对EAE可能有效。本研究观察了苦参素对EAE小鼠脊髓组织巨噬细胞激活及M1/M2极化的影响,并探讨其对p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)信号通路的影响,为临床MS的治疗提供参考。
1 材料与方法
1.1 药品、试剂与仪器髓鞘少突胶质细胞糖蛋白33-35(MOG33-35,上海万生昊天生物技术有限公司),完全弗氏佐剂(CFA,美国Sigma公司),减毒百日咳毒素(北京博蕾德科技发展有限公司),苦参素注射液[江苏正大天晴药业股份有限公司,生产批号150422304,规格2 mL∶0.6 g(以氧化苦参碱计)],醋酸泼尼松(PA)片(浙江仙琚制药股份有限公司,国药准字H33021207,规格5 mg),p38MAPK特异性激动剂茴香霉素(Anisomycin,美国Sigma公司),大鼠抗小鼠CD11b、兔抗小鼠CD86、兔抗小鼠CD206抗体(武汉益普生物科技有限公司),兔抗小鼠p38MAPK、兔抗小鼠磷酸化p38MAPK(p-p38MAPK)及辣根过氧化物酶标记的IgG(美国Abcam公司),FITC或CY3标记的IgG(美国Jackson公司)。DAPI显色试剂盒(上海信裕生物科技有限公司),Trizol试剂盒(日本TaKaRa公司),qRT-PCR试剂盒、脊髓髓鞘染色LFB溶液(北京全式金生物技术有限公司)。ERM3100石蜡切片机(上海京工实业有限公司),Multiskan Sky全波长酶标仪(美国Thermo Fisher公司),7500实时荧光定量PCR系统(美国ABI公司),CheniDoc XRS化学发光成像分析系统(美国Bio-Rad公司)。
1.2 实验动物分组、造模及给药50只SPF级雌性C57BL/6小鼠,6周龄,体重18~22 g,购自河南省实验动物中心,生产许可证号SCXK(豫)2017-0001,饲养于郑州大学药物研究院[使用许可证号SYXK(豫)2018-0004],动物实验操作符合3R原则。将50只小鼠采用随机数字表法分为5组:对照组、EAE组、PA组、苦参素组、激动剂组,各10只,除对照组外,其余各组采用MOG33-35诱导法建立EAE模型:3 g/L的MOG33-35(冻干粉融于生理盐水)与等体积CFA混匀,制备抗原乳剂。小鼠腹腔注射水合氯醛麻醉,于脊柱中线两侧,分4点皮下注射总量200 μL的抗原乳剂,注射当日及48 h后分别腹腔注射200 ng减毒百日咳毒素进行免疫增强。第26天神经功能评分>0.5分则为发病,建模成功。取建模成功小鼠(EAE组10只、苦参素组10只、PA组9只、激动剂组9只)用于后续实验。于发病日开始干预,苦参素组腹腔注射200 mg/kg苦参素注射液,EAE组和对照组腹腔注射10 mL/kg生理盐水,激动剂组腹腔注射200 mg/kg苦参素注射液+2 mg/kg Anisomycin,PA组灌胃6 mg/kg的PA溶液(溶解于5 mg/L羧甲基纤维素钠溶液),1次/d,连续给药14 d。
1.3 神经功能评分各组小鼠均于干预后第0、1、3、5、7、9、11、13天进行神经功能评估,采用国际通用5分制评分:无临床症状为0分;尾部无张力,轻度步态笨拙为1分;一侧后肢无力,反正反射正常为2分;双侧后肢无力,翻正反射异常,但刺激后尚可移动为3分;四肢瘫痪为4分;濒死或死亡为5分。
1.4 组织取材神经功能评估结束后,每组取4只,腹腔注射水合氯醛麻醉,心脏灌注40 mg/L多聚甲醛,立即取出脊髓腰段组织放入40 mg/L多聚甲醛中固定,用于HE、LFB和免疫荧光染色;每组从剩余鼠中取4只小鼠麻醉后,心脏灌注1×PBS,取脊髓腰段组织立即放置于-80 ℃,用于qRT-PCR和Western blot检测。
1.5 脊髓组织炎性细胞浸润评分及髓鞘脱失评分取已固定的脊髓标本,常规脱水、透明及石蜡包埋,制成厚度为5 μm的连续切片。①每只小鼠取5张切片,经脱蜡、水化后,行常规HE染色,最后中性树胶封片,于光学显微镜下观察拍照。炎性细胞浸润评分[5]:少量分散的炎性细胞分布为1分;血管四周呈现炎性细胞浸润为2分;灰质区呈现不完全炎性细胞浸润或血管“袖套样”浸润为3分。②每只小鼠取5张脊髓组织切片,常规脱蜡、乙醇醇化,浸入LFB染液中,58 ℃孵育24 h,冷却至室温,体积分数95%乙醇洗涤5 min,蒸馏水洗涤2 min, 0.5 mg/L碳酸锂10 s,体积分数70%乙醇分化至灰质白质清晰可辨,蒸馏水洗涤5 min,脱水、透明后,中性树胶封片,于光学显微镜下观察拍照。髓鞘脱失评分[5]:无髓鞘脱失为0分;1~3个小范围髓鞘脱失为1分;1~2个大范围髓鞘脱失为2分;大范围髓鞘脱失且累及20%白质区域为3分。
1.6 脊髓组织中M1型、M2型巨噬细胞免疫荧光染色每只小鼠取5张脊髓组织切片,常规脱蜡、抗原修复,PBS洗涤5 min×3次,体积分数3% H2O2孵育15 min,再次洗涤,每张切片滴加山羊血清50 μL,常温封闭20 min,甩干血清勿洗,滴加50 μL大鼠抗小鼠CD11b、兔抗小鼠CD86、兔抗小鼠CD206(均1∶200稀释),4 ℃过夜,PBS洗涤5 min×3次,滴加50 μL FITC或CY3标记的IgG(1∶200稀释),37 ℃孵育2 h,再次洗涤,加入抗荧光猝灭剂封片,荧光显微镜下拍照。免疫荧光双染:滴加一抗染色后立即加入二抗染色,其余步骤同前,DAPI复染1 min后洗涤,抗荧光猝灭剂封片。M1型巨噬细胞CD11b+CD86+、M2型巨噬细胞CD11b+CD206+。于200倍镜下选取3个不重复视野,荧光显微镜下拍照,用ImagePro Plus 6.0软件识别M1或M2型巨噬细胞,计算M1或M2型巨噬细胞比例,即Merge黄绿色占DAPI蓝染细胞百分比。
1.7 脊髓组织中M1相关iNOS、TNF-α及M2相关精氨酸酶-1(Arg-1)、IL-10 mRNA的检测取-80 ℃保存的脊髓组织,按照Trizol试剂盒说明书步骤提取总RNA,反转录获取cDNA,琼脂糖凝胶电泳鉴定后,以cDNA为模板进行PCR,反应体系为:SYBR Premix Ex Taq 6.5 μL,10 μmol/L上下游引物各0.2 μL,cDNA 1 μL,ddH2O 4.1 μL,总反应体系为12 μL。反应条件:94 ℃预变性2 min;扩增42个循环(94 ℃变性20 s,60 ℃退火40 s,72 ℃延伸60 s)。以β-actin为内参,采用2-ΔΔCt法计算iNOS、TNF-α、Arg-1、IL-10 mRNA的相对表达量。引物序列见表1,由生工生物工程(上海)有限公司合成。

表1 引物序列
1.8 脊髓组织中p38MAPK、p-p38MAPK蛋白的检测取-80 ℃保存的脊髓组织,加入液氮研磨,4 ℃预冷细胞裂解液裂解,12 000 r/min离心10 min,取上清,测定总蛋白含量。取60 μg待测蛋白与等量上样缓冲液混匀,沸水浴10 min,再次离心,取上清,行SDS-PAGE凝胶电泳,经转膜、封闭,加入兔抗小鼠p38MAPK、p-p38MAPK(均1∶500稀释),4 ℃摇床孵育过夜,加入1∶2 000稀释的二抗(辣根过氧化物酶标记的IgG),常温孵育2 h,加入ECL发光液于暗室中曝光、显影,凝胶成像系统扫描拍照,以目的蛋白与β-actin条带灰度值的比值表示目的蛋白的相对表达量。
1.9 统计学处理采用SPSS 20.0进行数据分析。应用重复测量数据的方差分析比较干预后除对照组外其他各组神经功能评分;应用单因素方差分析和LSD-t检验比较各组小鼠脊髓炎性细胞浸润评分、髓鞘脱失评分,M1型、M2型巨噬细胞比例,iNOS、TNF-α、Arg-1、IL-10 mRNA及p38MAPK、p-p38MAPK蛋白的相对表达量。检验水准α=0.05。
2 结果
2.1 各组小鼠神经功能评分的比较结果见图1。对照组干预期间神经功能评分均为0分。EAE组、PA组、苦参素组及激动剂组干预后神经功能评分先升高后降低,第9天达到峰值;PA组、苦参素组及激动剂组神经功能评分均低于EAE组,且PA组<苦参素组<激动剂组(F组间=29.271,F时间=62.190,F交互=44.386,P均<0.001)。

图1 各组小鼠干预后神经功能评分的比较
2.2 各组小鼠脊髓组织炎性细胞浸润评分及髓鞘脱失评分的比较结果见图2和表2。对照组脊髓组织炎性细胞浸润评分及髓鞘脱失评分均为0分。PA组、苦参素组及激动剂组脊髓组织炎性细胞浸润评分及髓鞘脱失评分均低于EAE组,且PA组<苦参素组<激动剂组。

A:对照组;B:EAE组;C:PA组;D:苦参素组;E:激动剂组;1:HE染色;2:LFB染色
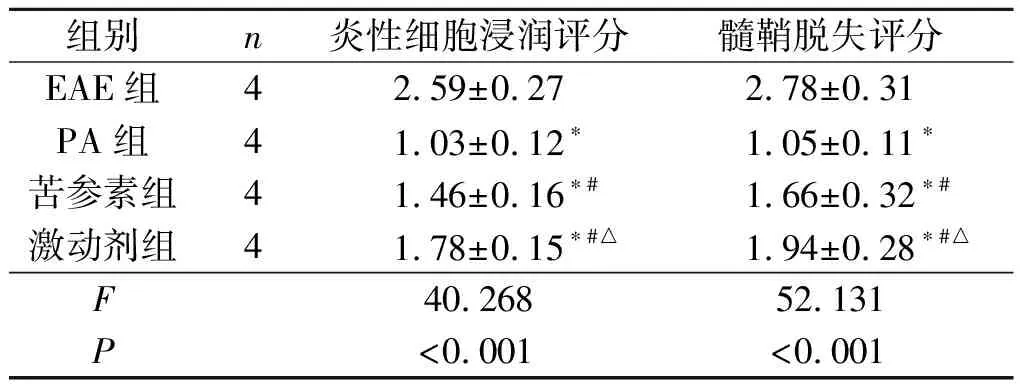
表2 各组小鼠脊髓组织炎性细胞浸润评分及髓鞘脱失评分的比较
2.3 各组小鼠脊髓组织M1型、M2型巨噬细胞比例的比较结果见图3和表3。与对照组比较,EAE组、PA组、苦参素组及激动剂组脊髓组织M1型、M2型巨噬细胞比例均升高。PA组、苦参素组及激动剂组M1型巨噬细胞比例均低于EAE组,且PA组<苦参素组<激动剂组;PA组、苦参素组及激动剂组M2型巨噬细胞比例均高于EAE组,且PA组>苦参素组>激动剂组。
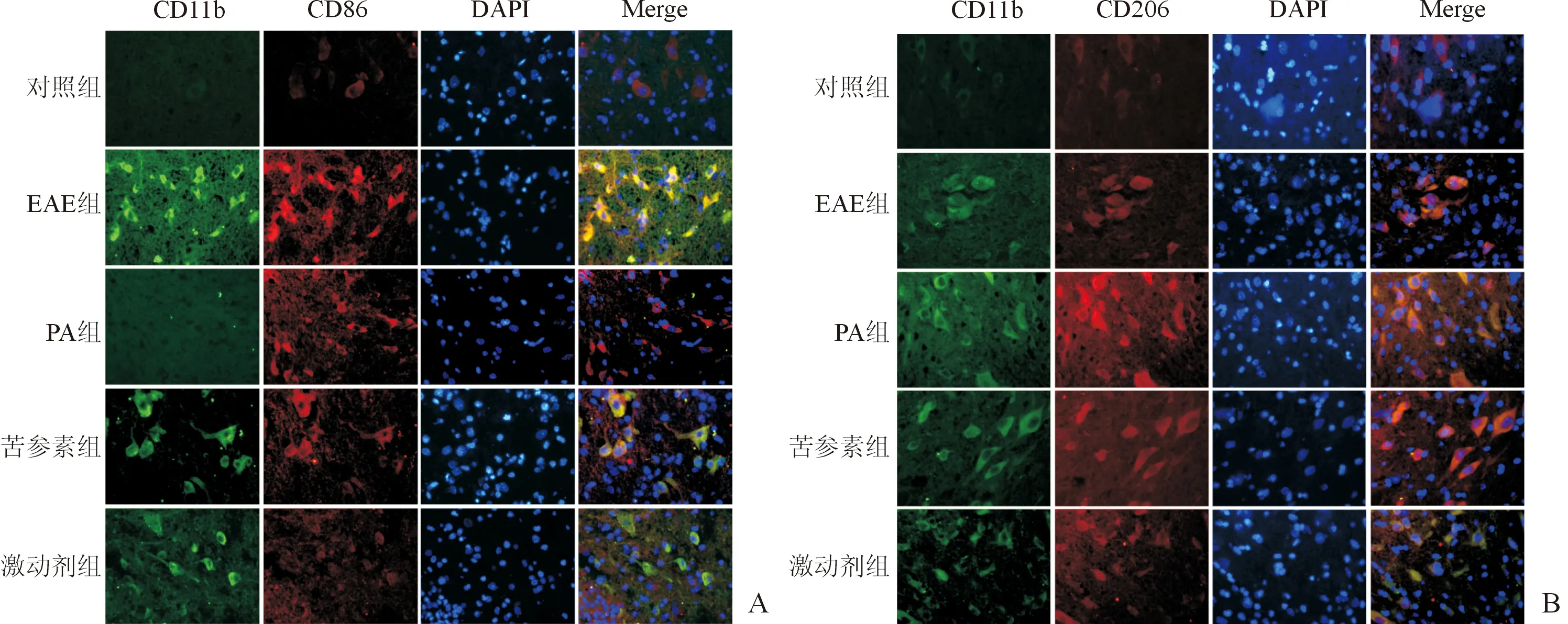
图3 脊髓组织M1型(A)、M2型(B)巨噬细胞免疫荧光染色结果(×400)
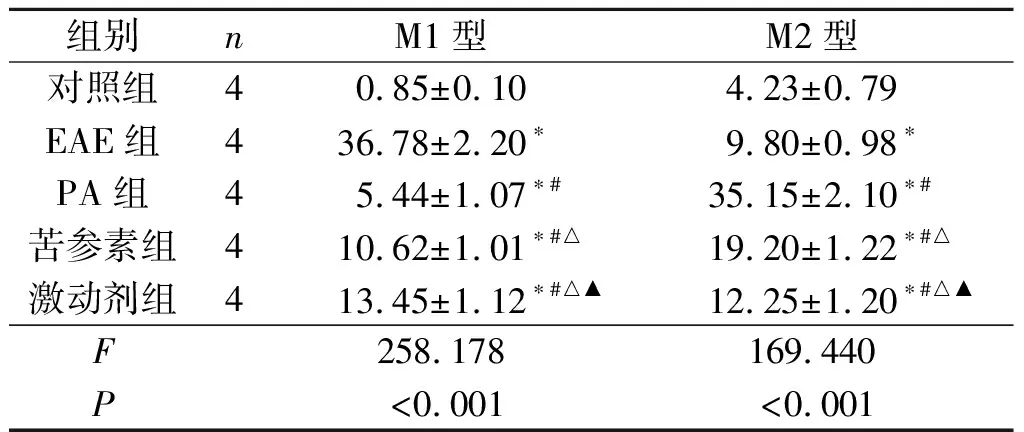
表3 各组小鼠脊髓组织中M1型、M2型巨噬细胞比例的比较 %
2.4 各组小鼠脊髓组织中iNOS、TNF-α、Arg-1、IL-10 mRNA相对表达量的比较结果见表4。与对照组比较,EAE组、PA组、苦参素组及激动剂组iNOS、TNF-α、Arg-1、IL-10 mRNA相对表达量均升高;与EAE组比较,PA组、苦参素组及激动剂组iNOS、TNF-α mRNA相对表达量均降低,且PA组<苦参素组<激动剂组。与EAE组比较,PA组、苦参素组及激动剂组Arg-1、IL-10 mRNA相对表达量均升高,且PA组>苦参素组>激动剂组。
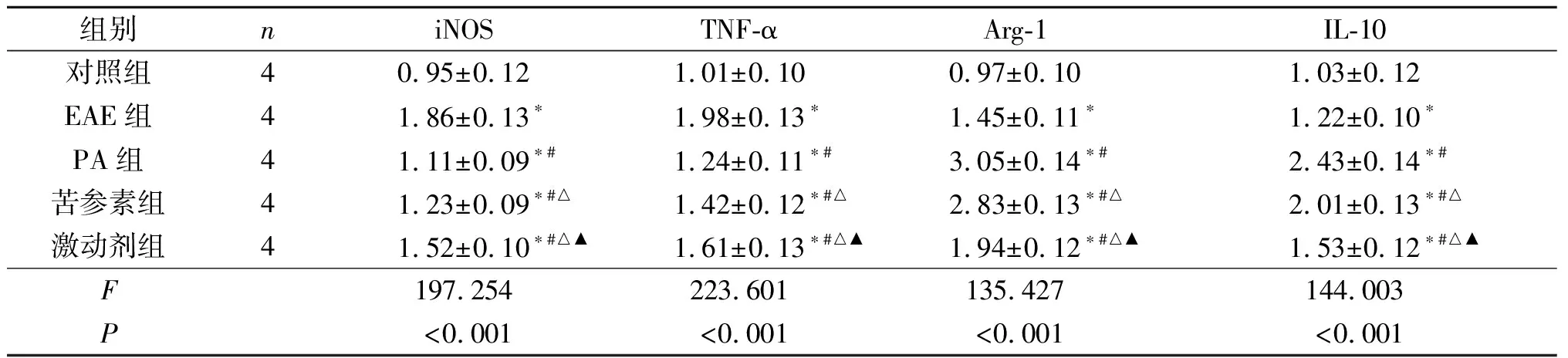
表4 各组小鼠脊髓组织中iNOS、TNF-α、Arg-1、IL-10 mRNA相对表达量比较
2.5 各组小鼠脊髓组织中p-p38MAPK/p38MAPK的比较结果见图4和表5。与对照组比较,EAE组、PA组、苦参素组及激动剂组脊髓组织中p-p38MAPK/p38MAPK均升高。与EAE组比较,PA组、苦参素组及激动剂组p-p38MAPK/p38MAPK均降低,且PA组<苦参素组<激动剂组。

图4 各组小鼠脊髓组织中p-p38MAPK、p38MAPK蛋白Western blot检测结果
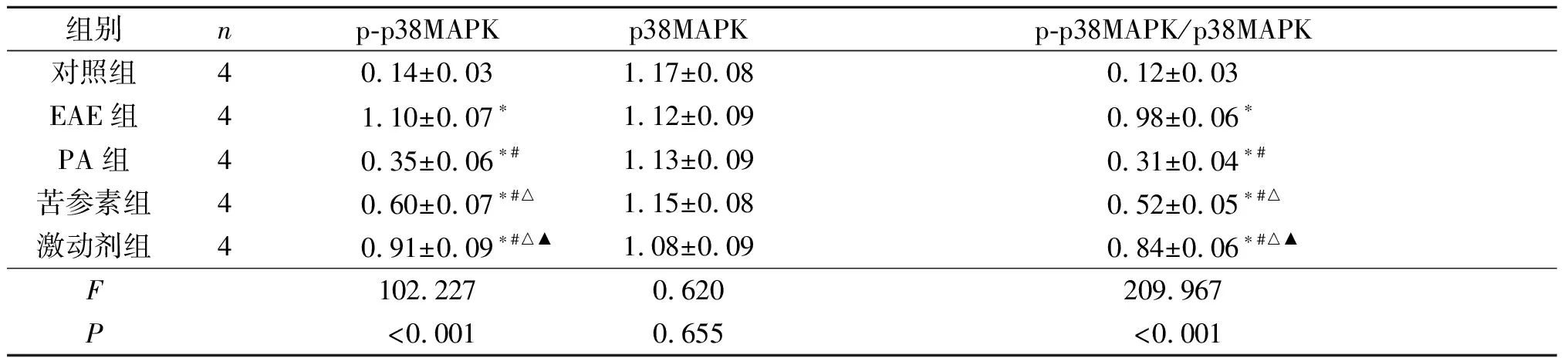
表5 各组小鼠脊髓组织中p-p38MAPK、p38MAPK蛋白表达及p-p38MAPK/p38MAPK的比较
3 讨论
MS是中枢神经系统脱髓鞘类常见疾病[6]。目前,临床尚缺乏MS理想治疗药物,临床常见的激活冲击或免疫抑制方法可显著缓解MS症状,但对降低MS复发率效果仍不理想,且易引发不良反应[7]。MS发病机制复杂,目前尚未完全阐明,已有研究[8]证实,巨噬细胞在EAE疾病进展过程中发挥关键调控作用。巨噬细胞可分化为致炎M1型和抗炎M2型两种细胞,巨噬细胞M1/M2型失衡参与MS疾病进展。因此,抑制巨噬细胞向M1型极化对缓解病情有重要作用。
本研究结果显示,给予苦参素干预后,EAE小鼠神经功能评分、脊髓组织炎性细胞浸润评分、髓鞘脱失评分均降低,提示苦参素可有效改善EAE小鼠神经功能,抑制脊髓组织炎症反应及髓鞘脱失。苦参素含大量氧化苦参碱及少量氧化槐果碱,临床已广泛用于治疗感染及肿瘤,且尚未发现严重不良反应,安全性较好。既往研究[9]发现,苦参素可减轻EAE小鼠脊髓组织氧化应激,增强线粒体自噬,从而保护中枢神经系统。本研究中经苦参素干预后,EAE小鼠脊髓组织中M1型巨噬细胞比例及iNOS、TNF-α mRNA相对表达量降低,M2型巨噬细胞比例及Arg-1、IL-10 mRNA相对表达量增加,提示苦参素可诱导脊髓组织巨噬细胞向M2型极化。在EAE发病早期阶段,外周巨噬细胞向中枢神经系统浸润,巨噬细胞以M1型为主,诱导促炎因子释放,从而导致中枢神经系统损伤,疾病后期M2型巨噬细胞占主导地位,诱导抗炎因子释放,修复受损组织[10-11]。因此,诱导巨噬细胞向M2型极化可作为MS的防治策略。
p38MAPK是MAPK家族重要成员之一,属细胞内中枢信号转导通路,参与调控多种中枢神经系统疾病的发生、发展过程。有研究[12]表明通过诱导EAE小鼠脊髓组织巨噬细胞向M2型极化,可减轻EAE炎症程度。另有报道[13]显示,p38MAPK信号通路的激活可诱导小鼠巨噬细胞向M1型极化,从而导致慢性炎症的恶性循环。由此可知p38MAPK信号通路在EAE病变过程过程中起重要作用。本研究结果显示,经苦参素干预后EAE小鼠脊髓组织中p-p38MAPK/p38MAPK降低,提示苦参素可能通过抑制p38MAPK蛋白磷酸化,调控巨噬细胞M1/M2极化;进一步应用p38MAPK激动剂干预后,小鼠脊髓组织炎症及髓鞘脱失较苦参素干预时加重,且巨噬细胞向M2型极化较苦参素组减弱,说明激活p38MAPK信号通路可削减苦参素的治疗作用,进一步支持苦参素可能是通过抑制p38MAPK磷酸化参与诱导巨噬细胞向M2型极化;此外,激动剂组p38MAPK磷酸化水平高于苦参素组但仍低于EAE组,说明单独p38MAPK磷酸化并不能完全消除苦参素的作用,侧面提示苦参素可能存在多个靶标,但本研究并未进一步深入研究,需另行设计实验证实该推论。
综上所述,苦参素可有效改善EAE小鼠神经功能,抑制脊髓组织炎症及髓鞘脱失,诱导巨噬细胞向M2型极化,其作用机制可能与抑制p38MAPK磷酸化有关。在今后的研究中,应进一步探讨苦参素是否存在其他信号通路调控巨噬细胞M1/M2极化,为苦参素用于临床MS的防治提供更为充分的理论依据。