光谱法研究小麦蛋白与直链淀粉的相互作用
2022-02-15王岸娜楚雯文吴立根
王岸娜,楚雯文,吴立根
河南工业大学 粮油食品学院,河南 郑州 450001
蛋白和多糖是两种生物大分子物质,关于它们的相互作用在食品领域有着广泛的研究[1-2]。淀粉是最常见的多糖,是食品中的重要成分,常与蛋白共存于食品体系中,两者相互作用的研究对食品的质构、稳定性和感官特性等具有指导意义[3]。
小麦蛋白是从小麦粉中提取的植物源蛋白质[4],具有高度聚合的状态[5],根据溶解性的不同,可分为清蛋白、球蛋白、醇溶蛋白和谷蛋白。在食品加工中小麦蛋白与淀粉紧密结合[6],研究发现小麦蛋白富含谷氨酰胺,谷氨酰胺的氨基和淀粉葡萄糖单元的第二或第三羟基之间会形成氢键[7],在淀粉糊化和回生过程中,单体蛋白(清蛋白、球蛋白和醇溶蛋白)与淀粉的氢键作用力更强[8]。它们的相互作用影响着食品的流变学特性[3,9]、糊化特性[10]和消化特性[11-12],因此从分子层面上阐述两者的相互作用具有重要意义。
尽管近年来对小麦蛋白与淀粉相互作用的研究越来越深入,但很少涉及具体成分之间的研究,直链淀粉作为淀粉的主要组成部分,与小麦蛋白的相互作用研究较少,结合位点和作用机制尚不明确。因此,作者通过紫外光谱、荧光光谱和同步荧光技术测定两者相互作用的猝灭常数、结合常数、结合位点和热力学参数,判断直链淀粉与4种蛋白的相互作用以及结合机制,以期对淀粉基食品的设计提供新思路,对改善食品的质构、风味等提供理论基础。
1 材料与方法
1.1 试验材料
谷朊粉:封丘县华丰粉业有限公司;直链淀粉:卡迈舒生物科技有限公司;氯化钠、乙醇、氢氧化钠、酒石酸钾钠、硫酸铜等均为分析纯。
1.2 仪器与设备
DF-101S集热式恒温加热磁力搅拌器:河南佰泽仪器有限公司;Cary Eclipase荧光分光光度计:美国VARIAN;TU-1901双光束紫外可见分光光度计:北京普析通用仪器有限公司。
1.3 试验方法
1.3.1 小麦蛋白的制备及含量测定
根据蛋白溶解性的不同,采用Osborne法[13]分级提取蛋白,以蒸馏水、3%氯化钠溶液、75%乙醇溶液和0.2%氢氧化钠溶液为溶剂,料液比为1∶ 10 g/mL,从谷朊粉中依次提取清蛋白、球蛋白、醇溶蛋白和谷蛋白,离心后取上清液过滤备用。
谷朊粉总蛋白质含量的测定:参照GB 5009.5—2016,采用双缩脲法[14]测定4种小麦蛋白含量。
1.3.2 小麦蛋白-直链淀粉复合体系的制备
小麦蛋白-直链淀粉复合体系的制备参照徐兴凤[15]使用的方法并加以修改。清蛋白、球蛋白、醇溶蛋白、谷蛋白用相应试剂稀释至质量浓度为0.5 mg/mL,将不同质量浓度(0、0.025、0.05、0.1、0.15、0.2、0.25、0.3 mg/mL)的直链淀粉溶液[16]加入蛋白溶液中,等体积均匀混合反应30 min。
1.3.3 紫外光谱的测定
室温下,分别扫描4种蛋白与不同质量浓度直链淀粉复合体系的紫外光谱,扫描范围为200~400 nm。
1.3.4 荧光光谱的测定
1.3.4.1 荧光猝灭光谱及猝灭类型
在温度298 K和310 K的条件下测定小麦蛋白-直链淀粉复合体系的内源荧光,设定激发波长为280 nm,发射波长为300~450 nm,激发和发射狭缝宽度分别为5 nm和10 nm。
根据Stern-Volmer方程(1)可以确定直链淀粉和4种蛋白的荧光猝灭机制:
(1)
方程(1)中:F0为只存在蛋白时的荧光强度;F为添加直链淀粉之后的荧光强度;[Q]为直链淀粉的物质的量浓度;KSV为相互作用的猝灭常数;Kq为相互作用的猝灭速率;τ0为荧光分子平均寿命,一般取10-8s。
1.3.4.2 结合位点和结合常数
直链淀粉和4种蛋白的结合常数及结合位点通过双对数方程(2)计算。
(2)
方程(2)中:Ka为相互作用的结合常数;n为相互作用的结合位点。
1.3.4.3 结合力类型
由Van’t Hoff方程(3)和热力学方程(4)得到反应的热力学参数ΔH(焓变)、ΔS(熵变)和ΔG(自由能)。
(3)
ΔG=ΔH-TΔS,
(4)
方程(3)和(4)中:K为与温度T相对应的结合常数;T为试验温度(298 K和310 K);R为气体常数,8.314 J·mol-1·K-1。
根据参数的大小和正负可以判断相互作用力类型:当ΔH<0,ΔS<0时,作用力为氢键和范德华力;当ΔH>0,ΔS>0时,作用力为疏水相互作用;当ΔH<0,ΔS>0时,作用力为静电相互作用。
1.3.5 同步荧光光谱的测定
在室温下扫描复合体系Δλ=15 nm和Δλ=60 nm的同步荧光光谱,扫描范围200~350 nm。
2 结果与分析
2.1 蛋白质含量
以牛血清蛋白的质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,回归方程为:y=0.053 8x+0.006 1(R2=0.999 5)。
谷朊粉中总蛋白含量为60.68%,其中清蛋白占比为2.49%,球蛋白为3.38%,醇溶蛋白为40.41%,谷蛋白为32.07%。
2.2 紫外光谱
紫外吸收光谱是一种研究蛋白结构变化的方法,也是确定猝灭机理的一种手段。在蛋白质的紫外吸收光谱中,280 nm左右的吸收峰主要是由于芳香族氨基酸残基的苯杂环结构的π→π*跃迁形成的B吸收带,对于动态猝灭,仅影响了发色团的激发态,紫外吸收光谱不发生变化,对于静态猝灭,直链淀粉与蛋白形成复合物,吸收光谱发生变化。
如图1所示,清蛋白在270 nm处有吸收峰,球蛋白在265 nm处有吸收峰,吸收谷均在245 nm处,随着直链淀粉质量浓度的升高,吸收峰和吸收谷消失,在吸收谷的位置出现了新的肩峰;醇溶蛋白的吸收峰在278 nm处,直链淀粉的加入使吸收峰红移,250 nm处出现新的肩峰,这表明直链淀粉使醇溶蛋白肽链伸展,跃迁所需能量减少,吸收峰向长波移动;谷蛋白的吸收峰在280 nm处,随着直链淀粉浓度的增加,峰形和吸收峰波长没有发生变化,吸收峰的强度增加可能是由于发色团的微环境发生了改变。紫外吸收光谱图的改变表明4种蛋白和直链淀粉发生相互作用形成基态复合物,初步证实了直链淀粉对4种蛋白荧光猝灭的机制是静态猝灭。
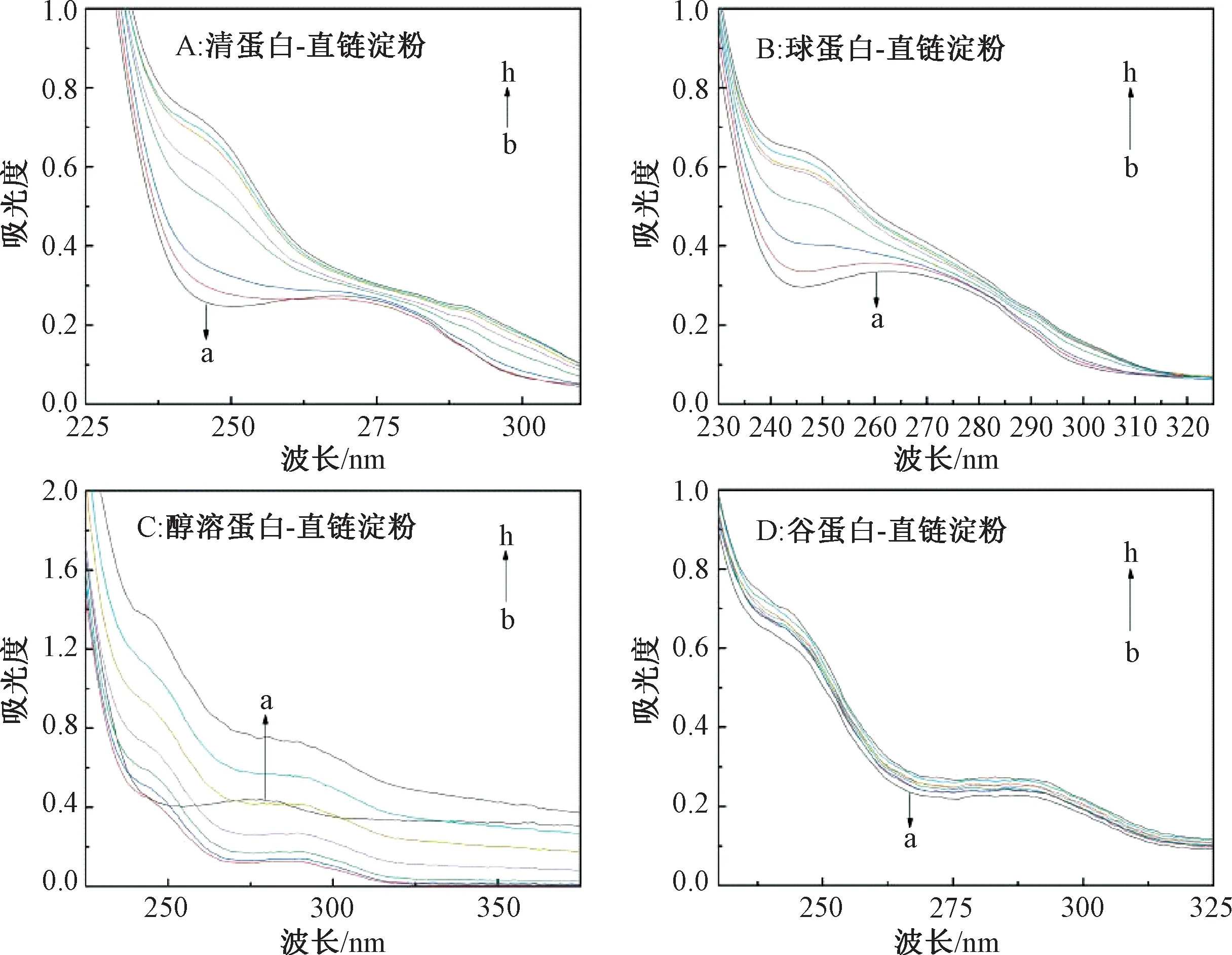
注:曲线a到h对应的直链淀粉质量浓度分别为0、0.025、0.05、0.10、0.15、0.20、0.25、0.30 mg/mL。图2、图3同。图1 直链淀粉与4种蛋白相互作用的紫外吸收光谱Fig.1 UV absorption spectroscopy of interacting between amylose and four proteins
2.3 荧光光谱
2.3.1 荧光猝灭光谱及猝灭类型的确定
从图2可以看出,在298 K时4种蛋白的荧光强度随着直链淀粉质量浓度的增加而降低,310 K时的荧光强度的变化趋势与298 K时相同(图省略),因此直链淀粉对4种蛋白均具有荧光猝灭作用。直链淀粉质量浓度为0.30 mg/mL时,清蛋白的荧光猝灭率为52.7%,最大发射峰红移9 nm,可能是由于清蛋白中含有较多的色氨酸[17],因此直链淀粉对清蛋白的猝灭率较高。球蛋白的荧光猝灭率为60.8%,最大发射峰红移2 nm。醇溶蛋白的荧光猝灭率为35.4%,发射峰红移3 nm,且峰形有所变化,由于醇溶蛋白是单肽链,呈球状,相互作用改变了其构象,使肽链伸展程度增加。在天然蛋白质分子中,色氨酸和酪氨酸多处于分子内部,周围微环境极性较弱,在加入直链淀粉后,蛋白质肽链舒展,氨基酸侧链基团暴露于溶液中,微环境极性增大,荧光基团的疏水性减小,蛋白质荧光发射峰红移,表明直链淀粉的加入改变了蛋白质的构象,二者发生了相互作用。谷蛋白的荧光猝灭率仅为22.8%,最大发射峰为353 nm,直链淀粉并未使谷蛋白最大发射峰发生改变,可能由于谷蛋白是线性高分子,因此直链淀粉对谷蛋白猝灭率较弱,微环境改变较小。

图2 直链淀粉与4种蛋白相互作用的荧光光谱Fig.2 Fluorescence spectra of interaction between amylose and four proteins
不同温度下直链淀粉猝灭4种蛋白的猝灭常数(KSV)和猝灭速率(Kq)如表1所示,在298 K和310 K时,拟合方程呈现良好的线性关系。4种蛋白的猝灭速率均大于2×1010L·mol-1·s-1,可以认为猝灭方式不是动态猝灭。静态猝灭是猝灭剂与荧光物质分子之间形成了复合物,因此温度升高会导致复合物稳定性变差,猝灭常数减小。由表1可知,直链淀粉对4种蛋白的猝灭常数均随着温度的升高而降低。基于上述结果,可以判断直链淀粉对4种蛋白的荧光猝灭是由于相互作用形成了复合物而引起的静态猝灭。
2.3.2 结合位点及结合常数的确定
不同温度下直链淀粉与4种蛋白相互作用的结合常数和结合位点如表2所示。结合常数表示直链淀粉与蛋白结合的强度,数值越大结合力越强。由表2可知,清蛋白、球蛋白与直链淀粉的结合力比醇溶蛋白和谷蛋白弱,这可能是由于清蛋白和球蛋白多为单体结构。清蛋白和球蛋白的结合常数和结合位点随着温度的升高而降低,表明结合过程是放热的,结合位点小于1表明直链淀粉不易渗透到蛋白内部的疏水腔;醇溶蛋白和谷蛋白的结合常数随温度的升高而升高,表明结合过程是吸热的,结合位点均大于1表明这两种蛋白与直链淀粉形成的复合物更加稳定,结合力比较强。
2.3.3 热力学参数及作用力的确定
不同温度下,直链淀粉与4种蛋白相互作用的热力学参数如表3所示。清蛋白-直链淀粉和球蛋白-直链淀粉体系的ΔH、ΔS和ΔG均为负值,表明这两种体系的主要作用力类型为氢键和范德华力,并且结合过程是放热、焓驱动的自发过程,因此在温度升高时,不利于这两种体系的相互作用,导致结合常数下降。Lian等[18]发现清蛋白和球蛋白的赖氨酸残基存在于蛋白肽的末端,赖氨酸残基的—NH2可与淀粉葡萄糖残基的亲水性—OH通过氢键结合。醇溶蛋白-直链淀粉和谷蛋白-直链淀粉体系的ΔH和ΔS均为正值,ΔG为负值,表明这两种体系的主要作用力为疏水相互作用,结合过程是吸热、熵驱动的自发过程,因此在温度升高时,可促进这两种体系的相互作用,使结合常数上升。直链淀粉腔内是疏水性的,可为非极性部分提供具有高亲和力的结合位点[19],醇溶蛋白和谷蛋白的α-螺旋存在于N端和C端结构域中,β-折叠和β-转角存在于中央重复结构域中[20],这些含有脯氨酸和酪氨酸残基的中心重复结构域可以形成疏水相互作用[21]。醇溶蛋白和谷蛋白表面暴露着大量酪氨酸残基,在与淀粉的相互作用中酚羟基既是氢键的供体又是受体,因此醇溶蛋白、谷蛋白与直链淀粉形成复合物主要的驱动力为疏水作用力,也存在氢键。
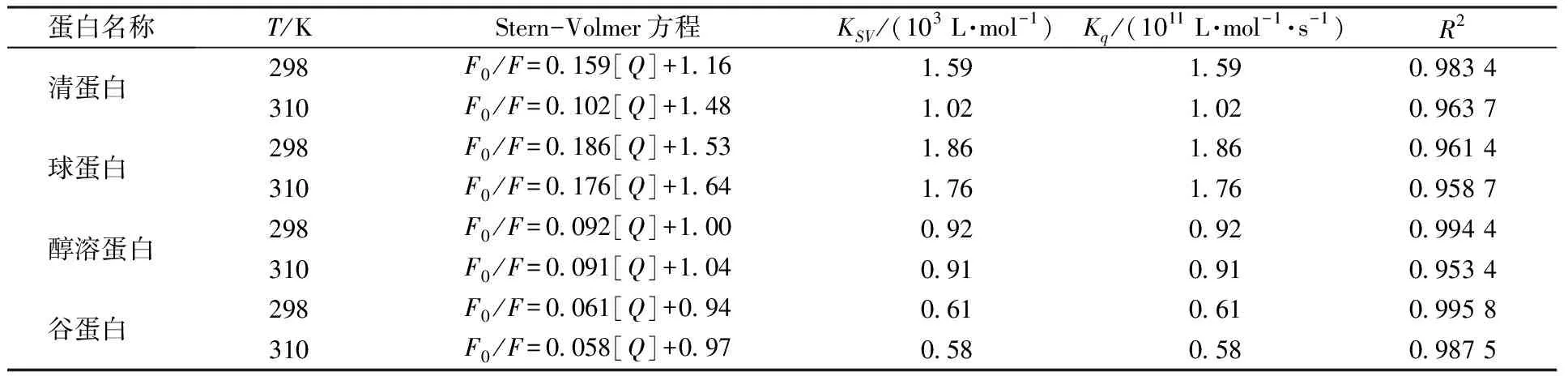
表1 不同温度下直链淀粉与4种蛋白相互作用的猝灭方程及猝灭常数Table 1 Quenching equations and quenching constants for the interactions between amylose and four proteins at different temperatures

表2 不同温度下直链淀粉与4种蛋白相互作用的结合常数及结合位点Table 2 Binding constants and binding sites of interaction between amylose and four proteins at different temperatures
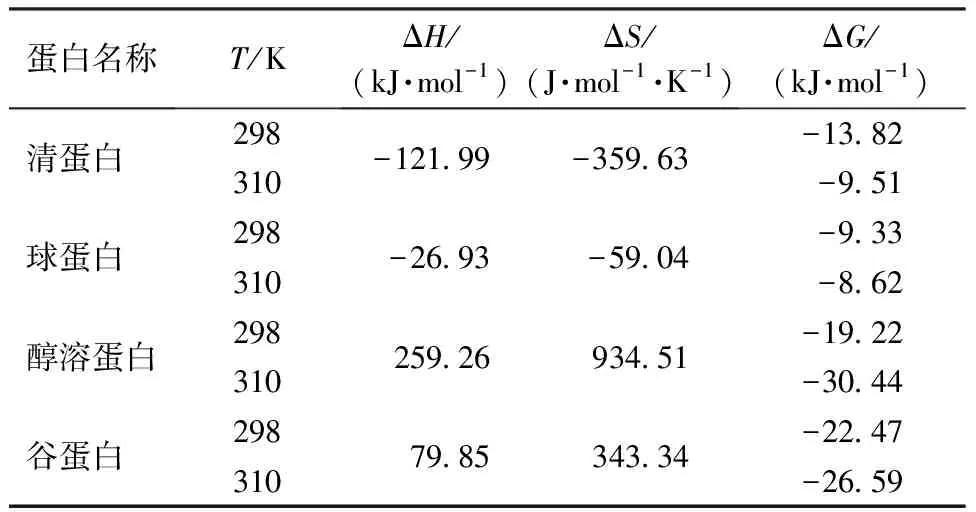
表3 不同温度下直链淀粉与4种蛋白相互作用的热力学参数Table 3 Thermodynamic parameters of interaction between amylose and four proteins at different temperatures
2.4 同步荧光光谱
直链淀粉与4种蛋白在常温下相互作用的同步荧光光谱如图3所示。由图3可以看出,色氨酸残基比酪氨酸残基具有更大的荧光强度。当Δλ=15 nm时,清蛋白最大发射峰红移了8 nm,球蛋白最大发射峰红移了10 nm,醇溶蛋白随着直链淀粉质量浓度的增大最大发射峰趋于水平,因此直链淀粉使清蛋白、球蛋白和醇溶蛋白的酪氨酸残基周围微环境亲水性增加;当Δλ=60 nm时,清蛋白、球蛋白和醇溶蛋白的最大发射峰并未发生改变,说明直链淀粉没有对这3种蛋白的色氨酸残基微环境的极性造成影响。而谷蛋白的最大荧光发射峰波长均无显著性变化,即酪氨酸残基和色氨酸残基周围微环境变化不明显,与紫外光谱结果一致。清蛋白酪氨酸残基的荧光降低率为81.8%,色氨酸残基的荧光降低率为57.3%;球蛋白酪氨酸残基的荧光降低率为69.9%,色氨酸残基的荧光降低率为61.5%;醇溶蛋白酪氨酸残基的荧光降低率为70.0%,色氨酸残基的荧光降低率为46.0%;谷蛋白酪氨酸残基的降低率为20.1%,色氨酸残基的降低率为23.3%。说明4种蛋白的酪氨酸残基与色氨酸残基均参与了结合过程,清蛋白、球蛋白及醇溶蛋白与直链淀粉的结合位点更接近于酪氨酸残基,而谷蛋白与直链淀粉的结合位点更接近于色氨酸残基。

图3 直链淀粉与4种蛋白相互作用的同步荧光光谱Fig.3 Synchronous fluorescence spectra of interaction between amylose and four proteins
3 结论
采用紫外光谱法、荧光光谱法及同步荧光法研究了清蛋白、球蛋白、醇溶蛋白及谷蛋白与直链淀粉的相互作用机制。通过静态猝灭机制,直链淀粉可与4种蛋白生成复合物,能够有效猝灭4种蛋白的内源荧光。清蛋白和球蛋白与直链淀粉通过氢键和范德华力结合,结合力较弱,是放热、焓驱动的自发过程;醇溶蛋白和谷蛋白主要通过疏水相互作用结合,结合力较强,是吸热、熵驱动的自发过程。清蛋白、球蛋白和醇溶蛋白的结合位点更接近酪氨酸残基,谷蛋白的结合位点更接近色氨酸残基。
