甘草素对非小细胞肺癌细胞放疗敏感性的影响
2022-02-13代军强刘鑫李甸源
代军强, 刘鑫, 李甸源
(1.郑州人民医院放疗科,河南郑州 450000;2.许昌市中心医院呼吸内科,河南许昌 461000;3.郑州大学第一附属医院放疗科,河南郑州 450052)
肺癌是临床常见的呼吸系统恶性肿瘤,发病率、死亡率居全球所有癌症首位,且呈逐年上升的趋势。非小细胞肺癌(non-small cell lung cancer,NSCLC)是除小细胞肺癌之外的所有肺上皮癌,主要包括腺癌、鳞状细胞及大细胞癌,占肺癌总数的75%~80%[1-2]。目前,NSCLC的临床治疗以手术为主,并联合术前后的辅助治疗,包括放疗、化疗、免疫治疗、靶向治疗,控制肿瘤进展或复发[3]。其中,放疗作为重要的辅助治疗手段对提高治疗效果、改善患者预后具有重要的意义,但肿瘤细胞对放疗的耐受性降低了其疗效[4]。因此,探讨NSCLC放疗耐受性机制以及寻找提高肿瘤细胞放疗敏感性的药物成为研究热点。甘草素是从中药甘草中提取的二氢黄酮化合物,具有抗炎、抗氧化应激、抗肿瘤等多种生物学效应[5-6]。体外细胞实验表明,甘草素可增加三阴性乳腺癌细胞株MDA-MB-231和BT549对多柔比星的敏感性,提高治疗效果[7]。另外,有研究[8]证实,甘草素可增加肺癌细胞株H1299放疗敏感性,抑制细胞增殖、促进细胞凋亡。基于甘草素具有增加化疗及放疗敏感性的作用,本研究以非小细胞肺癌A549细胞为研究对象,探讨甘草素对NSCLC细胞放疗敏感性的影响及其可能的作用机制,为甘草素相关药物的研发及NSCLC的临床治疗提供实验依据,现将研究结果报道如下。
1 材料与方法
1.1 细胞株及培养人NSCLC细胞株A549购自中国科学院上海细胞库。复苏人NSCLC细胞A549,加至体积分数10%优质胎牛血清的RPMI 1640培养基(NaHCO32.5 g/L、100 U/mL青霉素和100μg/mL链霉素),置于体积分数为5%CO2、37℃恒温恒湿密闭培养箱中,于郑州大学医学科学院培养。
1.2 药品、试剂与仪器甘草素(纯度≥98%,分子式:C15H12O4,分子量:256.25,批号:JOT-10442,成都普菲德生物技术有限公司生产);miR-21拟似物(miR-21 mimics)和miR-21拟似物阴性对照(miR-21 mimics-NC)(广州市锐博生物科技有限公司);Lipofectamine 2000(美国invitrogen公司);细胞计数试剂盒8(CCK-8)(美国Sigma Aldrich公司);膜联蛋白V-异硫氰酸荧光素(Annexin VFITC)凋亡检测试剂盒(美国BD公司);双荧光素酶报告基因试剂盒(美国Promaga公司);二喹啉甲酸(BCA)蛋白定量试剂盒(上海碧云天生物技术有限公司);兔抗人蛋白络氨酸磷酸酶MEG2、β-actin等抗体和羊抗兔辣根过氧化物酶(HRP)标记的免疫球蛋白(IgG)抗体(英国Abcam公司)。直线加速器(美国瓦里安医疗系统公司);多功能酶标仪、蛋白凝胶电泳仪(美国Thermo Fisher Scientific公司);流式细胞仪(美国BD公司);荧光定量PCR仪(美国Bio-Rad公司)。
1.3 观察指标与方法
1.3.1 CCK-8细胞毒性检测实验观察不同浓度甘草素对A549细胞增殖的影响 取对数期A549细胞,磷酸盐缓冲液(PBS)重悬,调整细胞密度为1×105个/mL,接种至96孔板,贴壁培养12 h后,加入不同浓度甘草素(0.05、0.1、0.2、0.4、0.8 mmol/L),另设空白组,设置5个复孔。24 h后,加入10μL的CCK-8试剂于培养箱中孵育4 h,应用多功能酶标仪于波长450 nm处检测光密度(OD)值。计算细胞增殖抑制率,增殖抑制率=(1-不同浓度药物OD值/空白组OD值)×100%。后续实验需联合射线共同作用,因此选取接近于20%抑制浓度(IC20)的甘草素浓度进行后续实验。
1.3.2 克隆形成实验观察细胞放疗敏感性 取对数生长期A549细胞,调整细胞密度为1×105个/mL,接种于6孔板,培养基中加入0.2 mmol/L甘草素作用48 h。另设空白组,采用不同剂量(0、2、4、6、8 Gy)6 MV-X射线室温照射,每组设5个复孔。照射野:10 cm×10 cm;源皮距:100 cm;剂量率:1 Gy/min。照射完毕,PBS清洗,甲醇固定30 min,Giemsa染色20 min,流水冲洗,室温干燥,倒置显微镜下观察。计算:克隆形成率=克隆细胞数/接种细胞数;细胞存活分数(survival fraction,SF)=照射后细胞克隆形成率/照射细胞克隆形成率。根据单击多靶模型方程[9]:合细胞存活曲线,计算平均致死剂量(mean lethal dose,D0)和N,准阈剂量(quasi-threshold,Dq)=D0lnN,其中D为放射剂量,N为外推数或靶数。放射增敏比(sensitization enhancement ratio,SER)定义:达到相同生物学效应时,单纯照射的剂量/药物干预照射的剂量,SERD0=空白组D0/干预组D0,SERDq=空白组Dq/干预组Dq。
1.3.3 细胞转染与分组 将A549细胞按1×105个/mL接种于6孔板,随机分为5组:对照组、甘草素组、miR-21 mimics-NC组、miR-21 mimics组、甘草素+miR-21 mimics组。待细胞密度为70%时,对照组、甘草素组加入等体积分数Lipofectamine 2000的完全培养液,miR-21 mimics-NC组转染miR-21 mimics-NC,miR-21 mimics组、甘草素+miR-21 mimics组转染miR-21 mimics。按照Lipofectamine 2000说明书进行转染:分别使用250μL Opti-MEM稀释5μL Lipofectamine 2000和5μL miR-21 mimics-NC或miR-21 mimics,孵育5 min后,将2种稀释物混合,形成复合物,将复合物加入6孔板进行转染。转染24 h后,荧光显微镜下观察细胞转染效果,确定转染效果良好后,甘草素组、甘草素+miR-21 mimics组加入0.2 mmol/L甘草素,其余各组加入等量细胞培养液作用24 h,采用4 Gy 6 MV-X射线照射后进行后续实验。
1.3.4 CCK-8法检测细胞活力 收集各组细胞,PBS重悬,用细胞计数板对细胞悬液进行计数。调整细胞密度为1×105个/mL,接种至96孔板,每组设置5个复孔。贴壁培养12 h后,加入10μL CCK-8试剂。培养箱中孵育4 h后,应用多功能酶标仪于波长450 nm处检测OD值。计算细胞相对活力:细胞相对活力(%)=(实验组OD值/对照组OD值)×100%。
1.3.5 流式细胞术检测细胞凋亡情况 收集各组细胞,4℃预冷的PBS清洗2次,以1 200 r/min(离心半径8 cm)离心10 min,加入500μL结合缓冲液重悬细胞。先后加入5μL Annexin V-FITC和PI室温避光孵育15 min,流式细胞仪检测各组A549细胞凋亡率。实验重复3次。
1.3.6 定量聚合酶链反应(qPCR)法检测细胞miR-21、MEG2 mRNA相对表达量 收集各组细胞,用TRIzol试剂提取组织中总RNA,应用紫外分光光度计检测RNA浓度[OD(260 nm)/OD(280 nm)],反转录为cDNA。反应条件:30℃10 min,42℃30 min,99℃5 min,4℃5 min。产物cDNA按照定量PCR试剂盒说明书进行Realtime PCR反应。反应条件:95℃5 min,94℃20 s,60℃20 s,40个循环。分别以U6和GAPDH为内参,采用2-ΔΔCT法计算miR-21和MEG2 mRNA的相对表达量。实验重复3次。PCR引物序列见表1。

表1 PCR引物序列Table 1 PCR Primer sequences
1.3.7 双荧光素酶报告基因实验验证miR-21与MEG2的靶向关系 通过Starbase V2.0、PicTar、TargetScan等数据库预测分析miR-21与MEG2之间的结合位点,将MEG2的3’UTR区域,插入双荧光素酶报告基因pmirGLO中,构建野生型pmirGLO-MEG2-3’-UTR wild type和 突 变 型pmirGLO-MEG2-3’-UTR mutant重组质粒。将A549细胞按1×105个/mL接种至24孔板,使用Lipofectamine 2000将报告质粒与miR-21 mimics或miR-21 mimics-NC共转染。24 h后,每孔加入100μL Passive Lysis Buffer置于摇床上裂解15 min,于4℃、12 000 r/min(离心半径8 cm)离心10 min。转移上清至24孔板,每孔加入100μL Luciferase Assay ReagentⅡ、20μL细胞裂解液,应用荧光测定仪检测内参发光值。再加入100μL stop&GLO Reagent,荧光测定仪检测报告基因发光值。实验重复3次。
1.3.8 蛋白免疫印迹(Western Blot)法检测细胞MEG2蛋白表达水平 收集各组细胞,提取细胞总蛋白,BCA试剂盒检测蛋白浓度。95℃金属浴使蛋白变性,进行10%十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(SDS-PAGE),转膜仪将蛋白转移到聚偏氟乙烯(PVDF)膜上,50 g/L脱脂牛奶室温封闭1 h,分别加入MEG2(1∶1 000稀释)、β-actin(1∶1 000稀释)一抗4℃孵育过夜,TBST洗膜3次,10 min/次。再加入HRP标记的二抗(1∶2 000稀释)室温孵育1 h,TBST洗膜3次,10 min/次。最后,将PVDF膜浸入电化学发光液(ECL),于暗室中曝光显影,应用ImageJ软件对胶片蛋白条带进行灰度分析,以目的蛋白条带灰度值/内参GAPDH蛋白条带灰度值的比值,作为目的蛋白相对表达量。实验重复3次。
1.4 统计方法采用SPSS24.0统计软件对实验数据进行分析,所有实验数据以均数±标准差(±s)表示。两组间比较采用t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度甘草素对A549细胞增殖的影响随着甘草素浓度增加,细胞增殖抑制率升高(P<0.05),表明不同浓度甘草素均可抑制A549细胞增殖,其中0.2 mmol/L浓度的甘草素对A549细胞增殖的抑制率为(20.43±1.86)%,接近于IC20。为确保后续实验有效性,故选取甘草素浓度为0.2mmol/L。见图1。
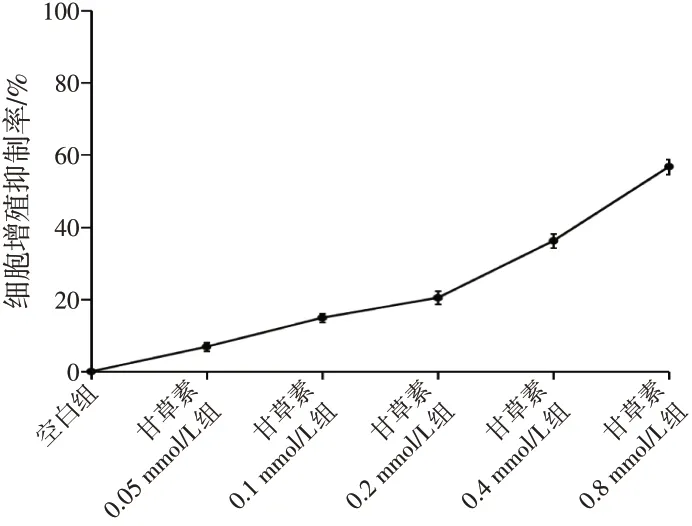
图1 不同浓度甘草素对A549细胞增殖的抑制作用Figure 1 Inhibitory effect of different concentrations of liquiritigenin on the proliferation of A549 cells
2.2 甘草素对A549细胞放疗敏感性的影响随着放射剂量增加,空白组与甘草素组A549细胞SF均逐渐降低,甘草素组细胞SF较空白组显著降低(P<0.05)。甘草素组A549细胞的SERD0和SERDq分别为1.27、1.54,放射增敏比>1。结果表明,甘草素可以增强A549细胞的放疗敏感性。照射剂量为4 Gy时,A549细胞SF接近0.5,因此后续研究选用放射线剂量4 Gy作为照射剂量。具体结果见图2、表2。
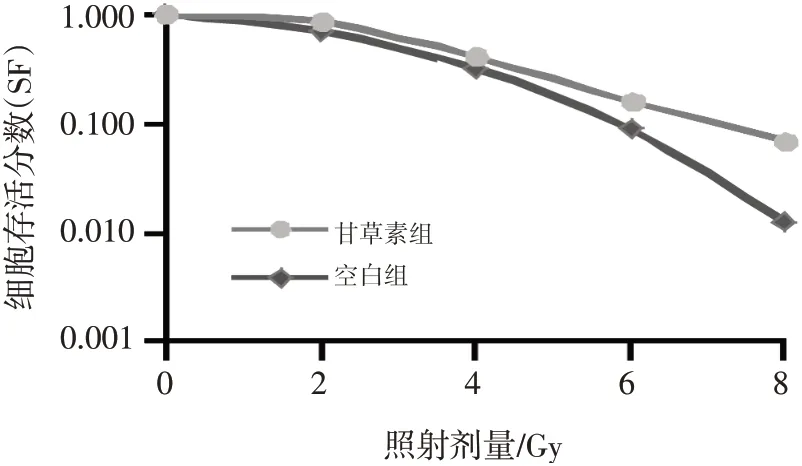
图2 不同剂量放射线照射后细胞存活曲线Figure 2 Cell survival curve after different doses of radiation

表2 单击多靶模型参数比较Table 2 Comparison of single-click multi-target model parameters
2.3 各组A549细胞相对活力比较各组细胞相对活力组间比较,差异有统计学意义(P<0.05)。与对照组比较,甘草素组细胞相对活力降低,miR-21 mimics组细胞相对活力升高(P<0.05);与甘草素组比较,miR-21 mimics组、甘草素+miR-21 mimics组细胞相对活力升高(P<0.05);与miR-21 mimics-NC组比较,miR-21 mimics组细胞相对活力升高(P<0.05);与miR-21 mimics组比较,甘草素+miR-21 mimics组细胞相对活力降低(P<0.05)。结果表明,甘草素可减弱miR-21 mimics促进A549细胞增殖的作用。具体结果见表3。
表3 各组A549细胞相对活力比较Table 3 Comparison of the relative viability of A549 cells in various groups (±s;n=5)
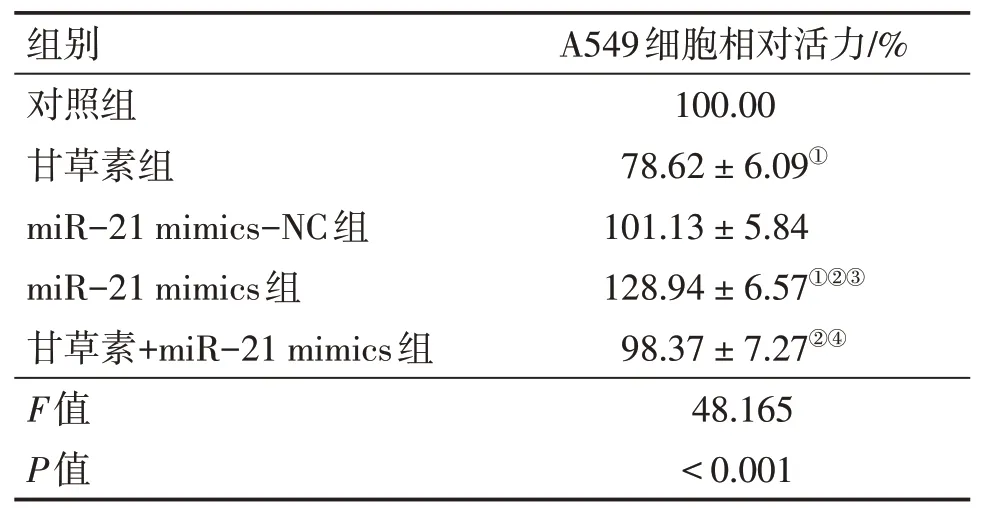
表3 各组A549细胞相对活力比较Table 3 Comparison of the relative viability of A549 cells in various groups (±s;n=5)
①P<0.05,与对照组比较;②P<0.05,与甘草素组比较;③P<0.05,与miR-21 mimics-NC组比较;④P<0.05,与miR-21 mimics组比较
?
2.4 各组A549细胞凋亡率比较细胞凋亡率组间比较,差异有统计学意义(P<0.05)。与对照组比较,甘草素组细胞凋亡率升高,miR-21 mimics组细胞凋亡率降低(P<0.05);与甘草素组比较,miR-21 mimics组、甘草素+miR-21 mimics组细胞凋亡率降低(P<0.05);与miR-21 mimics-NC组比较,miR-21 mimics组细胞凋亡率降低(P<0.05);与miR-21 mimics组比较,甘草素+miR-21 mimics
组细胞凋亡率升高(P<0.05)。结果表明,甘草素可增加miR-21 mimics抑制A549细胞凋亡的作用。具体结果见表4、图3。

图3 各组A549细胞凋亡情况比较Figure 3 Comparison of A549 cell apoptosis in various groups
表4 各组A549细胞凋亡率比较Table 4 Comparison of apoptosis rate of A549 cells in various groups (±s;n=3)
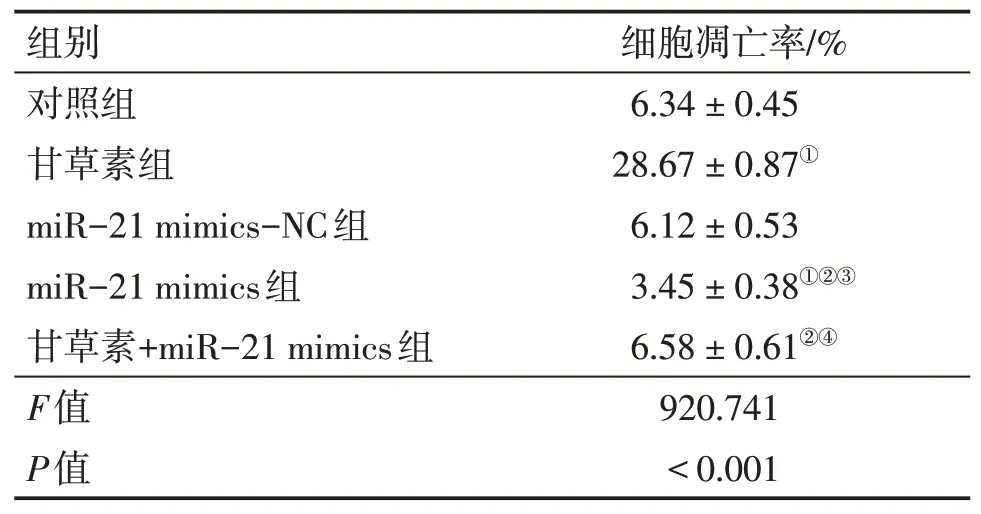
表4 各组A549细胞凋亡率比较Table 4 Comparison of apoptosis rate of A549 cells in various groups (±s;n=3)
①P<0.05,与对照组比较;②P<0.05,与甘草素组比较;③P<0.05,与miR-21 mimics-NC组比较;④P<0.05,与miR-21 mimics组比较
?
2.5 各组A549细胞miR-21和MEG2 mRNA相对表达量比较各组细胞miR-21和MEG2 mRNA相对表达量组间比较,差异有统计学意义(P<0.05)。与对照组比较,甘草素组miR-21相对表达量降低,MEG2 mRNA相对表达量升高,miR-21 mimics组miR-21相对表达量升高,MEG2 mRNA相对表达量降低(P<0.05);与甘草素组比较,miR-21 mimics组、甘草素+miR-21 mimics组miR-21相对表达量升高,MEG2 mRNA相对表达量降低(P<0.05);与miR-21 mimics-NC组比较,miR-21 mimics组miR-21相对表达量升高,MEG2 mRNA相对表达量降低(P<0.05);与miR-21mimics组比较,甘草素+miR-21 mimics组miR-21相对表达量降低,MEG2 mRNA相对表达量升高(P<0.05)。结果表明,miR-21可能与MEG2 mRNA表达相关。具体结果见表5。
表5 各组A549细胞miR-21和MEG2 mRNA相对表达量比较Table 5 Comparison of the relative expression levels of miR-21 and MEG2 mRNA in A549 cells of various groups (±s;n=3)

表5 各组A549细胞miR-21和MEG2 mRNA相对表达量比较Table 5 Comparison of the relative expression levels of miR-21 and MEG2 mRNA in A549 cells of various groups (±s;n=3)
①P<0.05,与对照组比较;②P<0.05,与甘草素组比较;③P<0.05,与miR-21 mimics-NC组比较;④P<0.05,与miR-21 mimics组比较
?
2.6miR-21与MEG2的靶向关系通过数据库预测miR-21与MEG2的靶向关系,结果显示,miR-21可以结合MEG2的3’-UTR区域,见图4-A。双荧光素酶报告基因实验结果显示,与共转染miR-21 mimics-NC、MEG2 3’-UTR野生型载体的A549细胞比较,共转染miR-21 mimics、MEG2 3’-UTR野生型载体的细胞荧光素酶活性显著降低(P<0.05),与共转染miR-21 mimics-NC、MEG2 3’-UTR突变型载体的A549细胞比较,共转染miR-21 mimics、MEG2 3’-UTR突变型载体的细胞荧光素酶活性无明显变化。结果表明,miR-21直接靶向调控MEG2表达。具体结果见图4-B。
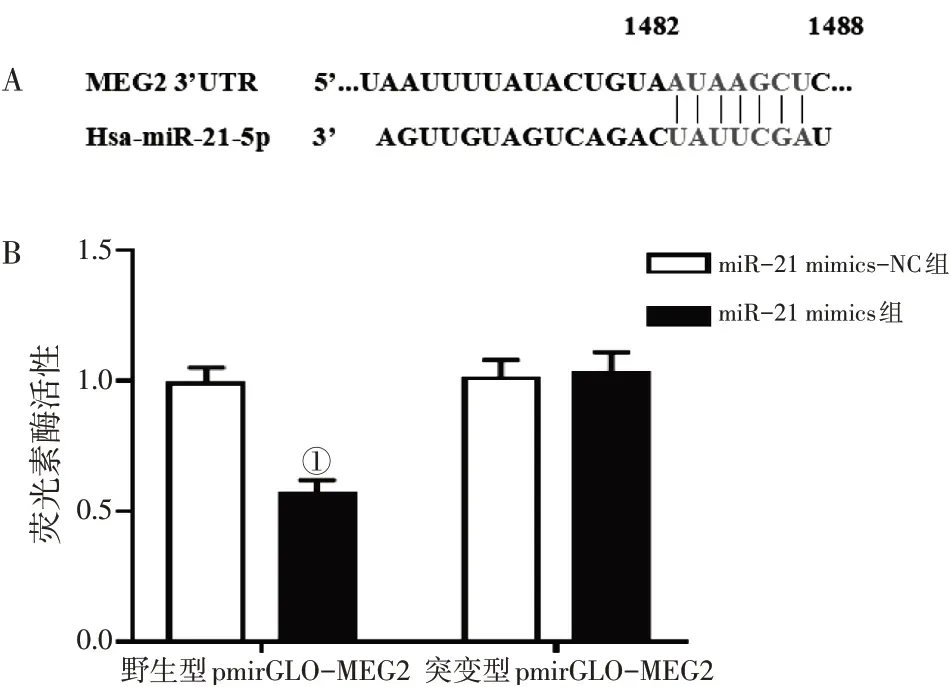
图4 miR-21与MEG2的靶向关系Figure 4 Targeting relationship between miR-21 and MEG2
2.7 各组A549细胞MEG2蛋白相对表达量比较各组A549细胞MEG2蛋白相对表达量组间比较,差异有统计学意义(P<0.05)。与对照组比较,甘草素组MEG2蛋白相对表达量升高,miR-21 mimics组MEG2蛋白相对表达量降低(P<0.05);与甘草素组比较,miR-21 mimics组、甘草素+miR-21 mimics组MEG2蛋白相对表达量降低(P<0.05);与miR-21 mimics-NC组比较,miR-21 mimics组MEG2蛋白相对表达量降低(P<0.05);与miR-21 mimics组比较,甘草素+miR-21 mimics组MEG2蛋白相对表达量升高(P<0.05)。表明甘草素可减弱miR-21对MEG2的抑制作用。具体结果见图5、表6。
表6 各组A549细胞MEG2蛋白相对表达量比较Table 6 Comparison of protein relative expression level of MEG2 in A549 cells of various groups(±s;n=3)
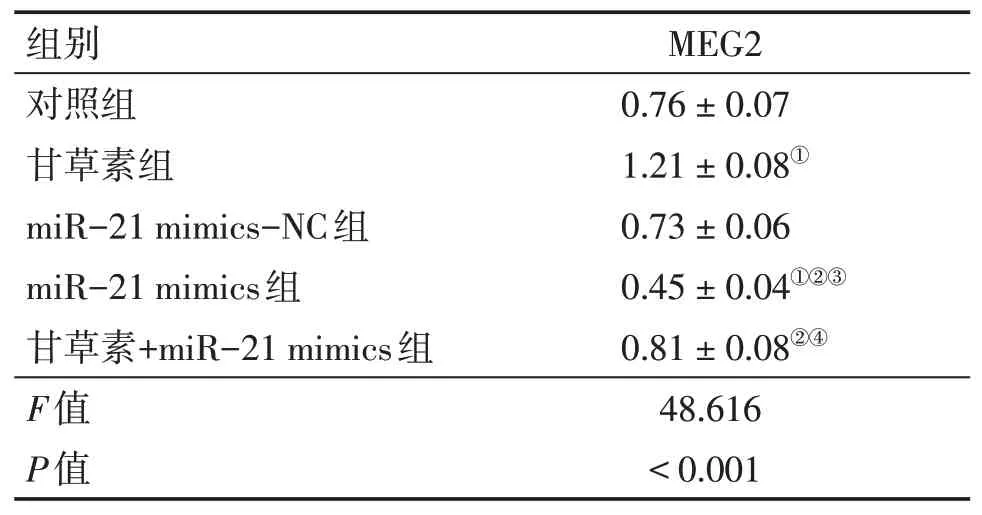
表6 各组A549细胞MEG2蛋白相对表达量比较Table 6 Comparison of protein relative expression level of MEG2 in A549 cells of various groups(±s;n=3)
①P<0.05,与对照组比较;②P<0.05,与甘草素组比较;③P<0.05,与miR-21 mimics-NC组比较;④P<0.05,与miR-21 mimics组比较
?

图5 各组A549细胞MEG2蛋白表达比较Figure 5 Comparison of MEG2 protein expression in A549 cells of various groups
3 讨论
目前,我国每年非小细胞肺癌(NSCLC)新发病例约73.3万,死亡病例约59.1万[10]。NSCLC发生发展过程中原癌基因表达下调和抑癌基因表达上调,基因异常表达及长期积累引起细胞增殖凋亡调控失常,细胞异质恶性增殖导致NSCLC发生[11-12]。NSCLC病情进展隐蔽,多数患者确诊时已处于中晚期,多失去手术治疗的机会。非手术患者应首先考虑进行常规或立体定向放射治疗[13]。放射治疗是通过电离辐射在肿瘤细胞中产生自由基,损伤癌细胞基因组DNA,细胞周期停滞,损伤修复失败直接或间接导致细胞凋亡[14]。肿瘤细胞对致死性损伤修复的能力高低是导致肿瘤细胞产生放疗耐受性的机制之一,NSCLC患者的放疗抵抗性极大降低了放疗效果[15]。因此,寻找安全、低毒、高效及副作用小的放疗增敏药物对提高放疗效果意义重大。
目前,甘草素在多种肿瘤细胞中的抗肿瘤作用及放疗增敏作用已被证实[16-17],但应用于NSCLC放疗增敏方面鲜有报道。为探讨甘草素对NSCLC细胞放疗敏感性的影响及其可能的作用机制,本研究以NSCLC细胞A549为实验对象,使用不同浓度甘草素处理A549细胞,结果显示不同浓度甘草素均对A549细胞具有增殖抑制作用。本研究采用克隆形成实验检测A549细胞放疗增敏作用,CCK-8实验检测A549细胞增殖活力及流式细胞术检测A549细胞凋亡情况,结果显示,使用甘草素后的SERD0和SERDq分别为1.27、1.54,且甘草素组A549细胞相对活力较对照组下降,凋亡率升高。结果表明甘草素可抑制A549细胞增殖,促进A549细胞凋亡并增强其放疗敏感性。
微小RNA(microRNA,miRNA)是18~25个核苷酸组成的非编码单链RNA,可在转录后水平调节基因表达,参与多种生理和病理过程,包括细胞增殖、凋亡、分化、发育及癌细胞浸润等[18]。既往研究显示,通过与辐射相关信号转导途径中的关键成分如上游受体、中游换能器和下游效应因子等相互作用,miRNA可有效激活细胞核中DNA损伤反应基因和细胞周期相关基因的表达,调节肿瘤细胞的辐射反应和放射敏感性[19]。Liu等[20]研究表明,miR-21是通过第10号染色体同源丢失性磷酸酶张力蛋白(PTEN)/蛋白激酶B(Akt)途径调节电离辐射诱导肺上皮细胞上皮-间质转化的关键因子。Liu等[21]研究表明,过表达miR-21可降低晚期宫颈癌通过SMAD7对放化疗的敏感性,提示miR-21具有放疗增敏作用。miRNA可通过调控下游靶基因,发挥相应生物学作用。Bao等[22]研究表明,miR-21通过直接靶向MEG2促进结直肠癌细胞的增殖、侵袭并抑制凋亡。饶钟鸣等[23]研究显示,miR-21可通过靶向抑制MEG2表达,参与调节肺癌细胞增殖、侵袭和凋亡过程。本研究将A549细胞转染miR-21 mimics诱导miR-21过量表达,MEG2 mRNA和蛋白相对表达量降低,细胞相对活力升高,凋亡率降低,再经甘草素干预后miR-21相对表达量降低,MEG2 mRNA和蛋白相对表达量升高,细胞相对活力降低,凋亡率升高,逆转了miR-21表达上调的作用效果,双荧光素酶报告基因结果表明miR-21直接靶向MEG2,提示甘草素可能通过miR-21/MEG2轴抑制NSCLC细胞增殖,诱导细胞凋亡和增强其放疗敏感性。
综上所述,甘草素可以抑制NSCLC细胞增殖,诱导凋亡,增强其放疗敏感性,可能是通过调控miR-21对MEG2转录和翻译的抑制发挥作用。本研究结果可为甘草素相关药物的研发及应用于NSCLC的临床治疗提供理论依据。
