胃息肉患者PGI、PGII、G- 17的临床变化及与Hp感染研究
2022-02-11仇娇敏韦兴静崔立王军
仇娇敏 ,韦兴静 ,崔立,王军
1.北京燕化医院消化科,北京 102500;2.首都医科大学门头沟区教学医院门头沟区医院心内科,北京 102300
胃息肉是起源于胃黏膜上皮及黏膜下的一种局限性隆起性良性病变,近些年,胃息肉检出率逐渐增高,胃息肉的具体病因及发病机制尚不明确,但大量研究表明胃息肉地发展与慢性炎症刺激、幽门螺杆菌(helicobacter pylori, Hp)感染、胆汁返流、长期应用质子泵抑制剂等有关[1],而胃蛋白酶原Ⅰ(pepsinogen Ⅰ, PGⅠ)、胃蛋白酶原Ⅱ(pepsinogenⅡ, PGⅡ)及胃泌素-17(gastrin-17, G-17)变化与胃息肉关系的研究报道不多[2],本研究选取2019年9月—2021年8月北京燕化医院门诊及住院的患者,根据胃镜检查结果选取胃息肉患者130例为研究对象,旨在分析本院胃息肉患者PGⅠ、 PGIⅡ、G-17的变化,以期其对临床有指导意义,并进一步观察Hp感染与胃息肉的相关性[3-4]。现报道如下。
1 资料与方法
1.1 一般资料
选取本院门诊及住院患者,要求近1周内未使用质子泵抑制剂(proton pump inhibitor, PPI)。据胃镜检查结果分为观察组(胃息肉患者)130例,男68例,女62例;年龄36~79岁,平均(55.0±1.4)岁;对照组(正常者)118名,男56名,女62名;年龄35~70岁,平均(50.0±1.6)岁。胃息肉患者据病理分组:增生性息肉组64例,男30例,女34例;平均年龄(56.0±1.2)岁;炎性息肉组34例,男21例,女13例;平均年龄(54.0±1.3)岁;胃底腺息肉组22例,男10例,女12例;平均年龄(55.0±1.6)岁;腺瘤性息肉组10例,男8例,女2例,平均年龄(55.0±1.4)岁。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。患者及其家属知情同意,且经院内医学伦理委员会批准。
1.2 方法
1.2.1 标本处理 晨起采集空腹静脉血2 mL,OOO r/min离心5 min,分离血清,血清标本储存于-20℃低温水箱中待测。
1.2.2 仪器与试剂 血清PGⅠ、 PGⅡ、 G17应用荧光免疫层析法(fluorescence immunochromatographic assay, FICA)检测,采用必欧瀚生物技术有限公司的荧光免疫分析仪检测,及必欧瀚生物技术(合肥)有限公司的PGⅠ、 PGⅡ、G-17试剂盒检测,呼气试验检测采用13C尿素酶呼气试验检测仪[5]。
1.3 统计方法
采用SPSS 17.0统计学软件进行数据处理,符合正态分布的计量资料以(±s)表示,组间差异比较采用t检验;计数资料以[n(%)]表示,组间差异比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组PGⅠ、 PGⅡ、 PGR、G-17水平比较
观察组PGⅠ、 PGⅡ、 G-17水平均高于对照组,差异有统计学意义(P<0.05),两组PGR水平比较,差异无统计学意义(P>0.05)。见表1。
表1 两组PGⅠ、PGⅡ、PGR、G-17水平对比(±s)
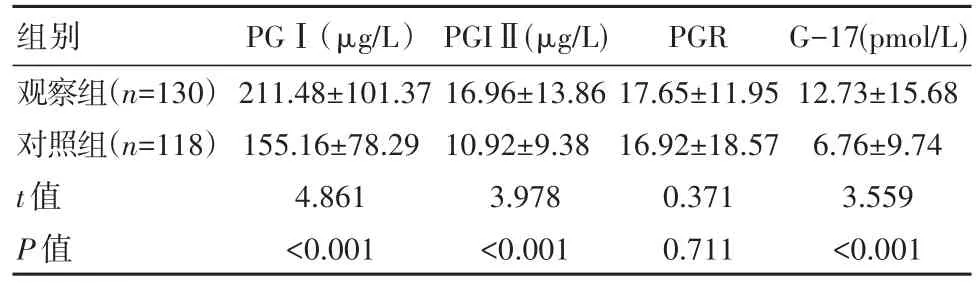
表1 两组PGⅠ、PGⅡ、PGR、G-17水平对比(±s)
组别观察组(n=130)对照组(n=118)t值P值PGⅠ(μg/L)211.48±101.37 155.16±78.29 4.861<0.001 PGIⅡ(μg/L)16.96±13.86 10.92±9.38 3.978<0.001 PGR 17.65±11.95 16.92±18.57 0.371 0.711 G-17(pmol/L)12.73±15.68 6.76±9.74 3.559<0.001
2.2 观察组内不同分型患者PGⅠ、 PGⅡ、 PGR、G-17水平比较
增生性息肉组与炎性息肉组PGⅠ、 PGⅡ、 G-17、PGR水平比较,差异无统计学意义(P>0.05);增生性息肉患者G-17水平高于胃底腺息肉患者,差异有统计学意义(P<0.05);炎性息肉患者G-17水平高于胃底腺息肉患者,差异有统计学意义(P<0.05)。见表2。
表2 观察组内不同分型患者PGⅠ、PGⅡ、PGR、G-17水平对比(±s)
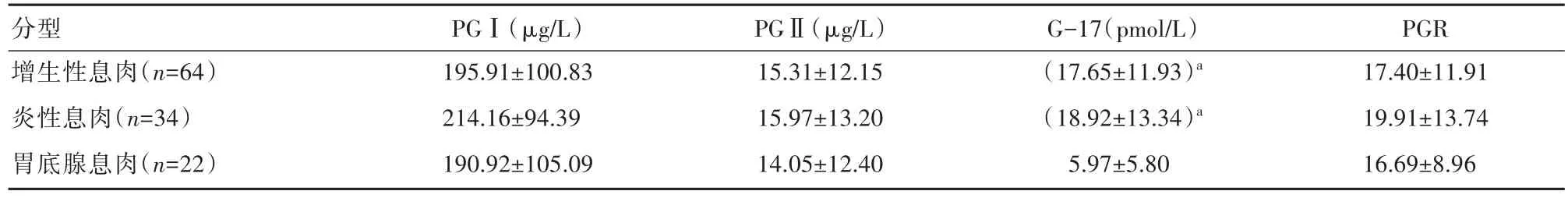
表2 观察组内不同分型患者PGⅠ、PGⅡ、PGR、G-17水平对比(±s)
注:与胃底腺息肉组比较,aP<0.05
分型增生性息肉(n=64)炎性息肉(n=34)胃底腺息肉(n=22)PGⅠ(μg/L)195.91±100.83 214.16±94.39 190.92±105.09 PGⅡ(μg/L)15.31±12.15 15.97±13.20 14.05±12.40 G-17(pmol/L)(17.65±11.93)a(18.92±13.34)a 5.97±5.80 PGR 17.40±11.91 19.91±13.74 16.69±8.96
2.3 胃息肉发生部位与Hp感染率比较
130例胃息肉患者中,Hp感染率为46.2%;其中增生性息肉组Hp感染率为53.1%,明显高于胃底腺息肉Hp的感染率27.3%,差异有统计学意义(P<0.05);炎性息肉组的Hp感染率为55.9%,明显高于胃底腺息肉组,差异有统计学意义(P<0.05);增生性息肉组与炎性息肉组Hp感染率比较,差异无统计学意义(P>0.05)。见表3。
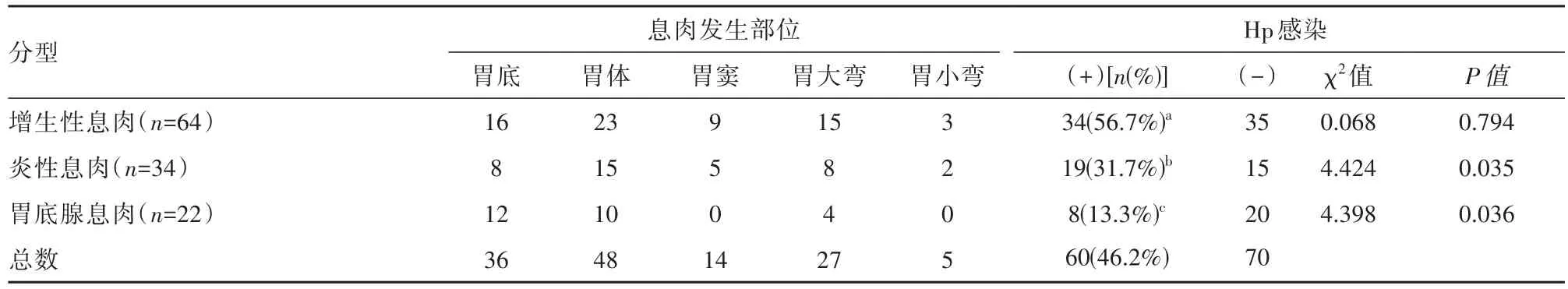
表3 胃息肉发生部位与Hp感染率对比
3 讨论
胃息肉是消化科的常见疾病,近几年胃息肉检出率为3%~5%逐年增高[6-7],大多数胃息肉无特殊临床症状,合并其他消化的科疾病时才出现临床症状[8]。胃息肉病理特征分为增生性息肉、炎性息肉、胃底腺息肉及腺瘤性息肉。
胃蛋白酶原(pepsinogen,PG)为胃蛋白酶前体,分为PGⅠ和PGⅡ两种亚型,PGⅠ由胃底与胃体的主细胞分泌,PGⅡ由胃底腺、贲门腺、幽门腺,Brunner腺(存在于十二指肠深部)分泌,两者经胃酸活化后形成胃蛋白酶,PG是浅表性胃炎、糜烂性胃炎、消化性溃疡等胃部疾病的初筛指标和治疗的监控指标,当胃黏膜存在刺激或炎症时,胃粘膜细胞分泌能力增强,PG的产生增多,胃黏膜毛细血管出现扩张及膜通透性增加,致使PGⅠ和PGⅡ大量进入血液中[9],G-17由胃窦G细胞产生,主要作用促进胃酸分泌,反应胃窦G细胞的分泌功能[10]。本研究中,胃息肉组PGⅠ、 PGⅡ、 G-17水平均明显高于对照组(P<0.05),这与多数研究报道结果具有一致性[11-12]。提示胃息肉患者胃黏膜存在明显的炎症刺激,从而导致大量PGⅠ、 PGⅡ释放入血。本研究中胃息肉组间比较,增生性息肉组、炎性息肉组、胃底腺息肉组PGⅠ、 PGⅡ水平对比差异无统计学意义(P>0.05),与王凯等[12]、庞训雷等[13]研究报道一致,其研究中,胃增生性息肉组PGⅠ、 PGⅡ、 G-17水平高于浅表性胃炎组,增生性息肉组血清G-17水平高于胃底腺息肉,这与本研究中增生性息肉组、炎性息肉组的G-17水平均高于胃底腺息肉组一致,提示增生性息肉、炎性息肉组亦存在高泌素血症。高胃泌素血症亦被认为是一种重要的癌前病变的预测指标,提示增生性息肉较胃底腺息肉癌变率可能性更大。
研究发现增生性息肉、炎性息肉与Hp感染存在相关性[14],周政[15]研究报道在520例胃息肉患者中,Hp感染率为40.38%,其中增生性息肉组与炎性息肉组Hp感染率较高,分别为38.71%和39.31%;本研究中,胃息肉Hp感染率56.7%,进一步分组统计,增生性息肉与炎性息肉组Hp感染率均明显高于胃底腺息肉组(P<0.05),与其报道一致,提示胃增生性息肉、炎性息肉患者的胃黏膜炎症刺激与Hp感染密切相关。Hp感染致长期炎症刺激,致胃黏膜分泌功能增强,进而促进胃泌素地分泌增加,胃泌素进一步促进胃酸分泌,致使PGⅠ、 PGⅡ水平升高[16],进一步加重胃黏膜反应,促使黏膜炎症或腺体增生,导致息肉形成。而胃底腺息肉组G-17及Hp感染率均较低,提示Hp感染对胃底腺息肉地发生无相关性。目前普遍认为,胃底腺息肉与长期应用PPI制剂关系密切[17]。
综上所述,胃增生性息肉与炎症性息肉患者血清PGⅠ、 PGⅡ、 G17水平较高,胃黏膜存在明显炎症刺激,具有临床指导意义;Hp感染与增生性息肉及炎性息肉具有相关性,积极抗Hp治疗可降低胃息肉的发生率。
