银黄吸入溶液的指纹图谱建立及酚酸类成分的含量测定
2022-02-07高进李翠尹睿卓马新称王慧阳龚春晖陈承瑜曹晖
高进 李翠 尹睿卓 马新称 王慧阳 龚春晖 陈承瑜 曹晖
中圖分类号 R284.1 文献标志码 A 文章编号 1001-0408(2022)02-0160-05
DOI 10.6039/j.issn.1001-0408.2022.02.06
摘 要 目的 建立银黄吸入溶液的指纹图谱,并同时测定新绿原酸、绿原酸、隐绿原酸的含量。方法 以黄芩苷为参照峰,采用高效液相色谱(HPLC)法建立银黄吸入溶液的指纹图谱;以绿原酸为参照物,采用斜率校正法计算新绿原酸、隐绿原酸的相对校正因子,再根据相对校正因子计算两者的含量,并将上述一测多评(QAMS)法的检测结果与外标法进行比较。结果 10批银黄吸入溶液共有18个共有峰,与对照指纹图谱的相似度均大于0.90;共指认了7个共有峰,分别为黄芩苷、新绿原酸、绿原酸、隐绿原酸、异绿原酸B、3,5-二-O-咖啡酰奎宁酸和4,5-二-O-咖啡酰奎宁酸。新绿原酸、绿原酸、隐绿原酸检测进样量的线性范围分别为0.025 0~1.247 4 μg(r=0.999 7)、0.039 3~1.178 7 μg(r=0.999 9)、0.031 6~1.184 1 μg(r=0.999 9);精密度、重复性、稳定性(48 h)试验的RSD均小于 1.0%;平均加样回收率分别为93.92%(RSD=1.32%,n=6)、94.46%(RSD=1.45%,n=6)、93.93%(RSD=1.57%,n=6)。新绿原酸、隐绿原酸相对于绿原酸的相对校正因子分别为1.068、1.233。QAMS法测得新绿原酸、隐绿原酸含量分别为0.301 8~0.386 3、0.262 5~0.362 5 mg/mL,外标法测得新绿原酸、绿原酸、隐绿原酸含量分别为0.302 6~0.387 2、0.231 0~0.334 0、0.261 6~0.361 3 mg/mL;两种方法含量测定结果(绿原酸除外)的偏差均不高于0.20%。结论 所建HPLC指纹图谱稳定、可行,所建QAMS法准确、重复性好;HPLC指纹图谱结合QAMS法可用于银黄吸入溶液的质量控制。
关键词 银黄吸入溶液;高效液相色谱法;指纹图谱;酚酸类成分;一测多评法;含量测定
Establishment of the fingerprints of Yinhuang solution for inhalation and content determination of phenolic acids
GAO Jin1,2,LI Cui1,2,YIN Ruizhuo2,MA Xincheng2,WANG Huiyang2,GONG Chunhui2,CHEN Chengyu1,2, CAO Hui1[1. College of Pharmacy, Jinan University, Guangzhou 510632, China; 2. Increasepharm(Hengqin) Institute Co., Limited/National Engineering Research Center for Modernization of Traditional Chinese Medicine New Drug Delivery System Branch/Guangdong Province Engineering Research Center for Aerosol Inhalation Preparation, Guangdong Zhuhai 519000, China]
ABSTRACT OBJECTIVE To establish the fingerprints for Yinhuang solution for inhalation and determine the contents of neochlorogenic acid, chlorogenic acid and cryptochlorogenic acid simultaneously. METHODS Using baicalin as reference, the fingerprints of Yinhuang solution for inhalation were established by high performance liquid chromatography (HPLC). Relative correction factors of neochlorogenic acid and cryptochlorogenic acid were calculated by slope correction method, using chlorogenic acid as reference; the contents of them were calculated according to relative correction factor. The results of quantitative analysis of multi-components by single marker (QAMS) were compared with those of external standard method (ESM). RESULTS There were 18 common peaks in the fingerprints of 10 batches of Yinhuang solution for inhalation, and their similarities with reference fingerprint were higher than 0.90. A total of 7 common peaks were identified as baicalin, neochlorogenic acid, chlorogenic acid, cryptochlorogenic acid, isochlorogenic acid B, 3,5-di-O-caffeoylquinic acid and 4,5-di-O-caffeoylquinic acid. The linear range of neochlorogenic acid, chlorogenic acid and cryptochlorogenic acid were 0.025 0-1.247 4 μg(r=0.999 7), 0.039 3-1.178 7 μg(r=0.999 9), 0.031 6-1.184 1 μg(r=0.999 9), respectively. RSDs of precision, reproducibility and stability tests (48 h) were all lower than 1.0%. The average recoveries were 93.92%(RSD=1.32% ,n=6), 94.46%(RSD=1.45%,n=6), 93.93%(RSD=1.57%,n=6). Relative correction factors of neochlorogenic acid and cryptochlorogenic acid were 1.068 and 1.233. The contents of neochlorogenic acid and cryptochlorogenic acid determined by QAMS method were 0.301 8-0.386 3 and 0.262 5-0.362 5 mg/mL, respectively. The contents of neochlorogenic acid, chlorogenic acid and cryptochlorogenic acid by ESM were 0.302 6-0.387 2, 0.231 0- 0.334 0, 0.261 6-0.361 3 mg/mL, respectively. The deviations of the content determination results of the two methods (except for chlorogenic acid) were both not higher than 0.20%. CONCLUSIONS Established HPLC fingerprints are stable and feasible. Established QAMS method is accurate and rapid. HPLC fingerprint combined with QAMS can be used for the quality control for Yinhuang solution for inhalation.
KEYWORDS Yinhuang solution for inhalation; high performance liquid chromatography; fingerprint; phenolic acids; quantitative analysis multi-components by single marker;content determination
银黄制剂主要由金银花提取物和黄芩提取物组成,具有疏风解表、清热解毒之功效,可用于临床治疗外感风热和肺胃热盛所致的咽干、咽痛、喉核肿大、口渴、发热、急慢性扁桃体炎、急慢性咽炎、上呼吸道感染等[1-2]。该药主要含有酚酸类和黄酮类成分,其中酚酸类成分新绿原酸、绿原酸、隐绿原酸为金银花的主要活性成分,具有抗炎、抑菌等药理作用[3-4];黄酮类成分黄芩苷为黄芩的主要活性成分,具有抗过敏、抗炎、解热、抗肿瘤等药理作用[5-6]。
现有银黄制剂的剂型包括颗粒剂、片剂、胶囊剂、口服液、注射液等[7-8]。相比上述传统剂型,雾化吸入制剂具有起效剂量低、生物利用度高等优势,应用前景广阔[9]。目前,关于银黄制剂的质量标准研究多涉及指纹图谱的建立及以绿原酸为指标的含量测定[1-2]。由于中药制剂成分復杂,仅以单一成分作为指标无法全面反映制剂的质量。银黄吸入溶液由国内某药物研究院有限公司首次研发,其工艺与银黄口服液、注射液不尽相同,且尚未有相关雾化吸入产品上市,因此亟需建立银黄吸入溶液的质量标准。指纹图谱具有特征性强、重现性好和可操作性强的特点,可全面系统地表征中药中各化学成分及其相对含量[10]。一测多评(quantitative analysis multi-components by single marker,QAMS)法可通过单一对照品来实现对多个成分的同步测定,含量测定结果准确度高,还具有节约实验耗材、简化操作步骤、节省测定时间等优点[11-12]。考虑到银黄吸入溶液中新绿原酸、隐绿原酸对照品难以获取,检测成本较高,故本研究建立了银黄吸入溶液的高效液相色谱(high performance liquid chromatography,HPLC)指纹图谱,并采用QAMS法同时测定了制剂中新绿原酸、绿原酸、隐绿原酸的含量,旨在为银黄吸入溶液的质量控制及后续药效学研究提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有1260 Infinity Ⅱ型HPLC仪及配备的OpenLab CDS2.3网络版工作站、G7117A型检测器、G7014A型液相泵、G7129B型进样器、G7116B型柱温箱(美国Agilent公司),SQP型十万分之一电子分析天平[赛多利斯科学仪器(北京)有限公司],Master-s15型纯水机(上海和泰仪器有限公司)等。
1.2 主要药品与试剂
银黄吸入溶液[盈科瑞(横琴)药物研究院有限公司,批号分别为CP-201229-01、CP-201231-01、CP-210106- 01、CP-201204-01、CP-201205-02、CP-201214-01、CP- 200805-05、CP-200805-06、CP-200814-04、CP-201127- 02,编号依次为S1~S10];黄芩苷对照品(批号110715- 201821,纯度95.4%)、绿原酸对照品(批号110753- 201817,纯度96.8%)、3,5-二-O-咖啡酰奎宁酸对照品(批号111782-201807,纯度94.3%)、4,5-二-O-咖啡酰奎宁酸对照品(批号111894-201102,纯度94.1%)均购自中国食品药品检定研究院;新绿原酸对照品(批号DST200521-015,纯度97.6%)、隐绿原酸对照品(批号DST200521-035,纯度97.5%)均购自成都乐美天医药科技有限公司;异绿原酸B对照品(批号000319-201912,纯度98.3%)购自江西佰草源生物科技有限公司;黄芩提取物[盈科瑞(横琴)药物研究院有限公司实验室自制,批号2-Z-201121-01];乙腈、磷酸均为色谱纯,其余试剂均为分析纯,水为超纯水。
2 方法与结果
2.1 HPLC指纹图谱的建立
2.1.1 色谱条件 以Welch Ultimate® XB-C18(250 mm×4.6 mm,5 µm)为色谱柱,以乙腈(A)-0.4%磷酸溶液(B)为流动相进行梯度洗脱(0~14 min,8%A→15%A;14~20 min,15%A→16%A;20~22 min,16%A→26%A;22~30 min,26%A→28%A;30~40 min,28%A→60%A);检测波长为240 nm;柱温为30 ℃;流速为1.0 mL/min;进样量为10 μL。
2.1.2 对照品溶液的制备 精密称取黄芩苷对照品适量,加甲醇溶解并稀释,摇匀,制得黄芩苷质量浓度为0.2 mg/mL的指纹图谱对照品溶液。另取新绿原酸、绿原酸、隐绿原酸、异绿原酸B、3,5-二-O-咖啡酰奎宁酸、4,5-二-O-咖啡酰奎宁酸对照品适量,加50%甲醇溶解并稀释,摇匀,制成上述成分质量浓度分别为40、40、40、10、5、10 µg/mL的单一对照品溶液。
2.1.3 供试品溶液的制备 精密量取银黄吸入溶液1 mL,置于10 mL棕色量瓶中,加50%甲醇稀释并定容,摇匀,经0.22 μm微孔滤膜滤过,取续滤液,即得。
2.1.4 精密度试验 取“2.1.3”项下供试品溶液(编号S2),按“2.1.1”项下色谱条件连续进样测定6次,以16号峰(黄芩苷)为参照,记录各共有峰的相对保留时间和相对峰面积。结果显示,18个共有峰相对保留时间的RSD为0~0.18%(n=6),相对峰面积的RSD为0.04%~1.19%(n=6),表明方法精密度良好。
2.1.5 重复性试验 取银黄吸入溶液(编号S2),共6份,按“2.1.3”项下方法制备供试品溶液,再按“2.1.1”项下色谱條件进样测定,以16号峰(黄芩苷)为参照,记录各共有峰的相对保留时间和相对峰面积。结果显示,18个共有峰相对保留时间的RSD为0.05%~0.26%(n=6),相对峰面积的RSD为0.54%~2.31%(n=6),表明方法重复性良好。
2.1.6 稳定性试验 取“2.1.3”项下供试品溶液(编号S2),分别于室温下放置0、2、4、8、16、24、36、48 h时按“2.1.1”项下色谱条件进样测定,以16号峰(黄芩苷)为参照,记录各共有峰的相对保留时间和相对峰面积。结果显示,18个共有峰相对保留时间的RSD为0.07%~0.44%(n=8),相对峰面积的RSD为0.15%~2.91%(n=8),表明供试品溶液于室温下放置48 h内稳定性良好。
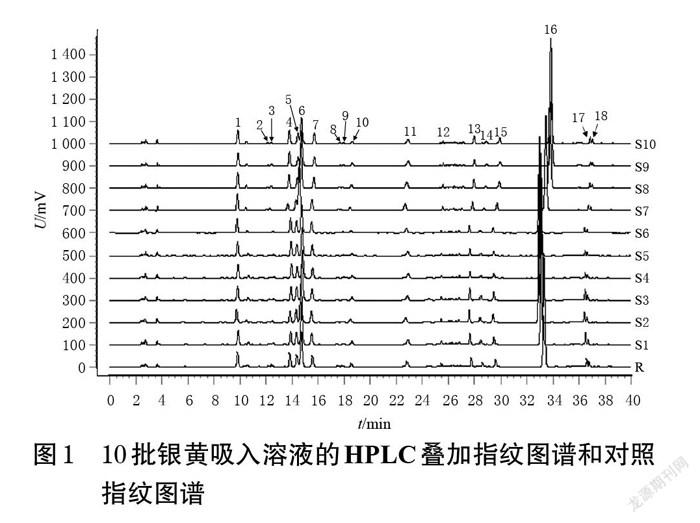
2.1.7 指纹图谱的建立 取10批银黄吸入溶液,按“2.1.3”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件进样测定,记录色谱图。采用《中药色谱指纹图谱相似度评价系统(2012版)》对10批银黄吸入溶液的色谱图进行分析,以S1为参照图谱,采用中位数法自动匹配,得到10批银黄吸入溶液的叠加指纹图谱和对照指纹图谱(R),详见图1。由图1可见,10批银黄吸入溶液中共有18个共有峰。
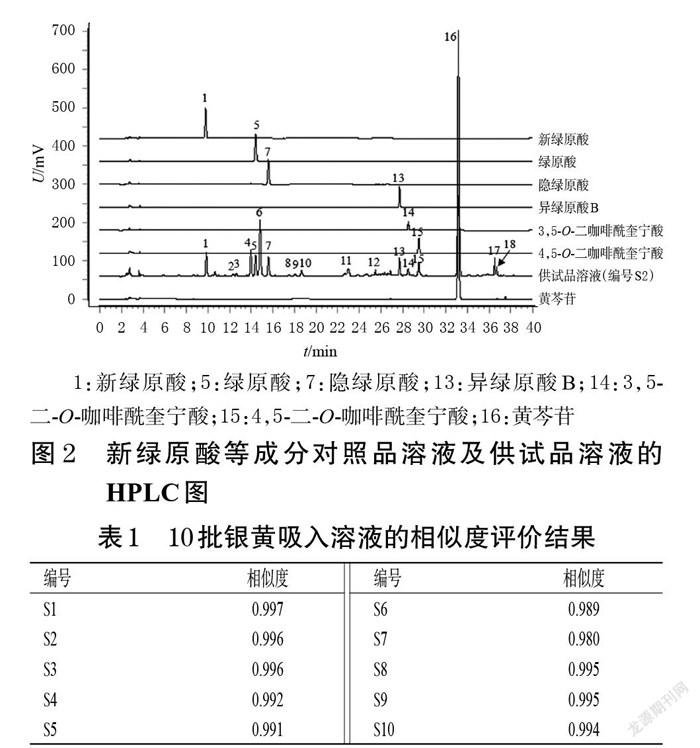
2.1.8 共有峰的指认 通过与“2.1.2”项下各对照品溶液(按“2.1.1”项下色谱条件进样测定所得)及供试品溶液(编号S2)的色谱图(图2)进行比对,共指认了7个共有峰,分别为新绿原酸(1号峰)、绿原酸(5号峰)、隐绿原酸(7号峰)、异绿原酸B(13号峰)、3,5-二-O-咖啡酰奎宁酸(14号峰)、4,5-二-O-咖啡酰奎宁酸(15号峰)和黄芩苷(16号峰)。因黄芩苷色谱峰的响应值较大、分离度较好,故以黄芩苷峰为参照峰。
2.1.9 相似度评价 采用《中药色谱指纹图谱相似度评价系统(2012版)》对10批银黄吸入溶液进行相似度评价。结果显示,10批样品与对照指纹图谱的相似度均大于0.90(黄芩苷峰面积超过总峰面积的60%,未参与相似度计算),表明10批银黄吸入溶液的化学成分种类相近,制备工艺较为稳定。结果见表1。
2.2 3种成分的含量测定
2.2.1 色谱条件 以Welch Ultimate® XB-C18(250 mm×4.6 mm,5 µm)为色谱柱,以乙腈(A)-0.4%磷酸溶液(B)为流动相进行梯度洗脱(0~14 min,8%A→15%A;14~20 min,15%A→16%A;20~22 min,16%A→26%A;22~30 min,26%A→28%A;30~40 min,28%A→60%A);检测波长为327 nm;柱温为30 ℃;流速为1.0 mL/min;进样量为10 μL。
2.2.2 混合对照品溶液的制备 精密称取新绿原酸、绿原酸、隐绿原酸对照品适量,加50%甲醇溶解并稀释,摇匀,制成上述成分质量浓度分别为24.95、39.29、31.58 μg/mL的混合对照品溶液。
2.2.3 供试品溶液的制备 同“2.1.3”项。
2.2.4 空白对照溶液及阴性样品溶液的制备 取50%甲醇,经0.22 μm微孔滤膜滤过,取续滤液,即得空白对照溶液。取黄芩提取物适量,置于10 mL棕色量瓶中,加50%甲醇溶解并稀释至刻度,摇匀,经0.22 μm微孔滤膜滤过,取续滤液,即得缺金银花药材的阴性样品溶液。
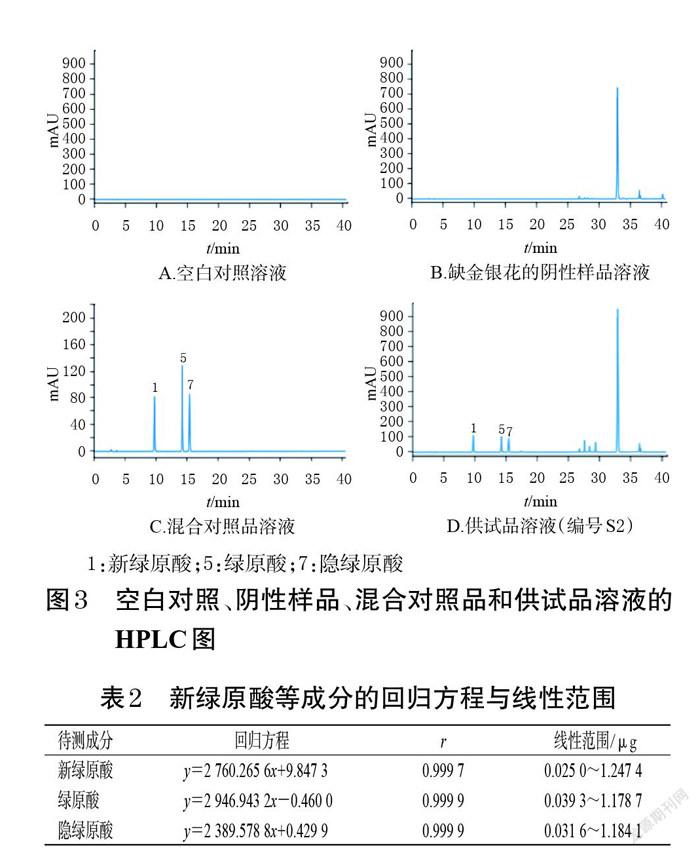
2.2.5 系统适用性试验 取上述混合对照品溶液、供试品溶液(编号S2)、空白对照溶液及阴性样品溶液,按“2.2.1”项下色谱条件进样测定,记录色谱图,详见图3。由图3可见,空白对照溶液及阴性样品溶液未干扰测定,各待测成分色谱峰与相邻色谱峰的分离度均大于1.5,理论板数均不低于10 000。
2.2.6 线性关系考察 取“2.2.2”项下混合对照品溶液为线性工作溶液Ⅰ。取新绿原酸、绿原酸、隐绿原酸质量浓度分别为83.16、78.58、78.94 μg/mL的混合对照品溶液(取新绿原酸、绿原酸、隐绿原酸对照品,按“2.2.2”项下方法制备)为线性工作溶液Ⅱ。精密吸取线性工作溶液Ⅰ1、2、5、10 μL,线性工作溶液Ⅱ6、10、12、15 μL,按“2.2.1”项下色谱条件进样测定,以进样量(x,μg)为横坐标、峰面积(y)为纵坐标进行线性回归。结果见表2。
2.2.7 精密度试验 精密吸取“2.2.2”项下混合对照品溶液,按“2.2.1”项下色谱条件连续进样测定6次,记录峰面积。结果显示,新绿原酸、绿原酸、隐绿原酸峰面积的RSD分别为0.11%、0.09%、0.11%(n=6),表明仪器精密度良好。
2.2.8 重复性试验 取银黄吸入溶液(编号S2),共6份,分别按“2.2.3”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,记录峰面积并按外标法计算样品含量。结果显示,新绿原酸、绿原酸、隐绿原酸含量的RSD分别为0.50%、0.49%、0.47%(n=6),表明方法重复性良好。
2.2.9 稳定性试验 取“2.2.3”项下供试品溶液(编号S2),分别于室温下放置0、2、4、8、16、24、36、48 h时按“2.2.1”项下色谱条件进样测定,记录峰面积。结果显示,新绿原酸、绿原酸、隐绿原酸峰面积的RSD分别为0.12%、0.08%、0.13%(n=8),表明供试品溶液于室温下放置48 h内稳定性良好。
2.2.10 加样回收率试验 取已知含量的银黄吸入溶液(编号S2),每份0.5 mL,共6份,置于10 mL量瓶中,精密加入混合对照品溶液(取各对照品,按“2.2.2”项下方法制备,得各成分质量浓度均为40 μg/mL的混合对照品溶液)4 mL,按“2.2.3”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率。结果显示,新绿原酸、绿原酸、隐绿原酸的平均加样回收率分别为93.92%、94.46%、93.93%,RSD均小于2.0%(n=6),表明方法准确度良好。结果见表3。
2.3 QAMS法
2.3.1 校正因子的计算 取银黄吸入溶液,按“2.2.3”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定3次,记录峰面积。以绿原酸为参照物(绿原酸对照品价格较为低廉,且易获得),采用斜率校正法计算新绿原酸、隐绿原酸的相对校正因子(fs/i):fs/i=ks/ki(式中,ki为待测成分斜率,ks为参照物斜率[11])。结果显示,新绿原酸、隐绿原酸的fs/i分别为1.068、1.233。
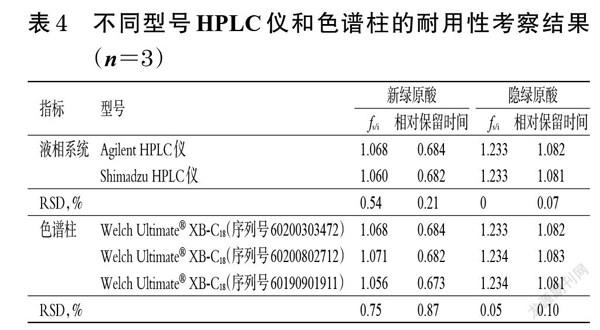
2.3.2 耐用性考察 取银黄吸入溶液,按“2.2.3”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定3次,记录峰面积,分别考察不同型号HPLC仪和色谱柱对新绿原酸等成分fs/i及相对保留时间的影响,结果见表4。由表4可见,在不同型号HPLC仪和色谱柱下,新绿原酸、隐绿原酸fs/i及相对保留时间的RSD均小于1.0%,表明不同型号HPLC仪和色谱柱对新绿原酸等成分fs/i和相对保留时间的影响较小,方法耐用性良好[10]。
2.4 外标法与QAMS法的含量测定结果
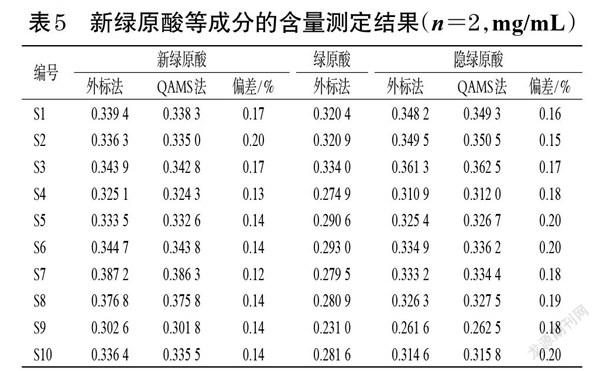
取10批银黄吸入溶液,按“2.2.3”项下方法制备供试品溶液,以绿原酸为参照物,通过fs/i分别计算各样品中新绿原酸、隐绿原酸的含量:Ci=Cs×Ai×fs/i/As(式中,Ai为待测成分峰面积,As为参照物峰面积,Ci为待测成分浓度,Cs为参照物浓度);同时,采用外标法测定10批银黄吸入溶液中新绿原酸、隐绿原酸的含量。每批样品平行测定2次,并计算两者的偏差:偏差=|(外标法检测结果-QAMS法检测结果)/(外标法检测结果+QAMS法检测结果)×100%|,结果见表5。由表5可见,两种方法含量测定结果的偏差均不高于0.20%,表明两种方法测定结果无明显差异。
3 讨论
本课题组前期对甲醇、50%甲醇、70%甲醇等不同样品提取溶剂进行了考察。结果显示,所得供试品溶液的含量测定结果无显著差异,但当以50%甲醇为溶剂时,所得供试品溶液指纹图谱的色谱峰峰形更好,故选择50%甲醇为提取溶剂。有研究发现,银黄制剂指纹图谱的检测波长为235~350 nm[13-16]。在参考上述文献的基础上,本课题组比较了不同检测波长(210、235、240、325、350 nm)下的色谱图,结果显示,当以240 nm为检测波长时,所得色谱图的信息量较大,各色谱峰分离较好,故选择指纹图谱的检测波长为240 nm。考虑到绿原酸等酚酸类成分在327 nm波长下的响应值最大,且各色谱峰分离较好,故选择327 nm为含量测定的检测波长。同时,本课题组前期又对银黄吸入溶液中间体与成品中的酚酸类成分进行了初步测定,结果显示,3,5-二-O-咖啡酰奎宁酸、异绿原酸B、4,5-二-O-咖啡酰奎宁酸的含量均低于0.2 mg/mL,而绿原酸、新绿原酸、隐绿原酸的含量均高于0.2 mg/mL,且后三者在生产过程中稳定,故选定绿原酸、新绿原酸、隐绿原酸为含量测定的指标成分。
含量测定结果显示,QAMS法测得新绿原酸、隐绿原酸含量分别为0.301 8~0.386 3、0.262 5~0.362 5 mg/mL;外标法测得新绿原酸、绿原酸、隐绿原酸含量分别为0.302 6~0.387 2、0.231 0~0.334 0、0.261 6~0.361 3 mg/mL;外标法和QAMS法测得新绿原酸、隐绿原酸含量的偏差均不高于0.20%,表明两种方法测定结果无明显差异,提示QAMS法准确、可靠。此外,相比外标法,QAMS法解决了新绿原酸、隐绿原酸对照品难以获得的问题,降低了分析检测成本[10]。
综上所述,本研究所建HPLC指纹图谱可稳定、全面地反映银黄吸入溶液的质量差异,同时QAMS法能准确地测定银黄吸入溶液中新绿原酸、绿原酸、隐绿原酸等成分的含量,为银黄吸入溶液的质量控制提供了参考,也为该制剂后续的药效学评价提供了技术支持。
参考文献
[ 1 ] 周淑芳,刘晓妹,于聪,等.银黄制剂的研究进展[J].中国实验方剂学杂志,2015,21(14):222-225.
[ 2 ] 范建伟,邱大伟,李艳芳,等.银黄制剂处方渊源、剂型沿革、质量控制、现代药理的研究进展[J].中成药,2021,43(1):149-153.
[ 3 ] 宋亚玲,王红梅,倪付勇,等.金银花中酚酸类成分及其抗炎活性研究[J].中草药,2015,46(4):490-495.
[ 4 ] 张忠斌,沈洪宽,孙玉风,等.金银花中酚酸类有效成分的提取及其抗菌活性研究[J].中國民族民间医药,2019,28(16):27-29.
[ 5 ] 宋亚玲,倪付勇,赵祎武,等.金银花化学成分研究进展[J].中草药,2014,45(24):3656-3664.
[ 6 ] 徐玉田.黄芩的化学成分及现代药理作用研究进展[J].光明中医,2010,25(3):544-545.
[ 7 ] 冯群,关永霞,姚景春,等.银黄制剂抗感染作用与临床应用进展[J].中国药物评价,2020,37(3):211-214.
[ 8 ] 沈汶,蒋卓霖,吴雨晴,等.基于网络药理学探究银黄药对抗病毒作用机制[J].中成药,2020,42(5):1329-1333.
[ 9 ] 杜光,赵杰,卜书红,等.雾化吸入疗法合理用药专家共识:2019年版[J].医药导报,2019,38(2):135-146.
[10] 罗国安,王义明.中药指纹图谱的分类和发展[J].中国新药杂志,2002,11(1):46-51.
[11] 左岚,孟胜男.一测多评法在中药药物分析中的应用进展[J].中国药房,2016,27(18):2589-2592.
[12] 蒋向辉,蒋天智,苑静,等.一测多评法测定青钱柳中5种黄酮类成分含量[J].华中师范大学学报(自然科学版),2017,51(5):620-625.
[13] 高燕,吕凌,王亮,等.银黄颗粒HPLC指纹图谱与模式识别分析[J].中华中医药杂志,2017,32(9):4238-4242.
[14] 何艳,胡小祥.银黄胶囊HPLC特征图谱和6个成分含量测定[J].中国现代应用药学,2020,37(11):1314-1319.
[15] 任菲菲,郑艳青,马斐,等.小儿感冒颗粒HPLC指纹图谱研究[J].药学研究,2020,39(10):575-580.
[16] 戴德雄,刘根才,朱婷,等.银黄滴丸HPLC指纹图谱研究[J].中草药,2016,47(24):4370-4373.
(收稿日期:2021-08-11 修回日期:2021-11-10)
(编辑:陈 宏)
